Method Article
シリアルブロック面と集値イオンビームスキャン電子顕微鏡を用いた標的研究
要約
ここでは、シリアルブロック面と集積イオンビーム走査電子顕微鏡を効率的に組み合わせて対象領域を標的とするプロトコルを紹介する。これにより、3 次元で効率的な検索を行い、大きな視野でまれなイベントを検索できます。
要約
このプロトコルは電子顕微鏡の決断レベルの3次元の細胞か組織のサンプルの有効で、有効なイメージ投射を可能にする。長年にわたり、電子顕微鏡(EM)は本質的に2次元技術のままです。シリアル走査型電子顕微鏡イメージング技術(体積EM)の出現により、統合されたマイクロトームまたは集積イオンビームを使用してスライスし、埋め込み組織を表示することで、第3次元が容易にアクセスできるようになります。シリアルブロック顔走査型電子顕微鏡(SBF-SEM)は、SEMチャンバに封入された超微小トームを使用しています。それは大きい標本(1,000 μm x 1,000 μm)および小さいX、Yピクセルサイズのイメージ大きい視野を扱う機能を有するが、ダイヤモンドナイフによってZ次元で限られている。集値イオンビームSEM(FIB-SEM)は、3D分解能に限定されないが、(≤5nmの等方性ボクセルは達成可能である)が、視野ははるかに限定される。このプロトコルは、2 つの手法を組み合わせて、大きなフィールドで対象領域 (ROI) を見つけ、その後のターゲットボリュームを高等方性ボクセル解像度でイメージングするためのワークフローを示します。固定細胞または組織の準備は、SEMイメージングにおける効率的な信号生成に必要な余分なコントラストのために、体積EM技術に対してより厳しい。このようなプロトコルは、時間がかかり、労働集約的です。このプロトコルはまた試薬の浸透を促進するマイクロ波支援ティッシュ処理を組み込み、処理プロトコルに必要な時間を数日から数時間に減らす。
概要
このプロトコルは、目的の特定の領域(ROI)に対する高解像度の3次元電子顕微鏡(EM)の効率的なターゲティングのためのワークフローを記述する。1930年代に始まって以来、EMは本質的に2次元の技術でした。最初に公開された画像は、組織全体または細胞であったが、それはすぐに超微小トームを使用して手で切断され、透過型電子顕微鏡(TEM)を使用して画像化されたセクションに道を譲った。TEMは、細胞構造の最小でも明確に識別可能な非常に高解像度の顕微鏡写真を生成します。しかし、組織が電子ビームによって画像化されるのに必要な断面の薄さは、Z次元の情報を最小限に抑えた。細胞は三次元構造であるため、細胞構造と細胞表面との相互作用は限られたデータから推測されなければならなかった。これは、特に複雑な構造において、誤解の可能性を高めました。一部の顕微鏡学者は、細胞や組織を連続断面化することによって、より正確な3D構造を得て、個々のTEM画像1からそれらを苦労して再構築することができました。これは非常に手間のかかるプロセスであり、デジタルイメージングとコンピュータレンダリングの出現前には、結果を視覚化することも困難でした。近年、より多くの実験室でEMを3次元で利用できるようになった体積電子顕微鏡(体積EM)2として総称されるようになった2つの技術が導入されている。
電子顕微鏡内の埋め込みブロックから画像のスタックを取得するという考えは、スティーブ・レイトンとアラン・クジリアンがミニチュアマイクロトームを構築し、走査型電子顕微鏡3(SBF-SEM)のチャンバーに置いた1981年までさかのぼることができます。.このプロトタイプは最終的にデンクとホルストマン4によって23年後にコピーされ、改良され、その後製品化されました。ほぼ同時に、生物科学者は、主に材料科学、焦点を合わせたイオンビームで使用される別の技術に気づきました。この技術は、何らかの種類のイオンビーム(ガリウム、プラズマ)を使用して、サンプル(FIB-SEM)5から非常に少量の表面材料を除去する。どちらの手法も、X、Y、Z、スタックに組み合わせることができる一連の画像を提供するイメージングに続いて断面を採用しています。どちらの手法も、3D 情報を提供しますが、解像度のスケールが異なります。SBF-SEMは、長いシリアルイメージング実行のために50 nm以下の薄さのスライスにダイヤモンドナイフの物理的特性によって制限されます。しかし、断面できるサンプルブロックサイズは、最大1mm x 1 mm x 1 mm. ブロック面から信号を受信する背面散乱電子検出器(32k x 32kピクセル)の大きなデジタル集録フォーマットのため、イメージ ピクセル サイズは 1 nm と小さくすることができます。この結果、X,Y 次元がZより小さくなる非等方性ボクセルが発生します。イオンビームの精度のために、FIB-SEMは等方性ボクセル≤5 nmで画像を収集する能力を有する。ただし、画像化できる総面積は非常に小さいです。2 つの手法でイメージ化されたさまざまなサンプルとボリュームの概要表が以前に 3.
体積EMの組織調製は、サンプルをSEMで適切なシグナル生成を提供するために染色する必要があるため、標準的なTEMまたはSEMよりも困難です。識別と再構成を容易にするために、特定の細胞構造とは対照的です。ここで使用されるプロトコルは NCMIR 標準6に基づいています。追加の染色は、通常、追加のプロトコルステップを意味します。したがって、体積EMの場合、試薬が試料に浸透するのに十分な時間を確保するために、標準プロトコルを拡張する必要があります。マイクロ波支援処理は、数時間から数分までの染色に必要な時間を短縮し、ボリュームEMサンプル調製をより効率的に7.この方法は、すべての細胞および組織タイプ8に適用可能であり、組織の不均一性が特定の領域のサンプリングを不可欠なものにする問題を研究する9.
データ スタックを取得したら、データ スタックを整列し、残りのデータからセグメント化し、3D でモデル化します。組織の多くのスライスをイメージングの自動化は、画像の取得を比較的簡単にしましたが、データをデジタル的に再構築および視覚化するプロセスは時間のかかる作業です。この目的のためのソフトウェアはまだ統合されていないか、完全に自動化されていません。ボリュームEMを用した初期の研究の多くは神経科学に向けられたため、軸ゾンなどの構造を染色し、デジタルセグメント化する技術は、他の細胞や小器官に比べてかなり進歩しています。他の非神経組織の文献が急速に成長している間、非線形または不規則な構造はより多くの手動入力を必要とする。
SBF-SEMとFIB-SEMの両方を使用することは、3Dで高解像度で特定の、非均質な組織構造を標的化およびイメージングするための有用なアプローチです。マイクロ波アシストティッシュ処理と組み合わせることで、サンプル調製に必要な時間を大幅に短縮できます。このワークフローを組み合わせることで、微細構造の高解像度等方性ボクセル画像データセットを効率的かつ迅速なプロセスにします。
プロトコル
1. 電子顕微鏡検査用のサンプル固定と処理
- 0.5%パラホルムアルデヒドで寒天プレート上で成長したアラビドプシスタリアナの苗を固定し、0.1Mリン酸バッファー(PB)pH 6.8を室温(RT)で2.8でグルタルアルデヒドを2.5%。
注意:アルデヒドは刺激性と腐食性であり、発癌性、変異原性および催奇形性の可能性を持っています。すべてのソリューションは、適切な保護装置とヒュームフードで処理する必要があります。 - ステップ1.1で成長した植物の根の先端をカットし、4 °Cで一晩同じ固定を含む0.5 mLチューブに2-3の先端を入れます。
注: このボリュームと残りのステップのソリューションは、サンプルボリュームによって決まります。サンプルと溶液の最小比率は10:1です。任意の次元で1ミリメートルを超えるサンプルは汚れにくいので、より大きな組織ブロックでの作業はより困難です。すべての組織が同じ特性を持っているわけではありません。例えば、植物の葉や茎は汚れにくい場合があります。より大きなサンプルまたは困難な組織タイプが望まれる場合は、データ収集に進む前にサンプル処理の最適化を行う必要があります。 - チオカルボヒドラジド(TCH)溶液を準備し、ステップ1.7の前に新鮮で利用可能な必要がありました。チオカルボヒドラジドの0.1gを10mLの二重蒸留水(ddH2O)に加え、オーブンで60°Cに1時間加熱して溶解する。使用前に、0.22 μmのシリンジフィルターを使用してTCH溶液をフィルタリングします。
- チューブから固定を取り外し、0.1 M PB pH 6.8 に交換します。100rpmで軌道揺振りテーブルにチューブを置き、10分間洗浄し、新鮮なPBSを使用して洗浄を5回繰り返します。
- ポストは、0.1 M PB pH 6.8でPBを2%の一石性(OsO4)と0.2%のルテニウム赤に置き換えることによって根の先端を修正します。蓋を開けて電子レンジにチューブを入れ、プログラム9(表1)を起動します。
注意:オスミウムは、摂取の場合には非常に危険であり、吸入の場合は非常に危険であり、皮膚接触の場合には危険です。常に適切な保護具とヒュームフードを使用して取り扱ってください。
注:プロトコル全体を通して、チューブのふたは常にマイクロ波のステップの間に開いています。 - 根の先端をddH2Oで2回、ベンチトップでそれぞれ5分間洗います。第3および第4のddH2O洗浄使用プログラム15については、電子レンジ(表1)を使用する。最初の40秒のddH2O洗浄後、電子レンジからサンプルを取り出し、バッファを新鮮なddH2Oに置き換え、サンプルを電子レンジに戻し、プログラムを続けます。
メモ:バッファをリフレッシュする必要がある場合、マイクロ波はアラームを鳴らします。真空チャンバの蓋が毎回正しく交換されていることを確認してください。 - ベンチ上で2分間RTで以前に調製したTCH溶液中のサンプルをインキュベートし、さらにインキュベーションのためにマイクロ波プログラム8(表1)を使用する。ベンチと電子レンジの間で溶液を交換しないでください。
- ステップ1.6に記載されているようにサンプルを洗浄します。
- マイクロ波プログラム9(表1)の場合、ddH2Oで1%OsO4にサンプルを入れます。
- ステップ1.6に記載されているようにサンプルを洗浄します。
- マイクロ波プログラム16(表1)を用いてddH2Oで酢酸1%の尿酸をインキュベートする。
注意:酢酸ウラニルは有毒であり、刺激性であり、発癌性、変異原性および催奇形性の可能性を有する。常に適切な保護具を使用して取り扱います。 - ステップ1.6に記載されているようにサンプルを洗浄します。
- 手順 1.14 で使用するウォルトンのリード ソリューションを準備します。まず、dH2 Oの250mLに0.998gのL-アスパラギン酸を添加し、pHを1MKOHで3.8に調整してL-アスパラギン酸のストック溶液を作ります。次に、L-アスパラギン酸ストック溶液の10mLに硝酸鉛0.066gを溶解し、pHを5.5に調整する。溶液を60°Cのオーブンに30分間放置します。
注:沈殿物が形成されるべきではありません。 - 60°Cのオーブンで30分間ウォルトンの鉛溶液でサンプルをインキュベートします。
- ステップ1.6に記載されているようにサンプルを洗浄します。
- 50%、70%、ddH2Oで90%、次いで100%EtOHで2倍の等級ステップでEtOHでサンプルを脱水します。マイクロ波プログラム10(表1)を使用すると、電子レンジは40sごとにユーザーに次のEtOHステップでソリューションを交換するように求めます。これは電子レンジで行われる最後のステップです。
- さらに、ベンチ上のRTでそれぞれ10分間100%プロピレン酸化物2xで脱水し、工程間の溶液を置き換える。
注:酸化プロピレンは、ポリスチレンなどのいくつかのプラスチックを溶解することができます。このステップのためにガラスバイアルを使用するか、抵抗のための事前テストプラスチックを使用してください。
注意:酸化プロピレンは非常に可燃性です。常に適切な保護具とヒュームフードを使用して取り扱ってください。 - プロピレン酸化物(分2時間)で50%スパーの樹脂でインキュベートすることにより、根の先端の浸潤を開始します。
注意:スパーの樹脂成分は刺激性です。常に適切な保護具とヒュームフードを使用して取り扱ってください。 - 100%スパーでソリューションを交換し、RTで一晩残します。
- フレッシュ100%スパーの樹脂に2回(分2時間インキュベーション)に変更します。
- サンプルを埋め込み型に入れ、再び新鮮な100%スパーの樹脂を含み、65°Cのオーブンで36-48 hで重合します。
注:使用される埋め込み金型は、組織の種類とイメージングに使用されるアプローチによって異なります。ここでは、平らなシリコーン埋め込み金型を用いた(図1A)。
2. イメージング用に埋め込みサンプルを準備する
- オーブンからサンプルを取り出し、埋め込み金型から樹脂を取り出します(図1B)。
- かみそりブレードを使用して、サンプルを最大 0.5 mm x 0.5 mm x 0.5 mm (図 1C)のブロックに大まかにトリミングします。
注:SBF-SEMでの充電を防ぐためには、できるだけ多くのベア樹脂を取り除き、サンプルをできるだけ平ら/薄くすることが重要です。理想的には、ブロックのすべての側面に既に組織が含まれていますが、最も重要なのは、金属ピンに取り付けられる側(ステップ2.3を参照)は、組織が導電性金属と直接接触するように露出した組織を含む必要があります。 - 余分な樹脂からサンプルを取り出し、導電性エポキシ樹脂で金属ピン(図1D)に取り付け、組織の一部が金属ピンに触れていることを確認します。エポキシは65°Cでオーブンで一晩硬化させてください。
注: SB-SEM のステージの動きが制限されているため、サンプルがピンの中央に配置されていることを確認します。非常に小さな樹脂で包まれたサンプルを余分な樹脂から取り除くことは、小さなサンプルが剥離すると飛び去る傾向があるため、困難な場合があります。これに対する簡単で効果的な解決策は、参照1の補足ムービーに示すように、パラフィンフィルムのシートでサンプルをカバーすることです。 - ウルトラマイクロトームのホルダーにキャリアを固定します。余分なエポキシを除去するためにかみそり刃を使用し、ピラミッドを形成し、ブロックの顔と側面を滑らかにするために、超マイクロトームとダイヤモンドナイフを使用しています。少なくとも一部の組織が既にブロック面に露出していることを確認します。
注:ダイヤモンドナイフを使用する余分なステップはオプションですが、ブロック面上のナイフの影が明確であるため、ナイフとブロック面の間の距離を推定しやすくなるため、SBF-SEMで得られたブロックが近づきやすくなります。 - トリミングされたサンプルブロックをスパッタコーターに入れ、サンプルを白金(Pt)の薄い層(2−5nm)でコーティングします。
注:ブロック面のプラチナは、SBF-SEM(下記参照)のアプローチ中に切り取られますが、ピラミッドの側面にあるプラチナは追加の導電性を提供します。この例では、サンプルは白金でコーティングされましたが、金、または金/パラジウムも有効です。しかし、ゴールドでコーティングすると、イメージング実行中にブロック面の破片が増加しました。
3. SBF-SEMにおけるイメージング
- キャリアをSBF-SEM顕微鏡に挿入し、ナイフをサンプル表面に近づけます。ダイヤモンドナイフを使用して、Pt層が既に除去され、組織の少なくとも一部が露出できるように、サンプルの上部をトリミングします。
注:このプロセスはSBF-SEM顕微鏡ごとに異なるので、すべてのステップがここで指定されるわけではありません。サンプル表面がPtから自由で、イメージングの準備ができている限り、次のステップは可能である。 - 低解像度および短い在入時間でイメージングを開始して、サンプルの概要を取得し、対象となる領域を見つけます (図 1E)。
注:ここでは、512 x 512ピクセルと1 μsのドウェル時間をステージの迅速なスキャンと位置決めに使用し、2,000 x 2,000ピクセルを1 μsの留置時間でイメージングウィンドウを最適化し、フォーカスを調整するために使用しました。 - 80−100 pAの電流で1.5~2.0kVの加速電圧を使用して、組織の画像をキャプチャします。
注:ここで示す例は、非常にサンプル依存性である充電を最小限に抑えるためにビーム電流を調整する必要がある高真空システム上で画像化されました。通常、電子ビームは1.5−2.0 kVに設定されますが、これはサンプル依存です。高い倍率(通常は> 10,000x)では、樹脂はビームの影響を受けすぎて滑らかな断面を保証するので、通常、ピクセルサイズは8,000−10,000 x 8,0000ピクセルの画像サイズで8-20 nmに設定され、対応する倍率は430ピクセルです。それぞれ64 X 64 mm と 200 x 200 mm のフィールド サイズの 1,400x とフィールド サイズ。 - 対象領域を決定し、背面散乱電子検出器を使用して、対象の体積をカバーし、イメージング実行を開始するために必要なセクションの数を決定します。
注: ここで示す例では、80 nm の 500 セクションを 10 nm ピクセルと 10,000 x 10,000 ピクセルのイメージ (所用時間 1 μs) でイメージしました。顕微鏡を1.6kV及び100pAに設定した。一般に、セクション数はROIのサンプルとサイズに依存し、連続するセクションの100sから1,000sまで変化する可能性があります。結果のデータセットは、各セクションの単一のイメージで構成されます。これらのイメージは、3D スタックに変換する必要があります。
4. SBF-SEMデータ処理
- フィジーを使用して、ファイルインポートイメージシーケンスを選択し、イメージスタックを見つけてイメージをロードします。データセットのサイズに応じて、[仮想スタックを使用] チェック ボックスをオンにします。
注: データセットが本当に大きい場合は、まず 8 ビット (16 ビットで収集された場合) に変換し、必要に応じてデータを実行可能なサイズになるまでビンに変換します。 - イメージの下部にある再生ボタンを使用して、データセットをスクロールして、イメージングの実行が成功したかどうかを確認します。ブロック面のナイフから落ちるセクション、裸の樹脂の領域で充電、ナイフのアーティファクトを切断する(画像上の水平線)など、SBF-SEMの典型的なイメージングアーティファクトをチェックしてください。
- コマンドイメージプロパティを使用すると、実行中に使用されるピクセルサイズとボクセル深度(断面厚さ)を調整します。データが既にビン分割されている場合は、この問題を考慮に入れます。
- コマンド プラグイン登録-リニア スタックの整列を SIFT と使用してデータを登録します。
注:SBF-SEMデータの登録は、サンプルの充電またはドリフトのためにイメージング中にわずかなサンプルの動きがある可能性があるため、登録が必要です。これは XY の最小限の動きに過ぎないため、翻訳のみが必要です。 - データセットをスクロールして位置合わせを確認し、OK の場合は[ファイル]メニューの下にある save コマンドを使用して、整列されたデータセットを 3D-tif ファイルとして保存します。
- データセットを注意深く分析して、ROI が含まれており、生物学的な質問に必要な情報が含まれているかどうかを確認します。スタックの最後のイメージ(=現在のブロック面)で、FIB-SEM イメージング用の新しい ROI を選択します。
注: 現在のブロック面に FIB-SEM イメージング用の良好な領域がない場合は、ROI が表示されるまで、ブロック(SBF-SEM 内にまだある)からさらにセクションを切断できます。FIB でイメージできるボリュームには制限があります。SBF-SEM画像のROIは、X,Yの最大値を30-40 μm x 15-20 μm にすることができます。
5. FIB-SEMにおけるイメージング
- SBF-SEM のサンプルの概要イメージを撮影し、FIB-SEM で認識できるサンプルの 1 つ以上のエッジを含むのが理想的です (図 2A,C)。
注: この例では、SBF-SEM の概要イメージは 10 nm ピクセル サイズ、8,000 x 8,000 ピクセルの 1 μs のドウェルタイムで撮影されました。顕微鏡はまだ1.6 kVと100 pAに設定された。 - SBF-SEMからサンプルを取り出し、スパッタコーターに入れておきます。FIB-SEMイメージング用の≥20 nmプラチナでサンプルをコーティングします。
- サンプルをFIB-SEMにロードし、15 kVの二次電子検出器を使用して、1 nAはブロック面上のSBF-SEMで識別されたROIを見つけます(図2B、D)。
注:15 kVでのイメージングは、プラチナコーティングを通して見る必要があります。 - ステージを動かして傾けることによって、サンプルのROIをFIBビームとSEMビームの偶然の一致点に持ち込みます(図3A)。
注: FIB カラムは通常、角度の下に取り付けられます (図 3A)。つまり、画像化および断面するサーフェスが FIB ビームに平行に配置されるような方法でサンプルを傾ける必要があります。イメージされる表面はSEMビームに対して傾き、SEMがROIをイメージできるようになる前に組織のトレンチを除去する必要がある(図3E) - FIBビームおよびガス噴射システムを使用して、ROIの上の表面に白金の1mm保護層を堆積させる(図3C)。次に、低フライスライン(50-100 pA)を使用して、自動焦点とイメージング実行中の3Dトラッキングのためのプラチナ堆積に細線をミルします(図3D)。FIBカラムとカーボンガスインジェクターを使用して、これらのラインをカーボン堆積で覆います。
注: ここでの ROI のサイズは SBF-SEM イメージの ROI のサイズに対応し、最大サイズは 30- 40 μm x 15-20 μm になります。この例では、17 μm x 8 μm の ROI を画像化しました。カーボン堆積は、ラインの保護のために必要とされ、自動焦点に最適なカーボンとプラチナの間に白黒のコントラストを作成するために必要とされます。各ステップに使用されるフライス加工電流は、表2に示されています。 - 高いフライス加工電流を使用して、ROIの前に30μmのトレンチを粉砕し、SEMビームの撮像面を作成します(図3E)。
注:FIBビームは本質的に破壊的であり、高電流でさらにそうです。ROIで樹脂を溶かさないように、高電流での画像を低倍率および高速スキャン速度で最小限に抑えるようにしてください。 - イメージング実行中に使用される電流に近いフライス加工電流でイメージングサーフェスを滑らかにします。すべてのオートフォーカスマークと3Dトラッキングマークがイメージングサーフェイス上にはっきりと見える場合は、研磨を停止します(図3F)。FIBの進行は、研磨しながらEM(背面散乱電子検出器を使用)で表面をイメージングして続けることができます。
- 新しく作成したサーフェス上のイメージ領域を決定し、イメージング パラメータを設定します。電子ビームが表面に焦点を当てていることを確認し、明るさとコントラストを設定し、ピクセルサイズと断面の厚さを設定します。撮影時間を1分以下に保ち、ドウェル時間とライン平均を調整します。
注:ブロックの表面だけがイメージされるようにするために、電子ビームでのイメージングには低電圧を使用することが重要です(つまり、サンプルの深部からの電子が画像化されないように)。これは、電圧を2kV以下に保ち、グリッド電圧でバック散乱電子検出器を使用して、高エネルギー電子のみを画像化することによって行われます。この例では、電子ビームを1.5kVと1nAに設定し、背面に散乱電子検出器に1.2kVのグリッド電圧を設定した。また、ここで5nmのピクセルサイズを5nmセクションで使用し、等方性ボクセルを持つデータセットを得た。17 μm x 10 μm の面積を 6.5 μs の所要時間と 1.0 のライン平均で画像化しました。 - 自動チューニングと 3D トラッキング用のウィンドウを設定し、イメージングに使用するのと同じピクセル サイズ、ドウェル時間、ライン平均を使用します。
注: このプロセスはシステムによって異なるため、異なるアクションを指定せずにステップのみが記載されます。 - イメージングの実行を開始し、最初の 50~100 セクションの間のプロセスの安定性を監視します。システムがスムーズに動作したら、部屋を離れ、部屋にできるだけ少ない障害があることを確認してください。
注: 実行の継続時間とセクション数は、ROI のサイズと断面の厚さによって異なります。FIB-SEM では、Z 軸は実際には SBF-SEM イメージ上の ROI ボックスの高さ (最大 15−20 μm;図3E)。 - SBF-SEM データに対して上記と同じ方法で FIB-SEM データを登録します。
結果
SBF-SEMからの画像は、組織の概要を提供し、細胞および細胞間接続の空間的な向きに関する洞察を与える(図4A)。その後の新しい領域でのFIB-SEMイメージングは、通常、SBF-SEM実行の検査後に決定される関心領域であり、特定の細胞および/または構造の高解像度の詳細を追加する(図4B)。
図 4C,Dは、SBF-SEMデータ(図4C)と同方性ボクセルFIB-SEMデータ(図4D)の非同方性ボクセルのレンダリングの違いを示す。SBF-SEM で使用される z の厚さは、レンダリングがセクションを明確に示し、サーフェスに「階段」効果をもたらすことを意味します。FIB-SEM データでは、5 nm セクションを使用すると、レンダリングがはるかに滑らかに見え、個々のセクションがサーフェスに完全にブレンドされます。
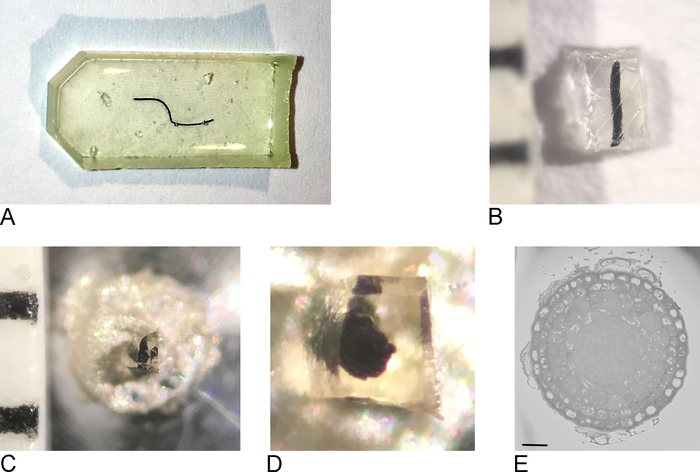
図1:樹脂埋め込みサンプルからのブロック面の作成。(A) 樹脂に埋め込まれた根元。(B) カミソリブレードを使用して、余分な樹脂は0.5mm2のブロックが残るまでトリミングされます。(C, D)トリミングされたブロックは金属ピンに接着され、オーブンで夜を過ごした後、ブロックの側面がトリミングされ、表面は超マイクロトームを使用してダイヤモンドナイフで滑らかにされます。(E) SBF-SEM内では、ブロックフェースとROIが認識できるようにサンプルの向きが広がり、スケールバー= 20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
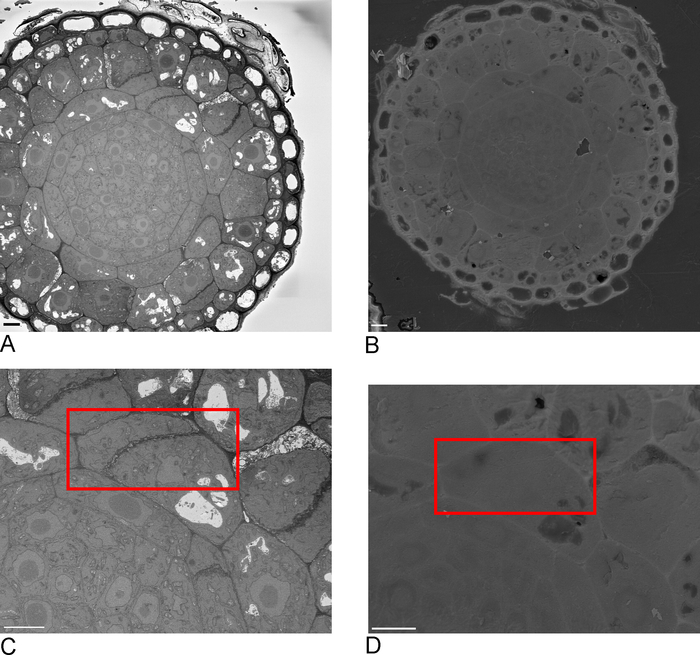
図2:SBF-SEMとFIB-SEMの相関SBF-SEM (A) および FIB-SEM (B) を使用したブロック面の概要イメージ、 スケール バー = 5 μm (C,D) ROI のズーム。赤いボックスは、FIB-SEM でイメージされる領域を描き、スケール バー = 5 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
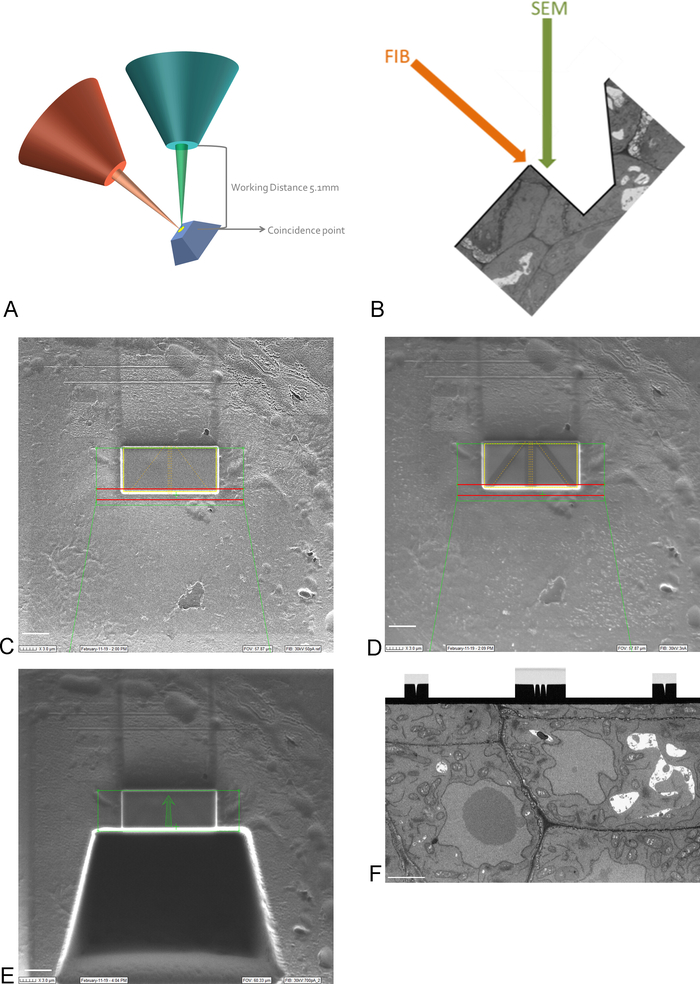
図 3: FIB-SEM スキームと準備手順(A) FIBビーム、SEMビーム、サンプルの向きを示すスキーム。サンプルを FIB ビームと SEM ビームの偶然の一致ポイントに配置して、同じ領域でミルアンドイメージを作成する必要があります。(B) FIBによって除去されたセクションのSEMイメージングに必要なトレンチの概略図。(C) ROI上のプラチナ堆積を示すFIBビームで撮影した画像、スケールバー5 μm(D)自動焦点と3Dトラッキングに使用される線を示すFIBビームで撮影した画像。中央の線はオートフォーカスに使用され、外側の線は 3D トラッキングを提供します。ラインの上のカーボン堆積は、これらのタスクを実行するために必要なコントラスト(プラチナ対カーボン)を提供し、スケールバー5μm.(E)トレンチの粉砕後にFIBビームで撮影された画像、スケールバー5μm(F)を示すSEMビームで撮影した画像FIB-SEMの実行中に画像化された対象領域、スケールバー2 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
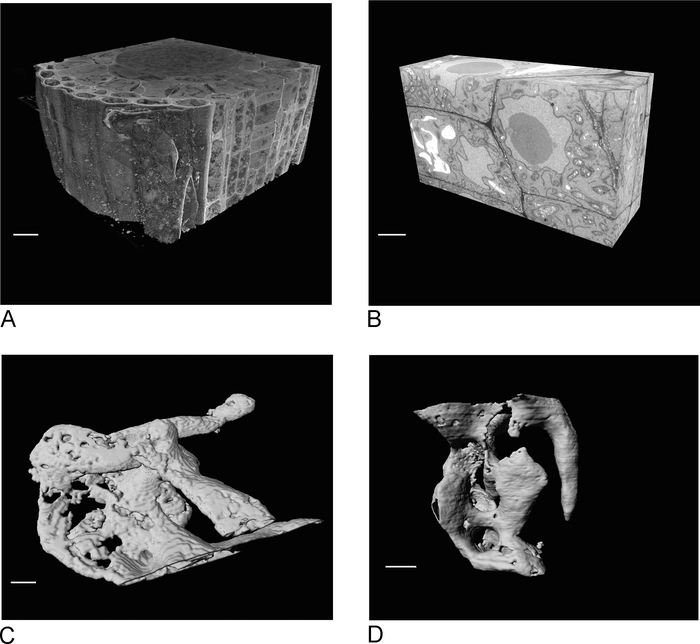
図 4: セグメンテーションの前後に SBF-SEM および FIB-SEM の結果が出ます。(A) SBF-SEM データセットの 3D ビュー (100 x 100 x 40 μm、スケール バー = 10 μm)、(B) FIB-SEM データセットの 3D ビュー (17 x 10 x 5.4 μm、スケール バー = 2 μm) (C) SBF-SEM データからレンダリングされたバキュールを SBF-SEM データからレンダリングした mしきい値によってFIB-SEMデータからインメント、スケールバー = 2 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
| マイクロ波処理のためのプロトコル | |||||||||
| プログラム# | 説明 | ユーザー プロンプト (オン/オフ) | 時間(時間:分秒) | 電力(ワット) | 気温 (°C) | ロードクーラー(オフ/オート/オン) | 真空/バブラーポンプ(オフ/バブ/vacサイクル/vacオン/vap) | 定常温度 | |
| ポンプ(オン/オフ) | 気温 (°C) | ||||||||
| 8 | TCH | オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 |
| オフ | 0:01:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 | ||
| 9 | オスミウム | オフ | 0:02:00 | 100 | 50 | オフ | 真空サイクル | に | 30 |
| オフ | 0:02:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:02:00 | 100 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:02:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:02:00 | 100 | 50 | オフ | 真空サイクル | に | 30 | ||
| 10 | 50% エトウ | に | 0:00:40 | 150 | 50 | オフ | オフ | に | 30 |
| 70% エトウ | に | 0:00:40 | 150 | 50 | オフ | オフ | に | 30 | |
| 90% エトウ | に | 0:00:40 | 150 | 50 | オフ | オフ | に | 30 | |
| 100% エトウ | に | 0:00:40 | 150 | 50 | オフ | オフ | に | 30 | |
| 100% エトウ | に | 0:00:40 | 150 | 50 | オフ | オフ | に | 30 | |
| 15 | 0.1M カコジレート | に | 0:00:40 | 250 | 50 | オフ | 真空サイクル | に | 30 |
| 0.1M カコジレート | に | 0:00:40 | 250 | 50 | オフ | 真空サイクル | に | 30 | |
| 15 | ddH2O | に | 0:00:40 | 250 | 50 | オフ | 真空サイクル | に | 30 |
| ddH2O | に | 0:00:40 | 250 | 50 | オフ | 真空サイクル | に | 30 | |
| 16 | ウラネル・アセテート | オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 |
| オフ | 0:01:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 0 | 50 | オフ | 真空サイクル | に | 30 | ||
| オフ | 0:01:00 | 150 | 50 | オフ | 真空サイクル | に | 30 | ||
表 1.マイクロ波処理のための詳細なプロトコル。
| ステップ | 現在の | 推定時間 |
| 蒸着プラチナ | 3n A | 10~15分 |
| フライス加工オートチューンとトラッキングマーク | 50-100 pA | 4~6分 |
| 堆積カーボン | 3 nA | 5~10分 |
| ミリング粗いトレンチ | 15-30 nA | 30~50分 |
| 研磨面 | 1.5-3 nA | 15~20分 |
| イメージング実行 | 700 pA-1.5 nA | 営業時間日数 |
表 2.サンプル調製およびイメージング実行に使用されるFIBフライス電流
ディスカッション
体積電子顕微鏡は、従来のSEMやTEMよりも困難で時間がかかります。組織または細胞をブロックに染色する必要があるため、処理ステップは、試料が試料全体に浸透するのを確実にするのに十分な長さでなければなりません。マイクロ波エネルギーを使用して浸透を容易にすると、より短く、より効率的な処理ができ、染色が改善されます。EMの調製は光顕微鏡検査よりもはるかに厳しいので、すべての溶液と試薬は品質を厳密に制御する必要があります。pHの変化、トニシティ、不純な試薬の使用、および不十分な技術による汚染物質の導入は、すべて最終的な画像に有害な影響を及ぼす可能性があります。
ボリュームEMはまた、異なるサンプルタイプごとに個別に調整されたプロトコルを必要とします。異なるタイプの哺乳類組織:植物、酵母などの単一細胞、トリパノソーム、C.エレガンスなど、すべてが最適な結果を達成するために独自のバリエーションを必要とします。固定と染色は、構造的完全性を維持し、サンプルを可能な限り生体内形態に近づけるように設計する必要があります。生理的温度、pHおよびトニシティでの組織の固定は、サンプルを可能な限り実物そっくりにするために重要です。サンプルの高圧凍結(HPF)は、より生命的な状況を維持するのに役立つかもしれませんが(またはおそらく異なるアーティファクトを生み出すだけかもしれません)、細胞や非常に薄い組織以外のHPFは、静脈氷が少量でしか生成できないため失敗します。したがって、多くの質問のために化学的固定が唯一の選択肢です。固定がHPFまたは化学的であるかどうかにかかわらず、EM実験では、構造結果を生細胞または組織イメージングの同様の結果と慎重に比較して、それらが一貫しているかどうかを確認する必要があります。また、回答が必要な特定の質問と、デジタル画像の視覚化に使用されるプロトコルを考慮しながら、染色を最適化する必要があります。
SBF-SEMとFIBシステムの両方を近接して持つことは、多くの実験で大きな利点です。SBF-SEMの大きな視野と高いX、Y分解能は、個々の構造/細胞/イベントを簡単に見つけ出し、組織内の細胞の全体的な空間的な向きを提供します。さらに、Zのサンプルを通してイメージ投射を可能にする能力は非常に強力である;ただし、細かい幾何学的ディテールを必要とする再構成は、生成される非等方性ボクセルのために、この手法を使用して失敗したり、アーティファクトを生成したりする可能性があります。FIBは、プロセスの物理学によってより小さいイメージング分野に制限されますが、その3D解像度は非常に正確な再構成のために十分です。サンプルは、さらなる処理や調製なしでSBF-SEMからFIBに移動できるため、2つの技術を組み合わせることは簡単です。我々は、特定の領域を見つけるためにサンプルを検索するためにSBF-SEMを使用することは、はるかに有能なツールの非常に高価な使用であることを認めます。ただし、新しいブロックフェースをすぐに確認し、ROI に到達したかどうかを判断する機能は大きな利点です。さらに、シリアル半薄(0.5 μm)LMセクションを使用する代替案は、検出される前に小さな構造物を除去し、切断し、グリッド上に置き、同等に高価なTEMで見なければならない単一のTEMセクションを使用してブロックを検査する場合があります。提示された方法として効率的です。
データをセグメント化してレンダリングするプログラムが多数存在し、特定の構造体のニーズが単一のアプリケーションでは最適でない場合があるため、標準ワークフローを提案することはできません。一部の単純な構造体は、非常に狭い灰色のスケール値内に収まる場合、しきい値アルゴリズムでセグメント化できます。神経構造は、Ilastik11などのプログラムを使用して半自動セグメント化できますが、ERなどのよりランダムな形の小器官にはあまり役に立ちません。顕微鏡画像ブラウザは、ボリュームEMデータを整列、セグメント化、およびレンダリングできる非常に柔軟なプログラムですが、ユーザーとの重要な操作が必要です12.原則として、結果をデジタルで視覚化するのに必要な時間は、サンプルとイメージングの準備時間を大幅に超えます。
体積EM技術は、超構造解析に第3次元を開いた。3D EMを得る他の方法は、その体積(TEM断層撮影)、またはその効率(シリアルセクションTEM)に制限があります。ほとんどの部分体積EM技術は複雑でコストがかかりすぎて個々のラボで実装できませんが、それらを提供する共有コア設備の数は増加しており、正常に画像化されたサンプルタイプの数は急速に増加しています。特定の質問と特定の組織を持つ人のために、誰かがその準備とイメージングに関するアドバイスや指示を提供することができる可能性が高いです。ボリュームEM装置は、SBF-SEMでより大きなサンプルを処理する能力とFIBでより大きなROIを粉砕する能力を含むように改善することができます。より自動化された方法で関心のある構造をセグメント化できるソフトウェアは、データを分析するプロセスを大幅に簡素化し、計算速度を向上させるため、必要な時間を短縮できます。現在の制限にもかかわらず、ボリュームEMはまだ有用なツールであり、SBF-SEMとFIB-SEMを組み合わせることで、まれなイベントを識別し、高解像度でイメージングするための効率的なワークフローを提供します。
開示事項
著者は何も開示していない。
謝辞
ボリュームEMのための機器は、フランダース政府からの寛大な助成金によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
参考文献
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved