Method Article
化学遺伝子解析で作られた皮質間ニューロン前駆体を早期産後マウス脳に移植
要約
ここでは、初期産後マウスの皮質に移植された皮質間ニューロン前駆体の活性を操作するために化学遺伝学的ツールを使用するように設計されたプロトコルを提示する。
要約
神経の発達は、環境因子と遺伝的要因の複雑な組み合わせによって調節される。各成分の相対的な寄与度を評価することは複雑な作業であり、γ-アミノブチル酸(GABA)作動性皮質間ニューロン(CI)の開発に関しては特に困難である。CIsは大脳皮質の主な抑制性ニューロンであり、個々のピラミッド型ニューロンの活性と神経アンサンブルの振動挙動の両方を調節することによって、ニューロンネットワークにおいて重要な役割を果たします。それらは、子宮エレクトロポレーションアプローチで使用して効率的に標的化することが非常に困難である一過性胚構造(中間および間神経節の発現-MGEおよびCGE)で生成される。インターニューロン前駆体は、皮質回路に統合される前に、通常の胚発生時に長距離を移動します。開発中のネットワークに分散して統合するこの驚くべき能力は、胎児間ニューロン前駆体を出生後早期の宿主皮質に移植することによってハイジャックされうる。ここでは、焦点外生体エレクトロポレーションを用いて胚間ニューロン前駆体の遺伝子改変を可能にするプロトコルを提示する。これらの工学的なニューロン間前駆体は、出生後早期の宿主皮質に移植され、容易に識別可能なCIに成熟する。このプロトコルは、複数の遺伝的にコードされたツールの使用、または細胞間前駆体における特定の遺伝子の発現を調節する能力を、遺伝的変数または環境変数が成熟に及ぼす影響を調べることを可能にする。Cの統合。
概要
ニューロンネットワークの機能は、興奮性投影ニューロンと阻害性インターニューロンのバランスのとれた補体の存在に依存しています。皮質間ニューロン(CI)は哺乳類皮質中のすべてのニューロンの20%しか表さないが、その数または機能の欠損は神経発達障害1、2の病因において重要な役割を果たすと考えられている。CIの開発の研究は、CIがアクセスしにくい一時的な胚構造で生成され、それらはpalliumに到達し、成熟した解剖学的および生理学的に発達する前に長い接線移行に従うので、困難です。プロパティ3.遺伝的および環境的メカニズムの両方がCIの発達を調節することが知られているが、複数の因子の相対的な寄与を研究することは困難であることが証明されている。
CI開発における多くの洞察は、神経節の高虫5,6から前駆体を単離した後、インビトロ培養システムを用いて得られた。これらの方法の大きな利点の1つは、単離された前駆子にラベルを付け、遺伝的に改変し、細胞自律的な変化を検出するために、その分化に詳細に従う可能性です。ただし、これらの方法では、開発中のインターニューロンとアクティブなネットワークとの相互作用に関する情報を提供することはできません。我々は、改変された前駆体を早期出生後皮質に移植することによって、これらのプロトコルを適応させた。胚性神経節の発現から単離されたニューロン間前駆体は、皮質7、8への移植時に生存、分散、宿主ネットワークへの統合を可能にする。この方法は、遺伝的マウスモデルにおけるてんかん発作の重症度を減少させるために用いられており、異なる神経発達障害9、10に対する可能な新しい治療法として提案されている。前のプロトコルは、移植11の前にウイルスベクターでこれらの前駆体をトランスデュースする手順を説明する。ここで説明するプロトコルは、ニューロン間の遺伝的修飾も可能ですが、ウイルスベクターの作成を必要とせず、プラスミドDNAのみを必要とし、柔軟性を大幅に向上させます。いくつかの研究は、結節性神経節(CGE)12における神経細胞間前駆体を遺伝的に改変するために子宮エレクトロポレーションで使用することに成功したと報告したが、この方法は再現が非常に困難であることが証明されている。
代表的な結果セクションでは、移植されたCIにおいてデザイナー薬(DREADDs13)によって排他的に活性化されるデザイナー受容体を発現するこの方法の使用を例示し、最近の出版物14で使用した方法である。ヒトコリン作動性受容体CHRM3に基づく工学的受容体であるhM3D(Gq)を発現し、その特異的リガンドクロザピン-N-オキシド(CNO)と結合しない限り、神経機能に影響を与えない。CNO投与は、細胞を発現するhM3D(Gq)の活性化を選択的にトリガする。この方法を用いて、細胞の自律化と一過性脱分極が、開発14の間にCIのアポトーシスを防ぐのに十分であることを示した。異なる遺伝的にコード化されたツールと組み合わせることで、このプロトコルは、遺伝子発現をアップまたはダウンレギュレートし、ニューロン間分化の異なる段階における細胞活性を可視化または操作する可能性を有する。
プロトコル
動物は、英国動物法(科学的手続き)法(1986年)に従って飼育され、飼育された。
注:pCAGGs-hM3D(Gq)-IRES-RFPコンストラクトの生成のために、hM3D(Gq)配列を含むSalI-StuIフラグメントはプラスミド50463(Addgene)から単離され、発現ベクターpCAGG-RFP(F.ギルモットからの贈り物)に挿入された。XhoI-エコルフ
1. マウス胚皮質スライスの調製
- 適切な洗剤溶媒および70%エタノール(EtOH)溶液(H2O)でラボ機器(例えば、ステレオ顕微鏡)および表面(例えば、ベンチ)を殺菌する。
- オートクレーブされた解剖ツールを使用し、常に100%EtOHに保管してください。
- 1xリン酸緩衝液(PBS)で4%低ゲル化温度アガロースの20mLアリコートを3本、50mLチューブで準備し、55°Cに保ちます。
- 妊娠13.5または14.5日の子宮頸部脱臼による妊娠マウスの犠牲(胚の日E13.5-E14.5)。
- 解剖はさみで、妊娠中のマウスの腹部を開き、子宮角(胚と共に)を取り出し、90mmのペトリ皿に氷冷クレブス溶液(表1)に入れます。
- まっすぐな学生の細かい鉗子のペアで、膜下嚢を開き、胚を取り除き、新鮮な氷冷クレブス溶液でそれらを移し、新しい90mmペトリ皿で。マウスの胚の脳(前脳、中脳、後頭脳)を胚体の残りの部分から解剖する。
- 後頭脳から解剖した脳を保持し、新しい90ミリメートルペトリ皿で氷冷クレブス溶液でそれらを転送し、氷の上にそれらを維持します。
- 防水ペンで、6つの35ミリメートルペトリ皿の底部の中央に、外面に直線を描きます。
- 1 4%低ゲル化アガローズ/PBS 20 mLアリコートを37°Cで5分間置き、その直後に35mmペトリ皿2個に10mLを入れ、解剖した脳を埋め込みます。
注:嗅球は下向き(ペトリ皿の底)に向かう必要があります。ペトリ皿ごとに3-4の脳を埋め込み、以前に描かれた直線でそれらを整列させる。2 つの脳の間に 3-5 mm のスペースを残します。 - 解剖されたすべての脳が埋め込まれるまで、手順 1.8 と 1.9 を繰り返します。
- 埋め込まれた脳を4°Cに置き、アガロースが固化するために、その後、適切なサイズと向きの単一のブロックに3つの脳を彫刻します。
注:脳サンプルの縁の周りに約3ミリメートルを残します。嗅球を上部にして、脳の向きを変更します。 - マイクロトームベースの表面にブロックを接着し、外科ブレードを使用して、ブロックの底部を通して、各2つの脳の間で、3つの独立したブロック(1つの脳を含む各ミニブロック)を作成します。
- ブロックを、氷冷クレブス溶液で、振動ブレードマイクロトームを使用して、250 μm厚いスライスに切断します。
- 平らに編んだ平らなマイクロへらは、中間または卵性神経節のエミネを含むスライスのみを収集します(MGEまたはCGE;図1)ポリスチレンセンターウェル臓器培養皿(60mm x 15 mm)で、フィルター膜(直径13μm、細孔サイズ8.0μm)に個別に移し、最小必須媒体(MEM、表1)に浮遊します。
- 料理をCO2組織培養インキュベーターに置き、37°C、1時間、焦点電ポレーションを準備します。
2. 急性脳スライスエレクトロポレーション
- エレクトロポレーション手順を開始する前に、100mmペトリ皿に1%アガロースゲルの50 mLを調調します。アガロースゲルを室温(RT)で約30分間固化させます。
- 小さなアガロースカラム(直径1mm、長さ10mm)を準備し、ガラスピペット(225mmの長さ、2mL容量)でパンチし、氷冷クレブス溶液でそれらを転送します。
注:2 mLピペットに適したゴム製ドロッパー電球をピペットに取り付け、それを押すことでガラスピペットからクレブス溶液にカラムを放出することができます。 - 外科ブレードを使用して、電極の表面に収まる小さなアガロースブロック(下記参照)と、脳スライスへの焦点DNA注射を行うためのベースとして使用される大きなアガローゼブロックをカットします。同様に氷冷クレブス溶液でアガロースブロックを転送します。
- 焦点注射と急性エレクトロポレーションのセットアップを準備します (図2)。
注:注射には、1)明視野解剖ステレオ顕微鏡、2)空気ピコポンプインジェクター、3)マイクロマニピュレータ、4)磁気スタンド、5)鋼ベースプレートが必要です。急性スライスエレクトロポレーションには、1)1つの正方形白金10mmペトリ皿電極、2)1つの正方形白金10mmカバー電極、3)マイクロマニピュレータ、および4)エレクトロポレータが必要です。 -
フォーカルDNA注射
- 発現ベクターのDNA混合物を調製する:pCAGGs-IRES-GFP(対照ベクター)+pCAGGs-hM3D(Gq)-IRES-RFPを、各ベクターに対して1μg/μLの濃度で調製し、1/10希釈で高速緑色溶液(ストック25mg/mL)を添加する。
- 引っ張られたガラスマイクロピペット(内径0.5mm、外径1mm)をDNA混合物の10μLで充填し、スライスの選択領域(MGE/CGE)に少量(25~50nLの範囲)を注入します(図1および図2)。
-
急性エレクトロポレーション
注:エレクトロポレーションは、焦点DNA注射の直後に行われるべきである。- ペトリ皿電極に小さなアガロースブロックを置き、フラットエンドのマイクロへらの助けを借りて、モバイルカバー電極にアガロースカラムを取り付けます。
- 支持膜を持つスライスをアガロースブロックに移し、スライスの選択した領域(MGE/CGE)の上にアガロースカラムを付けて上部電極を配置します。
注:125Vの充電電圧(それぞれ5ミリ秒の2パルス、間隔500ミリ秒)は、エレクトロポレーションに成功します(図3)。
- エレクトロポレーションの後、スライスを支持膜で皿に入れ、37°CでCO2組織培養インキュベーターに皿を移します。
- 1時間後、一次神経培養に適した基礎培地(ニューロン塩基性培地;表 1)約18〜24時間、一晩スライスをインキュベートします。
3. 細胞移植片の調製
- すべてのスライスのエレクトロポレーションの効率を確認します。許容数の蛍光細胞が観察されるスライスのみを選択します(図3)。
注:移植のための適切な数の細胞を獲得するために、実験ごとに約30スライス/実験を電気的にする(下記参照)。 - 各スライスから選択した領域(MGE/CGE)を解剖し、蛍光解剖ステレオ顕微鏡下で氷冷クレブス溶液中の小片に組織を切断します。
- 一方、900 μLニューロン基本培地を含む1.5mLチューブを37°Cの水浴に入れます。
- P1000マイクロピペットを使用して組織片を、DMEM/F12培地に1mg/mL DNaseストックの100μLをL15培地の900μLに加えて調製したL15/DNase培地の500μLを含む1.5mLチューブに移します。ティッシュピースをタップして洗います。
- 900 μL ニューロン基本培地に DNase の 100 μL (DMEM/F12 培地のストック 1 mg/mL) を追加します。
- L15/DNase培地を廃棄し、ステップ3.5で調製した200 μLニューロン基本/DNase培地で組織片を再懸濁します。
- P200マイクロピペットを180μLに設定し、滑らかで「クリーミー」な懸濁液が得られるまで、20~30回、ゆっくりと上下にピペッティングして組織片を機械的に解離します。
- ニューロン基本/DNase培地(最終総体積400μL)の200 μLを追加し、再中断します。
- 細胞の4 μLアリコートを取り、適切に希釈し、血球計に取り付けます。
- 明るい視野顕微鏡の下で、解離の効率を確認し、細胞の数を数えます。
注:解離が成功した場合、明るい(生きている)単一の細胞と細胞凝集体が観察されます。 - ステップ3.8からの遠心分離細胞懸濁液は、1,000 rpmで、RTで、5分間、その後、チューブから上清を取り出し、適切なL15/DNase培地(通常は5-7 μL)を加えて、細胞の最終的な濃度が8 x 105-1.2 x 10 6になります。セル/μL。
注:再停止中は、気泡を避けることは非常に重要です。 - 氷の上にセルアリコートを置き、注射のための追加のL15/DNase培地を持っています。
4. 頭蓋内注射
注:以下の手続きは、アニマルハウス施設内の手続き室で行われます。細胞は脳を露出させることなく新生児の子犬の脳に直接注入されるので、無菌状態は70%EtOH溶液で作業スペースを殺菌し、オートクレーブガラス針を使用することによって保たれます。頭蓋内注射には、1)明視野解剖ステレオ顕微鏡、2)マイクロインジェクター、3)マウス回復用の加熱パッドが必要です。
- 製造業者の推薦に従って針を引っ張ることによってガラスの針を準備する。このプロトコルでは、外径80μm、内径40μm、ベベル30°ベベルを備えたガラス針を使用しています。
注:前述のように、針は使用前にオートクレーブする必要があります。 - 30G、2インチの針と注射器を使用して、生物学的に不活性な油で針を手動でバックフィルします。
- 製造元の指示に従って、インジェクタユニットに針を組み立てて挿入します。
- 最大音量(69 nL)と相対低速(23 nL/s)で射出設定を決定します。
- プランジャーが完全に伸びるまで針を空にします。
-
針を満たして
- 移植テープから小片を切り取り、明るい視野解剖ステレオ顕微鏡の下に置きます。P10マイクロピペットを使用して、サンプル(セルアリコート)から5μLをテープに移し、球状のドロップが形成されます。
- サンプルに針の先端を置き、針を埋めます(プランジャーは引き込み、それにサンプルを引き出します)。
注:サンプルは非常に粘性である必要がありますので、サンプルが平衡化し、気泡が形成されるのを防ぐ遅い速度で、小さなステップで針を埋めます。サンプルは針の中で滑らかで均質でなければならない。サンプルが粘性が高すぎて針を満たすることができない場合は、正しい粘度を得るために必要なL15/DNase培地を多く加えます。それにもかかわらず、これはサンプルの濃度を変更し、理想的には避けるべきです。
- 生まれたばかりの子犬(生後0-2[P0-P2])を氷上で2~5分間麻酔する。
注:子犬が動いていないことを確認してください。 - 明視野解剖ステレオ顕微鏡の下に麻酔された子犬を置きます。
- 各半球でそれぞれ69 nLの3-4注射を行います。
注:注射部位は、中線に約1mm横に位置し、1mmの風下からブレグマまで、1mmのロストラル間に位置する。針の先端は、約1mmの深さの槍の表面に配置する必要があります。各注射の後、針は約30sの所定の位置に残され、期間内に引き抜かれる。 - 注射の直後に、その最も低い設定(37 °C)で加熱と加熱パッドに子犬を置きます。子犬が回復すると、母親と一緒にケージに転送します。
注:おかごの中に子犬を置いておかないでお母さん。全体の手順(そのごみから子犬を取り除くことから、それが返されるまで)は10分未満続くべきです。
5. クロザピン-N酸化物注射
- DREADDリガンド、CNOストック溶液を50μLのジメチルスルホキシド(DMSO)で1mg希釈してCNOストック溶液を半透明になるまで調記する。CNOの最終的な濃度が0.1 mg/mLであることを生理生理物で10 mLまでトップアップ。
注:DMSOは有毒だ0.1%より高い濃度にそれを使用することは避けてください。CNO含有溶液と同じDMSO濃度を含む生理生理生理物溶液を制御として使用する。 - 出生後14日目および3日間(P14-P16)から、各マウスでCNO(CNO濃度:1mg/kg)または0.05%DMSOの2回の経皮内注射(CNO濃度:1mg/kg)または0.05%DMSOを1日あたり、12h離れて行う。
- 最終日(P17)に、30分1時間の時間枠内で頸部脱臼による単回注射及び犠牲マウスを行う。
結果
ここで提示した手順を用いて、出生後初期の皮質間ニューロンの生存が細胞自律的な方法での活動によって調節されるかどうかを試験した。pCAGGs-IRES-GFP(対照)とpCAGGs-hM3D(Gq)-IRES-RFP発現ベクターを用いて、3つの脳スライスエレクトロポレーション実験(12~16胚[E14.5胚])を、各構築物に対して1μg/μLの濃度で行いました。私たちのエレクトロポレーション実験では、ほんの一部(約50%;図 3)GFP+ニューロンの共発現hM3D(RfP+)の、したがってGFP+RFP-集団はDREADDリガンドの効果のための内部制御として役立った。トランスフェクトされた皮質胚間ニューロンを機械的に解離し、得られた細胞懸濁液(8 x 105細胞/μL)をP0-P1野生型マウスの皮質に移植した。脳1人当たり6つの注射を行いました。各実験では、少なくとも6つの新生の子犬が注入された。CNOの投与は、活動依存性タンパク質cFosの発現によって実証されるように、トランスフェクトRFP+細胞の活性を選択的に増加させた(図4)。記載されたプロトコルに従ったCNO処理(1日2回P14-P17を投与)は、GFP+RFP+に対するGFP+RFP+細胞に対する割合の増加をもたらし、車両と比較して(生理食べ物中の0.5%DMSO) 管理されたリッターメイト(図5)。
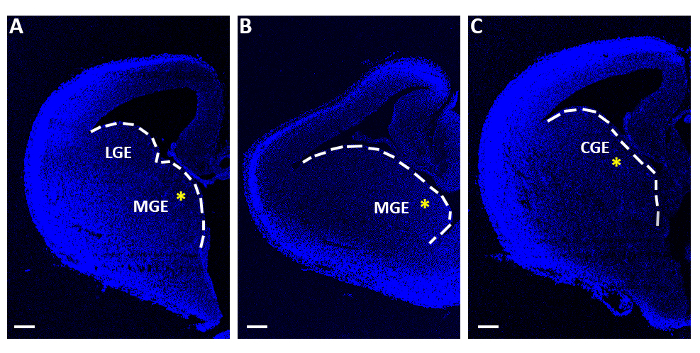
図1:急性エレクトロポレーション実験に用いられる代表的なテレンスファリックスライス。(A-C)3つの異なるシーケンシャルロストロカウダルレベルで得られたテレンスファリックスライスは、4',6-ダイアミディーノ-2-フェニリンドール(DAPI)で染色した。LGE: 横性神経節の卓越性;MGE: 中間神経節のエミレンス;CGE: 思春期の神経節の発現。スケールバー = 200 μm。黄色のアスタリスクは、各スライスのエレクトロポレーション部位を示します。白い線は神経節の優位性の端を示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
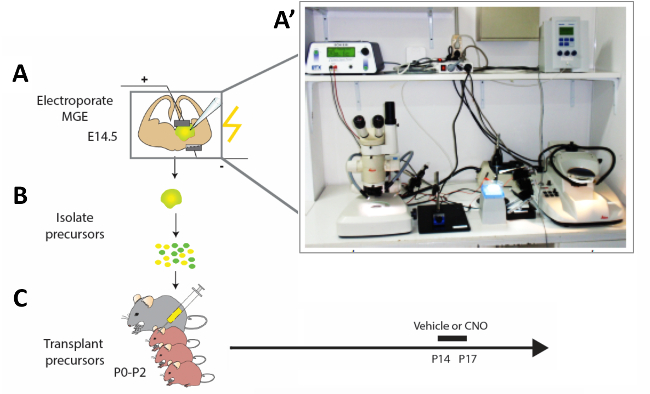
図 2: 実験ワークフローの概略図。(A)マウス脳スライスは適切な構成で電気的にされ、(B)12時間修飾皮質間ニューロン(CI)前駆体が単離され、(C)新生児マウスの子犬のパリウムに移植された(P0−P2)。未熟なCIの活性を修飾するために、細胞移植を受けたP14匹の子犬は、提示されたプロトコルに従って4日間CNOまたは車両を注入した。(A')急性マウス脳スライスエレクトロポレーションセットアップの写真。この図のより大きなバージョンを表示するには、ここをクリックしてください。
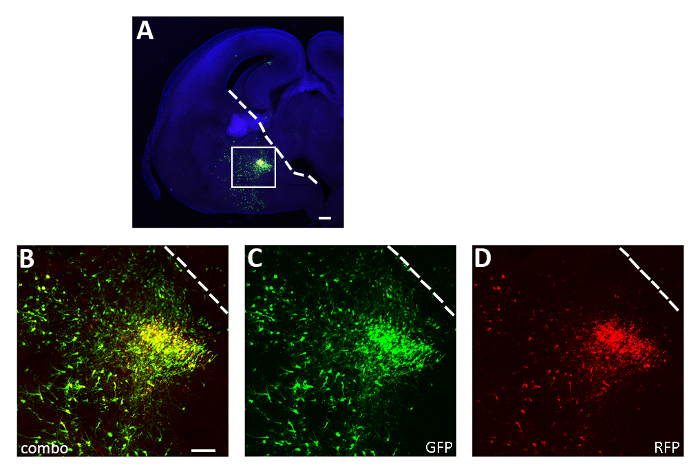
図 3:代表的な急性スライスエレクトロポレーション実験に成功。(A) PCAGGs-IRES-GFP(GFP)とpCAGGs-hM3D(Gq)-IRES-RFP(RFP)プラスミドを共にCGEにトランスフェクトしたE14.5胚脳の代表的な冠状セクションを12時間培養した。このセクションは、GFP(A、B、C)およびRFP(A、B、D)に対して免疫染色されている。パネルAのボックス化された領域は、蛍光レポーター(B)、GFP(C)およびRFPのみ(D)の両方の発現を示すために拡大される。白い線は神経節の優位性の端を示します。B-D:同じ写真、異なるチャンネルまたは2つの異なるチャンネルの組み合わせ。スケールバー = 200 μm (A)、100 μm (B-D)。この図は、Denaxa ら14.この図のより大きなバージョンを表示するには、ここをクリックしてください。
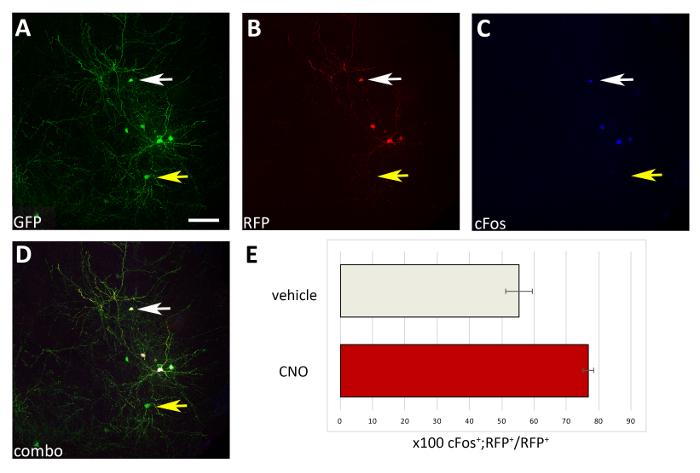
図4:CNO投与時のM3D(Gq)発現移植CIsの活性の細胞自律的増加。(A-D)P1で移植されたP17マウスの冠状動脈部の代表的な共焦点画像は、pCAGGs-IRES-GFP(GFP)とpCAGGs-hM3D(Gq)-IRES-RFP(RFP)プラスミドの両方でトランスフェクトされ、CNOで処理されたCI前駆体を有する。このセクションは、GFP (A)、RFP (B)、および cFos (C) に対して免疫染色されています。(D) A、BおよびC免疫蛍光(コンボ)の組み合わせ画像。なお、両方のプラスミド(A-Dの白い矢印)を共発現するCIのみが、対GFPプラスミド(A-Dの黄色の矢印)のみを発現するCIと比較してcFos+である。(E)P1で移植したP17マウスのpalliumに見られるcFos+RFP+細胞の定量(全RFP+集団に正規化)を車両またはCNO(N=2)で処理した。 A-D:同じ写真、異なるチャンネル、または3つの異なるチャンネルの組み合わせ。スケールバー = 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
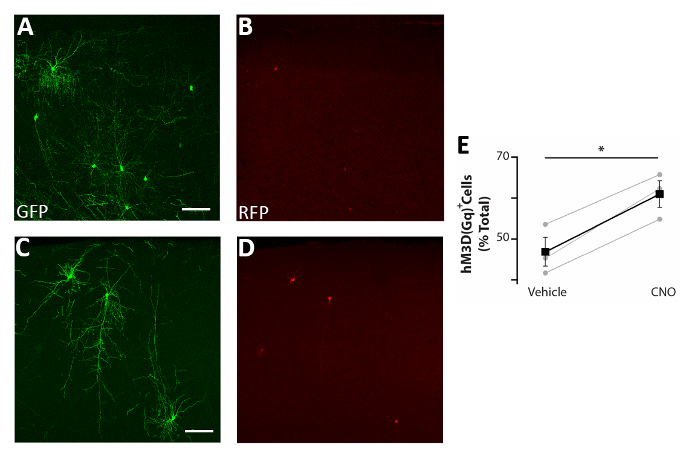
図 5:細胞自律的に増加するCIsの活性は生存を高める.(A-D)PCAGGs-IRES-GFP(GFP)とpCAGGs-hM3D(GFP)-IRES-RFP(RFP)プラスミドおよび処理された車両(A-B)の両方でトランスフェクトされたCI前駆体を有するP0-P2で移植されたP17マウスの体感覚皮質冠状の代表的な共焦点画像(C-D)。(E)P0-P2で移植したP17マウスの前脳に見られるRFP+細胞の定量(GFP+集団全体に正規化)。 RFP+ (車両) = 47% ± 3%、 CNO = 61% ± 3%、p = 0.01、学生の対サンプル t 検定、n = 3 車両および 3 CNO、脳あたりの最小 150 細胞数。AとB:同じ写真、異なるチャンネル。CとD:同じ写真、異なるチャンネル。スケールバー = 50 μm.この図は、Denaxa ら14.この図のより大きなバージョンを表示するには、ここをクリックしてください。
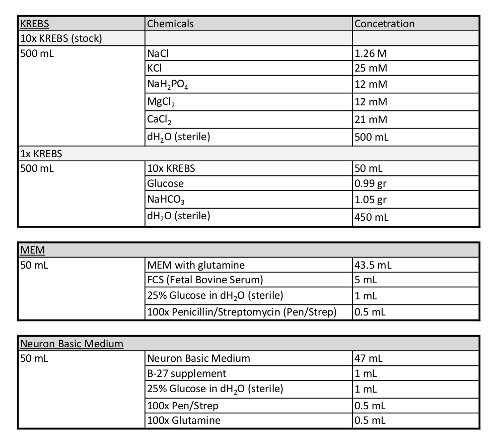
表 1: このプロトコルで使用されるメディアに関する追加情報。
ディスカッション
ここでは、CI前駆体の活性を遺伝的に改変してCI成熟に及ぼす影響、および/または活動変調されたCIが統合皮質の組み立て/機能に及ぼす影響を研究するために、広くアクセス可能な方法論を説明する。回路。
過去には、私たち自身を含むいくつかの研究室は、投影ニューロン6を遺伝的に改変するために子宮エレクトロポレーション実験を行っていた。しかし、CI前駆体を含む神経節の発現に対する子宮エレクトロポレーションは、電気伝導経路の問題のために非常に困難である。この問題を解決するために、少数のラボが超音波誘導注射を行い、それに続いてエレクトロポレーションを行っています。このプロトコルは、科学コミュニティの大半がアクセス可能なこれらの方法論に代わるものです。
このプロトコルの最も困難な側面の1つは、通常、目盛り解析が行われる場合(実験設計に非常に依存するが、通常はP17より古い)、宿主皮質で生き残る細胞の数を成熟段階まで最大化することである。調査者が注意すべき3つの重要なステップがあります:(1)エレクトロポレーションの効率。これは、DNAプラスミドの純度を確保することによって最大化することができます。この手順には、高品質のDNAプラスミド(A260/A280比1.9~2.0)のみを使用してください。塩化セシウムDNA精製を用いることで、このような高品質なDNA製剤を得ます。もう一つの重要な要因は、目的の遺伝子の発現を駆動するプロモーターです。我々は、鶏b-アクチンプロモーターから成るpCAGGベクターが非常に強力であり、エレクトロポレーション効率を劇的に高めることができることを見出した。(2) 開始ドナー胚の数。同じ段階の胚の多数(12-16)が電気的であることを確認することが重要です。この数は、より多くの実験者が胚の解剖と断面を一緒に行っている場合、胚皮質スライスが得られ、電気的に、できるだけ早くインキュベーターに移ることが重要である場合に増加させることができる。(3)成熟期まで移植細胞生存の可能性が高いことを確認するために、各子犬に大量の細胞を注入することが重要です。さらに、低密度細胞製剤は細胞と培地との不均一な混合を引き起こし、移植された脳に有意な変動を生じるため、移植が成功する可能性が劇的に向上します15.
ここで説明するプロトコルは、細胞自律的な方法でCI生存を調節する活動の役割を調査するために調整された。CNO注射を行うためのP14-P17時間枠は、公開されたデータに従って特異的に選択され、移植されたCI前駆子の細胞死のピークがこの期間16の間に起こることを示す。したがって、この時間枠またはCNO注射の頻度は、他の細胞型または脳領域に当てはまらず、研究者は特定の実験目的に従ってこれらのパラメータを調整する必要があります。最後に、ここでは、CIの頭蓋内注射に関する方法論は、P0-P5の子犬に対してのみ実行可能です(マウスラインの背景にも依存します)。原則として、P5上の任意の注射は、頭蓋骨15の間引きまたは除去を必要とします。
このプロトコルの主な利点の 1 つは、新しい遺伝子組み換えツールを使用して、異なる分化のさまざまな段階で、開発中のネットワークに統合する際に、シスの活動を視覚化または操作する機能です。新しい遺伝的にコードされた電圧およびカルシウムセンサー、ならびに新しい化学遺伝学および光遺伝学的ツールの発見のペースで、このプロトコルは、研究者がAddgeneなどのプラスミドリポジトリにリリースの数週間以内にそれらを使用することを可能にします。
開示事項
著者は何も開示していない。
謝辞
この作品は、ERCスターターグラント(282047)、ウェルカムトラスト調査賞(095589/Z/11/Z)、FP7 EC DESIRE助成金、JBリスター研究所賞の支援を受けました。V.P.の研究室での仕事はBBSRC(BB/L022974/1)、英国医学研究評議会(MRC)、フランシス・クリック研究所(MRC、がん研究英国、ウェルカム・トラストから資金を受け取る)によって支えられています。M.D.ラボでの研究は、ギリシャの研究を支援する財団のイニシアチブの一環として、スタブロス・ニアルコス財団からB.S.R.C.「アレクサンダー・フレミング」への助成金を通じて可能になりました。
資料
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
参考文献
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved