このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
免疫学的単一細胞力分光法のための単一T細胞または単一粒子による原子間力顕微鏡片持ちの機能化
要約
我々は、免疫学的研究のための単一のT細胞およびビーズ粒子を用いて原子間力顕微鏡(AFM)片持ちを機能化するプロトコルを提示する。AFMによる単一対T細胞樹状細胞結合をプローブし、蛍光イメージングを用いてAFMによる単一固体粒子に対するマクロファージのリアルタイム細胞応答を監視する手順が示されている。
要約
原子力顕微鏡ベースの単一細胞力分光法(AFM-SCFS)は、生細胞の生物物理学的特性を研究するための強力なツールです。この技術は、細胞、受容体およびリガンド間の相互作用の強さとダイナミクスを、他の多くのバリエーションと共に調知することを可能にする。また、単一細胞に対して物理的または生化学的刺激を時空間的に制御した方法で送り出すメカニズムとしても機能し、生細胞と組み合わせると、特定の細胞活性化とその後の細胞イベントをリアルタイムで監視することができます。蛍光イメージング。これらのAFM-SCFS測定の重要なステップは、AFM片持ち機能化、つまり、目的の対象を片持ちに取り付けることです。ここでは、免疫学的研究のために、単一のT細胞と単一のポリスチレンビーズでAFM片持ちを修飾する方法を紹介する。前者は、溶液中の平らな片持ちの先端に単一のT細胞を結合する生体適合性の接着剤を含み、後者は空気環境における単一ビーズ接着のためのエポキシ接着剤に依存する。各片持ち修正に関連する2つの免疫学的応用も同様に提供される。ここで説明する方法は、異なる細胞タイプおよび固体粒子に容易に適合させることができる。
概要
原子力顕微鏡(AFM)、汎用性の高いツールは、細胞生物学研究1、2、3、4、5で多くの応用を発見しました。その高解像度イメージング機能とは別に、ネイティブ力プローブ機能により、生細胞の生物物理学的特性を単一細胞レベル6、7の現場で直接調べることができる。これらには、細胞内構造または細胞全体の剛性8、9、10、11、12、特異的リガンド/受容体結合強度が含まれる。細胞表面上の単一分子レベル13は、固体粒子と細胞の単一対間または2つの細胞間の接着力1、2、14、15。後者の2つは、多くの場合、単一細胞力分光法(SCFS)16として分類される。様々なばね定数を持つ容易に利用可能な片持ちのために、AFMにアクセス可能な力範囲は、数十からの力を含む細胞イベントの全範囲を十分にカバーするいくつかのピコニュートン(pN)からマイクロニュートン(μN)までかなり広いです。受容体ベースの単一分子結合などのpNの、nNへの、例えば、咽頭細胞イベント15。この大きなダイナミックフォースレンジは、光学/磁気ピンセットやバイオ膜力プローブなどの他の力プローブ技術に比べてAFMに有利であり、弱力測定に適しており、通常は200 pN17未満の力を持ちます。,18.さらに、AFMは、時空間的に定義された方法で単一細胞に様々な刺激を提供する高精度マニピュレータとして機能することができます 4,19.これは、リアルタイム単一細胞活性化研究に望ましい。生細胞蛍光イメージングと組み合わせることで、特定の刺激に対するその後の細胞応答を同時に監視できるため、AFMベースのSCFSは光学イメージングとして非常に堅牢になり、細胞シグナル伝達をプローブする実用的なツールを提供します。例えば、AFMは、骨芽細胞20でカルシウム過渡を引き出すために必要な株を決定するために使用された。本研究では、AFM先端を用いた培養骨芽細胞への局所的な力の適用後、カルシウム過渡性画像を用いてカルシウム過渡を蛍光で追跡した。最近では、肝系ステラー細胞(HSC)が増殖したコラーゲン線維化を伸縮するためにAFMが採用され、このメカノ変換HSC活性化は蛍光Srcバイオセンサによってリアルタイムモニタリングされ、そのリン酸化物は、バイオセンサの蛍光強度は、HSC活性化3と相関している。
AFMベースのSCFS実験では、AFM片持ち式の適切な機能化が測定の成功に向けた重要なステップです。私たちの研究の関心は免疫細胞の活性化に焦点を当てているので、我々は定期的に食細胞症や強力な免疫応答を引き起こす可能性のある単一固体粒子などの粒子状物質を持つ片持ちを機能化 4,14,活性化樹状細胞(DC)2などの抗原提示細胞を有する免疫シナプスを形成できる15および単一T細胞。 単一固体粒子は、通常、空気中のエポキシ接着剤を介して片持ちに結合されますが、単一のT細胞は、その非粘着性の性質のために、溶液中の生体適合性接着剤を介して片持ちに機能化されます。ここでは、これら2種類の片持ち修正を行い、2つの関連するアプリケーションを提供する方法について説明する。最初の応用は、AFM-SCFSとのT細胞/DC相互作用をプローブし、細胞力学の観点から制御T細胞の抑制機構を理解することです。2つ目は、AFMと生細胞蛍光イメージングを組み合わせて、受容体非依存ホスファチリノシトール4,5-ビスリン酸(PIP2)の分子機構を明らかにするために、固体粒子に対するマクロファージの細胞応答をリアルタイムで監視することを含む。モエシンは、咽頭細胞症を媒介した。このプロトコルの目的は、興味を持つ研究者が免疫学的研究のためのAFMベースの単一細胞分析を用いて独自の実験設定を設計し、実装するための参照フレームワークを提供することです。
プロトコル
マウス実験プロトコルは清華大学の動物ケアガイドラインに従う
1. 単一T細胞による片持ち可能な機能化
- マウス脾臓細胞製剤
- 二酸化炭素を用いてマウス(8〜16週齢(どちらかの性別)を犠牲にし、続いて子宮頸部脱臼を行う。
- 75%のエタノールでマウスをきれいにし、中間線の皮膚切開を行い、脾臓摘出を行います。
- ガラススライドを使用して2%の胎児ウシ血清(FBS)を含むPBSの4 mLで脾臓を均質化し、70 μmメッシュナイロンストレーナーを通して細胞懸濁液を通過させることによって凝集体および破片を除去する。
- 5分間500xgで細胞懸濁液を遠心分離し、上清を捨て、赤血球溶解バッファーの2mL(室温でバランスをとった)で細胞を5分間再懸濁する。
- 2%FBSおよび1 mM EDTA(溶液Aとして標識)を含むPBSの1 x 108細胞/mLの密度で細胞懸濁液を500 x gで遠心分離し、細胞密度に応じて通常0.25-2 mLを再懸濁する。再懸濁したセルを 5 mL (12 x 75 mm) のポリスチレン丸底チューブに移します。
- マウス CD4+ T 細胞の準備
- 50 μL/mLラット血清(材料表参照)と50 μL/mL CD4+ T細胞単離カクテル(材料の表を参照)をステップ1.1.5から得られた細胞試料に追加します。室温で10分間混ぜてインキュベートします。
- ストックストレプトアビジンコーティング磁性粒子溶液(材料の表を参照)を30sまたは粒子が均等に分散するまで渦。
- 75 μL/mLストレプトアビジンコーティング磁性粒子を細胞試料に追加します。室温で2.5分間混ぜてインキュベートします。
- 溶液Aを加えてセルサンプルを2.5mLに上げ、2~3回上下にゆっくりとピペッティングして混ぜます。
- サンプルチューブ(蓋なし)を磁石(材料の表を参照)に入れ、室温で5分間インキュベートします。新しい5 mLポリスチレンラウンドボトムチューブに濃縮されたセルサスペンションを慎重に注ぎます。
- 5分間500xgでセル懸濁液を遠心分離し、上清を廃棄し、濃縮されたT細胞を溶液Aの500 μLで再懸濁する。
注:濃縮されたCD4+T細胞には、従来のT細胞と調節細胞の両方が含まれています。
- 従来のT細胞からの調節T細胞分離
- ステップ1.2.6から得られた濃縮T細胞サンプルに25 μLのFcRブロッカー(材料表を参照)を追加します。室温で5分間混ぜてインキュベートします。
- T細胞陽性選択カクテルの25 μLをT細胞サンプルに追加します(材料の表を参照)。室温で10分間混ぜてインキュベートします。
- PE選択カクテルの10 μLをT細胞サンプルに追加します(材料の表を参照)。室温で5分間混ぜてインキュベートします。
- ストックデキストランコーティング磁性粒子溶液(材料の表を参照)を30sまたは粒子が均等に分散するまで渦。
- T細胞サンプルに10μLのデキストランコーティング磁性粒子を添加します。室温で5分間混ぜてインキュベートします。
- 溶液Aを追加してTセルサンプルを2.5mLに上げ、2~3回上下にゆっくりとピペッティングして混ぜます。
- T細胞試料管(蓋なし)を磁石に入れ、室温で5分間インキュベートします。慎重に新しいチューブに上清を注ぎます。
注:上清は濃縮された従来のCD4+T細胞を含んでいる。 - 濃縮された従来のCD4+T細胞を5分間500xgで遠心分離し、10%FBS、0.05 mM β-メルカプトエタノール、0.01 M HEPESおよび1%ペニシリン/ストレプトマイシン(培地B)を含むRPMI1640の4mLで細胞を再懸濁する。
- 制御T細胞が磁石から濃縮されたチューブを取り外します。チューブに溶液Aの2.5 mLを追加し、2〜3回上下にゆっくりとピペッティングして混ぜます。チューブを磁石に戻し、5分間インキュベートし、慎重に注ぎ、上清を捨てます。この手順をもう 3 回繰り返します。
- 培地Bの2mLで濃縮調節T細胞を再停止する。
- 精製された従来のT細胞と調節性T細胞の両方を100 U/mL hIL-2で一晩または37°Cで少なくとも4時間、加湿したCO2で37°Cで少なくとも4時間インキュベートしてから、片持ち可能な機能化に使用します。
- 樹状細胞製剤
- ピラニア溶液を調出し、30%H2O2(30%)70% H2SO4 (コンク) (v/v)。H2 O2の3mLをH2 SO4の7mLに一定の撹拌と冷却の下でゆっくりと注ぐ。
注意:ピラニア溶液は非常に腐食性であり、それは燃焼し、体組織を破壊することができます。したがって、混合物がビーカーの周りに飛び散るので、フードの下にピラニア溶液を使用し、適切な安全装置を着用する方が安全です。使用後はNaOHで溶液を中和し、pH7にします。 - 直径24mmのガラスカバーをピラニア溶液に30分間浸し、その後、滅菌超純水で十分に洗い流します。
- 75%エタノールに1組のピンセットを30分間浸し、冷たい消毒を行います。
- ピンセットで6ウェル培養プレートにきれいなガラスカバーリップを導入します。
- DC2.4細胞を4mLの培地Bで予自培養した6cmのプラスチック培養皿を傾け、すべての培地を吸引する。培養皿に2mLのPBSを加えてDC2.4細胞をすすいで捨てます。このすすり手順をもう 2 回繰り返します。
- 0.25%トリプシンEDTAの1 mLを2分間培養皿に加え、この皿に中Bの1mLを加え、酵素消化反応を終わらせる。消化した細胞懸濁液を15 mLチューブに移します。
- 5分間500xgでセル懸濁液を遠心分離し、中Bで2 x 105セル/mLの密度でDC2.4細胞を再懸濁する。
- ガラス上の種子DC2.4細胞はステップ1.4.4で調製し、5%CO2で37°Cで加湿室で一晩細胞をインキュベートする。
注:2つの単一細胞間の相互作用力を測定するためには、比較的低濃度のDC2.4細胞(すなわち<10%の合流性)が細胞間の適切な間隔を持つ必要がある。
- ピラニア溶液を調出し、30%H2O2(30%)70% H2SO4 (コンク) (v/v)。H2 O2の3mLをH2 SO4の7mLに一定の撹拌と冷却の下でゆっくりと注ぐ。
- AFM片持ち製剤
注:単一細胞力分光実験に適した片持ちは、通常0.01-0.06 N/mの範囲で、低ばね定数を持つものである。ここで、単一細胞および単一固体粒子の機能化に対して、ソフトチップレス片持ちが好ましい。- ピラニア処理またはプラズマまたはUV-オゾン洗浄によって片持ちをきれいにします。
- クリーニングされた片持ちはAFMスキャンヘッドに取り付けます。
- 純水で満たされたクリーンなサンプルチャンバを準備し、最初にガラス基板上の力曲線を実行して水溶液中の片持ち式を校正し、感度(接近曲線の反発部に対する線形フィットの傾き)を得て、次にAFMの取扱説明書に従ってスプリング定数を抽出するために熱雑音スペクトルを記録する。
- 溶液からAFM走査ヘッドを取り出し、取り付けられた片持ち元を数滴の純粋なエタノールで洗い、カンチレバーを走査ヘッドに乾かしたままにします。
- 片持ち式に単一の T セルを取り付ける
- 37 °Cで5%CO2で生細胞環境筐体を予熱します。
- ステップ1.4.8から試料チャンバアセンブリに成長したDC2.4セルでガラスカバースリップを取り付け、すぐに中Bの600 μLをチャンバーに追加し、AFMサンプルステージに組み立てに置きます。
- hIL-2インキュベートされたCD4+T細胞(従来型または調節的なT細胞)を試料チャンバに添加する。
注: サンプルの総容積は1 mLを超えてはなりません。 - 追加された CD4+T セルがカバースリップの底に完全に落ち着くまで待ちます。
注:気泡は実験に大きな乱れを引き起こすので、ステップ1.6.2と1.6.3の気泡を避けることをお勧めします。 - 図1に示すように、取り付けられた片持ちの端に2μLの生体適合性接着剤を追加し、サンプルステージにスキャンヘッドを素早く配置し、生体適合性接着剤でコーティングされた片持ち端をソリューション。
注意:ピペット先端でガラスブロックや片持ち式に触れないでください。ここで使用される生体適合性接着剤は空気中の酸化を起こしやすいので、この工程はできるだけ早く行う必要があります。 - サンプルステージを動かして片持ち先端の下に健康なTセルを粗く顕微鏡下で見つけ、走査ヘッドを動かして位置を細かく調整します。
注:正常なCD4+Tセルは、通常、明視野イメージングにおいて比較的大きなサイズ、滑らかなエッジ、および光学的に透過性を有する。 - ステッパーモータを制御して、ステップサイズを50μmから10、5、2、0.5 μmに徐々に下げていきます。ステッパーモータの位置を保持し、片持ち先端とセルの間のより良い位置合わせのためにスキャンヘッドの位置を調整し、片持ちがレーザー光線の小さな変位によって示されるターゲットTセルとしっかりと接触したら0.5-1.5 nNの典型的な力の範囲に対応する光検出器の位置。
注:このステップは、セットポイント(セルに適用される力)と接触時間をソフトウェアで明確に定義できる単一の力測定を実行することによっても行うことができます。しかし、T細胞の非接着性のために、手動アプローチは、自動接近よりも照準、位置決め、接触時間を制御する柔軟性を提供し、T細胞接着のために確実に動作します。将来の実験者は、対象のシステムに適して動作する方法を見つけるために、手動と自動アプローチの両方を試してみる必要があります。 - 接触の30s後に片持ち式を引き込む。
注: セルが片持ちで移動する場合、アタッチメントは成功します。そうでない場合は、ステップ 1.6.6 を繰り返しますが、別の T セルで繰り返します。生体適合性接着剤は酸化が容易である。ステップ 1.6.5-1.6.7 は 5 分以内に完了する必要があります。さらに、T セルのアタッチメントで同じ片持ちが 3 回失敗した場合は、新しい片持ち式を使用し、接続手順をステップ 1.5.2 から再度開始する必要があります。
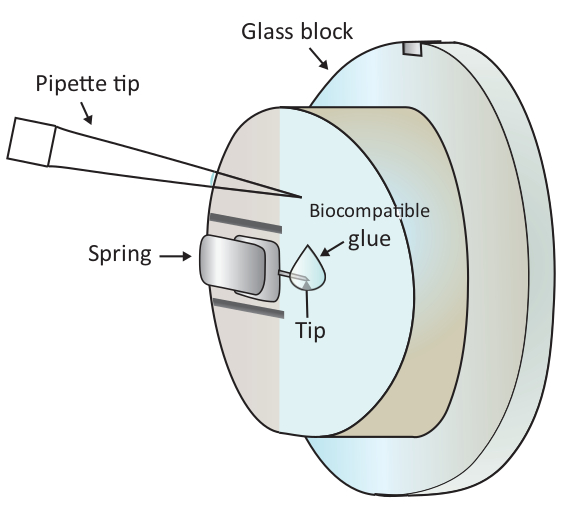
図1:取り付けられた片持ち式に生体適合性接着剤の小さな滴を加える概略図。片持ちはAFMスキャンヘッドに取り付けられているガラスブロックホルダーのクランプスプリングを介して取り付けられます(ここでは描かれていない)。スキャンヘッドが水平面に立つと、片持ちは図面に示すように垂直方向に配置されます。約2μLの生体適合性接着剤は、マイクロピペットで片持ちの先端に添加することができます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
- 単一対T細胞/樹状細胞相互作用の強制分光法
注:細胞/細胞相互作用をプローブするには、2つの細胞を完全に分離するために、従来の10-15 μmより大きいZ範囲を持つAFMが必要です。ここで使用されるAFMは100 μmのZ範囲を有し、細胞/細胞接触後に樹状細胞からT細胞を分離するのに十分である。- サンプルステージまたはスキャンヘッドを移動して、接続されたTセルを別のDC2.4セルの上に配置します(図2を参照)。
- 適切なパラメータを設定し、フォース分光を実行します。
注:通常、次のキー設定が使用されます:セットポイント0.5 nN、引っ張り長さ50 μm、Z移動定数速度、拡張速度5 μm/s、接触時間10s、遅延モード定数力。T-DC ペアごとに、20 回のフォース カーブが収集され、さらに解析に最低 14 個のフォース カーブが使用されます。 - 新しい洗浄された片持ちは、ステップ1.5.3のように純水でキャリブレーションし、同じT-DCセルサンプルに戻り、別のT-DCペアのステップ1.6と1.7を繰り返します。各条件に対して少なくとも 5 つのペアをプローブします。
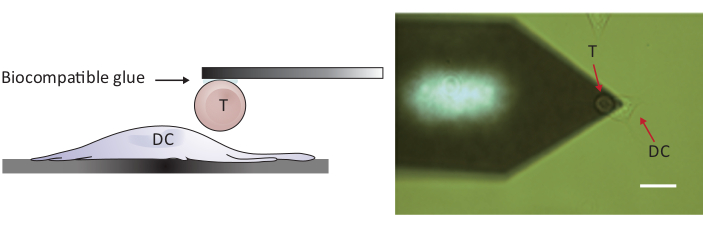
図2:単一のTセルとDCの間の力プローブの実験的構成。(A) 片持ち式に取り付けられたTセルを力プローブ用基板上で成長させたDCに持ち込む実験構成の概略図。(B) T細胞機能性片持ちとDCの明視野画像。スケールバー、20 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
2. 単一のポリスチレンビーズを用いた片持ち可能な機能化
- シングルビーズ製剤
- 6 μmポリスチレンビーズのストック懸濁液を100%エタノールで希釈します。
注:希釈ビーズ溶液の濃度は、ガラスカバースリップ表面に添加すると、個々のビーズが溶媒蒸発後に有意なクラスタリングなしで十分に分離するように十分に低くする必要があります。 - 24mm径ガラスカバーをエタノールで清掃し、N2の空気の流れでほこりを取り除きます。
- 洗浄されたガラスカバーをサンプルチャンバアセンブリに取り付け、組み立てを顕微鏡に取り付けます。
- 希釈ビーズ溶液を左側に入れ、カバースリップの中心に近づけ(図3参照)、20倍の目的で顕微鏡下の明視野で溶媒蒸発後のビーズ間の間隔を確認します。個々のビーズが十分に分離されている場合は、次のステップに進みます。
- マイクロピペットの先端または爪楊枝をよく混合したエポキシ接着剤に浸し、右側に連続した穏やかなタッチで3つの別々のスポットにそのような接着剤の少量を転送しますが、カバースリップの中心に近い。
注: 3 つの接着スポットは垂直方向に位置合わせする必要があります(図 3を参照)。接着剤の量が最も少ない最後のスポットは、後で使用されます。
- 6 μmポリスチレンビーズのストック懸濁液を100%エタノールで希釈します。
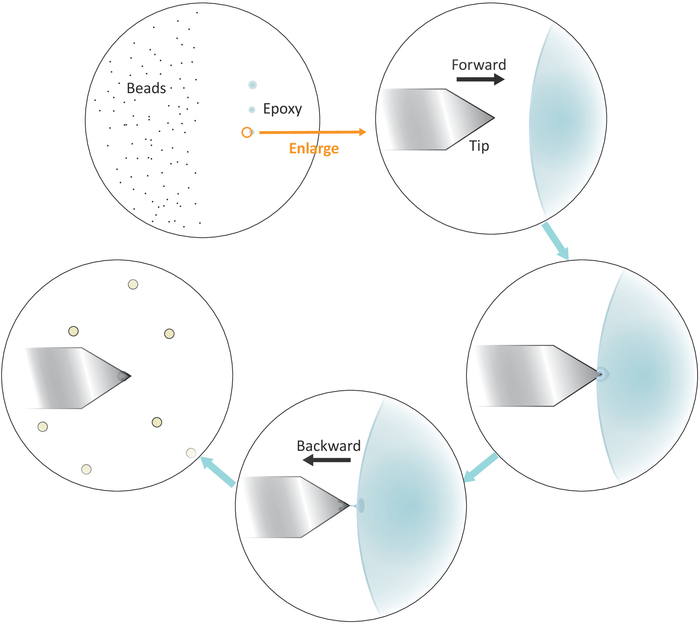
図3:片持ち式での単一ビーズ機能化のための作業フローの概略表現。よく分離されたミクロンサイズのビーズは、基板の左側に調製され、エポキシ接着剤の小さな量は、3つの連続した穏やかなタッチを介して基板の右側に転送され、3つの接着剤スポットをもたらす。接着剤の最小量を持つ最後のスポット(円で示される)のみが片持ちの端をコーティングするために使用されます。左から接着剤に片持ち端に近づき、片持ち端の最後に接着剤を閉じ込めるために接着剤に浸すと、片持ち端を後方に動かします。ターゲットビーズを片持ちの下に持ち込み、ビーズの接着にしっかりと接触する前に適切に整列します(通常は2~5nN)。ビーズが片持ち缶で正常に機能すると、新しい片持ち缶を取り付けて新しい機能化サイクルを開始できます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
- AFM片持ち製剤
- AFMスキャンヘッドにきれいなチップレス片持ちを取り付けます。
- この片持ちは、きれいな表面で空気中で調整し、ばね定数を得ます。
- 片持ち缶に単一のビーズを取り付ける
- 図 3に示すように、最後のエポキシ接着剤スポットの左側の境界上に片持ち先端を配置します。
- ステッパーモーターを小さなステップサイズで下げることで、片持ち先を接着剤にゆっくりと近づけます。
- 先端が接着剤に浸されたら、AFMスキャンヘッドを手動で(左に)後方に動かして、片持ち先を接着剤から素早く引き離します。
注: ほんの少量の接着剤だけが先端の端に付着していることを確認します。先端に過度の接着剤がある場合は、触れることによって接着剤の量を減らし、その後、空の表面に先端をスライドさせることが可能である。 - 十分に隔離された単一のビーズの上に片持ち先端を移動します。
- 片持ち素を単一のビーズにゆっくりと近づき、ビーズとしっかりと接触させる(2-5 nNの典型的な力範囲に対応する光検出器のレーザー光位置の変位によって示される)約10sの間にtの微調整IP の位置を横に配置すると、先端の最後にビードを見つけるのに役立ちます。接触の終わりに先端を引き込みます。
注:元の焦点面からの非常にビーズの消失は、成功した付着イベントを示します。 - ビーズを改変した片持ちは慎重に取り外し、接着剤を完全に固化させるため、一晩片持ちの箱に入れます。
- AFMによって送達される単一ビーズに対するマクロファージの細胞応答の蛍光イメージング。
注:蛍光イメージングは、市販の顕微鏡スタンドに基づいて、自家製目的型全内部反射蛍光顕微鏡で行った。このイメージングシステムには、4つのレーザー光源(405 nm、488 nm、561 nm、647 nm)、2色検出用のスプリッタービューア、広視野イメージング用の電子乗算電荷結合デバイス(EMCCD)が装備されています。- ガラスカバー上のRAW264.7細胞を5%CO2加湿室で37°Cで成長させます。
- トランスフェクト・メシン-EGFPおよびPLCδ-PH-mCherryをトランスフェクションキットを用いてRAW264.7細胞に(材料の表を参照)、メーカーのプロトコルに従って、モーシンおよびホスファチリノシトール4,5-ビスリン酸(PIP2)分子を蛍光的に可視化する。それぞれ。
注:Moesinは、ファゴサイトのキープレーヤーであるSykを活性化できるITAMモチーフを持っています。PIP2は、細胞膜にモエシンを募集することが知られています。 - ガラスカバーを細胞でサンプルチャンバアセンブリに取り付け、アセンブリをAFMサンプルステージに取り付けます。
- ビーズを変更した片持ちはAFMスキャンヘッドに取り付けます。
- 空の領域でフォース カーブを実行し、このカーブからの感度とステップ 2.2.2 で測定されたばね定数でフォースを調整します。
- 488/561 nm励起を有する緑色(Moesin-EGFP)および赤(PLCδ-PH-mCherry)チャネルの両方で適切な蛍光強度を有する十分に単離された細胞を見つけます。
- AFMを使用した裸の6 μmポリスチレンビーズを、1 nNの一定力と500sの接触時間でセル表面に届けます。
- 分析のためにビーズと接触する細胞の蛍光画像シリーズを記録する(通常は10フレーム/秒)。
注:蛍光体の光漂白を減らすためには、目的の細胞を探索するために比較的低い励起力を使用する必要があります。さらに、細胞応答のダイナミクスが遅い時間スケールにある場合、断続的な励起スキームを使用して蛍光時間トレースを延長することができます。
結果
図4Aは、1つのアプローチリトラクトサイクルにおける単一Tセルと単一DCとの結合相互作用からの典型的な力距離曲線を示す。明るい赤い曲線は延長曲線で、濃い赤のカーブは引き込み曲線です。延長曲線は通常、インデントまたは剛性解析に使用されるので、ここでは引き込み曲線のみが細胞接着に関係します。曲線の最小値(緑色の円)は、最?...
ディスカッション
AFMベースの単細胞力分光法は、生細胞の生体物理学的特性に対処するための強力なツールとして進化してきました。これらのアプリケーションでは、目的の細胞上の特定の相互作用または特性をプローブするために、片持ちは適切に機能化する必要があります。ここで、単一T細胞と単一ミクロンサイズのビーズを先端のない片持ち先に結合する方法についてそれぞれ説明する。片持ち式に単...
開示事項
著者は何も開示していない。
謝辞
この研究は、中国国家自然科学財団(31370878)、国家キープログラム(31630023)、革新的研究グループプログラム(81621002)によって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
参考文献
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved