このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ジフェニルエーテルのヒドロデオキシゲーションのためのPt/CNT触媒の酸性度のチューニング
要約
HNbWO 6、HNbMoO 6、HTaWO6固体酸ナノシート修飾Pt/CNTの合成のためのプロトコルが提示される。
要約
本明細書では、HNbWO 6、HNbMoO 6、HTaWO6固体酸ナノシート修飾Pt/CNTの合成方法を提示する。様々な固体酸ナノシートの重量を変化させることにより、異なる固体酸組成物を持つ一連のPt/xHMNO6/CNT(x = 5、20重量%;M = Nb, Ta;N=Mo、W)は、カーボンナノチューブ前処理、プロトニック交換、固体酸剥離、凝集および最終的にPt粒子含浸によって調製された。Pt/xHMNO6/CNTはX線回折、走査型電子顕微鏡、透過電子顕微鏡およびNH 3-温度プログラムされた脱離によって特徴付けされる。今回の研究では、HNbWO6ナノシートがCNTに取り付けられ、ナノシートの一部の縁が形で曲がっていることを明らかにした。サポートされるPt触媒の酸強度は、次の順序で増加します: Pt/CNTs < Pt/5HNbWO6/CNTs < Pt/20HNbMoO6/CNTs < Pt/20HNbwo6/lt; Pt/20HTaWO6/CNTs 6 /CNTs 6 /CNTs 6 /CNT.また、リグニン由来モデル化合物の触媒ハイドロコンバージョン:合成Pt/20HNbWO6触媒を用いたジフェニルエーテルが検討されている。
概要
化学物質の製造のための多くの工業プロセスは、水性無機酸の使用を伴います。典型的な例の1つは、シクロヘキサンを生成するシクロヘキサンの水和のための従来のH2 SO4プロセスである。このプロセスには、シクロヘキサンが有機相にあり、シクロヘキサノール産物が酸性水性相にあるため、単純な蒸留による分離プロセスが困難な二相系が含まれます。分離および回収の困難とは別に、無機酸も非常に毒性が高く、機器に腐食性があります。時には、無機酸の使用は、製品の収率を低下させ、避けなければならない副産物を生成します。例えば、H2 SO4を用いて1,3-シクロヘキサニエンを生成する2-シクロヘキセン-1-olの脱水は、副産物1の重合につながります。したがって、多くの工業プロセスは固体酸触媒を使用する方向にシフトします。上記の問題を解決し、HZSM-5やアンバリースト-15の使用など、製品の収率を最大化するために、様々な耐水性固体酸が使用されます。高シリカHZSM-5ゼオライトの使用は、ベンゼン2からのシクロヘキサノールの産生におけるH2 SO4を置き換えることが示されている。ゼオライトは中性水相に存在するため、製品は有機相のみに行き、分離プロセスを簡素化します。しかしながら、ルイス酸部位への水分子のルイス酸塩基付加体形成により、ゼオリティック材料は依然として不活性部位3の存在による選択性が低いことを示した。これらすべての固体酸の中で、Nb2O5は、ルイスとブリンステッド酸部位の両方を含む最良の候補の一つです。Nb2 O5∙nH2Oの酸性度は、陰気な陽子の存在に起因する70%H2 SO4溶液と同等である。プロトニックゼオライト材料に匹敵するBrØnsted酸味は非常に高いです。この酸味は、水の除去に続いてルイスの酸性度に変わります。水の存在下では、Nb2O5は四面体NbO4-H2O付加体を形成し、これはルイス酸性度において減少する可能性がある。 しかし、NbO4四面体は依然として有効陽性料金4を持っているので、ルイス酸部位は依然として有効である。このような現象は、ブドウ糖を5-(ヒドロキシメチル)フルフラール(HMF)への変換および水中のテトラリルスズを有するベンザルデヒドの同盟化において成功裏に実証された5。水耐性触媒は、再生可能エネルギーアプリケーションにおけるバイオマス変換において、特に水などの環境良性溶媒で変換が行われる場合に重要です。
多くの環境良性固体酸触媒の中でも、グラフェンを用した機能性カーボンナノ材料、カーボンナノチューブ、カーボンナノファイバー、メソポーラス炭素材料は、バイオマスの勇気化に重要な役割を果たしてきた。多孔性、極めて高い比表面積、および優れた疎水性6、7.硫化誘導体は、特に安定で高活性なプロトニック触媒材料です。それらは、スルホン化芳香族化合物8の不完全な炭化によって、または不完全な炭化糖9のスルホン化によって調製することができる。それらは液体H2 SO4の使用に匹敵する活性を有する非常に有効な触媒(例えば、より高い脂肪酸のエステル化のために)であることが証明されている。グラフェンおよびCNTは、大きな表面積、優れた機械的特性、良好な耐酸性、均一な細孔サイズ分布、ならびにコークス堆積に対する耐性を有する炭素材料である。スルホナ化グラフェンは、酢酸エチル10および二機能グラフェン触媒の加水分解を効率的に触媒することが見出され、酢酸のγ-バレロラクトン11へのレブリン酸のワンポット変換を容易にすることが見出された。CNTでサポートされる二機能性金属は、VO 2-PANI/CNT上のHMFの高選択的好気性酸化など、バイオマス変換12、13における適用に非常に有効な触媒でもある触媒14.
CNTでサポートされるNb2O5固体酸、機能性CNTおよび二機能性金属のユニークな特性を利用して、我々は高いNb(Ta)ベースの固体ナノシート修飾Pt/CNTの一連の合成のためのプロトコルを報告するナノシート集約法による表面積。さらに、Pt/20HNbWO6/CNTsは、HNbWO6ナノシートに由来する十分に分散したPt粒子および強酸部位の相乗効果の結果として、変換において最良の活性と選択性を示す実証済み。リグニン由来モデル化合物をヒドロデオキシゲーションにより燃料に含む。
プロトコル
注意:本書に記載されている化学物質の適切な取り扱い方法、特性および毒性については、関連する材料安全データシート(MSDS)を参照してください。使用される化学物質の一部は有毒であり、発癌性であり、特別な注意が必要です。ナノ材料は、潜在的に安全上の危険や健康への影響を引き起こす可能性があります。吸入と皮膚接触は避けるべきです。ヒュームフードで触媒合成を行うなど、安全上の注意を払う必要があり、オートクレーブ反応器による触媒性能評価を行う。個人用保護具は着用する必要があります。
1. CNTの前処理13
- 100mLビーカーに1.0gのCNTを50mLの硝酸に浸します。
- 溶液を25°Cで1.5時間超音波処理し、表面不純物を除去し、触媒の固定効果を高めます。
- 溶液を100mLの丸底フラスコに移します。
- 硝酸の混合物で溶液を還流 (65%)硫酸 (98%)一晩60°Cで。音量比を 3:1 に設定します。これにより、CNT に表面欠陥が発生します。
- 溶液を濾過し、固体の多壁カーボンナノチューブを得る。脱イオン水で固体を洗います。
- 固体を80°Cで14時間乾燥させます。
2. HNbWO6固体酸ナノシート15の調製、続いて剥離
- Li2CO3 (0.9236 g) と金属酸化物 Nb2O5 (3.3223 g) と WO3 (5.7963 g) の軟体量を 1:1:2 のモル比で混合します。
- 1つの中間粉砕で24時間800°Cで固体混合物をカルシン。
- 2M HNO3水溶液の200mLに10.0gのLiNbWO6粉末を50°Cで置き、60hで酸を1回置換して5日間(120時間)溶液混合物をかき混ぜます。
- 酸性液体を毎日交換し、ステップ2.3を繰り返します。
- 固体を濾過し、脱イオン水3倍で固体を洗浄します。
- 固形物を一晩80°Cで乾燥させます。
- pHが9.5~10.0に達するまで、ステップ2.6で得られた陽子化化合物の2.0gを用いた脱イオン水溶液の150 mLに25重量%TBAOH(テトラ(n-ブチランモニウム)水酸化物)溶液の量を加えます。
- 上記の溶液を7日間かき混ぜます。
- 上記の溶液を遠心分離し、分散ナノシートを含む上清溶液を収集する。
3. HNbMO6固形酸ナノシートの調製
注: 手順は、最初の手順と 3 番目の手順を除き、手順 2 の手順と似ています。
- Li2CO3と金属酸化物 Nb2O5および MoO3の軟体化量を 1:1:2 のモル比で混合します。
- 1つの中間粉砕で24時間空気中の800°Cで上記の固体混合物をカルシン。
- 2M HNO3水溶液の200mLに10.0gのLiNbMoO6粉末を50°Cで置き、60hで酸の1つの置換で5日間(120 h)溶液混合物をかき混ぜます。
4. HTaWO6固形酸ナノシートの調製
注: 手順は、最初の手順と 3 番目の手順を除き、手順 2 の手順と似ています。
- Li2CO3と金属酸化物 Ta2O5および WO3の軟体化量を 1:1:2 のモル比で混合します。
- 1つの中間粉砕で24時間空気中の900°Cで上記の固体混合物をカルシン。
- 2M HNO3水溶液の200mLにLiTaWO6粉末の10.0gを50°Cで置き、60hで酸の1つの置換で5日間(120 h)溶液混合物をかき混ぜます。
5. ナノシート凝集法によるHNbWO 6/MWCNTの調製
- ステップ1で得られた多壁CNTの2.0gをHNbWO6ナノシートの100 mL溶液に250mLの丸底フラスコに加える。
- 1.0 M HNO3水溶液の100 mLを丸底フラスコにドロップします。これにより、ナノシートサンプルが集約されます。
- 溶液を50°Cで6時間かき混ぜ続けます。
- 固体を濾過し、脱イオン水3倍で固体を洗浄します。
- 固形物を一晩80°Cで乾燥させます。
- 乾燥した固体の重量を量り、MWCNT上の固体酸の%負荷を記録します。
6. 含浸法によるPt/20HNbWO 6/CNTの調製
- H2PtCl6∙H2O を水に溶かします (1.0 g/100 mL)。
- 調製したナノシートを上記Pt水溶液の1.34mLでCNT材料を改変した。
- ナノシートCNT材料を80°Cで乾燥させ、材料を400°Cで3時間焼成する。
- Nb(Ta)ベースの固体ナノシート修飾Pt/CNT触媒を得る。
7. リグニン由来芳香族エーテルのヒドロデオキシゲーション
注:選択されたリグニン由来の芳香族エーテルは、この実験でジフェニルエーテルである。選択されたリグニン由来の芳香族エーテルは、この実験においてジフェニルエーテルである。Pt/20HTaWO6/CNTsの活性(88.8%変換、本稿では示さない)はPt/20HNbWO6/CNT(99.6%)よりも低いため、シクロヘキサンの収率は低下する。従って、シクロヘキサンの高い選択性はPt/20HTaWO 6/CNTsよりも高く得られたが、ジフェニルエーテルのより低い変換は、その利用を制限する。適切な保護装置とヒュームフードを用いて、発癌性試薬を用いて反応を行う。
- 石英砂の5ミリリットルで触媒の0.05グラムを希釈します。固定ベッド原子炉の真ん中に水晶毛の2つの枕の間に溶液をロードします。
- H2(40 mL/min)の触媒を300°Cで2時間減らします。
- ジフェニルエーテル原料(n-デカンで5.0重量%の反応物を含む)とガスクロマトグラフィー解析の内部標準として2.0wt.%n -ドデカンを異なる流量で固定ベッドリアクターに送り込む(0.05-0.06 mL/min)。
- 触媒Wの質量(g)と基板F(g/min)の流量の比として定義された異なる空間時間で製品を収集します。
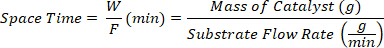
- 5977A MSDを用いてGC(HP-5、30 m x 0.32 mm x 0.25 μm)で液体製品を特定し、ガスクロマトグラフィー(GC 450、FID、FFAP毛細血管カラム30 m x 0.32 mm x 0.25 μm)でオフラインを分析します。
- 反応物の変換を決定する(+%) , 製品 I に対する選択性 (Si %, および製品iの収率 (Yi %)次の式を使用します。
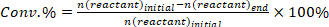 (1)
(1)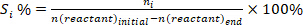 (2)
(2)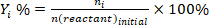 (3)
(3)
結果
X線回折パターン(XRD)は、前駆体LiNbWO6および対応するプロトン交換触媒試料HNbWO6について研究され、位相を決定した(図1および図2)。NH3-温度プログラム脱着(NH3-TPD)を用いた触媒試料の表面酸性度を調べた(図3)。X線顕微鏡解析と透過型電子顕微鏡(TEM)を用いた走査型電子顕微鏡(SEM)?...
ディスカッション
硝酸によるCNTの前処理は、比表面積(S BET)を有意に増加させる。生CNTは、処理後に103m2/gの特定の表面積を持ち、表面積を134m2/gに増加させた。従って、このような前処理は、CNT表面に欠陥を作成し、固体酸修飾および白金粒子含浸後の触媒上の特定の表面積にプラスの効果を有するであろう。ナノシートの取り込み後は表面積が減少するので、最終的な触媒の表面積を?...
開示事項
何も開示することはない
謝辞
本稿に記載されている研究は、中国香港特別行政区研究助成協議会(UGC/FDS25/E09/17)の助成金によって完全に支持された。我々はまた、触媒特性評価のための触媒特性評価および固定ベッド原子炉の分析機器を提供するための中国国家自然科学財団(21373038および21403026)に感謝する。香港研究助成協議会(UGC/FDS25/E09/17)の研究助成に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Carbon nanotubes (multi-walled) | Sigma Aldrich | 724769 | |
| Nitric acid (65%) | Sigma Aldrich | V000191 | |
| sulphuric acid (98%) | MERCK | 100748 | |
| Lithium carbonate (>99%) | Aladdin | L196236 | |
| Niobium pentaoxide (99.95%) | Aladdin | N108413 | |
| Tungsten trioxide (99.8%) | Aladdin | T103857 | |
| Molybdenum trioxide (99.5%) | Aladdin | M104355 | |
| Tantalum oxide (99.5%) | Aladdin | T104746 | |
| Chloroplatinic acid hexahydrate, ≥37.50% Pt basis | Sigma Aldrich | 206083 | |
| tetra (n-butylammonium) hydroxide 30-hydrate | Aladdin | D117227 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| n-Decane,98% | Aladdin | D105231 | |
| n-Dodecane,99% | Aladdin | D119697 | |
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) |
参考文献
- Jensen, J. L., Uaprasert, V., Fujii, C. R. Acid-Catalyzed Hydration of Dienes. 2. Changes in Activity Coefficient Ratios, Enthalpy, and Entropy as a Function of Sulfuric Acid Concentration. Journal of Organic Chemistry. 41 (10), 1675-1680 (1976).
- Ishida, H., Ono, M., Kaji, S., Watanabe, A. Synthesis of 1,3-Cyclohexadiene through Liquid Phase Dehydration of 2-Cyclohexen-1-ol in Aqueous Solution using Zeolite Catalyst. Nippon Kagaku Kaishi. 4, 267-275 (1997).
- Ishida, H. Liquid-phase hydration process of cyclohexene with zeolites. Catalysis Surveys from Japan. , 241-246 (1997).
- Ushikubo, T., Iizuka, T., Hattori, H., Tanabe, K. Preparation of highly acidic hydrated niobium oxide. Catalysis Today. 16, 291-295 (1993).
- Nakajima, K., et al. Nb2O5.nH2O as a heterogeneous catalyst with water-tolerant Lewis acid sites. Journal of the American Chemical Society. 133 (12), 4224-4227 (2011).
- Lam, E., Luong, J. H. T. Carbon Materials as Catalyst Supports and Catalysts in the Transformation of Biomass to Fuels and Chemicals. ACS Catalysis. 4 (10), 3393-3410 (2014).
- Sudarsanam, P., et al. Functionalised heterogeneous catalysts for sustainable biomass valorisation. Chemical Soceity Review. 47 (22), 8349-8402 (2018).
- Hara, M., et al. A carbon material as a strong protonic acid. Angewandte Chemie International Edition English. 43 (22), 2955-2958 (2004).
- Toda, M., et al. Biodiesel made with sugar catalyst. Nature. 438 (7065), (2005).
- Ji, J., et al. Sulfonated graphene as water-tolerant solid acid catalyst. Chemical Science. 2 (3), 484-487 (2011).
- Wang, Y., et al. Graphene-Based Metal/Acid Bifunctional Catalyst for the Conversion of Levulinic Acid to γ-Valerolactone. ACS Sustainable Chemistry & Engineering. 5 (2), 1538-1548 (2016).
- Ma, Q., et al. Catalytic depolymerization of lignin for liquefied fuel at mild condition by rare earth metals loading on CNT. Fuel Processing Technology. , 220-225 (2017).
- Rahzani, B., Saidi, M., Rahimpour, H. R., Gates, B. C., Rahimpour, M. R. Experimental investigation of upgrading of lignin-derived bio-oil component anisole catalyzed by carbon nanotube-supported molybdenum. RSC Advances. 7 (17), 10545-10556 (2017).
- Guo, Y., Chen, J. Bicomponent Assembly of VO2and Polyaniline-Functionalized Carbon Nanotubes for the Selective Oxidation of Biomass-Based 5-Hydroxymethylfurfural to 2,5-Diformylfuran. ChemPlusChem. 80 (12), 1760-1768 (2015).
- He, J., et al. Characterization of HNbMoO6, HNbWO6 and HTiNbO5 as solid acids and their catalytic properties for esterification reaction. Applied Catalysis A: General. , 145-152 (2012).
- Tagusagawa, C., Takagaki, A., Hayashi, S., Domen, K. Characterization of HNbWO6 and HTaWO6 Metal Oxide Nanosheet Aggregates As Solid Acid Catalysts. Journal of Physical Chemistry C. 113, 7831-7837 (2009).
- Niwa, M., Katada, N., Sawa, M., Murakami, Y. Temperature-Programmed Desorption of Ammonia with Readsorption Based on the Derived Theoretical Equation. Journal of Physical Chemistry. 99, 8812-8816 (1995).
- Leiva, K., et al. Conversion of guaiacol over supported ReOx catalysts: Support and metal loading effect. Catalysis Today. , 228-238 (2017).
- Deng, W., Liu, M., Tan, X., Zhang, Q., Wang, Y. Conversion of cellobiose into sorbitol in neutral water medium over carbon nanotube-supported ruthenium catalysts. Journal of Catalysis. 271 (1), 22-32 (2010).
- Huang, B., Huang, R., Jin, D., Ye, D. Low temperature SCR of NO with NH3 over carbon nanotubes supported vanadium oxides. Catalysis Today. 126 (3-4), 279-283 (2007).
- Takagaki, A., Tagusagawa, C., Hayashi, S., Hara, M., Domen, K. Nanosheets as highly active solid acid catalysts for green chemical syntheses. Energy & Environmental Science. 3 (1), 82-93 (2010).
- Hu, L. -. F., et al. Structure and photocatalytic performance of layered HNbWO6nanosheet aggregation. Journal of Nanophotonics. 9 (1), (2015).
- Geim, A. K. Graphene: Status and Prospects. Science. 324, 1530-1534 (2009).
- Golberg, D., et al. Boron Nitride Nanotubes and Nanosheets. ACS Nano. 4 (6), 2979-2993 (2010).
- Wilson, J. A., Yoffe, A. D. The transition metal dichalcogenides discussion and interpretation of the observed optical, electrical and structural properties. Advances in Physics. 18 (73), 193-335 (1969).
- Ma, R., Sasaki, T. Nanosheets of oxides and hydroxides: Ultimate 2D charge-bearing functional crystallites. Advanced Materials. 22 (45), 5082-5104 (2010).
- Pope, T. R., Lassig, M. N., Neher, G., Weimar Iii, R. D., Salguero, T. T. Chromism of Bi2WO6 in single crystal and nanosheet forms. Journal of Materials Chemistry C. 2 (17), 3223-3230 (2014).
- Yu, Y., et al. Controlled scalable synthesis of uniform, high-quality monolayer and few-layer MoS2 films. Scientific Reports. 3, 1866 (2013).
- Prasomsri, T., Shetty, M., Murugappan, K., Román-Leshkov, Y. Insights into the catalytic activity and surface modification of MoO3 during the hydrodeoxygenation of lignin-derived model compounds into aromatic hydrocarbons under low hydrogen pressures. Energy & Environmental Science. 7 (8), 2660-2669 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved