Method Article
再発作用ポテンシャル記録のためのマルチウェルマイクロ電極アレイ上のヒトiPSC由来心筋細胞ネットワーク
* これらの著者は同等に貢献しました
要約
本稿では、マルチウェルMEAプレート上で培養されたヒト誘導多能性幹細胞由来心筋細胞(hiPSC-CM)ネットワークの開発のためのプロトコルのセットを含み、作用電位測定のために細胞膜を可逆的に電気ポレートする。ハイスループットの記録は、同じセルサイトから何日も繰り返し取得されます。
要約
心臓の安全性スクリーニングは、創薬および治療にとって最も重要です。したがって、効率的な薬物検査には、hiPSC由来心筋細胞(hiPSC-CM)製剤に対する新しいハイスループット電気生理学的アプローチの開発が非常に必要とされている。多電極アレイ(MEA)は、興奮性細胞のフィールド電位測定に頻繁に使用されていますが、Joshi-Mukherjeeたちは、再発作用ポテンシャル(AP)記録への応用を説明し、検証した最近の出版物です。何日も同じhiPSC-CMの準備から。ここでの目的は、高精度と1 μsの時間分解能で電気ポレーションを介してAP波形を測定するための詳細なステップバイステップの方法を提供することです。このアプローチは、信頼性の高い電気生理学的調査のためのハイスループットAP測定のための細胞内アクセスを得るために使いやすい方法論の欠如に対処します。マルチウェルMEAプレート上のhiPSC-PMのメッキの詳細な作業フローと方法は、必要に確かな場合は重要なステップを強調して議論されます。さらに、迅速なデータ処理、抽出、解析を行うためのカスタム構築されたMATLABスクリプトを報告し、さまざまなAPデュレーションパラメータに関する形態の微妙な違いを定量化するために波形解析を包括的に調査します。不整脈と心毒性。
概要
ヒト誘導多能性幹細胞由来心筋細胞(hiPSC-PM)は、研究室1、2、3、4、5、6の増加する数のゴールドスタンダードです。 ,7,8,9,10.胚体11、12、13および単層3、7、10、11、12を打ち負かす13、14、15、16、17の分化は心筋細胞産生の好ましい方法であり、多電極アレイ(MEA)は一般的なモダリティとなっているこれらのネットワークの電気力学を監視するための18,19,20.打率、振幅、持続時間、RR間隔などのフィールド電位(GP)から抽出できるパラメータは、単層18、21を自発的に打ち負かすベースライン電気生理学的応答である一方、 22,23, これらの細胞外FP信号の基礎となる作用電位(AP)成分は、24を外挿することは困難である。直接再発AP測定のためのMEAの応用の発見に関する最近の出版物は、複数の再偏光段階で広範な波形解析を用いる例示的な細胞内AP読み出しの方法論の証明を提供するhiPSC由来心筋細胞ネットワーク3のバッチ。今回の研究では、hiPSC由来心筋細胞のネットワークへの電気刺激パルスの送達により、AP記録に対する細胞内アクセスが可能であることを実証した。これらの一時的なAP記録は、傷害部位3、25、26を通して観察される膜電位回復に依存する。本研究では、MEAとパッチクランプを介して記録された波形は、アプローチ3の信頼性を検証する同様のAP形態を示した。
いくつかの研究室は、カスタム構築されたMEA18、21、26、27、28、29を使用して、様々な電気原性細胞からのAPを測定すると報告しています。 30が、一貫性のある繰り返しAP測定のためにMEAを使用する信頼性は評価されなかった。現在、ゴールドスタンダードパッチクランプ技術は端末記録7、31に限定されていますが、MEAベースのAP測定値は一時的であるため、同じセル上で複数回行うことができます。また、最小限のフィルタリングを必要とするミリボルト範囲で高品質のAP信号を簡単に記録できることも示しています。したがって、研究者は、MEAを使用して同じ製剤で急性だけでなく慢性薬物研究を行うことができます。不整脈予測と薬物関連の心毒性に重点が置かれていることを考えると、24,32,33,34,35, AP測定の統合薬剤の安全性と有効性の評価を強化します。
ここでは、1)成熟のための凍結保存されたhiPSC-CMのプリメッキ、2)マルチウェルMEA上のhiPSC-CMの解離とめっき、3)hiPSC-CMネットワークからのGPとAPの記録、4)分析のためのデータのセグメント化と抽出、および5)のためのプロトコルを提示します。複数の再利用のために配列を復元します。各ステップは、重要なステップを重視して最適化されています。細胞の付着要件について、拍動同期単層を確保するための要件について議論し、反復的な電気生理学的研究のためのマルチウェルMEA修復の手順について説明する。最後に、AP信号抽出、品質保証、セグメンテーションワークフロー用にラボで開発されたカスタムGUIを提示し、APパラメータを定量化および分析します。
プロトコル
1. ソリューション・材料の作成(資料表参照)
-
6ウェル組織培養板基板コーティング
- 氷上または4°Cでコーティング基板を解凍します。
- 冷たいDMEM/F12培地に1:100コーティング代替膨張を調出します。ゆっくりとピペッティングして溶液を混ぜます。
- 6ウェル組織培養板のウェルあたりのコーティング基板溶液(ステップ1.1.2)の2mLを転送する。
- コーティングされた組織培養プレートを37°Cおよび5%CO2に少なくとも7時間置き、7日以内に使用する。
-
hiPSC-CM培養培地
- CM塩基媒体の4°Cから500mLに解凍したCM培地サプリメントを10mL加える。4°Cで最大2週間保存します。
- アリコートは、その日のメディアの量を必要とし、使用前に室温に持って来ます。
- hiPSC-CM解凍培地:hiPSC-CM培養培地(ステップ1.2)と10%の胎児ウシ血清(FBS)を混合して新鮮な調製する。サスペンション用のCOMを解凍する前に、メディアを室温に持ち込む。
- フィブロネクチン1mg/mLストック溶液:アリコート200 μLを1.5mLの無菌マイクロフュージチューブに入れ、後で使用するために4°Cで保存します。氷上に50 μg/mL濃度の作業溶液を新たに準備します。
- マルチウェル洗浄液:0.5gの酵素洗剤と50mLの滅菌二重蒸留水(ddH2O)を組み合わせます。内容を混合する渦。フィルターを取り、最大1週間4°Cで保存します。
2. 成熟のための凍結保存hiPSC-CMのプレメッキ(図1)
注:このセクションは、フィーダーフリー単層法3、16を用いて分化したhiPSC-PMを解凍および培養し、1〜200万個の細胞/バイアルで10日間分化後液体窒素で凍結保存することを目的としています。1つのバイアルからの細胞は、6ウェル組織培養プレートの2つの基板被覆井戸にめっきされる。心筋細胞はチューブの底部に定着する傾向があるので、プレメッキ時の穏やかな混合は、ウェル全体の細胞密度を達成するために重要です。
- 15 mL円錐管に解凍され、室温に持って来るhiPSC-CMのバイアルあたりFBSのアリコート2 mL。
- 凍結保存されたhiPSC-CMのバイアルを37°Cの水浴に入れて解凍し、3分以下でも解凍するために穏やかに旋回します。
- 直ちにFBSを含むチューブにバイアル内容物を移し(ステップ2.1参照)、5分間200 x gで旋回と遠心分離機で混合する。
- 上清を吸引し、解凍する1分のhiPSC-CM解凍媒体(ステップ1.3参照)の1mLで細胞ペレットを再中断する。トランスファーピペットを使用して、穏やかなトリチュレーションによってペレットを再中断します。細胞の生存率を評価します。
- ステップ2.4で解凍したhiPSC-CMのバイアルあたり3mLの解凍培地を追加し、転写ピペットを使用して穏やかに中断して細胞塊を解離します。
- 基板コーティングされた6ウェルプレートの各ウェルに2mLの細胞懸濁液を静かに分配する(ステップ1.1参照)。細胞培養インキュベーターを37°Cおよび5%CO2に置く。
- 24時間後に新鮮なhiPSC-CM培養培地に置き換え、その後20日間毎週3回使用してください。
注:細胞は24時間で基板コーティングに付着し、48hポストメッキで自発的にビートする必要があります(ビデオ1とビデオ2を参照)。
3. マルチウェルMEAプレート殺菌とコーティング(図2、図3)
注:ここで説明するプロトコルは、hiPSC-CMメッキ用のガラス上に12マイクロゴールドPEDOTコーティングされた電極を備えた24ウェルMEAプレートを準備するためのものです。電極に損傷を与える可能性があるため、プレートの底面に触れないようにしてください。
- 細胞めっきの2日前に、各ウェルに0.5mLのhiPSC-CM培養培地(ステップ1.2参照)を追加し、ベースライン記録を実行してMEAの品質チェックのための信号対雑音比を検証します。
- メディアを吸引し、無菌ddH2Oですすいで、一晩層流フード内の紫外線の下で殺菌します。
- 細胞めっきの前日に、MEA表面の親水性処理のために各井戸にFBSの0.1 mLを追加します。室温で30分間インキュベートします。この手順は、セルの接続に必要です。
- FBSを吸引し、0.5 mLの無菌ddH2Oをウェル当たりですすいでください。もう一度繰り返します。
- プレートを一晩層流フードで乾燥させます。
- ストックから冷たいDMEM/F12培地で50 μg/mLフィブロネクチンの作動希釈を準備します(ステップ1.4参照)。溶液を氷の上に置いてください。
- 働くフィブロネクチン希釈のピペット5μL(3.6参照)を慎重に各ウェルの中心に液滴を分配し、12個の電極をすべて覆います。液滴が乾燥するのを防ぐために、24の井戸を横切って迅速に作業することが重要です。
- 直ちにフィブロネクチンコーティングされたマルチウェルMEAプレートを、無菌ddH2Oを含む加湿室内の上げられた表面に置き、皿表面全体を覆う。細胞培養インキュベーターに3時間マルチウェルMEAプレートでチャンバーを置きます。
注:加湿室に24ウェルMEAプレートを配置することは、インキュベーション期間中にフィブロネクチン滴が乾燥するのを防ぐために重要です。
4. マルチウェルMEAプレート上のhiPSC-CM解離とめっき(図3)
注:MEAフィブロネクチンインキュベーションが完了する前に、約1時間前にこのステップを開始します。細胞解離液が37°Cで、iPSC-CM解凍媒体が室温であることを確認します。解離方法は、基板コーティングされた6ウェルプレート(ステップ2参照)で培養された分化後30日間最適化され、MEAめっきに対して約90%の実行可能なMSを得ています。細胞死を防ぐためにトリチュレーション中に気泡を導入しないように注意する必要があります。
- 30日後分化されたhiPSC-CM培養物(ステップ2.7参照)を使用して6ウェル組織培養皿の各ウェルから培養培地を吸引し、ウェル当たり2mLの無菌D-PBSで洗浄する。
- 温める前の細胞解離液(材料の表を参照)を1mL加え、37°Cで4分間インキュベートします。転写ピペットを使用して、溶解のために細胞を緩めるために穏やかにトリビュートします。細胞のほとんどがまだ付着している場合は、37°Cでさらに3分間インキュベートし、再びトリチュレートする。この追加のインキュベーションは、最大細胞の回復に役立つはずです.これは低細胞の生存率をもたらす可能性があるため、7分以上インキュベートしないでください。
- 転写ピペットを使用して、すべての解離された細胞をhiPSC-CM解凍媒体を含む円錐状チューブにプールします(ステップ1.3参照)。細胞解離溶液の活性を遮断するために、少なくとも2倍の培地量(収穫されるウェルあたり2mL)で細胞を一時停止することをお勧めします。
- 200 x gで5分間遠心分離機。
- ペレットが表面にゆるく取り付けられ、hiPSC-CM解凍媒体の0.1 mLで再装小さすように溶液を慎重に吸引します。トランスファーピペットを使用して、穏やかなトリチュレーションによってペレットを数回再中断します。
- 解離細胞のアリコート2 μLを1.5mLマイクロフュージチューブ中の18μLの培体で希釈した。トリパンブルーの20 μLを追加し、細胞数と生存率の評価のために混合します。
- hiPSC-CM解凍培地の適切な体積を加えて、細胞密度を6,000セル/μLに調整します。ペレットを数回ゆっくりフリックして吊り下げします。hiPSC-SIMは、特に高密度でメッキを施すと、ガラス表面から簡単に取り外します。15日間の電気記録を達成するために、種分密度とめっき条件を最適化しました。
- 準備ができたら、マルチウェルMEAプレートを細胞播種用の層流フードに入れます。フィブロネクチンの乾燥を防ぐためには、次の2つのステップを一度に1つずつよく実行することが重要です。
- 電極に触れることなく、P10ピペットを使用してフィブロネクチン液滴を慎重に取り外します。
- 12の電極すべてを覆うMEAプレートの井戸の中心に5μLセル液滴(30,000セル)を直ちに分配します。24の井戸がすべてめっきされるまで、手順を繰り返します。フリックによる細胞懸濁液の断続的な混合をお勧めします。
- マルチウェルMEAプレートを緩く覆われた加湿室に戻し、細胞取り付けのために37°Cと5%CO2で細胞培養インキュベーターに戻ります。
- P200ピペットを使用して細胞を邪魔することなく、各井戸に200 μLのhiPSC-CM解凍培地を慎重に追加します。メディアを井戸の側面にドロップして追加します。
- マルチウェルMEAプレートを細胞培養インキュベーターに戻します。
- 24時間ポストメッキで新鮮なhiPSC-CM培養培地に置き換えます。心筋細胞の自発的な拍動は、この時点で観察することができる(ビデオ3を参照)。
- 実験が終わるまで2日ごとにメディアを変更します。
5. hiPSC-CMエレクトロポレーションと信号集録(図4~6)
注:このプロトコルは、ハイスループット電極信号(24ウェルのそれぞれに対して12箇所)の同時記録用です。24 ウェル マルチウェル MEA システムは、取得ソフトウェアと共に使用されます (材料の表を参照)。すべてのMEAの記録は37 °Cで行われる。
- インターフェイス ボードの電源を入れ、取得ソフトウェアを開始します。マルチウェル MEA ヘッドステージが 37 °C の温度に達するまでの時間を十分に確保します (図 4の矢印 1 を参照)。
- ステップ 4 からマルチウェル MEA プレートをマルチウェル MEA ヘッドステージに挿入し、記録プラットフォームの上にカバーして挿入ボタンをクリックします (図 4の矢印 2 を参照)。録音を開始する前に温度が安定するようにします。
-
取得とエレクトロポレーションの設定を調整する
- [実験フローの定義] アイコン (図 4の矢印 3 を参照) をクリックし、記録時間を 2 分または必要に応じて設定します。
- データ集録設定アイコン(図4の矢印4を参照)をクリックし、サンプリングレートを20kHz、ハイパスフィルタを0.1Hz、ローパスフィルタを3500Hzに設定します。
- [刺激設定]アイコンをクリックします (図 5を参照)。[刺激定義]タブで、刺激を1mV、1msおよび1 Hzの二方対称電圧パルスとして定義します。[刺激電極]タブで、関連するすべての電極をハイライト表示してエレクトロポレーション部位を選択します。
- [探索]ボタンをクリックして、すべてのウェル内の信号を視覚化します。信号品質と定常状態を確認します。mV範囲のFP信号を持つ電極に注意を取ります。同じボタンをクリックして探索を停止します。この時点までデータは記録されていません。
- [移動]ボタンをクリックして録画を開始します。各ウェルの電極には、生データウィンドウにFP信号が表示されます(図6)。記録の30s後、刺激ボタンをクリックし、30sのために選択されたサイト上でエレクトロポレーションが行われることを可能にします。その後、同じボタンをクリックして刺激を停止し、残りの60秒の録画を続けます。
注:記録されたファイルは、「アプリケーション」ドロップダウンメニューで「リプレイヤーモード」に切り替えることで再生することができます。
6.再利用のためのマルチウェルMEAプレートクリーニング
- 最終的な実験の後、各井戸からすべてのメディア内容を吸引し、電極表面に触れないように注意深くすることで、マルチウェルプレート内のすべてのウェルをきれいにします。
- 生殖不能ddH2Oをウェル当たり1mL加える。吸引し、一度繰り返します。
- ウェルあたりのマルチウェル洗浄液の0.3 mL(ステップ1.5を参照)を追加します。室温で一晩インキュベートし、細胞や破片を取り除きます。
- 翌朝、溶液を吸引し、無菌ddH2O.インキュベートを5~7分間インキュベートし、吸引する1 mLですすいでください。5回繰り返します。
- 生殖不能ddH2Oの0.5 mLをウェルあたり追加します。洗浄されたMEAの品質チェックのために、洗浄されたマルチウェルプレートのベースラインを記録します(図7)。
- 使用する準備ができるまで4°Cで保管してください。
7. データファイルの変換とエクスポート
注: MWR、MWC、MWD、MWS ファイルの 4 つのデータ ファイルが記録ごとに生成されます。コンバータソフトウェアを使用すると、MWDファイルをH5ファイルに変換して、カスタム構築されたスクリプトを使用して後続の分析を行うことができます(補足ファイル1を参照)。
- コンバータ ソフトウェアを起動します(「材料の表」を参照)。
- [ファイル] メニューから [入力パスを設定] を選択します。対象のデータ ファイルを含むフォルダを選択します。
- [ファイル] メニューから [出力パスを設定] を選択します。変換されたファイルを保存するフォルダを選択します。
- 対象の MWD ファイルをハイライト表示します。
- [HDF5にエクスポート] ボタンをクリックします。
8. データセグメンテーションと分析(図8-10)
注:Matlabベースのカスタムソフトウェアは、様々なFPおよびAPデータパラメータをセグメント化し、抽出するために使用されます。ソフトウェアはオンデマンドで利用できます。
- Matlab を使用して波形解析コードを実行します (GUI のメイン ウィンドウのビューについては、図 8を参照してください)。
- [ファイル]をクリックし、[プロセス .h5]を選択します。
- 上記の手順 7 に従って作成された mwd.h5 ファイルを検索して選択します。
- [ディレクトリの保存]ボタンをクリックして、出力ファイルの保存場所を変更します。
- 信号処理キューを作成するには、対象の電極とウェルの組み合わせを選択し、[キュー]ボタンをクリックします。この手順を繰り返して、キューに処理する電極/ウェルの組み合わせを追加します。
- 細胞を薬物で処理した場合は、[Med Name/ Med濃度]を直接クリックしてキューを編集します(図8)。
- キューが最終的になったら、[波形の初期化]ボタンをクリックします。これにより、セグメンテーション用にシグナルが識別および抽出される予備処理が開始されます。
- [ズームイン]ボタンをクリックし、カーソルを使用して対象のアクションの潜在的な領域を選択します (図9)。
- [保持]ボタンをクリックし、パネルを確認します。ピーク(赤い'x')と谷(黄色の円)は波形ごとに検出され、正規化された作用電位が重ね合わされます。[キープ]ボタンをクリックし、キュー内の次のトレースに進みます (図 10)。
- キュー内の電極/ウェルの組み合わせ信号の残りの部分について、手順 8.8-8.9 を繰り返します。
注: .csvファイルは、波形ごとに測定される APD パラメータで生成されます。各.h5ファイルの.matファイルも保存され、セグメント化されたデータの追加処理が可能になります。
結果
解凍後のhiPSC-PMの生存率とめっき密度は、マルチウェルMEA培養に不可欠です。1-200万のhiPSC-CM/バイアルを50%以上の生存率を持つ6ウェル組織培養プレートの2つのウェルにプレメッキを施すと、48時間で自発的な打撃を受けた健全な単層培養が生まれます。非筋細胞集団。マルチウェルMEAめっきのために解離した場合、これらの単層は一般的に一貫性のない結果と悪い品質信号を生成するため、廃棄する必要があります。図1は、48時間ポストメッキにおける最適なhiPSC-C培養の例を示す。マルチウェルMEA上で直接ではなく、基板コーティングされた組織培養プレート上のMSを解凍すると、細胞回収および成熟3を可能にする。アレイ上の凍結保存されたSIMの直接めっきは、一貫性のない結果を生み出すのでお勧めしません。
解離されたCMの品質に加えて、マルチウェルMEA上の細胞アタッチメントは、細胞密度およびフィブロネクチンコーティング技術に大きく依存する。フィブロネクチン滴の大きさは、MSがフィブロネクチン被覆領域の境界に準拠するので重要です。このため、フィブロネクチン溶液の5μLのみが電極アレイ領域上に直接分配される。液滴が分散しないようにするには、コーティング時に井戸表面が完全に乾燥している必要があります。図2は、最適な調製のためのステップバイステップ前処理の回路図を用いたマルチウェルMEAプレートのレイアウトを示しています。さらに、フィブロネクチンがマルチウェルMEAプレートを乾燥させないようにするには、3時間以下のインキュベーション期間中に加湿室内に配置する必要があります(ステップ3.8参照)。インキュベーション期間が完了したら、CMメッキの直前に各ウェルからフィブロネクチン液滴を除去し、次のウェルメッキに進む方が重要です。MSの迅速かつ慎重な分配作業は、セルの接続を成功させる鍵です。
30日後分化におけるhiPSC-CM培養物は、酵素細胞解離法を用いてマルチウェルMEAめっきに対して解離される(ステップ4参照)。MSはフィブロネクチンコーティングされたMEA表面に3時間ずつ取り付け、アレイを覆う単層は24時間後のメッキ後に見える(図3)。単層の同期拍動は24〜48時間で観察され、細胞液滴分散は培養密度に影響を与えるか、あるいは乾燥および細胞死につながる。配列上の正確な細胞配置は最も重要であるため、最適なめっきのためにこの技術を実践する必要があります。参照電極への細胞接着は、電気信号の製造を妨げる。最適な CM 配置の画像と 24 時間後の培養の画像については、図 3を参照してください。
マルチウェルMEAで培養されたSIMは、48時間ポストメッキで電気的活動の品質チェックを受けます。通常、FP信号振幅は、約4日3日でμV範囲からmVに増加する。ネットワーク内の電極の 50% とネットワーク全体の 70% が FP 信号を生成しない場合、ネットワークまたはカルチャは最適ではないため、廃棄する必要があります。FP および AP 解析では、品質チェックに合格したカルチャのみが処理されます。図6は、良好およびサブ標準FP信号の例を示す。
エレクトロポレーション媒介AP記録は、培養物48hポストMEAメッキから複数回得ることができる。エレクトロポレーションを用いて、複数のhiPSC由来心筋細胞ネットワークから高解像度APを記録する細胞内アクセスを得た。30秒の低電圧パルス(1V、1ms、1 Hz)を、FPからAPへの可逆的な変換のために送達した。エレクトロポレーションにより、電極の約75%でAP測定に成功した細胞内アクセスが可能です。電気信号は、30sのプレエレクトロポレーション、30sの間に、1分のポストエレクトロポレーションを含む2分間記録されます。10 s AP 波形 10 s ポストエレクトロポレーションの列車は、信号品質と解析のためにすべてのサイトで評価されます。純粋な AP 信号に準拠していないトレースは破棄されます。AP振幅がFP信号に相関しているかどうかを調べるために、全288箇所を電光して波形を同時に記録した。2つの異なる電極から同じ細胞部位から記録された代表的なFPおよびAP信号を図11Aに示す。同じ細胞部位から記録されたFP振幅とポストエレクトロポレーションAP振幅との間に相関関係は認められなかった。さらに、0、24、48、72および96 hにおける同じ細胞部位の複数のエレクトロポレーションは、時間の経過とともにAP形状に有意な影響を及ぼさなかった(図11B)。
システムのハイスループットの性質を考えると、RR間隔、瞬間周波数、差動作用の潜在的な持続時間などの対象パラメータを抽出および定量する手動技術は非効率的で時間がかかります。要求ありの場合に研究コミュニティが利用できるカスタム構築されたMATLABスクリプトを使用して、1 μsの解像度で波形測定を行います。エレクトロポレーションタイムポイントは、信号抽出、品質保証、セグメンテーションワークフローを行うためのAPポストエレクトロポレーションの10sを識別するために抽出された信号と重ね合わせています(図8、図9、図)。 10)ユーザーインターフェイスはガイドとして重ね合わされたエレクトロポレーションの表示器を使用して目的の区間の選択を可能にする。セグメント化された波形は、個々のAP波形をさらに識別するためにサブルーチンによって処理されます。これはピーク検出によって完了し、サイクルごとに最高電圧と最低電圧が特定されます。このプロセスが完了すると、振幅が正規化され、関連付け時間ベクトルがシフトされ、ピーク値 1 で時間ゼロが定義されます。個々のサイクルに沿った交差点の補間を使用して、APD 測定値を決定しました。したがって、AP波形セグメンテーションの部分自動化ワークフローにより、短時間で複数のカルチャバッチにわたるさまざまな APD パラメータの効率的なデータ分析が可能になります。リアルタイムのデータ分析のために、GPとAPの包含基準と除外基準のさらなる自動化が進行中です。
マルチウェルMEAプレートの大きな利点は、複数回再利用できることです。この復元により、費用対効果の高い一貫したデータ収集のための反復的な電気生理学的研究が可能になります。6 つの復元後の同じアレイからの AP の記録を図 12に示します。信号対雑音比は、複数の再利用で同様です。反復的な電気生理学的研究のための配列の信頼性を実証するために、合計3815 AP波形が3つの復元バッチからプールされ、AP持続時間データが抽出され、結果の再現性を調べます。個々の波形APD 30、APD80、三角測量(APD80~APD30)および分数短縮((APD80~APD30)/(APD80))の分布プロットが表示されます(図13)。

図1:成熟のための凍結保存されたhiPSC-CMのプレメッキ。(A) 10日間の予備めっき1バイアルの細胞処理は、分化後10日間のバイアルを凍結保存し、(B)位相コントラスト画像の成功(左)と失敗(右)hiPSC培養物を使用する。スケールバー:275 μm。14 日と 24 日後の分化後のカルチャの例については、ビデオ 1およびビデオ 2を参照してください。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:マルチウェルMEAプレートのセットアップと準備。(A) マルチウェルMEAプレート回路図:プレートは、それぞれ12マイクロ電極アレイと4つの周辺参照電極を含む24ウェル(A1~D6)で構成されています。電極直径:30 μm/電極間距離:300 μm.記録は288個の電極から同時に得ることができます。(B) hiPSC-CMめっき前に行う殺菌および親水性処理工程。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:マルチウェルMEAプレート上のhiPSC-CM解離およびめっき。(A) 各ウェルのhiPSC-CM MEAメッキステップの回路図。(B)4参照電極に広がることなく全12極を覆う正しい細胞液滴配置を示す顕微鏡画像。(C) 位相コントラスト顕微鏡画像の例示的な(左)と最適でない(右)hiPSC-CMめっきは、24時間後めっきでMEAに置き換えます。スケールバー= 275 μm。MEA めっきの成功例については、ビデオ 3を参照してください。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4: マルチウェルスクリーン取得ソフトウェア。矢印は、テキストで参照される主要な機能の位置を示します: 温度制御 (1) パネルは、実験全体を通してリアルタイムの温度監視を可能にします。挿入/取り出し(2)ボタンは、マルチウェルMEAプレートをエンゲージして離します。実験フロー(3)機能を定義すると、ユーザーは記録の継続時間を設定することができます。データ集録設定(4)機能により、サンプリングレートと集録フィルタ設定を設定できます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 5:ハイプシ-CMエレクトロポレーションと信号集録.刺激定義タブはユーザーが電気ポレーションの脈拍変数を定義することを可能にする。刺激電極タブは、ユーザーが電極電極を選択することを可能にする。288の電極の任意の組合せは選ぶことができる。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図6:電気活動のためのマルチウェルMEAの品質チェック。マルチウェル- 最適(A)およびサブスタンダード(B)FP信号の代表的な例を持つ生データウィンドウを示す画面集録ソフトウェア。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 7: 新しいアレイと復元されたアレイからの FP 信号と AP 信号。マルチウェルMEA酵素洗浄ステップ(A)。新しいアレイのベースライン信号は、ノイズ比(B)に対する最小信号を示し、FP信号はネットワークの電気的活動を示します(C)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 8: データのセグメンテーションと分析。波形解析のためのGUIのメインウィンドウのビュー。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 9: データのセグメンテーションと分析。ウェーブフォームボタンを初期化して、セグメンテーション用のAP波形を識別して抽出し、対象となるアクションの潜在的な領域をズームインして選択して予備処理を開始します。赤い円はエレクトロポレーションインジケータです。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 10: データのセグメンテーションと分析。すべての波形に対してピーク(赤い'x')と谷(黄色の円)が検出され、正規化されたAPは波形の品質チェックのために重ね合わされます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図11:同じセルサイトからの複数の記録に対するFP信号へのAP振幅依存。2つの独立した電極から記録されたμV範囲(A、左上パネル)またはmV範囲(A、右上パネル)のFP振幅は、FP振幅とFP振幅との間に相関関係を示さないmV範囲(A、左下パネル)でAP振幅を生成し、ポストエレクトロポレーション AP 振幅。各記録の正規化された AP 波形は、各記録に示すように重ね合わされます。0~96時間の同じ細胞部位の複数のエレクトロポレーションにより、膜電気力学(B)の追跡を可能にする高品質のAP波形が生成された。この図のより大きなバージョンを表示するには、ここをクリックしてください。
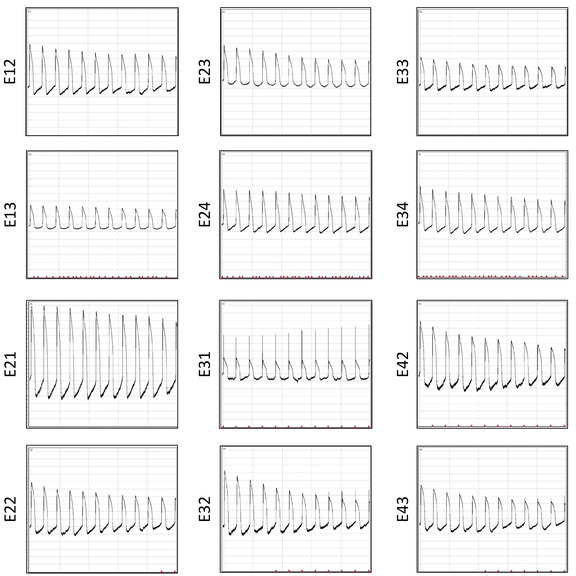
図 12: 6 回の復元後の AP 録画。同時に記録されたAP波形は、同じウェルから12の電極にわたって10sポストエレクトロポレーションが表示されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 13: 複数の復元からの APD パラメータヒストグラム。個々の波形 APD30 (A)、APD80 (B)、三角測量 (APD80—APD30)(C) および小数短さ ((APD80—APD30)/(APD80)の分布プロット)(D)が表示されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
補足ファイル。ビデオ 1-3.このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
長年にわたり、MEAの適用は、その電気生理学的特性36、37、38、39を研究するために興奮性細胞のFP測定を行うことに限定されてきた。カスタムMEAベースの技術18、29、30を使用して電気原性細胞からのAPトレースを報告しているグループはごくわずかです。しかし、これらのアプローチは、同じ準備からの繰り返し記録のために調査されていません。我々は、複数のhiPSC-CMネットワークで数日間にわたって同じ細胞部位からAPを同時に研究するための革新的で正確な方法論を開発した3.今回の研究では、ハイPSC-CM培養物の複数のバッチからAP波形ライブラリを高精度で1μsの時間分解能で生成するために、マルチウェルマイクロゴールドMEAプラットフォームを採用しました。ここで説明するプロトコルでは、高スループット AP 記録用の同期 CM ネットワークを効率的に開発するためのアレイ上の hiPSC-CM のシード処理について説明します。プロトコルのいくつかの重要なステップは、1)凍結保存バンキングのための品質管理されたCMの複数の高純度バッチの生産、2)プレメッキと成熟のための非常に実行可能なポスト解凍CM、3)CMのためのマルチウェルMEAプレートの処理です。シード、4)HIPSC-CM培養解離は、MEAメッキの30日後分化、および5)複数再利用のためのMEAの復元である。
hiPSC 分化におけるバッチ間変動が実験結果に影響を与える可能性があることに注意することが重要です。分化の単層法は、高パーセント心筋細胞産生3,40のために社内で最適化された。我々の培養物のMLC2vおよびTNNT2マーカーのFACS分析は、≥90%の心室様表現型3を示す。これらの品質管理された培養物は、実験研究のために凍結保存されています。現在の分化アプローチは、結節、心房および心室様細胞3、16、17、41の異種混合をもたらす。したがって、CMサブタイプ集団濃縮に用いられる戦略は、培養物の特異性をさらに向上させることができる。さらに、組織工学のアプローチは、その成熟を高めるために採用することができます。ここで提案される方法は、他の CM ソースに対して簡単に実装できます。
MEAを用いて記録されたAP波形は、光学マッピング42、43、相補金属酸化物半導体ベースMEA 18、21、およびシミュレートされたAPによって心筋細胞のネットワークから記録されたものと類似していた。FP録画を使用して 20.MEA HaiおよびSpira25を介したAP測定のメカニズムに対処するために、電極電極界面が確立された鋭いガラスマイクロ電極技術を模倣することを実証した。しかし、MEAシステムの電極電極界面が校正されていない、および振幅が感度と分解能の関数であることを考えると、我々の研究における残りの膜電位と真の振幅値を確立することはできません。技術。当社のアプローチは、AP振幅に関しては、光マッピングと同様の制限を共有しています。
ここで報告されたマルチウェルMEAベースのFP/AP読み出しは、薬物安全性評価のための新しい可能性を開きます。自発的であるが、これらのhiPSC-CM単層は一定の速度で打つ。複数のネットワークにわたる APD パラメータの分析により、電気的不均一性に関する洞察が得られます (図 13)。ただし、包括的な APD 払戻分析には、前の拡張期間隔を組み込む必要があります。さらに、96時間(図11B)にわたって同じ細胞部位から記録された高品質のAP波形は、開発および疾患において価値のある膜電気力学を経て追跡する最初の報告である。
AP パラメータを定量化するためにここで説明するプロトコルは、化合物をテストするための用量応答曲線を生成するために使用できます。最近エドワーズら3によって報告されているように、ノルエピネフリン、イソプロテレノールおよびE 4031の用量応答は、様々な再分極段階でAPDのためにプロットされる。公開された研究は、AP波形の線量依存の微妙な変化をリアルタイムで同定するためのアプローチの正確さと信頼性を実証した。この技術は、様々な電気生理学的応答を理解するために、他の化合物または小分子ライブラリーに対して容易に拡張することができる。
本研究で提示されたAP測定のためのMEAベースのアプローチは、電気生理学者だけでなく、細胞生物学者やシリコモデラーにも関心を持つでしょう。さらに、hiPSC-SIM上の同じセルサイトからのFP/AP記録により、研究者は短期間で多種多様な興奮性細胞ネットワークの生体電データライブラリを生成できるようになります。これらのリソースの可用性は、発見や疾患モデリングに有益です。
開示事項
著者は何も開示していない。
謝辞
なし
資料
| Name | Company | Catalog Number | Comments |
| Accutase | Sigma Aldrich | A6964-100ML | cell dissociation solution |
| Acquisition software | Multichannel Systems | Multiwell-Screen v 1.9.2.0 | |
| B27 Supplement | ThermoFisher | 17504-044 | CM media supplement |
| Converter software | Multichannel Systems | MultiChannel DataManager | |
| DMEM/F12 | ThermoFisher | 11330-032 | |
| D-PBS | ThermoFisher | 14190-250 | |
| FBS | Fisher Scientific | SH3007103HI | |
| Fibronectin | Sigma Aldrich | F1141-5MG | |
| Geltrex | ThermoFisher | A1413202 | coating substrate |
| Interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot Interface Board | |
| Multiwell MEA Plate | Multichannel Systems | 24W300/30G-288 | |
| RPMI 1640 | ThermoFisher | 11875-093 | CM base medium |
| Terg-a-zyme | Sigma Aldrich | Z273287-1EA | enzymatic detergent |
| Transfer pipettes, individually wrapped | Fisher Scientific | 1371148 | |
| Trypan Blue | Sigma Aldrich | T8154-100ML | |
| Ultrapure sterile water | ThermoFisher | 10977-023 | |
| 6-well tissue-culture treated plates | Fisher Scientific | 08-772-1B |
参考文献
- Dambrot, C., Passier, R., Atsma, D., Mummery, C. L. Cardiomyocyte differentiation of pluripotent stem cells and their use as cardiac disease models. Biochemical Journal. 434 (1), 25-35 (2011).
- Dunn, K. K., Palecek, S. P. Engineering Scalable Manufacturing of High-Quality Stem Cell-Derived Cardiomyocytes for Cardiac Tissue Repair. Frontiers in medicine. 5, (2018).
- Edwards, S. L., et al. A Multiwell Cardiac muGMEA Platform for Action Potential Recordings from Human iPSC-Derived Cardiomyocyte Constructs. Stem Cell Reports. 11 (2), 522-536 (2018).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Huebsch, N., et al. Miniaturized iPS-Cell-Derived Cardiac Muscles for Physiologically Relevant Drug Response Analyses. Scientific Reports. 6, 24726(2016).
- Lundy, S. D., Zhu, W. Z., Regnier, M., Laflamme, M. A. Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Stem Cells and Development. 22 (14), 1991-2002 (2013).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sharma, A., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes to assess drug cardiotoxicity. Nature Protocols. , (2018).
- Zhang, D., et al. Tissue-engineered cardiac patch for advanced functional maturation of human ESC-derived cardiomyocytes. Biomaterials. 34 (23), 5813-5820 (2013).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circulation Research. 111 (9), 1125-1136 (2012).
- Burridge, P. W., Holmstrom, A., Wu, J. C. Chemically Defined Culture and Cardiomyocyte Differentiation of Human Pluripotent Stem Cells. Current Protocols in Human Genetics. 87, (2015).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Burridge, P. W., Zambidis, E. T. Highly efficient directed differentiation of human induced pluripotent stem cells into cardiomyocytes. Methods in Molecular Biology. , 149-161 (2013).
- Laflamme, M. A., et al. Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts. Nature Biotechnology. 25 (9), 1015-1024 (2007).
- Sharma, A., et al. Derivation of highly purified cardiomyocytes from human induced pluripotent stem cells using small molecule-modulated differentiation and subsequent glucose starvation. Journal of Visualized Experiments. (97), (2015).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), (2014).
- Zhang, J., et al. Functional cardiomyocytes derived from human induced pluripotent stem cells. Circulation Research. 104 (4), e30-e41 (2009).
- Jans, D., et al. Action potential-based MEA platform for in vitro screening of drug-induced cardiotoxicity using human iPSCs and rat neonatal myocytes. Journal of Pharmacological and Toxicological Methods. 87, 48-52 (2017).
- Strauss, D. G., Blinova, K. Clinical Trials in a Dish. Trends in Pharmacological Science. 38 (1), 4-7 (2017).
- Tertoolen, L. G. J., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochemical and Biophysical Research Communications. 497 (4), 1135-1141 (2018).
- Braeken, D., et al. Open-cell recording of action potentials using active electrode arrays. Lab Chip. 12 (21), 4397-4402 (2012).
- Otsuji, T. G., et al. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Research. 4 (3), 201-213 (2010).
- Shinozawa, T., Imahashi, K., Sawada, H., Furukawa, H., Takami, K. Determination of appropriate stage of human-induced pluripotent stem cell-derived cardiomyocytes for drug screening and pharmacological evaluation in vitro. Journal of Biomolecular Screening. 17 (9), 1192-1203 (2012).
- Raphel, F., et al. Identification of Ion Currents Components Generating Field Potential Recorded in MEA From hiPSC-CM. IEEE Transactions on Biomedical Engineering. 65 (6), 1311-1319 (2018).
- Hai, A., Spira, M. E. On-chip electroporation, membrane repair dynamics and transient in-cell recordings by arrays of gold mushroom-shaped microelectrodes. Lab Chip. 12 (16), 2865-2873 (2012).
- Xie, C., Lin, Z., Hanson, L., Cui, Y., Cui, B. Intracellular recording of action potentials by nanopillar electroporation. Nature Nanotechnology. 7 (3), 185-190 (2012).
- Cohen, A., Shappir, J., Yitzchaik, S., Spira, M. E. Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors. Biosensors and Bioelectronics. 23 (6), 811-819 (2008).
- Ojovan, S. M., et al. A feasibility study of multi-site,intracellular recordings from mammalian neurons by extracellular gold mushroom-shaped microelectrodes. Scientific Reports. 5, 14100(2015).
- Shmoel, N., et al. Multisite electrophysiological recordings by self-assembled loose-patch-like junctions between cultured hippocampal neurons and mushroom-shaped microelectrodes. Scientific Reports. 6, 27110(2016).
- Lin, Z. C., Xie, C., Osakada, Y., Cui, Y., Cui, B. Iridium oxide nanotube electrodes for sensitive and prolonged intracellular measurement of action potentials. Nature Communications. 5, 3206(2014).
- Stett, A., Burkhardt, C., Weber, U., van Stiphout, P., Knott, T. CYTOCENTERING: a novel technique enabling automated cell-by-cell patch clamping with the CYTOPATCH chip. Receptors Channels. 9 (1), 59-66 (2003).
- Kanda, Y., Yamazaki, D., Osada, T., Yoshinaga, T., Sawada, K. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes: Japan iPS Cardiac Safety Assessment (JiCSA) update. Journal of Pharmacological Sciences. 138 (4), 233-239 (2018).
- Yang, X., Papoian, T. Moving beyond the comprehensive in vitro proarrhythmia assay: Use of human-induced pluripotent stem cell-derived cardiomyocytes to assess contractile effects associated with drug-induced structural cardiotoxicity. Journal of Applied Toxicology. 38 (9), 1166-1176 (2018).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come. British Journal of Pharmacology. 174 (21), 3749-3765 (2017).
- Zlochiver, V., Edwards, S., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochimica et Biophysica Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Current Protocols in Toxicology. 68, 21-22 (2016).
- Navarrete, E. G., et al. Screening drug-induced arrhythmia [corrected] using human induced pluripotent stem cell-derived cardiomyocytes and low-impedance microelectrode arrays. Circulation. 128 (11 Suppl 1), S3-S13 (2013).
- Harris, K., et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays. Toxicological Sciences. 134 (2), 412-426 (2013).
- Zlochiver, V., Edwards, S. L., Joshi-Mukherjee, R. Longitudinal Cardiotoxic Effect of Doxorubicin in a Multicellular Cardiac Model. Biophysical Journal. 116 (3), (2019).
- Waas, M., et al. Are These Cardiomyocytes? Protocol Development Reveals Impact of Sample Preparation on the Accuracy of Identifying Cardiomyocytes by Flow Cytometry. Stem Cell Reports. , (2019).
- Gorospe, G., et al. Automated grouping of action potentials of human embryonic stem cell-derived cardiomyocytes. IEEE Transactions on Biomedical Engineering. 61 (9), 2389-2395 (2014).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics & Molecular Biology. 120 (1-3), 3-17 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved