Method Article
中央記憶表現型の維持による9日間の主要T細胞の導入と拡張
要約
我々は、細胞有効性の注入研究のために十分な数の目的の遺伝子の優れた共発現を有する細胞を得るアカゲザル末梢血単核細胞の導入及び拡張のための9日間のプロトコルを概説する。
要約
感染症や癌を治療するための新たな免疫療法は、しばしば、疾患標的タンパク質をコードする遺伝子を用いた細胞集団の導入を伴う。例えば、がんやウイルス感染を治療するキメラ抗原受容体(CAR)-T細胞は、CAR分子をコードする合成遺伝子を有するT細胞の導入を伴う。CAR分子は、T細胞を特異的に認識させ、癌またはウイルス感染細胞を殺す。細胞はまた、関心のある他の遺伝子と共に導入することができる。例えば、細胞は、細胞を特定の場所に標的とするタンパク質をコードする遺伝子と共にトランスニューシーを行うことができる。ここでは、ウイルス特異的CARおよびB細胞卵胞ホーミング分子ケモカイン受容体5型(CXCR5)をコードする遺伝子を用いて、一次末梢血単核細胞(PBMC)をトランスデューシングするプロトコルを提示する。この手順は9日かかり、その結果、中央記憶表現型を維持するT細胞集団が導入される。中心記憶またはあまり分化された表現型の維持は、細胞の持続性と後注入に関連することが示されている。さらに、この方法で産生された細胞は、高レベルの生存率、2つの導入遺伝子の高レベルの共発現、および免疫療法用注入のための十分な量の細胞を示す。この9日間のプロトコルは、CAR-T細胞および他のT細胞免疫療法アプローチに広く使用することができる。ここで説明する方法は、以前の出版物で提示された研究に基づいています。
概要
がんや感染症などの疾患を治療する新しい手段として、細胞免疫療法が生まれつつあります。これらの免疫療法法は、多くの場合、特定の分子を発現する治療細胞を遺伝的に操作することを含む。例えば、キメラ抗原受容体(CAR)T細胞は、疾患細胞上の分子に特異的に結合する細胞外ドメインを有するCAR分子と、免疫細胞を引き起こすシグナル伝達ドメインを有するCAR分子を発現するように設計されている。CAR T細胞は、がん免疫療法において有効に使用されており、特にB細胞白血病11、2、32,3の治療に有効である。CAR-T細胞はまた、HIVなどのウイルス感染を治療するために開発されています。HIV特異的CARsは、ウイルス感染細胞4の表面上のエンベロープタンパク質を標的とする。免疫療法細胞はまた、特定の組織の位置に治療細胞を標的とするホーミング分子を発現するように設計することができる。我々は、ウイルス特異的CARとリンパ卵胞ホーミング分子CXCR55の両方をトランスデューシングするベクターを開発した。
ヒト免疫不全ウイルス(HIV)およびシミアン免疫不全ウイルス(SIV)を含むいくつかのウイルスのウイルス複製は、二次リンパ組織におけるB細胞包包内に集中する6。B細胞卵胞は、ウイルス特異的CTLの低レベルが継続的なウイルス複製77、8を可能にする幾分免疫の特権部位である。これらの理由から、CXCR5の発現を通じて卵胞にHIV/SIV特異的T細胞を標的化することは、ウイルス感染細胞99,1010の濾胞貯留層の排除のための戦略である。具体的には、CXCR5共発現を介して、SIV特異的CAR T細胞をB細胞卵胞にターゲットにしています。
このプロトコルでは、CAR/CXCR5をトランスデュースし、治療用注入のための十分な量のCAR/CXCR5 T細胞を産生するためにPBMCを拡大する方法を説明する。これらの方法で導入された細胞は、中央記憶表現型を維持する。研究は、中央記憶T細胞およびT記憶幹細胞のような分化表現型が少ない細胞が、より多くの分化細胞11、12,12よりもより良く持続することを示している。さらに、養子に移された細胞を産生するように設計された多くのプロトコルは、より分化された表現型および減少した持続性13を有する細胞をもたらす比較的長い培養時間を有する。さらに、長い培養時間を有する細胞は、アカゲザル14,15,15の標的リンパ組織の代わりに肺内に蓄積された。ここで説明し、実証する方法では、アカゲザルPBMCsを急速にトランスデュースして拡大し、中央記憶表現型を維持するトランスデューセT細胞を生成します。
CD4細胞とCD8T細胞の両方が免疫療法アプローチに含まれています。この混合細胞集団は、臨床試験において、CD8+T細胞産物中のCD4+T細胞の存在が、CD8+T細胞を注入して16個を持続させる不全と相関したために選択された。ここで説明する方法は、T細胞受容体を強力に刺激し、クローン性アナギー17、18,18を回避するための共刺激シグナルを提供する抗CD3および抗CD28抗体を用いてPBMCを活性化することから始まる。
活性化後、細胞は、ウイルス特異的CARおよびリンパ系ホーミング分子CXCR5をコードするガンマレトロウイルスベクターを用いてトランスタイズされる。その後、トランスデューシー細胞は、基部にガス透過膜を有する非接着細胞伝搬用に設計されたプレートを使用して拡張されます。この膜は、細胞の生存率と栄養の可用性を強化する井戸の底部でのガス交換を可能にします19.これらの方法を用いて、十分な機能細胞をインビボ注入研究のための9日間の時間枠で産生することができる。このプロトコルは、アカゲザルT細胞をトランスデューシングおよび拡張するために設計されているが、種特異的活性化抗体のわずかな改変により、他の種の細胞と共に使用することができる。これらの方法は、以前に発表された研究99、2020に基づいています。
プロトコル
注: このアカシスPBMCトランスダクションプロトコルは、ガンマレトロウイルスベクターの使用を必要とします。ガンマレトロウイルスは、ラボで生産するか、ウイルス生産会社に委託できることに注意してください。実験室での生産はステップ1で概説されたプロトコルで行うことができるし、ウイルスはステップ2で概説されるようにしがみつくことができる。ウイルスが現場で生成されるか、制作会社によって産生されるかに関わらず、MOI(培養中の細胞に対する感染性ビリオンの比率)は、ステップ3で概説されているように、新たに産生されたウイルス製剤および対象細胞ごとに決定されるべきである。
注意:ガンマレトロウイルスベクターまたは他のレトロウイルスベクターを使用するには、ラボコートや手袋の二重層の使用などの適切な安全対策が必要です。ウイルスのすべての取り扱いは、バイオセーフティフードで発生する必要があります。すべてのピペットは、30分間10%漂白剤の溶液中で除染する必要があります。すべての液体感染性廃棄物は、10%漂白剤の最終濃度で除染する必要があります。微生物学的エアロゾルの放出を防ぐシールを備えた二次封じ込めは、遠心分離のために必要とされる
1. ガンマレトロウイルスストックの製造
- トランスフェクション用プレート293T細胞。完全なウイルス製剤は、抗生物質なしでダルベッコの改変イーグル培地(DMEM)+10%胎児ウシ血清(FBS)で4.5 x 106細胞/フラスコで12 T75フラスコを必要とします。
- 細胞がトランスフェクションの前に37°Cで一晩成長するようにします。
- 1.5 mL減らされた血清培地で60μLのトランスフェクション試薬を希釈した。フラスコごとにチューブを1つ用意します。RTで5分間インキュベートします。
- フラスコごとに、1.5 mLの減らされた血清培地と以下のプラスミドを含むチューブを準備します:目的の遺伝子を含む転写プラスミドの9.0 μg、RD114の3 μgおよびVSV-G(エンベローププラスミド)の1.2 μg、および3 μgのギャグ/pol g。
注:エンベロープおよびgag/pol遺伝子は、レトロウイルス包装に必要です。当社のレトロウイルス生産のために、RD114エンベロープと、安定性を加えるため、少量のVSV-Gエンベロープを追加しました。 - 希釈したプラスミド(ステップ1.4)を希釈トランスフェクション試薬に加える(ステップ1.3)。やさしく混ぜます。室温で20分間インキュベートします。
- 細胞5 mLの新鮮な完全な培地を供給し、3 mLのトランスフェクション試薬/プラスミド混合物を1フラスコあたり滴下し、37°Cで5〜6時間インキュベートする。
- フラスコにさらに5mLの新鮮な培地を加え、37°Cで42〜43時間インキュベートします。
- 48時間の総トランスフェクション時間の後、培地と遠心分離機を4°Cで3分間1282 x gで回収し、細胞の破片を除去します。
- アリコートは将来の使用のために適切な量に、フラッシュはエタノール/ドライアイス浴でウイルスを凍結し、-80 °Cで保存します。
2. ガンマレトロウイルスのタテリング
注: 有効な価数を得るためには、いくつかの希釈ウイルスが必要になる場合があります。
- 6ウェルプレートに600,000個の細胞/ウェルで293T細胞をプレートし、37°Cで24時間プレートをインキュベートします。
- 細胞から培地を取り出し、293T(2 mLのウイルスの総量)に所望の量のDMEM + 10%FBSを加えます。
- 対応する井戸にウイルスを追加し、混合するために穏やかに渦巻きます。例えば、200 μL、100 μL、50 μL、25 μL をそれぞれ 4 つのウェルに加えます。フローサイトメトリー(模擬サンプル)のためのウイルスのないウェルを含める。
- 37°Cで48時間インキュベートする。
- トリプシン-EDTAを0.5 mL添加し、37°Cで4分間インキュベートすることにより、293T細胞をトリプシン化します。DMEM + 10% FBSの1.5 mLを加えてトリプシンを停止します。細胞を数え、自動化された細胞カウンターまたはヘモサイトメーターで生存率を決定する。
- セルカウンターを使用するには、10 μLのセルをトリパンブルーの10 μLに加え、混合し、チャンバースライドをロードし、カウンターに挿入します。「キャプチャ」ボタンを押してセルをカウントします。
- 0.5~1 x 106個のセルを収集し、フローサイトメトリーでCARおよびCXCR5のレベルを評価します(ステップ9.5を参照)。CXCR5と共にCD4またはMBLを発現させることで、CARおよびCXCR5とを併発現させる293T細胞を同定する。ステップ9.5.1の反応性抗体を参照してください。
- ウイルス性の高い抗剤を計算します。
注: 価数の計算には、トランスダクション レベルが 20% 以下のサンプルを選択します。- 次の数式を使用して、タンターを計算します。
トランスダクション単位/mL =(培養中の細胞数)(細胞の割合)/培養に添加されたウイルスの量
- 次の数式を使用して、タンターを計算します。
3. 新たに産生されたウイルス製剤と細胞の最適なMOIの決定
- 一次PBMCsとガンマレトロウイルス製剤の二重希釈を用いたトランスダクションプロトコル(セクション4~9)に従ってください。
- フローサイトメトリーにより対象遺伝子の発現レベルを評価する(ステップ9.5)。
- 細胞生存率を失うことなく最大の伝達を可能にするウイルスの濃度を選択してください。
4. 抗CD3抗体を用いてウェルをコーティングすることによりT細胞活性化のためのプレートを準備する
- リン酸緩衝生理食塩水(PBS)でストックを10 μg/mLに希釈して、抗マカクCD3抗体(FN18)を調製します。
- 6ウェルプレートに2 mL/ウェルを分配します。37°Cで2時間インキュベートする代わりに、プレートを4°Cで一晩インキュベートすることができる。
- PBSおよび非結合抗体を吸引する。2 mLのPBSでウェルを2回リンスし、すぐにPBMCsをプレートに使用します。
5. プレート結合抗CD3および可溶性抗CD28によるアゲサスPBMCsの刺激
- 少量の氷が残るまで、穏やかな攪拌で、37°Cの水浴で一次アカゲ座を解凍します。
- フード内で、ピペット細胞を円錐形のチューブにそっと入れ入れ。塩基性培地1mLでバイアルをすすい、ゆっくりと細胞に加えます。次に、細胞に9mLの温かい塩基性培地をゆっくりと加えます。
注:このステップはスケールアップできますが、一度に4バイアル以上を解凍することはありません。 - 22°Cで5分間600xgで遠心分離機を細胞にペレットする。 g上清を吸引し、少量の成長培地でペレットを再懸濁する。最終的な濃度は2 x 106細胞/mLでなければならないので、この時点で細胞の濃度が2 x 106細胞/mLを超えるような体積を選択してください。
- 細胞をトリパンブルーで染色し、その細胞を数えて生存細胞の数を決定します。
注:これは標準的なヘモサイトメーターまたは自動化された細胞のカウンターで行うことができる。生細胞の生存率と数を表示する自動セルカウンターを使用しています。- カウンターを使用するには、10 μLのセルを10 μLのトリパンブルーに加え、混合し、チャンバースライドをロードしてカウンターに挿入します。「キャプチャ」ボタンを押してセルをカウントします。
- 細胞濃度を体積で乗算して細胞の総数を計算し、増殖培地で細胞を2 x 106細胞/mLに希釈します。めっきする前に、T細胞活性化に必要な共刺激信号を提供するために、5 μg/mLの最終濃度に抗CD28を加えます。
- ピペット細胞を抗CD3コーティングプレートに。ウェルあたり3〜6 x 10個のセルを加え(良好なターゲットはウェルあたり2 mL培地で4 x 106細胞)、5%CO2で37 °Cで2日間インキュベートする。2
6. フィブロネクチンコーティングプレートの準備
注:PBMCおよびT細胞は、インテグリン受容体VLA-4またはVLA-5を発現し、フィブロネクチン媒介伝達の良い標的である。
- プレートをコーティングする前に、まず滅菌PBSで1:100に希釈してフィブロネクチン試薬を調製する。
- 6ウェルプレートの各ウェルに滅菌フィブロネクチン溶液のピペット2mL。室温で2時間軽く揺らすプレート。
注: 非処理、細胞培養グレードの組織培養プレートまたは皿は、このステップで使用する必要があります。 - フィブロネクチン溶液を吸引により除去し、次いでPBS中の滅菌2%ウシ血清アルブミン(BSA、フラクションV)の1mLでブロックする。プレートを室温で30分間揺らします。
- BSA溶液を吸引し、2mLのPBSでプレートを洗浄します。PBSの吸引後、フィブロネクチンコーティングされたプレートをシールラップで密封し、4°Cで最大1週間保存することができます。
注:私たちは通常、導入の1日前にプレートを準備します。
7. 活性化されたアキサスPbMCの導入
注意:ウイルスベクターまたはアカゲザルPBMCsで作業するには、ラボコートや手袋の二重層の使用などの適切な安全対策の利用が必要です。ウイルスおよび細胞のすべての取り扱いは、バイオセーフティフードで発生する必要があります。すべてのピペットは、30分間10%漂白剤の溶液中で除染する必要があります。すべての液体感染性廃棄物は、10%漂白剤の最終濃度で除染する必要があります。微生物学的エアロゾルの放出を防止するシールを有する二次封入は、遠心分離のために必要とされる。
- フィブロネクチンコーティングウェルにガンマレトロウイルストランスデューシングベクターを取り付けます。
- 2000 x gで約 30 分間走って、遠心分離機を 32 °C に温める。
- 37°Cの水浴で、無血清および成長培地の両方を温めます。
- 氷上でウイルスを解凍するか、少量の氷が残るまで37°Cの水浴でバイアルを穏やかに渦巻くことによって解凍します。ウイルス製剤の劣化を避けるために、内容物をウォームアップしないようにしてください。
- レトロウイルスを、血清フリー培地で所定の最適な感染多重度(MOI)に希釈する。
注:私たちのガンマレトロウイルスとアカゲスPBMCでは、0.5のMOIが最適であることがわかりました。- 希釈例: 4つのウェルをウイルスでコーティングし、1.5 x 106細胞を追加するには、(4)(1.5 x 10 6)(0.5)=3 x 106 TUが必要です。6ウイルス用のチターが1.1 TU/mLの場合は、5.3 mLメディアで2.7 mLウイルスを使用して、合計容量8mLを使用します。
- フィブロネクチンコーティングされたプレートの各ウェルに2mL希釈レトロウイルスを加えます。
- 陰性対照の模擬導入細胞の場合、フィブロネクチンコーティングされたウェルに単独で培地を添加する。
- あらかじめ温めた32°C遠心分離機に、バイオセーフカバーと遠心分離機を2000 x gでマイクロプレートキャリアに入れ、2時間置きます。
注:ウイルスコーティングされたプレートは、一晩4°Cで、ウイルスと一緒に、すぐにまたは保存することができます。 - 即時使用のために、ウイルス製剤をウェルから吸引し、2mLの成長培地を加える。ウイルスコーティングされた井戸を乾燥しないようにしてください。
- 刺激されたPBMCをプレートします。
- 逆顕微鏡を使って細胞を確認します。細胞は健康に見えるはずです, 彼らはラウンドであることを意味します, 明るく、光を屈折.彼らはまた、刺激を示す凝集した外観を示す必要があります。
- 標的細胞を収集し、50 mL円錐管に移します。1 mL成長培地でウェルを1回リンスし、円錐管に加えます。手順 5.4 のように、自動セル カウンターを持つ生細胞の数をカウントします。
注: 刺激された細胞は凝集し、この凝集は正確に細胞を数えるのが困難につながる可能性があります。 - 32°Cで5分間600xgで遠心分離してチューブg中の細胞をペレットにする。培地を細胞ペレットから吸引し、1.5 x 106細胞/mLの濃度で増殖培地中の細胞を再懸濁させた。
- 各ウイルスコーティングウェル(ステップ7.1で調製)に、合計1.5 x 106細胞/3 mLの細胞懸濁液を1mL加える。各ウェルには既に2 mL成長培地が含まれていることに注意してください。モックトランスデューセド細胞についても同じ手順を実行しますが、ウイルスを受け取らなかったフィブロネクチンコーティングされたウェルにプレートします。
- プレートを1000 x gで32°Cで10分間遠心します。
- 5%CO2の下で37°Cで48時間プレートをイン2キュベートします。
8. 細胞の転移
- 細胞を再懸濁させるために5 mLピペットでウェルの内容物を上下に描き、50 mL円錐形チューブに移します。
- 各ウェルに1 mLの成長培地を加え、無菌転写ピペットで上下に引き出し、接着細胞を除去します。
- ステップ 5.4 のように、セル数のカウントを行い、自動化されたセルカウンターを使用してセルの合計数と生存率を決定します。
- 必要に応じて、フローサイトメトリー用に1 x106細胞を除去し、遺伝子発現および表現型を評価する。推奨される抗体および格言戦略については、ステップ 9.5.1 および材料表を参照してください。
- 600 x gで細胞を 25 °C で 10 分間遠心分離します。
- 培地を吸引し、1 x 106細胞/mLの濃度に膨張培地中の細胞を再懸濁します。6-ウェルプレートの各ガス透過ウェルに5 mLの細胞をシードします。井戸ごとに25mLの拡張メディアを慎重に重ねてください。
注: 小さなボリュームにセルを追加し、残りのメディアを重ねて、セルがウェルの底部に残るようにします。 - 5%CO2インキュベーターで37°Cで4日間2培養を行います。
9. 細胞の拡大と、細胞のトランスデューシングの表現型の評価
- 20 mLの媒体を取り除き、廃棄することによってガス透過性の井戸から細胞を集める。細胞を乱さないように注意する必要があります。.
注: セルを 4 日間だけ展開し、この時点でセルを収集します。しかし、追加の日数の培養が望ましい場合は、細胞を乱さずに20mLの培地を取り除き、20mLの新鮮な膨張培地に交換してください。 - 残りのメディアを上下にピレットして、セルを取り外します。細胞がうまく成長している場合、メディアは非常に曇っているはずです。
- 滅菌移動ピペットを使用して、3 mL培地で各ウェルをリンスし、残留細胞を収集します。
- 自動カウンタまたはヘモサイトメーターを使用して細胞を数え、生存率と細胞数を確認します。
- 細胞細胞量測定の流れを行い、細胞表現型とトランスデューセド遺伝子発現を決定する。
- この例では、CD4(M-T477)に対する抗体を用いてアカゲザルPBMC表現型を決定し、内因性rhCD4およびrhCD4-MBL CARの両方で反応性を有するクローンである。合計T細胞とCD8 T細胞をそれぞれ染色するCD3(SP34-2)およびCD8(RPA-T8)に対して;細胞の記憶表現型を決定するために使用される死受容体CD95(DX2)と共刺激分子CD28(CD28.2)に対して;CXCR5(MU5UBEE)およびMBL(3E7)に対して、トランスデューセドセル上のCXCR5およびCD4-MBL CARを検出する。
- 生存率を評価し、固定可能な生存性染料で評価した。
- フローサイトメトリー用の細胞を準備します。
- チューブの総数の抗体マスターミックスを構成します。PBS を使用して、合計ボリュームまで持ち出します。
- フローチューブにセルを追加します。チューブあたり 0.5 ~ 1 x 106 個のセルを配置します。染色されていない細胞や、染色された模擬導入細胞などの陰性コントロールを含む。
- 細胞にPBSの2mLを加え、400 x gで遠心分離機を室温(RT)で5分間加え、デカントします。
- 100 μLの抗体ミックスをチューブに加え、RTで30分間インキュベートします。
- PBS 2 mL を加え、遠心分離機を 400 x gで 5 分間 RT とデカントで加えます。
- 300 μLのパラホルムアルデヒドを1%添加し、15分間インキュベートします。
- 400 x gでの遠心分離機 RT とデカンで 5 分間。300 μLのPBSを加え、混ぜます。
- フローサイトメーターで、各サンプルに対して150,000個のイベントを取得します。
- フロー解析ソフトウェアを使用してデータを分析します。
注: 格言戦略は以前に公開されました20.- トランスデューセド細胞の同定のために、リンパ球、シングル、ライブ、CD3+、およびMBL+CXCR5+上のゲート細胞。
- 中央記憶集団の同定のために、リンパ球上のゲート細胞、シングルト、生CD3+、CD8+、CD28+CD95+。
- 必要に応じてセルを使用します。細胞は、トランスウェル移行アッセイ9またはインビトロ細胞殺死アッセイ55,99などのインビトロの機能アッセイに使用することができる。細胞は動物への注入に使用することができる。あるいは、残りの細胞を90%FBSで10%ジメチルスルホキシド(DMSO)で凍結し、後で使用または分析する
注:アカゲザルへの養子移送細胞の注入の標的用量はまだ確立されていませんが、非ヒト霊長類の導入導入研究は0.6〜1.2 x 107セル/kg 21、1〜5 x21108細胞/kg 22、1.4〜8 x 108細胞/kg22 10を使用しています。この範囲をガイドラインとして、この9日間のプロトコルで注入のための十分な細胞を作り出すことができる。
結果
細胞製造
この資料で提示された結果は、以前に出版された作品9,,20に似ています。ここで示したプロトコルを利用して、5日目から9日目までの細胞の少なくとも8倍の拡張が期待されます(中央値は11.1倍、範囲は8.7-13倍)。ガス透過性ウェルを5 x106細胞の開始密度で播種し、4日間の成長の後、ウェルあたり55.6 x 106細胞の中央値密度を達成した(範囲43.5-64.8 x 106)(図1A)。Trypan Blue除外を含むセルカウントは、細胞がプロトコル全体で高い生存率を維持していることを示しています(9日目の中央値85.8%、範囲83-95%)(図1B)。我々は、細胞が拡大する能力における動物の変動に動物を見つける。しかし、1日目に50~100 x 106細胞の母集団を作り出すこのプロトコルを用いて、1~2 x 108個のセル/kgのアカゲザル注入に十分な細胞を作り出しました。
トランスデューセド遺伝子の共発現をフローサイトメトリーでモニタリングした(図2A)。この拡張プロトコルの5日目から9日目の間に、トランスデューセドされた細胞の表面上のCARおよびCXCR5の発現は比較的安定であった。5日目の中央値は42.8%(範囲は36.5~46.9%)細胞のうちCD4-MBL CARとCXCR5の両方を導入したが、9日目には中央値の発現が47.6%(範囲44.5~64.5%)であった。1回の伝達のラウンドを有する(図2B)。いくつかのプロトコルは、第二の伝達を必要としますが、プロトコルの終了時に総導入細胞の面で利益を見ていない(データは示されていません)。
細胞表現型
トランスデュース細胞をフローサイトメトリーで解析し、それらの記憶表現型をモニタリングした。導入と拡張の前に、ナイーブ、中央記憶およびエフェクターのメモリ集団が同定される(データは示さない)が、培養によってナイーブ集団は失われ、細胞は主に5日目(図3A)および9日目(図3B)によってCD95+ CD28+発現+によって識別される中央記憶細胞である。+この急速な伝達および拡張プロトコルの使用は、主に中央記憶細胞である細胞を産生し、したがって、試験動物に注入されたときに増殖し、持続する可能性が高い。
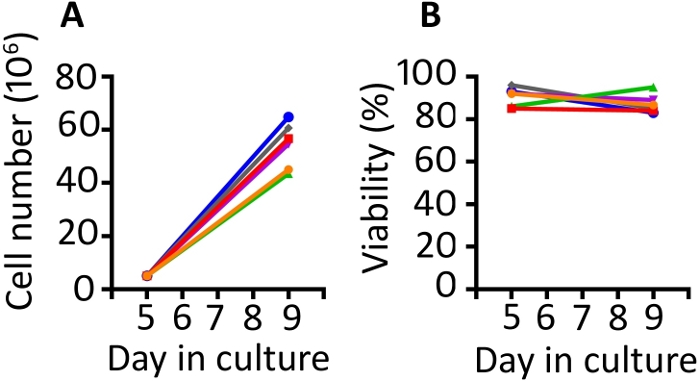
図1:この伝達および拡張プロトコルは、高い生存性を持つ豊富な導入細胞を生成する。(A) 6つの異なる動物から6つの異なる動物からガス透過性容器内での増殖性を5日目から9日目に、そして(B)同じ6匹の動物からトランスタイズされたPBMCの生存率。自動セルカウンターを用いたトリパンブルー排除を用いて、細胞数および生存率を監視した。この図の大きなバージョンを表示するには、ここをクリックしてください。
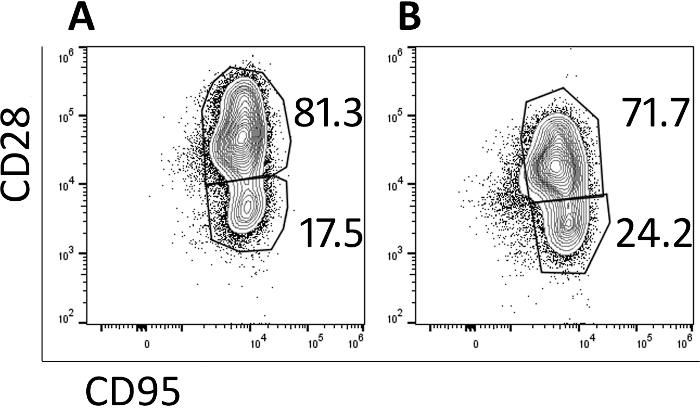
図2:この伝達プロトコルは、2つの導入された遺伝子の共発現を維持する細胞を産生する。(A) CD4-MBL CARとCXCR5の両方の発現を示す、トランスダクションおよび拡張プロトコルの9日目のアカゲサスPBMCの代表的なフロープロット。(B) リンジサイトメトリーで測定した培養5日目および9日目の6種類の動物からトランスデューセなアカゲスPBMCに対するCD4-MBL CARおよびCXCR5の発現。ゲートは、ライブ、CD3+セルに設定されました。トランスデューサされた細胞は、MBL+ CXCR5+として識別されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
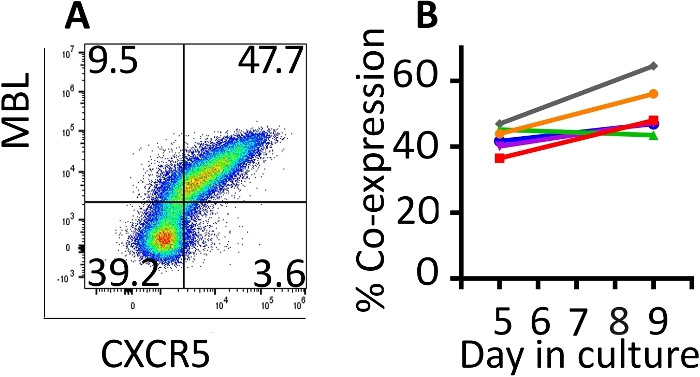
図3:9日間のプロトコルで産生される細胞の大部分は、中央記憶表現型を有する。代表流動サイトメトリープロット(A)日 5 および (B) 日 9 CAR/CXCR5 トランスデューサ アカゲサス PBMC.ゲートは、ライブ、CD3+、CD8+セルに設定されました。中央メモリは CD28+ CD95+と定義されました。エフェクター メモリは CD28-、CD95+と定義されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、抗ウイルスCARを発現するT細胞集団につながるアカゲザルPBMCをトランスデュースするためにガンマレトロウイルスベクターを利用するT細胞免疫療法の生産戦略を概説するCXCR5。合計8日間のex vivo培養時間で、生存可能な機能的なCAR T細胞は、前臨床有効性試験のために非ヒト霊長類への注入に使用される10、21、2222の公開範囲内の量で産生される。10,21
トランスダクションプロトコルの成功は、健康で刺激されたPBMCとガンマレトロウイルスの品質製剤の両方に依存しています。刺激・伝達を成功させるためには、収集後のPBMCの凍結・輸送に適切な注意を払う必要があります。理想的には、細胞が離れた場所に回収された場合、それらは液体窒素で出荷され、すぐに長期液体窒素貯蔵に入れられる。PVCは、ガンマレトロウイルスによって正常に導入されるために、有糸分裂活性である必要があります。抗CD3/抗CD28による刺激後の細胞のクラスタリングを視覚的に監視する必要があります。正しく活動化しないと、低効率の伝達が生じてしまいます。また、刺激された細胞の生存率を監視することも重要です。刺激ステップ後の生存率が悪いと、通常、あまり成功しなかった伝達につながります。ウイルス製剤がラボで製造されるか、外注されるかに関わらず、ウイルスに損傷を与え、トランスダクション効率を損なう可能性のある凍結融解サイクルを避けるために、-80°Cで単独使用アリコートに保存する必要があります。ウイルスは、各実験で一貫した量のウイルスを使用できるように、titeredする必要があります。ウイルスをトランスダクションに使用する場合は、ウイルスを素早く解凍し、必要になるまで氷の上に保存します。プロモーター、エンハンサーおよびエンベロープタンパク質の選択は、標的細胞におけるトランスジーンの伝達効率および発現に全て影響を及ぼす可能性がある。したがって、MOIは経験的に決定されなければならない。また、T細胞やプレートをガス透過ウェルで支えるように設計された培地を使用して膨張させ、細胞の増殖に優れています。しかし、動物に対する細胞膨張率の変動性がある。特定の細胞製剤の伝達および拡大の能力を決定するための試験研究を推奨する。拡張レベルは、小規模および大規模な伝達の両方で一貫しています。
このプロトコルを使用して、我々は試験動物への注入のための2.5 x 109細胞まで生産した。現時点ではプロトコルをスケールアップする必要はないことがわかりましたが、6つのウェルプレートの使用は大規模な細胞調製の制限であり、プロトコルは多くの細胞を生成するために変更を必要とします。潜在的な修飾の例としては、フィブロネクチンコーティング培養袋内でのトランスダクションを行って、細胞のトランスデュース数を増加させ、さらに拡大工程に対してより大きなガス透過性培養容器を利用することが挙げられる。我々はまだこれらの変更を行っていないが、彼らは市販の製品を利用し、現在のプロトコルに可能な変更です。
この方法を用いて、未感染動物、SIV感染動物、抗レトロウイルス療法(ART)で治療されたSIV感染動物から単離されたPBMCから細胞を導入した。しかしながら、ART処理細胞20におけるトランスダクション効率の低下を指摘している。この減少は、薬物による逆転写酵素および/またはインテグラーゼの阻害によるものと考えられていう。ART処理動物からの細胞の導入は、PBMCを収集する前に数日間ARTを停止するか、一般的に使用されているART薬の影響を受けない代替ベクターを使用することによって、ART薬物の細胞内レベルを低下させるなど、このプロトコルの変更を必要とする。
免疫療法のために産生される細胞は、輸液後12を持続させるため、最小分化表現型であることが重要である。細胞の養子移動のための多くのプロトコルは長い培養時間を必要とするが、分化の減少およびCAR T細胞機能13の改善との両方のex vivo培養時間の短縮と相関している。この伝達および拡張プロトコルの比較的急速な時間枠は、免疫療法の可能性20の試験に十分な細胞を産生しながら、所望の中央記憶表現型の維持を可能にする。
このT細胞免疫療法製品の生産戦略の目標は、SIV感染細胞を認識し、B細胞卵胞中のウイルス複製部位にトラフィックし、長期的に生じる動物に持続するT細胞を製造することです抗レトロウイルス薬を必要としない機能的な治療。ヒト免疫療法製品への翻訳のために、このプロトコルは、ヒト特異的抗体およびサイトカインの使用とGMP標準の実施を通じてヒトT細胞をトランスデュースするように変更することができ、機能性の治療法を作り出すHiv。
開示事項
パメラ・スキナー博士は、MarPamファーマの共同創設者兼最高科学責任者です。
謝辞
この研究は、NIH助成金5R01AI096966(PS、EC、およびEB)、1UM1AI26617(PS、 EC および EB、P51OD011106/P51RR00167 (ER) MN リーチ グラント 5U01HL127479-03 (PS) 1R01A1 43380-01(PSおよびEB)、1UM14126617(PSおよびEC)、およびNIAID内壁研究部門およびNIHインタルム内エイズ標的抗ウイルスプログラムによって提供される資金。これらの研究で使用される抗CD3および抗CD28は、NIH非ヒト霊長類試薬リソース(R24 OD010976、U24 AI126683)によって提供された。これらの研究で使用されるIL-2は、NCI前臨床リポジトリによって提供された。このCD4-MBL CAR/CXCR5プロジェクトの協力者、アリゾナ大学のエリザベス・コニック博士、NIAIDのエドワード・A・バーガー博士、NIHのエドワード・ア・バーガー博士、ウィスコンシン国立霊長類研究センターのエヴァ・G・ラカシュ博士、ミネソタ大学のジェフ・ハート博士、ミネソタ大学のプレティ・ハラン博士、ハーバード大学医学部のレスリー・キーン博士、キャサリン・ボルド博士また、ミネソタ大学のスコット・マクアイヴァー博士、フレッド・ハッチンソンがんセンターのクリストファー・ピーターソン博士、NIHのマシュー・トリベット博士、シアトル小児病院のアグネ・タラセビシウト博士、小児病院のコンラッド・ラッセル・クルーズ博士に感謝します。また、ミネソタ大学のチ・ファン氏とジョマリー・アレグリア=ベロカル氏がガンマレトロウイルス産生を認め、ウィスコンシン大学マディソン校のキム・ワイスグラウ氏がアカゲザルPBMCを隔離したことを感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Gammaretrovirus preparation | |||
| 0.025% Trypsin, 0.01% EDTA | Gibco | R-001-100 | |
| 293T cells | ATCC | CRL-3216 | |
| 6 well plates, treated | CytoOne | CC7682-7506 | |
| DMEM | Gibco | 10569-010 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| Lipofectamine | Invitrogen | 11668019 | transfection reagent |
| Opti-Mem | Invitrogen | 31985070 | reduced serum media |
| pBS-CMV-gagpol | Addgene | 35614 | A gift from Dr. Patrick Salmon |
| pMSGV1 containing CAR P2A CXCR5 | custom order from GenScript | ||
| RD114 | A gift from Dr. Ed Berger | ||
| T75 flasks | CytoOne | CC7682-4875 | |
| VSV-G | pMD.G | A gift from Dr. Scott McIvor | |
| T cell stimulation | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| Anti-CD28 | NHP Reagent Resource | Clone: CD28.2 | |
| Anti-macaque CD3 | NHP Reagent Resource | Clone: FN18 | |
| Phosphate buffered saline | Gibco | 14190-144 | |
| Rhesus macaque PBMC or CD8 T cells | WNPRC | Primary cells | |
| For Fibronectin coating | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| BSA (Fraction V) | HyClone | SH 30574.02 | |
| RetroNectin (1 mg/ml) | TaKaRa | T100A | |
| For T cell Expansion | |||
| G-Rex 6 Well Plate | Wilson Wolf | P/N 80240M | Plates with gas permeable wells |
| Media Components | |||
| b mercaptoethanol | Gibco | 21985-023 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| IL-2 | NCI Preclinical Repository | ||
| Penicillin/Streptomycin/Glutamine | Gibco | 10378-016 | |
| X-Vivo-15 medium | Lonza | 04-418Q | |
| Variations of Media used | |||
| Basic medium: | X-Vivo 15 medium, 10% heat-inactivated FBS, 1 x Penicillin/Streptomycin/L-Glutamine | ||
| Expansion medium: | Growth medium + 50 mM b mercaptoethanol | ||
| Growth medium: | Basic medium + 50 IU/ml IL-2 | Completion of media by addition of anti-CD28, IL-2 or b-mercaptoethanol should occur on the day of use. | |
| Cell counting | |||
| Countess cell counting chambers | Invitrogen | AMQAF1000 | |
| Countess II FL Automated Cell Counter | Invitrogen | T10282 | |
| Trypan blue, 0.4% solution | Invitrogen | T10282 | |
| Flow Cytometry | |||
| Alexa Fluor 647 Antibody Labeling Kit | Invitrogen | A20186 | for conjugation of MBL antibody |
| anti-CD28-BV605 | BD Biosciences | 562976 | |
| anti-CD3-AF700 | BD Biosciences | 557917 | |
| anti-CD4-FITC | BD Biosciences | 556615 | |
| anti-CD8-BV788 | BD Biosciences | 563824 | |
| anti-CD95-PerCP Cy5.5 | BD Biosciences | 561655 | |
| anti-CXCR5-PE | eBioscience | 12-1985-42 | |
| anti-MBL | Invitrogen | MA1-40145-S6 | |
| Flow Analysis software | FlowJo, LLC | FlowJo v10 | |
| Flow Cytometer | Beckman | CytoFlex | |
| Live/Dead Near IR | Invitrogen | L10119 | |
| Other equipment | |||
| Aerosolve canisters to contain aerosol leakage | Beckman | SX4750 | Safety equipment |
| Beckman Allegra Centrifuge | Beckman | Sterilgard e3 | |
| Cell culture incubator | Thermo Fisher | Everlast 247 | |
| Class II Laminar flow hood | Baker | Heracell Vios 160i | |
| Extra-Safe Disposable lab coat | Fisher Scientific | 359232 | Personal protective equipment |
| Microplate carriers with biocertified covers | Beckman | SX4750A | Safety equipment |
| Rocking platform | Benchmark | C10228 | |
| Swinging bucket rotor | Beckman | X13-R | |
| X-Gen Nitrile gloves | Genesee | Personal protective equipment |
参考文献
- Klebanoff, C. A., Rosenberg, S. A., Restifo, N. P. Prospects for gene-engineered T cell immunotherapy for solid cancers. Nature Medicine. 22 (1), 26-36 (2016).
- Lim, W. A., June, C. H. The Principles of Engineering Immune Cells to Treat Cancer. Cell. 168 (4), 724-740 (2017).
- Sadelain, M., Rivière, I., Riddell, S. Therapeutic T cell engineering. Nature. 545 (7655), 423-431 (2017).
- Kuhlmann, A., Peterson, C. W. Chimeric antigen receptor T-cell approaches to HIV cure. Current Opinion in HIV and AIDS. 13 (5), 446-453 (2018).
- Ghanem, M. H., Bolivar-Wagers, S., et al. Bispecific chimeric antigen receptors targeting the CD4 binding site and high-mannose Glycans of gp120 optimized for anti-human immunodeficiency virus potency and breadth with minimal immunogenicity. Cytotherapy. 20, 407-419 (2018).
- Folkvord, J. M., Armon, C., Connick, E. Lymphoid Follicles Are Sites of Heightened Human Immunodeficiency Virus Type 1 (HIV-1) Replication and Reduced Antiretroviral Effector Mechanisms. AIDS Research and Human Retroviruses. , (2005).
- Connick, E., Mattila, T., et al. CTL Fail to Accumulate at Sites of HIV-1 Replication in Lymphoid Tissue. The Journal of Immunology. 178 (11), 6975-6983 (2007).
- Connick, E., Folkvord, J. M., et al. Compartmentalization of Simian Immunodeficiency Virus Replication within Secondary Lymphoid Tissues of Rhesus Macaques Is Linked to Disease Stage and Inversely Related to Localization of Virus-Specific CTL. The Journal of Immunology. 193 (11), 5613-5625 (2014).
- Haran, K. P., Hajduczki, A., et al. Simian immunodeficiency virus (SIV)-specific chimeric antigen receptor-T cells engineered to target B cell follicles and suppress SIV replication. Frontiers in Immunology. 9 (MAR), 1-12 (2018).
- Ayala, V. I., Deleage, C., et al. CXCR5-Dependent Entry of CD8 T Cells into Rhesus Macaque B-Cell Follicles Achieved through T-Cell Engineering. Journal of Virology. 91 (11), e02507-e02516 (2017).
- Redeker, A., Arens, R. Improving adoptive T cell therapy: The particular role of T cell costimulation, cytokines, and post-transfer vaccination. Frontiers in Immunology. 7 (SEP), 1-17 (2016).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting Through Subsets. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Ghassemi, S., Nunez-Cruz, S., et al. Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells. Cancer Immunology Research. 6 (9), 1100-1109 (2018).
- Minang, J. T., Trivett, M. T., Bolton, D. L., Trubey, C. M., Estes, J. D., Li, Y., et al. Efficacy of Adoptively Transferred Central and Effector Memory-Derived Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones in Rhesus Macaques during Acute Infection. The Journal of Immunology. 184 (1), 315-326 (2010).
- Bolton, D. L., Minang, J. T., et al. Trafficking, persistence, and activation state of adoptively transferred allogeneic and autologous Simian Immunodeficiency Virus-specific CD8(+) T cell clones during acute and chronic infection of rhesus macaques. Journal of immunology (Baltimore, Md. : 1950). 184 (1), 303-314 (2010).
- Patel, S., Jones, R. B., Nixon, D. F., Bollard, C. M. T-cell therapies for HIV : Preclinical successes and current clinical strategies. Cytotherapy. 18 (8), 931-942 (2019).
- Chambers, C. A., Allison, J. P. Costimulatory regulation of T cell function. Current Opinion in Cell Biology. 11 (2), 203-210 (1999).
- Schwartz, R. H. A cell culture model for T lymphocyte clonal anergy. Science. 248 (4961), 1349-1356 (1990).
- Bajgain, P., Mucharla, R., et al. Optimizing the production of suspension cells using the G-Rex M series. Molecular Therapy - Methods and Clinical Development. 1, 14015(2014).
- Pampusch, M. S., Haran, K. P., et al. Rapid transduction and expansion of transduced T cells with maintenance of central memory populations. Molecular Therapy - Methods and Clinical Development. 16, 1-10 (2019).
- Taraseviciute, A., Tkachev, V., et al. Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discovery. 8 (6), 750-763 (2018).
- Berger, C., Sommermeyer, D., et al. Safety of targeting ROR1 in primates with chimeric antigen receptor-modified T cells. Cancer Immunology Research. 3 (2), 206-216 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved