Method Article
大規模核インターロームプロファイリングのためのラベルフリー免疫沈降質量分析ワークフロー
要約
記載されているプロテオミクスワークフローは、目的とするタンパク質の免疫親和性濃縮と標識フリー質量分析法を用いて核細胞内分画からタンパク質相互作用パートナーを同定するためのプロテオミクスワークフローである。このワークフローには、細胞内分画、免疫沈降、フィルター支援サンプル調製、オフラインクリーンアップ、質量分析、下流バイオインフォマティクスパイプラインが含まれます。
要約
免疫親和性精製質量分析法(IP-MS)は、タンパク質間相互作用を同定する堅牢な定量方法として浮上している。本書は、他の細胞内コンパートメントにも適用できる核からの低存在量タンパク質間相互作用を同定するために設計された完全な相互作用プロテオミクスワークフローを提示する。このワークフローには、細胞内分画、免疫沈降、サンプル調製、オフラインクリーンアップ、シングルショットラベルフリー質量分析、下流の計算およびデータ可視化が含まれます。当社のプロトコルは、内因性タンパク質の免疫沈降によって、全細胞のリザース(例えば、核内の転写因子相互作用)から識別することが困難なコンパートメント化された低存在量相互作用を検出するために最適化されています。分画された細胞下コンパートメント。ここで概説するサンプル調製パイプラインは、HeLa細胞核抽出物の調製、内因性ベイトタンパク質の免疫親和性精製、定量的質量分析に関する詳細な指示を提供する。また、質量分析ベースの相互作用プロファイリング実験で大規模な免疫沈降を行う方法論的考慮事項について議論し、真陽性タンパク質を区別するためのデータ品質を評価するためのガイドラインを提供する。非特異的相互作用からの相互作用。このアプローチは、CMGCキナーゼの核相互作用体を調べるため、核内の相互作用が不十分に定義された低存在量のタンパク質キナーゼであるDYRK1Aを調べる。
概要
ヒトプロテオームは、安定したマルチサブユニット複合体および一過性タンパク質間相互作用の形成を通じて、広大な構造的および生化学的多様性を示す。したがって、目的のタンパク質の相互作用パートナーの同定は、分子機構を解明するための調査において一般的に必要とされる。アフィニティー精製プロトコルの最近の進歩と高分解能高速走査質量分析装置の出現により、単一の偏りのない実験でタンパク質相互作用の風景を容易にマッピングできるようになっています。
タンパク質相互作用プロトコルは、一般に、アフィニティータグ付き融合構築物を有する異所性発現系を採用し、目的のタンパク質を認識する高品質の抗体を必要とせずにタンパク質相互作用を同定する。ただし、エピトープタグベースの方法にはいくつかの欠点があります。エピトープとの物理的相互作用は、非特異的コプリン化タンパク質3の検出につながる可能性がある。さらに、タンパク質のN−またはC末端へのこれらのエピトープタグの融合は、天然タンパク質間相互作用を遮断し、または非生理学的立体構造を促進するためにタンパク質の折り畳みを破壊し得る。さらに、エクトピック発現系は、典型的には、超生理学的濃度で餌タンパク質を過剰発現し、特に投与量感受性遺伝子5に対する関節実性タンパク質相互作用の同定をもたらし得る。これらの問題を回避するために、内因性餌タンパク質は、天然タンパク質を認識する高品質の抗体の入手可能性を仮定して、関連する相互作用獲物タンパク質と共に免疫沈降することができる。
ここでは、CMGCプロテインキナーゼDYRK1Aを例に用いて内因性タンパク質の核相互作用体を検出するための相互作用プロテオミクスワークフローを提供する。DYRK1Aコピー数、活性レベル、または発現の破壊は、ヒトにおいて重度の知的障害を引き起こす可能性があり、マウス6、7、8、9における胚致死性を引き起こす可能性がある。DYRK1Aは、動的時空間調節10、および区画化タンパク質相互作用11、12を示し、異なる細胞内コンパートメントに特異的な低存在性相互作用パートナーを検出することができるアプローチを必要とする。
このプロトコルは、ヒトHeLa細胞の細胞画分を細胞質および核視分画に用い、免疫沈降、質量分析のためのサンプル調製、およびデータ品質を評価し、結果を可視化するためのバイオインフォマティクスパイプラインの概要を、分析および可視化のために提供されるRスクリプトを用いる( 図1)。このワークフローで使用されるProteomicsソフトウェアパッケージは、すべて自由にダウンロード可能であるか、Webインターフェイスを介してアクセスすることができます。ソフトウェアと計算方法の詳細については、提供されているリンクの詳細なチュートリアルと指示を参照してください。
プロトコル
注:すべての緩衝組成物とプロテアーゼ混合物の概要を表1に示します。
1. 細胞の調製
注:この免疫沈降質量分析(IP-MS)アプローチには、反復当たり1-10mgの核分解物の出発原料が必要です。細胞量は、三重に三重のコントロールを加えた核免疫沈降の1mgのために与えられる。
- 付着細胞株を使用する場合は、収穫前に複製ごとに3 x 15cmの食器で細胞を90%のコンフルエンシーに成長させます。
注:餌および制御条件に対して、少なくとも3つの反復免疫沈降を行うことをお勧めします。このプロトコルは、セクション4から始まるビーズとの豊富な非特異的相互作用を制御する「ビーズのみ」コントロールの使用を前提としています。その他の種類のコントロールも役立ちます。これらについては、討論セクションで詳しい説明を行います。- リン酸緩衝生理食塩分(PBS)でプレート2xを洗浄し、15cmプレート当たり0.25%トリプシンの3mLを用いて細胞をトリプシン化する。1,200 x gで細胞を5分間スピンダウンし、トリプシンをデカントします。
- 懸濁細胞の場合、同様のスケール/密度に成長し、総タンパク質の70−80mgを達成する。
- 1,200 x gおよび 4 °C のペレットセルを 5 分間デカントし、メディアを慎重にデカントします。
注:ペレットは、セクション2で概説した大規模な細胞内分画を使用して効率的な処理を可能にするために、このステップ中に組み合わせることができます。
- 1,200 x gおよび 4 °C のペレットセルを 5 分間デカントし、メディアを慎重にデカントします。
- プロテアーゼ阻害剤(API)およびホスファターゼ阻害剤(PhI)を補充したPBS+5mM MgCl2で細胞ペレット2xを洗浄する(表1参照)。
注:細胞ペレットは、液体窒素中でフラッシュ凍結し、分画の準備ができるまで-80°Cで保存することができます。
2. 核抽出物の調製
注:プロテアーゼおよびホスファターゼ阻害剤は、使用の30分以内に分画バッファーに添加する必要があります。
- 凍結した場合は、冷間バッファーA+PHI/PHの1xペレット体積で15分間細胞ペレットを解凍する。解凍中のリサスペンションを助けるために、4°Cのヌータレータにセルペレットを置きます。それ以外の場合は、ステップ 1.3 から 1x ペレット ボリューム バッファー A + API /PH にセル ペレットを再中断します。
- 2,000 x gと 4 °C で 10 分間ペレットはバッファーをデカントします。
- バッファー A でパックされたセルボリュームを 5 倍にしてセルを中断し、氷上で 20 分間インキュベートします。
- 2,000 x gと 4 °Cのペレットは、バッファーをデカントし、2x 元のパックセルボリュームバッファー A + ピス / PH とダンピング ~7x を "A"/緩い害虫で再サスペンドします。
- 2,000 x gおよび 4 °C で 10 分間のリサートを遠心分離します。
- 慎重に上清をオフピペットし、液体窒素で凍結フラッシュ。lysateを-80°Cで保管してください。この工程からの上清は、細胞細胞下細胞画分である。
注:核ペレットは、液体窒素でフラッシュ凍結し、-80°Cで保存することにより、このステップ中に保存することができます - バッファーB +ピス/PHIの0.9xペレットボリュームでペレットを再サスペンドし、4°Cで5分間ヌータで混合します。
- 核を溶解するには、よりタイトな害虫「B」で20倍にダウンス。
- 核リサートをヌータで4°Cで30分間混ぜ、均質になるようにします。
- 核のリサートを4°Cで21,000 x gで30分間遠心分離する。上清をピペットオフし、可溶性核タンパク質抽出物として保存します。
注:得られた核ペレットのヌクレアーゼ処理は、クロマチン関連タンパク質画分の回収を可能にする。 - 4°Cで3時間、緩衝液C+APIに対して可溶性核抽出物を透析する。
- 8 kDa分子量をカットして、24 mm幅透析チューブの適切な長さをカットします。チューブの片側をクランプし、管に核視をロードします。lysateをロードした後、もう一方の端をクランプし、バッファC +APIを含むきれいなガラス容器に水没します。
- 透析済み核抽出物/核小核形成を4°Cで21,000 x gで30分間遠心分離し、ウェスタンブロットによる分画検証のためのアリクォート3x20μL量の核抽出物を分離する。IP-MS分析に使用される核抽出物は、液体窒素中で引用してフラッシュ凍結し、必要に応じて-80°Cで保存することができます。
3. 細胞内分画の検証
- タンパク質アッセイを完了し、核リサートのタンパク質濃度を決定します。ビシンコニン酸タンパク質アッセイは、下流の適用に十分な感度を提供します。
- 前述の13に記載されたウェスタンブロット分析のためのSDS-PAGEゲル上の細胞細胞と核画分の両方の20μgをロードする。サンプルの特性の誤りを避けるために、読み込み時にレーンをスキップします。
- 核マーカーとしてp84(THOC1)のウェスタンブロットをプローブし、細胞質マーカーとしてGAPDHをプローブします。核分率の細胞質マーカーの比率によって分画の程度を決定し、その逆も同様である。
注:他の核マーカーおよび細胞質マーカーに対する抗体が使用され得る。
4. 内因性核餌タンパク質の免疫沈降
注:この時点から低保存チューブを使用することをお勧めします。これにより、サンプル処理中のチューブへの非特異的結合が減少し、サンプルの不必要な損失を回避できます。さらに、LCMS グレード H2O を使用して、残りのステップのバッファーを準備することを確認します。
- マイクロ遠心管にタンパク質Aとタンパク質-Gの両方のビードボリュームを12.5μL組み合わせることで、複製ごとにタンパク質A/Gビーズ混合物を調製します。ビーズストックを20%エタノールを含むスラリーとして保管してください。スラリー%(v/v)内のビーズの濃度を決定し、ビーズが先端に入ることができることを確認するために先端にカットされたピペット先端を使用して必要なボリュームをピペット。
- 300 μLのIPバッファ1でタンパク質A/Gビーズ混合物2xを洗浄します。ビーズを1,500 x gで4°Cで1分間回転させ、デカント緩衝液を回します。
- 抗体タンパク質A/Gビーズを調製する:抗体をビーズに結合するには、目的の抗体のIPバッファ1と10μgの300μLを添加する。ビーズ/抗体混合物を一晩で4°Cでヌータで揺らします。ビーズのみのコントロールの場合は、抗体を追加しないでください。
注:複製あたり合計10μgの抗体を出発点として使用できますが、実験で使用される個々の抗体とリサートのスケールごとに正確な量を最適化する必要があります。 - 水浴中のステップ2.10から核のリゼス化を解凍し、複製当たり1mgのタンパク質入力のための低保存マイクロ遠心管に適切な量をアリコートする。
- 16,000 x gで30分間リサートを回転させ、新しいチューブに上清を移します。
- 1mgの核リサート1mgにつき1μLのベンゾナーゼ(250単位/μL)を加え、4°Cのヌータで10−15分間ロックします。
- ライサートをプリクリアするためのビーズを準備します。ステップ4.1のように、各タンパク質Aとタンパク質Gビーズの12.5μLを1.5 mL低保持チューブに加えます。IPウォッシュバッファ1 +ピスで2xを洗浄し、バッファをデカントします。
- ステップ4.5からビーズに核リジン酸塩を1mg加えます。4°Cで1時間ヌータで揺らしながらインキュベートする。
- 遠心分離機は1,500 x gでリゼを予めクリアし、1分間4°Cとした。
- 核核解毒剤は、ステップ4.5.1でビーズでインキュベートしている間、抗体タンパク質A/Gビーズ2xをIPバッファ1 +APIで洗浄します。1,500 x gおよび4 °Cで1分間遠心分離し、緩衝液をデカントする。
- ステップ4.6.1からプレクリアされた核リサートを抗体タンパク質A/Gビーズに移す。1,500 x gでインキュベーションした後、4時間の遠心分離機でヌーテーターを揺らしながらインキュベートし、1分間は4°Cでインキュベーションします。
- 各反復の流れとしてラベル付けされたチューブに上清を転送します。
- IPバッファ2 +ピスの1 mLで抗体タンパク質A/Gビーズを洗浄します。1,500 x gおよび4 °Cで1分間の遠心分離、デカント緩衝液、および合計3倍に繰り返す。
- 前の手順と同様に、1 mL の IP バッファ 1+ PI 遠心分離でビーズ 2x を洗浄します。最後の洗浄後にすべてのバッファーが取り外されていることを確認します。
- 0.1 Mグリシン(pH 2.75)の20°Lで溶出2xをそれぞれ30分間行います。溶出バッファーを使用してインキュベーション中にチューブが揺れていることを確認します。750 x gと 4 °C で 1 分間スピンし、各 30 分間のインキュベーション後に上清をピペットオフします。
注:ここで説明する低pHグリシン法は、ほとんどの餌タンパク質を溶出しますが、一部の抗体抗原相互作用は、より厳格な緩衝条件を必要とします。 - フラッシュ凍結は液体窒素中で溶出し、-80°Cで保存する。
5. サンプル調製
注:免疫沈降溶出サンプルにスパイクされたインスリンは、トリクロロ酢酸(TCA)沈殿およびサンプル処理中のタンパク質の回収に役立ち、これは低い豊富な内因性ベイトタンパク質にとって重要です。
- 凍った場合は室温で溶出を解凍する。
- サンプルを氷の上に置き、溶出物100μLごとに10μLの10mg/mLインスリンを加えます。ボルテックスを加え、直ちに1%デオキシコール酸ナトリウムの10μLを加えます。サンプルを再びボルテックスし、20%TCAの30 μLを加え、その後に1つの最終渦を加えます。
- 氷上のサンプルを20分間インキュベートし、4°Cで21,000 x gで30分間遠心分離します。
- 上清を吸引し、-20°Cにプレチルされたアセトンを0.5mL加えます。ボルテックスを21,000 x g、4 °Cで30分間回転させます。
- 上清を吸引し、チューブの底に残っているペレットを乾燥させます。
- 14の下に概説されているように、サンプル処理を減らすための最適化された、修正されたフィルターエイドサンプル準備 (FASP) メソッドを使用して質量分析用のサンプルを準備します。
- SDS アルキル化バッファーの 30 μL を使用して、ステップ 5.1.4 からタンパク質ペレットを再中断します (表 1を参照)。95°Cのヒートブロックでサンプルを5分間インキュベートします。次のステップに進む前に、室温で15分間冷やします。
- 各サンプルに300μLのUA溶液と30 μLの100 mM TCEPを加えます。この溶液を30k遠心フィルターにロードします。遠心フィルターを室温で21,000 x gで10分間回転させます。
注:餌タンパク質とその可%)は、この時点でフィルタに結合する必要があります。ただし、フィルタに問題がある場合には、流れが保たれておく場合があります。 - UAの250 μLでフィルターを洗浄し、21,000 x gで10分間流れをデカントし、合計3倍繰り返します。
- 100 mM Tris pH 8.5の100 μLでフィルターを洗浄し、21,000 x gで10分間遠心分離機を流し、流れをデカントし、合計3倍に繰り返します。
- 0.1 M Tris pH 8.5に3μL/1μL Lys Cを再懸濁して加えます。フィルターを100μLのマークまで充填し、ヌータで揺らしながら37°Cで1時間消化できるようにします。
- 1 μL 1 μg/ μL MS グレードトリプシンを加えます。穏やかに混合し、トリプシンがヌータを揺らしながら37°Cで一晩サンプルとインキュベートすることができます。
- 21,000 x gで20分間遠心分離し、フィルターからペプチドを溶出する。
メモ:すべての溶出物を回復するために、遠心分離の複数のラウンドが必要な場合があります。これを行わない場合は、サンプル損失が深刻な可能性があります。
- C18スピンカラムを用いてペプチドを脱塩する。製造元から提供されているプロトコルに従います。
- 凍結乾燥ペプチドを0.1%TFAの7μLで5%アセトニトリルに再スレド。サンプルを3分間超音波処理し、ペプチドが再懸濁されたことを確認します。14,000 x gで 10 分間スピンダウンします。
- 再懸濁ペプチドを適切なサンプルバイアルに移し、液体クロマトグラフィー-質量分析(LC/MS)システムにローディングします。
6. LC/MSシステム適合性
注:小さなスケールで、一般的にアフィニティー精製サンプルからのタンパク質の量が少ないため、LC/MSプラットフォームが最大限の感度と堅牢性で動作することが重要です。
- LC/MSグレードのギ酸1mLを移動相A用LC/MSグレード水の1Lに加え、LC/MSグレードのギ酸1mLを移動相B用のLC/MSグレードアセトニトリルの1Lに加えます。
- <2 μm の逆相 C18 樹脂を詰めた 75 μm の融合シリカキャピラリーカラムを準備または取り付けます。最良の結果は、カラムへのサンプルの直接注入で得られます。
- 新鮮なモバイルフェーズで超高性能液体クロマトグラフィー(UPLC)システムをパージします。C18カラムを取り付けた状態で、適切なエミッタを使用して安定した流量とエレクトロスプレーを確立します(つまり、20μm id x 360 μm odを10μmの先端に引っ張ります)。カラムを40−60°Cに維持します。
- HeLa全体の溶解トリプティックダイジェストの100-200ngのような複雑な品質管理基準を注入して、LC/MSシステム全体のパフォーマンスをテストします。複雑なサンプルに適した勾配(2~3時間の勾配溶出時間)で溶出します。ペプチドおよびタンパク質同定のベースラインシステム性能を確立する。
注:最良の結果を得るには、20,000-35,000個のユニークなペプチドから3,000−5,000以上のタンパク質同定が実験サンプルに最適な性能を提供します。 - 定期的なLC/MSシステム適合性のために、牛血清アルブミン(BSA)のような単一のタンパク質消化標準の100−200 fmol以下を注入する。短いグラデーション(20−30分)で溶出します。
注:タンパク質ダイジェストの複数の注入は、ベースラインLC/MSシステム性能の確立に役立ち、各IP-MSサンプルの後に注入を繰り返し、実験全体を通してシステム性能の尺度を提供し、標識のない実験に偏りを持つ機器ドリフトの検出を可能にします。選択した個々のピーク強度とピークシェイプのベースラインは、MS、LC、およびカラムのパフォーマンスに関する情報を提供します。 - 分析カラムの過負荷を避けるため、実験用サンプルの小さな部分(全体の15~30%)をカラムにロードし、複雑なサンプルに適した勾配(2~3時間)を使用して分離します。タンパク質同定の数が不十分な場合は、すべてのサンプルをカラムにロードします。
- サンプル間で単一のタンパク質ダイジェスト標準を実行して、LC/MSシステムのパフォーマンスとサンプルキャリーオーバーを監視します。サンプルによっては、サンプルの持ち越しを減らすために複数の規格が必要になる場合があります。
7. データ処理
- https://www.maxquant.org/にあるプロテオミクスソフトウェアパッケージMaxQuantをダウンロードします。
注: これは、ステップ 6.6 の RAW MS データ ファイルを、下流分析用の識別に関連付けられたタンパク質 ID、遺伝子名、および定量値のデータ テーブルに処理するために使用されます。- [生データ] タブの [入力データ]サブヘッダーで[読み込み]を選択します。
- [グループ固有]タブをクリックし、[ダイジェスト]を選択します。酵素リスト内でLysCを選択し、右矢印をクリックして、検索で使用されるリストにこの酵素を追加します。次に、[計測器]を選択し、画面上部のドロップダウンリストに正しいインストゥルメントタイプが表示されていることを確認します。その他のグループ固有の検索パラメータは、標準設定のままにしておきます。
- [グローバルパラメータ]タブをクリックし、[シーケンス]を選択します。この検索で使用する分類に適した FASTA ファイルを追加します。これを行わない場合、ペプチドは正しく割り当てられません。人間のプロテオームについては、uniProt からHTTPS://WWW.UNIPROT.ORG/HELP/HUMAN_PROTEOMEの FASTA ファイルをダウンロードします。
- [グローバル パラメータ]タブで、[タンパク質の定量]をクリックします。[定量化のペプチド]ドロップダウン メニューで、[一意 + Razor]を選択します。
注:MaxQuantは、強度ベースの絶対定量(iBAQ)とラベルフリー定量(LFQ)を通じてタンパク質の代替定量を提供します。しかしながら、ペプチド数情報は、このプロトコル15における下流分析に十分である。 - MaxQuant インターフェイスの左下で、検索に使用するプロセッサの数を選択します。これは実行に必要な時間の長さに直接影響するため、できるだけ多く選択します)画面の左下にある [開始]をクリックして、実行を開始します。画面上部の [パフォーマンス]タブを選択して、検索の進行状況を表示します。
- 実行が完了したら、Perseus、プロテオミクス計算プラットフォーム、またはその他のスプレッドシート プログラムで proteingroups.txt ファイルを開き、データ16を表示します。
- ペルセウスを使用して、一般的な汚染物質を除去し、逆タンパク質配列にヒットします。http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactionsの詳細なペルセウスのドキュメントに従ってください。
注:分析ソフトウェア(例えば、Excel)でproteingroups.txtファイルを開くと、特定の遺伝子名とタンパク質名が自動的に破損します。
- ペルセウスを使用して、一般的な汚染物質を除去し、逆タンパク質配列にヒットします。http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactionsの詳細なペルセウスのドキュメントに従ってください。
- アフィニティ精製 (CRAPome) のコンタミナント リポジトリを使用して実験データを分析します。このリポジトリhttp://crapome.org/にアカウントを登録し、必要に応じてチュートリアルに従ってください17,18.
- CRAPome ホームページにあるデータ分析ワークフローを使用します。この相互作用実験で使用されるアフィニティー精製システムに対応する外部コントロールを選択します。
注: これらのコントロールを使用して、一般的な汚染物質の検出に役立つ 2 番目の折り替えエンリッチメントを計算できます。 - Perseus または適切なスプレッドシート アプリケーションを使用して、MaxQuant から出力された proteingroups.txt から入力ファイルを生成します。手動書式設定の詳細については、http://crapome.org/?q=fileformattingを参照してください。または、提供されている R スクリプト "export_CRAPomeSAINT_Input_File.R" を使用して、SAINT/CRAPome 入力ファイルを生成します。「補足コーディング ファイル」の README.txt を参照してください。
- 分析を実行して、免疫沈降における各ベイトタンパク質の折り畳み性濃縮およびSAINT(INTERactomeの有意性分析)確率を決定します。[FC-A] のドロップダウン メニューで[ユーザー コントロール]が選択され、[FC-B] ドロップダウンで[CRAPome コントロール]または[すべてのコントロール]が選択され、確率スコアが選択され、SAINT 確率が生成されます。 実行が完了したら、[分析結果]で使用可能な出力とジョブ ID を表示します。将来のプロットとデータの視覚化のために「分析結果」からデータマトリックスをダウンロードします。
- CRAPome ホームページにあるデータ分析ワークフローを使用します。この相互作用実験で使用されるアフィニティー精製システムに対応する外部コントロールを選択します。
- 補足コーディングファイルで提供されるRスクリプトに従って、FC-A(IP対ユーザコントロール)とSAINT確率の関数としてタンパク質をプロットします。
注:調整されたp値の範囲で着色されたFC-A対SAINT確率およびiBAQ対ログ2(タンパク質の存在量)のプロットを生成するためのRスクリプトのセットは、ラベルフリー強度の経験的ベイズ分析から着色されます。差動統計解析とプロットの詳細はREADME.txtとRスクリプト「main_differential_analysisにあります。補足コーディング ファイルの R" を参照してください。 - ベイトタンパク質の既知の相互作用タンパク質がFC-AおよびSAINTによってランク付けされている場所を評価します。FC-A > 3.00 と SAINT > 0.7 のカットオフを行い、三重の餌実験を出発点として行います。
注:「高信頼」インターアクターと「低信頼」インターアクターのカットオフの選択は、生物学的情報によって通知される必要があります。
8. データ可視化
注:プロテオミクスデータを効果的に視覚化できるプログラムはたくさんあります(例:R、ペルセウス、サイトスケープ、STRING-DB)。信頼度の高いヒット間の接続性を分析し、これらのインターアクターの機能的なエンリッチメントは、ヒットに優先順位を付け、さらに検証と機能特性評価を行うための便利な戦略となります。
- https://cytoscape.org/download.html19のオープンソースネットワーク可視化ツール「Cytoscape」をダウンロードします。
- ベイト (ソース ノード)、獲物 (ターゲット ノード)、相互作用の種類 (エッジ タイプ) の 3 つの列で書式設定されたタブ区切りファイルとして、対話データの入力ファイルを準備します。これは、ペルセウス座または任意の任意のスプレッドシート プログラムで行うことができます。
- プログラムの左上にある[ファイルからテーブルをインポート]アイコンを選択します(下向き矢印とアイコンのマトリックスで指定)。Cytoscape は、カスタムの書式設定とデザインの準備が整ったネットワークに対話データを自動的に入力します。
- [Cytoscape] のコントロール パネルの[スタイル]タブを選択し、[Def]列の四角形をクリックして、ネットワーク全体の属性を調整します。ネットワーク内の特定のノードまたはエッジを選択し、スタイル メニューのByp.列内の正方形を選択して、既定の設定をバイパスし、選択したオブジェクトのみを調整します。または、スタイルメニューの上部にあるドロップダウンメニューをクリックして、プリセットネットワークフォーマットを表示します。
注:STRING-dbタンパク質間相互作用データは、この時点でこのネットワークに統合され得るが、この時点で、入力ファイルを介して手動で、またはCytoscapeのプラグインとして利用可能な様々なエンリッチメントツールを介して、20http://apps.cytoscape.org/。エンリッチメント分析に推奨されるサイトスケーププラグインは、http://apps.cytoscape.org/apps/cluego21にあります。 - このワークフローで生成されるデータセットの信頼性を高めるために、対象の獲物タンパク質を餌としてターゲットとする相互 IP-MS または IP-western 実験を実行します。
結果
IP-MS実験で同定されたタンパク質量の大部分は、非特異的タンパク質から構成されています。したがって、IP-MS実験の重要な課題の1つは、どのタンパク質が高信頼インターアクター対非特異的インターアクターであるかの解釈です。データ品質の評価に使用される重要なパラメータを実証するために、研究はビーズのみの制御を利用してHeLa核抽出物の5mgからの三重免疫沈降を分析しました。IP-MS実験が確実に信頼できることを確認する最初の内部チェックは、ベイトタンパク質が、制御のフォールドチェンジとSAINT確率の両方によって同定される最も高い濃縮タンパク質の1つとしてランク付けされるかどうかです。この場合、餌DYRK1Aは、対照上の上位3つの濃縮タンパク質の中でランク付けされた(図2A、B)。4つの独立した抗体を利用したDYRK1Aの核相互作用研究では、FC-Aカットオフ>3.00とSAINT確率カットオフ>0.7は、新規および以前に検証されたインターアクター22の両方を同定するための厳格なカットオフを提供した。この実験に適用すると、高信頼インターアクターと>95%の非特異的として同定されたコプログラタンパク質との間に明確な分離が見られた(図2A、B)。折り変えの濃縮と確率しきい値の両方を適用すると、生物学的複製間で一貫して高いタンパク質 ID の濃縮が必要になるため、ストリンジェンシーが増加します。
統計的スコアリングに加えて、CRAPome解析ワークフローは、以前に報告された相互作用をベイト獲物データ23にマップします。このマッピングは、高信頼度と低信頼度の相互作用をしきい値付けする場合に役立ちますが、以前に報告された相互作用はFC-AとSAINT確率によってスコアが低く、特定の細胞タイプ、コンテキスト、またはオルガネラにのみ存在する可能性があることを示す可能性があります。DYRK1A データセットの例では、iREF インターアクティバ FC-A 値は 0.45 と低く、制御に対する非常に低いエンリッチメント (図 2C)を表します。誤検知のインフレを避けるために、統計的閾値は、偽陰性の減少よりもストリンジェンシーを優先する方法で実行されるべきである。なお、これらの相互作用の検出はタンパク質の存在量(図2C)とは無関係であった。HeLa細胞内の各iREF相互作用の計算された絶対コピー数は、IP-MS24による相互作用パートナーの検出レベルとの相関を示さなかった。
Cytoscapeは、相互作用データ19の複数の層を可視化するための効果的なツールとして機能する。ここで説明するDYRK1A免疫沈降実験では、FC-A>3.0とSAINT>0.9を併用して、高信頼インターアクターのリストを6つのタンパク質に還元した(図2D)。ただし、3.0 の FC-A カットオフを単独で適用すると、8 個のタンパク質がネットワークに追加されました。これらの追加のタンパク質インターアクターは、すでにネットワーク内のインターアクターとの接続性が高く、類似した複合体または機能的役割に関連していることを示唆しています。この用に、タンパク質間相互作用のSTRING-DBからの証拠は、青い破線20としてこのネットワークに統合された。このシングルベイト、三重実験は、完全なDYRK1A相互作用ネットワークの限られたサンプルを提供しますが、追加の餌の使用、複製、および大規模なパブリックデータセットの統合を使用して、高信頼インタラクションのネットワークを拡張することができます。したがって、統計的カットオフは個々の実験に固有であり、徹底的に評価する必要があります。
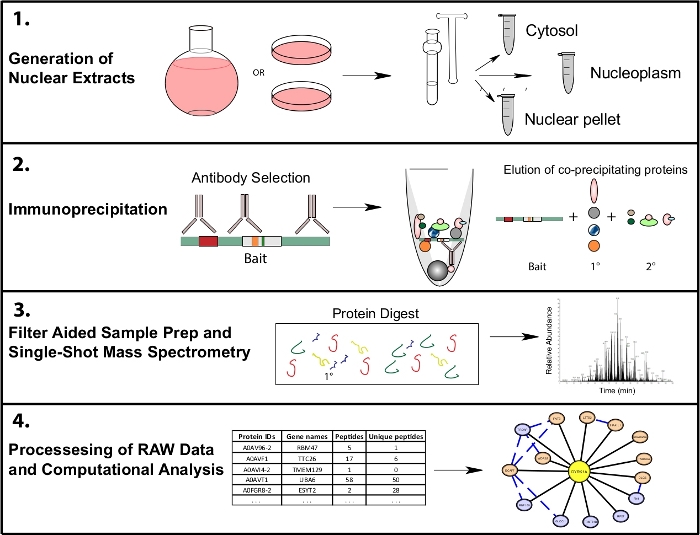
図1:細胞内IP-MSの代表的なプロテオミクスワークフロー細胞は、4 L丸底フラスコまたは15cmの組織培養皿のいずれかで成長し、細胞内分画のために同時に収穫される。細胞は細胞質、核、核ペレットに分画され、免疫沈降は同じ餌を認識する1つまたは複数の抗体を使用して1〜10mgの核リサートから行われます。フィルター支援サンプル準備(FASP)とオフラインサンプルクリーンアップは、シングルショット質量分析の前に実行されます。ダウンストリームの計算パイプラインは、データを解釈可能な相互作用データに処理するために使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
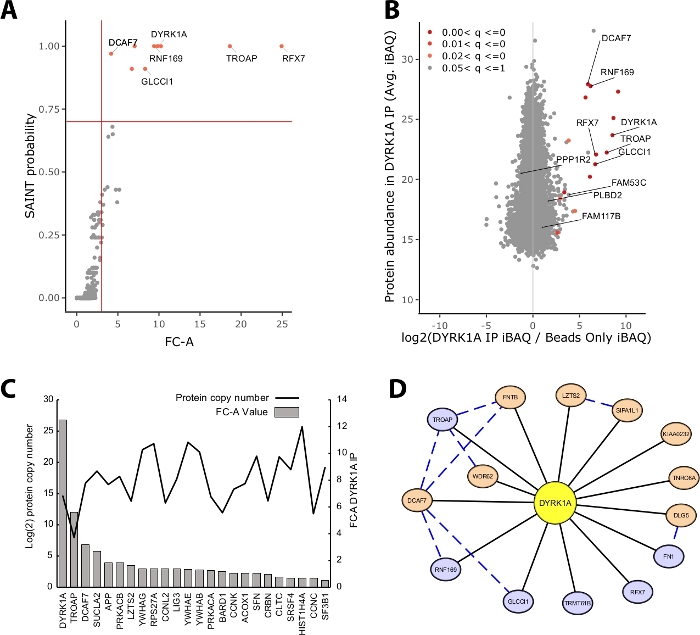
図2:シングルベイト単抗体IP-MS実験の代表データ。(A)球体分析ワークフローからのFC-AおよびSAINT確率出力は、キナーゼDYRK1Aに対する単一抗体を用いた最適な実験を行う(n=3)。比較にはビーズのみのコントロールが使用されました。赤い実線は、FC-A > 3.00 および SAINT > 0.7 に設定されたカットオフを表します。(B)MaxQuantタンパク質の存在量推定(iBAQ)出力対DYRK1A IPにおけるタンパク質の存在率を制御し、ラベルフリー強度の経験的ベイズ分析から調整されたp値の範囲で着色する。(C)FC-AおよびiRefデータベース23、24内の相互作用タンパク質としてリストされるタンパク質の推定コピー数。(D) DYRK1Aインターアクターのサイトスケープネットワーク可視化青色のノード = FC-A > 3.00、セイント > 0.7。オレンジ色のノード = FC-A > 3.00黒いエッジ=IPMS実験でインターアクターとして同定されたタンパク質。青い破線エッジ = 獲物タンパク質間の SAINT 相互作用 (信頼度 > .150)。この図の大きなバージョンを表示するには、ここをクリックしてください。
| プロテアーゼ阻害剤(PI)混合物 | |
| 試薬 | 最終濃度 |
| メタビスルファイトナトリウム | 1 mM |
| ベンザミジン | 1 mM |
| ジチオスレイトール (DTT) | 1 mM |
| フッ化フェニルメタンスルホニル(PMSF) | 0.25 mM |
| ホスファターゼ阻害剤(PhI)混合物 | |
| 試薬 | 最終濃度 |
| ミクロシスチンLR | 1 μM |
| オルソバナ酸ナトリウム | 0.1 mM |
| フッ化ナトリウム | 5 mM |
| 細胞内分画バッファー: | |
| バッファA pH 7.9 | |
| 試薬 | 最終濃度 |
| Hepes | 10 mM |
| MgCl2 | 1.5 mM |
| Kcl | 10 mM |
| バッファB pH 7.9 | |
| 試薬 | 最終濃度 |
| Hepes | 20 mM |
| MgCl2 | 1.5 mM |
| 塩化 ナトリウム | 420 mM |
| エチレンジアミンテトラ酢酸(EDTA) | 0.4 mM |
| グリセロール | 25% (v/v) |
| バッファー C pH 7.9 | |
| 試薬 | 最終濃度 |
| Hepes | 20 mM |
| MgCl2 | 2 mM |
| Kcl | 100 mM |
| エチレンジアミンテトラ酢酸(EDTA) | 0.4 mM |
| グリセロール | 20% (v/v) |
| 免疫沈降バッファー: | |
| IP バッファ 1 | |
| 試薬 | 最終濃度 |
| Hepes | 20 mM |
| Kcl | 150 mM |
| Edta | 0.1 mM |
| NP-40 | 0.1% (v/v) |
| グリセロール | 10% (v/v) |
| IP バッファ 2 | |
| 試薬 | 最終濃度 |
| Hepes | 20 mM |
| Kcl | 500 mM |
| Edta | 0.1 mM |
| NP-40 | 0.1% (v/v) |
| グリセロール | 10% (v/v) |
| SDS アルキル化バッファー pH 8.5 | |
| 試薬 | 最終濃度 |
| Sds | 4% (v/v) |
| クロロアセトアミド | 40 mM |
| TCEP | 10 mM |
| トリス | 100 mM |
| UA pH 8.5 | |
| 試薬 | 最終濃度 |
| 尿素 | 8 M |
| トリス | 0.1メートル |
| *HPLCグレードH2Oを使用 | |
表 1: バッファー構成
補足的なコーディング ファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで概説するプロテオミクスワークフローは、目的のタンパク質に対する高信頼タンパク質インターアクターを同定するための効果的な方法を提供します。このアプローチは、細胞内分数を通じてサンプルの複雑さを軽減し、堅牢なサンプル調製、オフラインサンプルのクリーンアップ、LC-MSシステムの厳格な品質管理を通じて、識別相互作用パートナーを増やすことに焦点を当てています。ここで説明する下流データ分析は、餌と共に凝固として同定されたタンパク質の簡単な統計的評価を可能にする。しかし、実験変数の数が多いため(スケール、細胞株、抗体の選択)、各実験では、データの可視化と濃縮に関する異なるカットオフと考慮事項が必要です。
IP-MS実験における最初の設計上の考慮事項は、相互作用するパートナーと共に目的のタンパク質の凝化に使用される抗体の選択である。市販の抗体の入手可能性は、過去数十年にわたってヒトプロテオームのより大きな部分をカバーするように拡大しましたが、試薬が制限されているタンパク質はまだ多くあります。さらに、ウェスタンブロット検出などの用途について検証された抗体は、免疫沈降実験において標的タンパク質の選択的濃縮が不可能な場合がある。大規模な相互作用プロテオミクス実験を行う前に、90%コンフルエント10cm皿、または同等の細胞数からIPを完了し、ウェスタンブロッティングによって目的の標的タンパク質をプローブすることが示唆される。免疫沈降のために複数の抗体が利用可能な場合は、さらに、タンパク質の異なる部分内のエピトープを認識する複数の抗体を選択することが示唆される。ベイトタンパク質への抗体の結合は、推定相互作用パートナーに必要な結合界面を閉塞させることができる。ベイトタンパク質の二次エピトープを選択すると、質量分析ベースの実験によって同定された相互作用プロファイルのカバレッジが増加します。
第二の主要な考慮事項は、高信頼度の相互作用と低信頼または非特異的相互作用を区別するための適切な制御の選択と、餌と共に凝固していると識別されるものとの間にある。IP-MS実験のための最も厳しい制御は、餌のCRISPR KO細胞株からの免疫沈降を完了することです。このような制御は、餌タンパク質ではなく抗体に直接結合する非特異的タンパク質の同定と除外を可能にする。各ベイトタンパク質のCRISPR KO細胞株を生成することが不可能な場合には、餌抗体の同一アイソタイプのIgGビーズコントロールを使用することができます。複数の種を表す抗体のパネルを用いた実験では、ビーズのみのコントロールの使用は適切ですが、高信頼インターアクターとして同定された偽陽性の速度を増加させます。
IP-MS実験で使用される細胞株の選択は、いくつかの重要な要因に依存する。タンパク質発現および局在化は、細胞の種類に大きく依存する。RNA発現の推定値は、多くの一般的に使用される細胞株のほとんどの遺伝子に対して見つけることができるが、タンパク質発現はRNA発現との相関が悪く、実験的に25を決定しなければならない。ベイトタンパク質が非常に低いコピー数で発現する細胞株は、必要とされる可能性のある細胞培養スケールの急激な増加に関連する問題を回避すべきである。ただし、サンプル調製は、非常に低い存在量タンパク質の検出に最適化できることに留意すべきである。フィルターエイドサンプル準備(FASP)法は、堅牢でありながら、試料中のペプチドの50%以上の損失を引き起こす可能性がある。シングルポット固相増強サンプル調製(SP3)は、サンプル損失26を最小限に抑える質量分析用サンプルを生成する効率的な方法です。サンプル調製のSP3法によって可能になる回復の増加は、検出限界に近いタンパク質を定量するためのこのワークフローで有用な代替手段であり得る。
このプロテオミクスワークフローは、キナーゼ、E3ユビキチンリガーゼ、マルチサブユニット複合体の足場メンバーを含む多くの核餌に適用されています。抗体試薬の適切な検証を前提として、このワークフローを正常に実行すると、目的のタンパク質に対する高信頼タンパク質核相互作用パートナーの検出が得られます。
開示事項
著者たちは何も開示する必要はない。
謝辞
この作品は、リンダ・クニック・インスティテュート・オブ・ダウン症候群のW.M.O.に対するグランドチャレンジ補助金と、DARPA協力協定13-34-RTA-FP-007によって支援されました。ジェシー・カーランドとキラ・コッツォリーノの原稿の読み取りとコメントに貢献してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA | Thermo Fisher Scientific | 25200056 | |
| 1.5 ml low-rention microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| 4-20% Mini PROTEAN TGX Precast Protein Gels | Bio-Rad | 4561096 | |
| acetone (HPLC) | Thermo Fisher Scientific | A949SK-4 | |
| Amicon Ultra 0.5 ml 30k filter column | Millipore Sigma | UFC503096 | |
| Benzamidine | Sigma-Aldrich | 12072 | |
| benzonase | Sigma-Aldrich | E1014 | |
| Chloroacetamide | Sigma-Aldrich | C0267 | |
| Dialysis tubing closure | Caroline Biological Supply Company | 684239 | |
| DTT | Sigma-Aldrich | 10197777001 | |
| EDTA | Sigma-Aldrich | EDS | |
| GAPDH antibody | Santa Cruz Biotechnology | Sc-47724 | |
| Glycerol | Fisher Scientific | 887845 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HeLa QC tryptic digest | Pierce | 88329 | |
| HEPES | Fisher Scientific | AAJ1692630 | |
| insulin | Thermo Fisher Scientific | 12585014 | |
| iodoacetamide | Sigma-Aldrich | I1149 | |
| KONTES Dounce homogenizer 7 ml | VWR | KT885300-0007 | |
| Large Clearance pestle 7ml | VWR | KT885301-0007 | |
| Lysyl endopeptidase C | VWR | 125-05061 | |
| Magnesium Chloride | Sigma-Aldrich | 208337 | |
| Microcystin | enzo life sciences | ALX-350-012-C100 | |
| Nonidet P 40 Substitute solution | Sigma-Aldrich | 98379 | |
| p84 antibody | GeneTex | GTX70220 | |
| Phosphate Buffered Saline | |||
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23227 | |
| Pierce BSA Protein Digest, MS grade | Thermo Fisher Scientific | 88341 | LCMS QC |
| Pierce C18 spin columns | Thermo Fisher Scientific | PI-89873 | |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher Scientific | 90057 | For mass spectrometry sample prep |
| PMSF | Sigma-Aldrich | P7626 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Protein A Sepharose CL-4B | GE Healthcare Bio-Sciences | 17-0780-01 | |
| Protein G Sepharose 4 Fast Flow | GE Healthcare Bio-Sciences | 17-0618-01 | |
| SDS | Sigma-Aldrich | L3771 | |
| Silica emitter tip | Pico TIP | FS360-20-10 | |
| Small Clearance pestle 7ml | VWR | KT885302-0007 | |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium Fluoride | Sigma-Aldrich | 201154 | |
| Sodium metabisulfite | Sigma-Aldrich | 31448 | |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | |
| Spectra/ Por 8 kDa 24 mm dialysis tubing | Thomas Scientific | 3787K17 | |
| TC Dish 150, Standard | Sarstedt | 83.3903 | Tissue culture dish for adherent cells |
| TCA | Sigma-Aldrich | T9159 | |
| TCEP | Thermo Scientific | PG82080 | |
| TFA | Thermo Fisher Scientific | 28904 | |
| Thermo Scientific Orbitrap Fusion MS | Thermo Fisher Scientific | ||
| Trizma Base | Sigma-Aldrich | T6066 | |
| Urea | Thermo Fisher Scientific | 29700 | |
| Waters ACQUITY M-Class UPLC | Waters | ||
| Waters ACQUITY UPLC M-Class Column Reversed-Phase 1.7µm Spherical Hybrid (1.7 µm, 75 µm x 250 mm) | Waters | 186007484 | nanoflow C18 column |
参考文献
- Varjosalo, M., et al. The protein interaction landscape of the human CMGC kinase group. Cell Reports. 3, 1306-1320 (2013).
- Kimple, M. E., Brill, A. L., Pasker, R. L. Overview of Affinity Tags for Protein Purification. Current Protocols in Protein Science. 73, (2013).
- Mahmood, N., Xie, J. An endogenous 'nonspecific' protein detected by a His-tag antibody is human transcription regulator YY1. Data in Brief. 2, 52 (2015).
- Zordan, R. E., Beliveau, B. J., Trow, J. A., Craig, N. L., Cormack, B. P. Avoiding the ends: internal epitope tagging of proteins using transposon Tn7. Genetics. 200, 47-59 (2015).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10, 715-721 (2013).
- Bronicki, L. M., et al. Ten new cases further delineate the syndromic intellectual disability phenotype caused by mutations in DYRK1A. European Journal of Human Genetics. 23, 1482-1487 (2015).
- Antonarakis, S. E. Down syndrome and the complexity of genome dosage imbalance. Nature Reviews Genetics. , (2016).
- Dowjat, W. K., et al. Trisomy-driven overexpression of DYRK1A kinase in the brain of subjects with Down syndrome. Neuroscience Letters. 413, 77-81 (2007).
- Fotaki, V., et al. Dyrk1A haploinsufficiency affects viability and causes developmental delay and abnormal brain morphology in mice. Molecular and Cellular Biology. 22, 6636-6647 (2002).
- Hämmerle, B., Elizalde, C., Tejedor, F. J. The spatio-temporal and subcellular expression of the candidate Down syndrome gene Mnb/Dyrk1A in the developing mouse brain suggests distinct sequential roles in neuronal development. European Journal of Neuroscience. 27, 1061-1074 (2008).
- Funakoshi, E., et al. Overexpression of the human MNB/DYRK1A gene induces formation of multinucleate cells through overduplication of the centrosome. BMC Molecular and Cell Biology. 4, 12 (2003).
- Yu, D., Cattoglio, C., Xue, Y., Zhou, Q. A complex between DYRK1A and DCAF7 phosphorylates the C-terminal domain of RNA polymerase II to promote myogenesis. Nucleic Acids Research. , 1-14 (2019).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76, 4350-4354 (1979).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6, 359-362 (2009).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11, 2301-2319 (2016).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13, 731-740 (2016).
- Mellacheruvu, D., et al. The CRAPome: A contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10, 730-736 (2013).
- Choi, H., et al. SAINT: Probabilistic scoring of affinity purificationg-mass spectrometry data. Nature Methods. 8, 70-73 (2011).
- Shannon, P., et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Research. 13, 2498-2504 (2003).
- Szklarczyk, D., et al. The STRING database in 2017: quality-controlled protein-protein association networks, made broadly accessible. Nucleic Acids Research. 45, 362-368 (2017).
- Bindea, G., et al. ClueGO: a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks. Bioinformatics. 25, 1091-1093 (2009).
- Guard, S. E., et al. The nuclear interactome of DYRK1A reveals a functional role in DNA damage repair. Scientific Reports. 9, 6539 (2019).
- Razick, S., Magklaras, G., Donaldson, I. M. iRefIndex: A consolidated protein interaction database with provenance. BMC Bioinformatics. 9, 405 (2008).
- Kulak, N. A., Pichler, G., Paron, I., Nagaraj, N., Mann, M. Minimal, encapsulated proteomic-sample processing applied to copy-number estimation in eukaryotic cells. Nature Methods. 11, 319-324 (2014).
- Liu, Y., Beyer, A., Aebersold, R. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell. 165, 535-550 (2016).
- Hughes, C. S., et al. Ultrasensitive proteome analysis using paramagnetic bead technology. Molecular Systems Biology. 10, 757 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved