このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラットの拡張恐怖調節プロトコルを用いた恐怖インキュベーション
要約
我々は、ラットの過剰訓練および恐怖インキュベーションを生み出す拡張された恐怖調節プロトコルを記述する。このプロトコルは、25のトーンショックの組み合わせ(すなわち、オーバートレーニング)と、トレーニング後の48時間(短期)および6週間(長期)のコンテキストおよびキューテスト中の条件付き凍結応答の比較を伴う単一のトレーニングセッションを伴う。
要約
感情的な記憶は、主に恐怖条件付けパラダイムで研究されてきました。恐怖のコンディショニングは、個人が回避的な出来事とそれ以外の中立的な刺激との関係を学ぶ学習の一形態です。感情的な記憶を研究するための最も広く利用されている手順は、ラットの恐怖のコンディショニングを伴う。これらのタスクでは、無条件刺激(US)は、単一または複数のセッションにわたって1回または数回提示されたフットショックであり、条件付き応答(CR)は凍結している。これらの手順のバージョンでは、キュード・フィア・コンディショニングと呼ばれ、トレーニング段階ではトーン(条件付き刺激、CS)がフットショック(米国)とペアになります。最初のテストでは、動物は訓練が行われたのと同じ文脈にさらされ、凍結応答はフットショックとトーン(すなわち、コンテキストテスト)がない場合にテストされます。第2の試験中、凍結は、コンテキストが変化したときに測定され(例えば、実験室の臭いと壁を操作することによって)、トーンはフットショックの不在時に提示される(すなわち、キューテスト)。ほとんどのキュード・フィア・コンディショニング・プロシージャには、トーンショックの組み合わせが少ない(例えば、1回のセッションで1-3回の試行)が必要です。恐怖インキュベーションと呼ばれる長期的な効果に関連する広範な数のペアリング(すなわち、過剰訓練)を含むあまり一般的でないバージョンへの関心が高まっています(すなわち、恐怖の反応は、回避的な出来事や条件付き刺激にさらされることなく、時間の経過とともに増加します)。拡張された恐怖調節タスクは、他の心理現象(例えば、心的外傷後ストレス障害)との関係を含む、恐怖インキュベーションの行動および神経生物学的側面の理解の鍵となっている。ここでは、ラットの過剰訓練と恐怖の潜伏を生み出す拡張された恐怖調節プロトコルについて述べています。このプロトコルは、25のトーンショックの組み合わせ(すなわち、オーバートレーニング)と、トレーニング後の48時間(短期)および6週間(長期)のコンテキストおよびキューテスト中の条件付き凍結応答の比較を伴う単一のトレーニングセッションを伴う。
概要
メモリは、情報の取得、統合(取得した情報の安定性を可能にする)、検索(統合プロセスの証拠)など、さまざまな段階を含む心理的プロセスである。統合フェーズでは、新しいシナプス接続の確立と既存の接続の変更が行われます。これは、これらの変化を引き起こす分子および生理学的事象が11,22に起こる期間の必要性を示唆している。これらの生理学的または分子的変化は、取り出された事象が感情的に充電されるかどうか(すなわち、感情的記憶)によって異なる。例えば、研究は、横核およびバソラショナル扁桃体複合体が感情的記憶33、4、54,5に特に関連していることを示している。
感情記憶現象は、主に恐怖調節パラダイム55,66で研究されてきた。恐怖のコンディショニングは、個人が回避的な出来事とそれ以外の中立的な刺激の関係を学ぶ学習の一形態である7.恐怖調節パラダイムは扁桃体の分子、細胞、構造変化を生み出します。さらに、恐怖コンディショニングは、感情的な記憶の統合および検索プロセス中に海馬の接続性を変更します。
恐怖の記憶を研究するための最も一般的に使用される手順の1つは、ラットの古典的な(パブロビアン)コンディショニングです。この手順は、通常、1つまたは複数のセッションで1回または数回配信される回避刺激としてフットショック(US)を使用します。この処置に曝されたラットの条件応答(CR)は凍結している(すなわち、「呼吸に用いられる筋肉を除いた動物の骨格筋の一般化された筋膜応答によって引き起こされる一般化不動性」7)。 この応答は、コンテキストテストとキューテストの 2 種類のテストで評価できます。コンテキストテストでは、被験者はトレーニングセッション中に所定の数のフットショックを受け、その後、定義された時間だけ実験室から取り除かれます。試験中、被験者は、トレーニングが行われたのと同じコンテキストに戻され、異なる凍結対策がフットショックがない場合に収集され(例えば、継続時間、凍結エピソードの割合または頻度)、およびトレーニング段階で確立されたベースラインレベルと比較される。第2のタイプのテストでは、キューテスト、刺激(通常はトーン)がトレーニング段階(すなわち、条件付き刺激、CS)の間にフットショックと対になっている。トレーニングが完了すると、動物は定義された時間のトレーニングコンテキストから取り除かれ、その後、変更されたコンテキスト(例えば、壁の異なる形状と異なる匂いを持つ別の実験室)に置かれます。キューは指定された回数表示され、キューに対する凍結応答が測定され、トレーニング中に収集されたベースライン レベルと比較されます。このパラダイムの最も一般的なバージョンでは、1回のトレーニングセッション中に1~3トーンショックのペアリングを使用し、その後、数時間または数日後にコンテキストテストとキューテストを行います。
他のあまり頻繁に実装されていない恐怖条件付け手順は、多くの場合、オーバートレーニング手順8と呼ばれているショックキューペアリング(すなわち、試験)の広範な数を含みます。これらのタスクへの関心の高まりは、恐怖インキュベーションと呼ばれる長期的で記憶効果の増加に関連しています(すなわち、回避的な事象または条件付き刺激へのさらなる暴露がない場合には、時間の経過とともに恐怖応答を調整すると増加します)9,,10,,11.このような過剰トレーニング手順の例では、10 セッションに分散された 100 トーンショックの組み合わせのトレーニング フェーズが必要であり、その後に 48 時間と 30 日後に11,,12を実行したコンテキストテストとキュー テストが続きます。大規模な訓練が数日間にわたって広がることを避けるために、Maren(1998)は、25組の組み合わせ8を持つ単一のセッションでオーバートレーニングを確立し、最適化することができると報告しました。インキュベーション効果は、48時間後に試験されたラットと比較して、トレーニングの31日後に試験されたラットにおける有意に高いレベルの状態の恐怖で証明される。拡張された恐怖調節タスクは、他の心理現象(例えば、遅発性心的外傷後ストレス障害)11、12、13,12,13との関係を含む、恐怖インキュベーションの根底にある行動および神経生物学的側面の理解のための鍵となっている。
ここでは、ラットにおける過剰訓練および恐怖インキュベーションを誘発する拡張された恐怖調節プロトコルについて述べる。トレーニング11の数日を必要とする他のパラダイムとは異なり、現在のプロトコルは、単一のトレーニング セッション8に焦点を当てています。25回のトーンショックの組み合わせを使用して、48時間後に行われたテストと比較して、トレーニング後6週間に行われたコンテキストおよびキューテスト中に、より高い条件付き凍結応答を生成しました。
プロトコル
次の議定書は、フンダシオン・ウニシアリシア・コンラート・ローレンツ(IACUC-KL)の制度的動物のケアと使用委員会によって承認されました。国際動物権利連盟、ジュネーブ、スイス(1989)が発行した動物の権利の普遍的な宣言とICLASによって発行された動物との実験の倫理的原則が尊重されました。
1. 対象準備
- 雄の成人のウィスターラット(n=12)を選択する。トレーニングとテストプロトコルの開始前に、3日間の順応のためにケージあたり4つのグループでそれらを収容します。実験を通して、ラットに水への自由なアクセスを提供します。室温を20°C~25°Cの間で制御し、12時間の明暗サイクル(07:00時間点灯)で制御します。
注:ラット株は、恐怖のコンディショニング中に差動性能を示していました。例えば、Schaap et al. (2013) は、ウィスター株とルイス株がフォーンフードおよびブラウンノルウェーラット12と比較して凍結行動のより長い期間を示したと報告した。したがって、痛みと熱閾値の違いを評価して、衝撃の強度と持続時間を調整する必要があります。 - 毎日同じ時間に制限された食物アクセスを与えることによって、彼らの自由な摂食体重(350〜400 gの間の正常体重)の85%でラットを維持する。光サイクル中に同じ時間に毎日ラットの重量を量る。延長恐怖コンディショニングトレーニングの開始前に3日間のアドリブ重量(100%重量)を計算します。
注:本実験で使用した動物は、ここでは報告されていない追加のインストゥルメンタルテストでテストされました。これらの追加のテストには食糧不足が必要でした。この手続き的変動は、インストゥルメンタル・フィア複合テストの可能性を示唆しているので、現在の手順の範囲を拡大する可能性が高いと仮定されます。しかし、恐怖コンディショニングテストのみを使用した研究では、食品の剥奪は必要ありません。 - ランダムに次のグループのいずれかに被験者を割り当てます: トレーニングの6週間後の感情的なテスト (n = 6);トレーニング後の48時間の感情検査(n=6)。
- 暗光サイクルの明るい段階で、同様の時間にトレーニングとテストを行います。同じ実験室に動物を割り当て、訓練とテスト中に動物の同じ順序を維持します。
注: 実装できる追加の制御は、トレーニングおよびテストの段階で動物の順序のバランスを取り除く方法です。複数グループを評価する場合、または複数の実験で異なるタスクを適用する場合は、この手法を使用して、タスクの順序が動作に及ぼす影響を減らすことをお勧めします。
2. 装置設定と衝撃キャリブレーション
- 実験室とステンレス鋼のグリッドフロアのすべての内部表面を10%エタノールで洗浄してください。各動物をテストする前に繰り返します。
- USBケーブルを使用して機器をコンピュータに接続し、CPU、制御キャビネット、赤外線、回避刺激/スクランブル、衝撃強度キャリブレータなどの冷凍検知システム装置を起動します。
注:このプロトコルは市販の機器(材料表)を使用して実行されましたが、さまざまなブランドの機器やソフトウェアを使用することができます。装置はプラスチックのギムで覆われた木箱に埋め込まれる内部アクリルの正方形の部屋(29.53 cm x 23.5 cm x 20.96 cm、実験室と呼ばれる)から成っている。外部ドアは、音、騒音または光(ボックスドアを減衰)の分離を可能にする。カメラは、外部ドアの内部部分に横向きに配置されます。床の金属グリッド(36ステンレス鋼の棒、3つの直径および間隔8 mm、中心から中央まで)が付いている内部のアクリル箱はフットショック配達を可能にする。内側の側面の1つでは、スピーカーは聴覚の手がかりを提示するために床から6cmに位置しています。 - 衝撃強度キャリブレータの赤と黒のクリップ(すなわち、正と負のコネクタ)をグリッドフロアの2つの異なるロッドに接続します。USBケーブルをコンピュータの対応するポートに接続します。赤と黒のクリップを別のバーで区切られたバーに接続してください。
注: このセクションでは、 材料表に記載されている特定のブランドの機器を使用した衝撃強度キャリブレーションプロセスについて説明します。しかし、校正プロセスは、さまざまなブランドの機器を使用して実行できます。一貫性があることを確認するために、グリッドフロアの3つのセクターで衝撃の強度を較正することをお勧めします。さらに、常に送電の配信中に干渉を避けるためにグリッドの床から便や尿の残渣を除去します。 - 衝撃強度の校正ソフトウェアを起動します (材料表)。範囲の矢印をクリックして、アプリケーションで 1.0 mA の強度を選択します。次に、[実行/停止] スイッチを [実行] に変更します。
注:私たちは、私たちの研究室でげっ歯類モデルとの研究に基づいて1.0 mAを提案し、恐怖コンディショニング33、34、3534,の研究に33十分な範囲として0.75 mAから1.5 mAの範囲を報告する文献。35 - 回避刺激装置またはフットショックを送達するために使用される装置のスイッチを入れ、アプリケーションのパネルに表示される衝撃強度を確認します。必要に応じて、回避刺激装置のノブを使用して強度を1.0 mAに調整します。
注: 回避刺激装置は、適切にテスト、キャリブレーション、および実験を実行するために「OUT」に設定する必要があります。
3. 凍結検出システムのキャリブレーション
- 実験室と音減衰ボックスドアを閉じます。この時点で動物を導入しないでください, それは凍結検出システムのキャリブレーションが完了した後、チャンバーに配置されます.ボックス内の光の強度が 20 ~ 30 ルクスであることを確認します。
- 凍結検出システムソフトウェアを起動し、[ 実験の設定 ] ダイアログ ウィンドウを開きます。各サブジェクトの詳細 (件名の識別番号、日付、グループなど) を入力し、「トレーニング プロトコル VFC.pro」(http://doi.org/10.17605/OSF.IO/4NKFQ)というタイトルのファイルを読み込みます。
注: コンテキストテストとキューテストでは、別のプログラム構成を使用します。したがって、各テストで正しいファイルを使用するようにしてください。この時点で、正しいファイルは「トレーニングプロトコルVFC.pro」に対応しています。テストフェーズでは、対応するファイルはトレーニングセッションとは異なることを覚えておいてください。 - 対応するカメラを選択し、[ ビデオを保存 ]オプションをオンにします(必要に応じて)。 モーションしきい値 を 100 に設定し、[ 最小フリーズ時間] を 30 フレームに設定します。
注: このモーションしきい値は、使用される種のサイズ(ピクセル数に基づく)に基づいています。最小フリーズ期間の値は、製造元によって推奨されます。これらの値は、チャンバー内の動物の適切な認識を確保するために使用されます。 - 選択したカメラのライブフィードが、モーション閾値グラフとトレーニング中に提示されるさまざまな刺激のタイムライン(例えば、音と衝撃)と共に画面に表示されることを確認します。
注:別のブランドを使用して、機器のセットアップは、動物が移動または凍結している時間の量の比較を可能にする必要があり、動きの「インデックス」を検出するために、動物の動きを測定する可能性を提供する必要があります。別の可能性は、ビデオソース(実験中または実験後)だけで動物が動いているか凍結している時間を検出することができるソフトウェアを使用することです。131415 - モーションインデックスが 100 (しきい値) 未満のままであることを確認しながら、[ キャリブレーション ] オプションを 3 回クリックします。次に、画面上の対応するボタンをクリックして、機器を ロック するように設定します。
注: このセクションでは、材料表に記載されている特定のブランドの機器を使用した凍結検出システムのキャリブレーションプロセスについて説明します。前に述べたように、キャリブレーションプロセスは、さまざまなブランドの機器を使用して行うことができます(機器およびソフトウェアの異なるオプションのレビューについては、Anagnostarasららを参照してください)16.
4. 恐怖コンディショニングトレーニングの延長
- 布で覆われた自宅のケージの中のラットを、動物のケア施設から実験室の行動訓練室に運ぶ。行動訓練室への動物の輸送中に騒音やストレス発生条件への暴露を避けてください。複数の動物が同時に輸送される場合は、試験対象の動物を持参し、他のラットを保持室に維持して実験的な制御を強化する。訓練を始める前に2分間動物をそっと扱ってください。
注:プロトコルでは、動物は行動訓練の前に2分間毎日処理されました。取り扱いに続いて、動物を実験室に導入した。私たちは、ラットを研究者に習慣化させるために動物を操作することをお勧めします。 - 実験室にラットを導入します。尾の基部で優しく取り扱い、チャンバーの真ん中に置きます。実験室と音減衰ボックスドアを閉じます。
- [記録]ボタンをクリックしてセッションを開始します。ラットをチャンバーに3分間順応させてください。この3分の期間は、機器メーカーが推奨する標準であり、部屋へのベースラインと習慣時間として機能します。
- セッションの 3 分から開始して、60 秒のインタートライアル間隔 (ITI) で 25 トーンショックの組み合わせ (試行) を提供します。各ITIの最後の10秒の間にトーン(条件付き刺激 – CS; 90 dB SPL, 2000 Hz, 50 ms上昇時間)を提示し、各ITIの最後の2秒の間にショック(無条件刺激 – 米国)を提示します。
注 :[記録 ]ボタンの有効化は、カメラが適切に調整され、ロックされていることを条件としています。 - 28分のセッションが終わったら、実験室からラットを取り除きます。それぞれのホームケージに動物を返します。布で覆われた自宅のケージのラットを行動訓練室から動物のケア施設に運ぶ。
- 凍結検出システムのキャリブレーション(ステップ3.1~3.5)と恐怖調節(ステップ4.1と4.3)を繰り返して、すべての被験者を訓練します。
注: フリーズ検出の情報を処理する際に、ソフトウェアが同じパラメータを維持するように、各動物の検出システムを再調整することを強くお勧めします。 - 休息期間:この期間中、動物は自宅のケージで個別に休ませてください。インキュベーション期間の6週間の間に週に2回動物の体重を監視します。各動物を2分間穏やかに操作し、重み付けします。
5. コンテキストテスト – シングル 10 分セッション
- トレーニング段階の後、 動物をコンテキストテストと呼ばれる最初のメモリテストにさらします。この10分の段階の間に、訓練が行われたが、手がかりまたは衝撃を提示しない同じ文脈にラットをさらします。動物の世話施設から行動訓練室に覆われた家のケージ(例えば、布で)でラットを輸送します。動物はグループに分かれており、トレーニング段階の48時間後に1つのグループがテストされ、もう1つのグループはトレーニングの6週間後にテストされることを覚えておいてください( 図1を参照)。
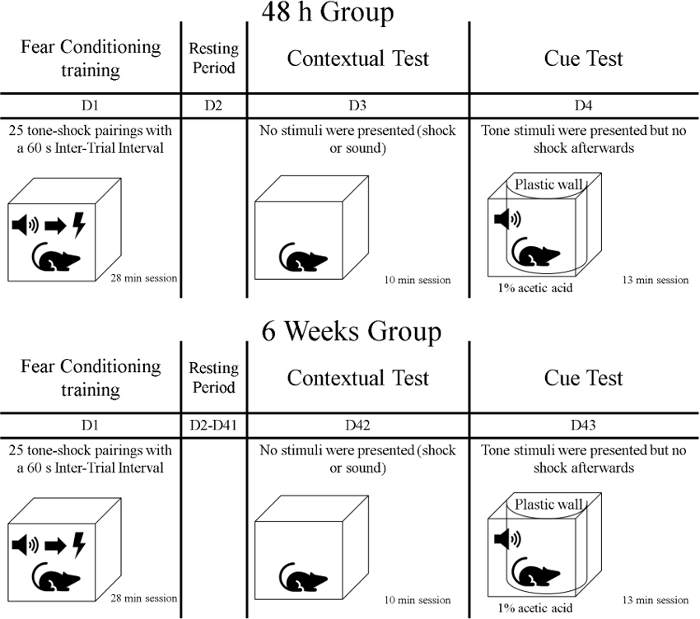
図1:実験のタイムライン。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 実験室とステンレス鋼のグリッドフロアのすべての内部表面を10%エタノールで洗浄してください。各動物をテストする前に繰り返します。
- 凍結検出システムのキャリブレーションを繰り返します(ステップ3.1~3.5)。 [実験のセットアップ ] ダイアログ ウィンドウを開き 、http://doi.org/10.17605/OSF.IO/4NKFQから入手できる "コンテキスト テスト protocol.pro" という名前のファイルを読み込みます。
注: このファイルには、衝撃や音が含まれるこの実験段階のセットアップが含まれています。 - 実験室に動物を紹介します。尾の基部で優しく取り扱い、チャンバーの真ん中に置きます。実験室と音減衰ボックスドアを閉じます。
- [記録]ボタンをクリックしてセッションを開始します。この単一の10分のコンテキストテストセッション中に、刺激は提示されません(ショックなしの音)。
- 10分のセッションが終わったら、実験室から被験者を取り除きます。動物をそれぞれのケージに戻し、覆われた自宅のケージの中のラットを行動訓練室から動物のケア施設に運ぶ。手順 5.2 ~ 5.5 を繰り返して、すべての被験者をテストします。
6. キューテスト – シングル 13 分セッション
- コンテキストテストの翌日、動物にキューテストと呼ばれるメモリの2番目のテストを受けさせます。この段階では、ラットは13分の間にトレーニングの異なるコンテキストになります。キュー(トーン)が提示されますが、衝撃は発生しません。カバーで覆われた自宅のケージのラットを動物のケア施設から行動訓練室に運ぶ。恐怖コンディショニングトレーニングの後にグループ72時間をテストし、トレーニングの6週と1日後に別のグループをテストします(図1)。
注:(動物のケア施設から実験室まで)交通の異なるシステムは、より多くのコンテキストとキューテストを区別するために実装することができます。動物は自宅のケージでトレーニングセッションとコンテキストテストセッションに運ばれたので、別の輸送ケージ、寝具および/またはカバーは、キューテストセッションへの輸送中に使用することができます。 - 実験室とステンレス鋼のグリッドフロアのすべての内部表面を10%エタノールで洗浄してください。各動物をテストする前に繰り返します。
- 視覚的なコンテキストを変更するには、プラスチック周囲の壁を実験室に挿入します。
- 嗅覚の文脈を変えるために、綿の先端の綿棒に1%の酢酸を適用し、格子底17、18、1918,19の下の金属トレイに置く。17
- 凍結検出システムのキャリブレーションを繰り返します(ステップ3.1~3.5)。 http://doi.org/10.17605/OSF.IO/4NKFQ ファイル"キューテストprotocol.pro"という名前のファイルを読み込みます。
注: このファイルには、この実験フェーズのセットアップが含まれていますが、これはトレーニングフェーズ(CS)の間に提示されたのと同じトーンで構成されていますが、ショック(US)がない場合)。 - 実験室に動物を紹介します。尾の基部で優しく取り扱い、チャンバーの真ん中に置きます。実験室と音減衰ボックスドアを閉じます。
- [記録]ボタンをクリックしてセッションを開始します。13分のキューテストセッション中に、CS刺激(トーン)はセッションの分3から10回提示されます。
注:最初の3分はこのセッションのベースラインに対応し、ショックがない場合は50のITIで10回のキューテスト試験(それぞれ10s)が配信されます。以前にロードされたファイルを使用して、トーンの配信は自動的に行われます。 - 13分のセッションが終わったら、実験室から動物を取り除きます。動物をそれぞれのケージに戻し、動物のケア施設に覆われた動物を輸送します。手順 6.2 ~ 6.5 を繰り返して、すべての被験者をテストします。
7. データ分析
- 凍結検出システムソフトウェアを使用してビデオストリームから導出される一般的な活動指標(すなわちモーションインデックス)を取得します。このソフトウェアは、自動的にセッションあたりの凍結時間の割合と凍結エピソードの数を提供するために、モーションインデックスを変換します。フリーズしきい値をシステムのデフォルトの最小フリーズ期間設定(1 s = 30 フレーム)に設定します。
- 次の情報を取得するには、追加のカスタムメイド プログラム (http://doi.org/10.17605/OSF.IO/4NKFQから入手できるファイル) を使用します。
- プログラムを使用して、トレーニングセッションの最初の3分間(つまり、ベースライン凍結、衝撃またはトーンがその3分間前または3分間に提示されなかったため)およびキューテストセッションの最初の3分間の間に凍結の割合を決定します。
- このプログラムを使用して、トレーニングセッションの 3 分のビン数が 8 個ごとに凍結率を決定します。
- プログラムを使用して、キュープレゼンテーション(トーン中のフリーズ)とキューなしの期間(インタートライアル間隔)の間にフリーズの割合を決定します。ITI)、トレーニングセッションとキューテストセッションの両方に使用します。
- これらのデータを取得するには、凍結検知システムソフトウェアを開きます。
- ファイルの選択 |レポート|バッチ コンポーネントの概要:
- 拡張子が付くファイルを選択します。cMP は http://doi.org/10.17605/OSF.IO/4NKFQ から入手できます。
- 出力ファイルに名前を付け、モーションしきい値を 100 に変更します。次に 、[OK]をクリックします。
- 分析するファイルを選択します (拡張子 )。RAW)。これらのファイルは、セッションが終了すると、凍結検出システムソフトウェアから自動的に生成され、各セッションの生データに対応しています。最初は、ファイルはコンピュータのデスクトップに保存されますが、カスタムフォルダ(例えば、ドキュメント-フィアコンディショニング)に保存して、分析が必要なときにその後の識別と開きが容易になります。
- 出力ファイル (拡張子 ) を開きます。CSV)。さらに分析するために、スプレッドシートソフトウェアで編集することができます。このファイルには、実験セッション中のフリーズの結果が含まれています。
注: フリーズの総割合を取得するには、対象がセッション全体に費やした時間を分割します。凍結エピソードの数は、セッションを通じて凍結イベントの数を数えて計算することができます。どちらの場合も、最小凍結期間に基づいてモーションしきい値を定義する必要があります。これは、フリーズ エピソードが記録されるかどうかを定義する時間基準です。自動記録システムでは、最小凍結時間の測定として、一定のフレーム/秒 (fps) を使用できます。たとえば、サンプルレートが 30 fps の場合、最低フリーズ期間は 15 フレームで、30 秒間続く不動のインスタンスをフリーズすると記録されます。
- 各セッションの各フリーズ エピソードの平均期間 (トレーニングと両方のテスト、コンテキスト、キュー) を、フリーズ エピソードの合計数に対して合計凍結時間 (秒) で割って計算します。
結果
トレーニングセッションの異なる段階における凍結時間の割合の変動は、依存 t 検定を用いてすべての被験者(n=12)について分析した(表1)。動物は活動的で、トレーニングセッションの最初の3分間(プロトコルの最初の日)、トーンやショックが送達されなかった時間(すなわち、ベースラインBL)の間に実験室を探索した。 図2Aに示?...
ディスカッション
現在の拡張された恐怖調節プロトコルは、短い(48時間)および長期期間(6週間)にわたる感情的記憶を評価するための効率的かつ有効なアプローチである。したがって、プロトコルは、ラットの過剰トレーニングおよび恐怖インキュベーション現象を研究することができます。このプロトコルの異なる利点の中には、以下のものがあります。コンテキストとキュー操作で 2 つの遅延 (48 時間と 6 ?...
開示事項
著者らは開示するものは何もない。
謝辞
この研究のための財政的支援は、フンダシオン大学コンラート・ローレンツによって提供されました - 助成金番号9IN15151。著者らは、コンラッド・ローレンツ大学の通信部に、ビデオの録画と編集、特にナタリア・リベラとアンドレス・セラーノ(プロデューサー)の助けに感謝したいと考えています。また、原稿に関するコメントについてはニコール・ファラー=サドフスキーとルチア・メディナ、コーポラシオン・ウニバーシタリア・イベロアメリカーナの学部長ヨハンナ・バレロは、制度的コラボレーションのために。著者には利益相反はありません。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
参考文献
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339 (2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871 (2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349 (2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99 (2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824 (2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091 (2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266 (2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved