このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
超音波画像によるマウスにおける肺腫瘍の進行の検出
要約
このプロトコルは、マウスにおけるKRAS肺腫瘍を誘導するために取られたステップと、超音波画像による形成された腫瘍の定量化を記述する。小さな腫瘍は、初期の時間でBラインとして視覚化されます。後の時点で、相対的な腫瘍体積測定は、超音波ソフトウェアの測定ツールによって達成される。
要約
年間160万人の犠牲者を出す肺癌は、世界的ながんの負担に大きく貢献しています。肺癌は、肺癌症例の約25%を構成するKRAS腫瘍遺伝子などの腫瘍遺伝子における遺伝的変化によって部分的に駆動される。KRAS主導の肺癌を治療的に標的化することの難しさは、実験室での病気の進行を模倣できる貧弱なモデルを持つことに部分的に起因する。我々は、超音波画像を介して、Cre-誘導性LSL-KRAS G12Dマウスモデルにおける原発性KRAS肺腫瘍の相対定量を可能にする方法を記載する。この方法は、肺のパレンチマの明るさ(B)モードの獲得に依存する。このモデルで最初に形成された腫瘍はB線として可視化され、取得した画像に存在するB線の数を数えることによって定量化することができる。これらは、マウス肺の表面に形成された相対的な腫瘍番号を表すであろう。形成された腫瘍は時間とともに発達するとともに、肺の中の深い裂け目として知覚される。形成された腫瘍の円周が十分に定義されているので、腫瘍の長さと幅を測定し、腫瘍キャリパー測定に用いる式に適用することにより、相対的な腫瘍体積を計算することが達成される。超音波画像処理は、マウスの腫瘍定量に使用されることが多い非侵襲的で、高速でユーザーフレンドリーな技術です。超音波画像を取得すると人工物が現れる可能性がありますが、このイメージング技術は、コンピュータ断層撮影(CT)イメージングなどの他のイメージング技術と比較して、マウスの腫瘍定量に対してより有利であることがわかりました。生物発光イメージング(BLI)。研究者は、マウスの異なるグループ間の肺腫瘍の開始と進行を比較することによって、この技術を使用して新しい治療標的を調査することができます。
概要
世界中のがん関連死の主な原因として、肺癌は、主に実験室1で病気を再現できる関連する前臨床モデルの欠如のために、治療に耐え難いままである。肺癌症例の約25%はKRASの癌遺伝子2の突然変異によるものである。KRAS駆動肺癌は、しばしば予後不良および治療に対する低応答と関連しており、この疾患におけるさらなる研究の重要性を強調する2。
KRAS肺がんによる免疫力マウスにおいて、肺腫瘍の成長をリアルタイムで相対的に評価できる方法を最適化した。我々は、KRAS G12Dオンコジーンをクレレンチウイルスベクター3、4で発現させることができる、ロクスストップ-ロクスKRAS G12D(LSL-KRAS G12D)マウスを用いる。これらのベクターは、炭酸脱水酵素2によって駆動され、ウイルス感染が肺胞上皮細胞5で特異的に起こるようにする。また、肺腫瘍の開始および進行を促進するために、レンチウイルス構築物は、U6/H1プロモーター(本明細書中のレンチウイルス構築物をCa2Cre-shp53)6と称するP53shRNAを発現する。この方法の生物学的関連性は、マウスの非正所性腫瘍の異種移植片とは対照的に、マウスにおける肺腫瘍の自然な過程にある。正所法を用いた障害は、マウスを犠牲にすることなく肺腫瘍の増殖をモニタリングすることである。この制限を克服するために、我々は、このマウスモデルにおける2次元(2D)モードでの肺腫瘍の進行の分析を可能にするために超音波画像を最適化した。感染後7週で腫瘍を発進させることは、超音波画像のB線として反映され、これは数えることができるが、肺に存在する腫瘍の正確な数を反映しない。B線は、肺のパレンチマ7、8の胸膜線から生じるレーザー状の垂直白線によって特徴付けられる。大きな腫瘍は、感染の18週間後に視覚化することができます。これらの腫瘍の相対的な容積は、超音波で行われる2D測定によって定量化される。
この方法は、LSL-KRAS G12Dマウスモデルにおける肺腫瘍の増殖に対する薬理薬の効果を調べている研究者にとって最適である。さらに、肺腫瘍の進行は、異なる遺伝的系統を有するマウス間で比較することができ、肺腫瘍容積の発達における特定の遺伝子/タンパク質の有無の重要性を調べることができる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物研究は、マギル大学の施設動物管理委員会(IACUC)に従って行われ、手順はマギル大学の動物福祉委員会(動物使用プロトコル#2009-5754)によって承認されました。
1. CA2Cre-shp53 レンチウイルス・ティトレの生成
注 : 以下のプロトコルは、Xia et al.6で説明したものと同じです。
- レンチウイルスの調製(15cm x 10cmの料理用)
- 1日目、プレートの健康なHEK293T細胞(10cm皿あたり7.5 x 106細胞)、10mLのダルベッコの変性イーグル培地(DMEM)、10%ウシ胎児血清(FBS)、および1%のペン/ストレップ。培養は37°C、5%CO2インキュベーターで培養した。
- リン酸カルシウム-トランスフェクション(15プレートの混合物)の混合物を準備します。レンチウイルスベクター(Ca2Cre-shp53)の225μg(15 μg/plate)、PsPAX2プラスミド(HIV-1ギャグおよびHIV-1 pol遺伝子を含む)の75μg(5μg/プレート)、pMD2.Gプラスミド(VSV遺伝子を含む)を含むチューブAを準備します。 0.15 M の最終濃度の CaCl2を、3.75 mL までの留め H2O でチューブを充填します。2x HEPES緩衝生理液の3.75 mLを含むチューブBを準備します(HBS;50mM HEPES、pH 7.05、280mM NaCl、10mM KCl、1.5mMNa2HPO 4・2H2O、および12mM D-デキスローズ)。
- 渦管Aを、連続的な渦の下でチューブBに滴下を加える。
注:総体積は7.5mLとなります。 - 暗闇の中で室温で20〜30分間インキュベートします。
- 細胞をめっきしてから約9時間、細胞培地に500μLのトランスフェクション混合物を滴下します(7.5mL/15皿:1皿あたり0.5mL)。
- 各料理をそっと旋回して混ぜ、すべての料理を37°C、5%CO2でインキュベートします。
- トランスフェクション後2日目、12-18時間、10cm皿あたり10mLの抗生物質フリーの還元血清培地(材料表)に交換してください。37 °C、5% CO2インキュベーターに戻します。
- 3日目に、Ca2Cre-shp53を発現するレンチウイルスを含む培地を収集し、0.45μmのフィルターをフィルターします。新鮮な抗生物質フリーの還元血清培地でメディアを補充します。
注:収集した培地は、4°Cで3日間以下で保管できます。 - 4日目に、レンチウイルスを含む培地を2回目に収集し、0.45μmフィルタを使用してフィルタを行います。4°C(3日以内)に保管してください。
- ステップ 1.1.8 および 1.1.9 からのウイルス上清を結合します。遠心フィルターユニット (材料表) を通して、4 °Cで30分間1,372 x gで遠心分離して濃縮します。収集されたすべてのメディアが列を通過するまで、このプロセスを繰り返します。
注:各遠心分離の後、濃縮濾液の100-200 μLを収穫することができます。 - 濃縮した濾液を15mLの氷冷チューブに集めて混ぜます。濃縮レンチウイルスをよく混ぜ、次にアリコート(例えば、100μL/チューブ)を混合する。80 °Cで保管してください。
- レンチウイルス滴定
注:緑色蛍光タンパク質(GFP)のloxP側のアレルを発現する不死化マウス胚性線維芽細胞(MEF)は、ウイルス力の定量のためにこのプロトコルで使用される。しかし、loxP-GFPアレレを有する任意の細胞株は、このステップに適しているべきである。- DMEMを用いてGFPのloxP側のアレを発現する培養細胞は、37°Cで10%FBSおよび1%ペン/ストレップ、5%CO2を有する。
- プレート 2 x 105細胞を 6 ウェルプレートの 2 つの 50 mm ウェルに入します。
注:一方のウェルの細胞はレンチウイルス感染に使用され、他方の細胞は陰性コントロールとして使用されます。 - 翌日、レンチウイルス感染前に、DMEM、10%FBS、および1%ペン/ストレップ2時間の細胞を補充する。
- レンチウイルス感染ウェルにCA2Cre-shp53レンチウイルス(必要に応じて体積が異なる場合)の20 μLを加える。
- 培養で3日後、図1に示すように、フローサイトメトリーによってCre誘導GFP陽性細胞の頻度を決定する。リン酸緩衝生理食塩水(PBS)で細胞を洗浄し、トリプシン化により剥離し、112xgで遠心分離して細胞を採取する。
- 細胞をPBSで2回洗浄します。最後に、細胞をPBSの100μLで懸濁する。細胞分析器 (材料表) によって GFP 陽性セルのパーセンテージを決定します。
- 次の式を使用してレンチウイルス感染性/機能的力力を計算します。

ここでFはGFP陽性細胞の頻度であり、感染前のGFP陽性細胞(Fi)の頻度からGFP陽性細胞の頻度(Fi)を差し引いて算出し(Fc)、図1(F=Fi-Fc)に示すように、Cnはメッキ細胞の数(2 x 105)、Vはイノキュラム(mL)の体積である。
注:感染性/機能濃度 = ~2 x 10 6 TU/mL。
LSL-KRASG12Dマウスにおけるレンチウイルスの気管内挿管法
注:気管内挿管の方法は、Vandivortら9によって公開されたプロトコルに記載されているように使用されました。このプロトコルでは、C57BL/6バックグラウンドのマウスLSL-KRASG12Dマウスが6〜8週齢で使用される。ヴァンディボルトらの説明に従って、自家製の作業手順ボードが使用されます。ボードは、便利なワークスペース(約1m2)で実験者の前に配置されています。
- 1 mLシリンジのプランジャーを取り外し、60 μLのPBSをシリンジに取り込んで、スピロメーターを準備します。
- 22Gのカテーテルチップをシリンジに取り付け、脇に置きます。
- ケタミン(50mg/mL)/キシラジン(5mg/mL)/アセプロマジン(1mg/mL)カクテルの1μL/gの腹腔内注射によってマウスを麻酔する。低呼吸数(1呼吸毎に2s)によってマウスの適切な沈離を確認してください。
- CA2Cre-shp53レンチウイルスの20μLをピペッタに吸引し、脇に置いた。
- 上の切り傷をボードの糸に引っ掛けて、鎮静したマウスを作業手順ボードに置きます。
注:マウスのドーサムは、プラットフォームに対して平らにする必要があります。 - 手順中にマウスの位置合わせを確認するために、胸腔の尾の部分をプラットフォームにテープで貼ります。
- グースネックのイルミレータを 80~100% の強度に調整し、皮膚表面から 1~2 cmの光を配置します。
- プラットホームの後ろから、無菌鉗子を使用してマウスの口腔から舌を引き出す。
- 舌を固定しながら、マウスの口腔に圧圧器を挿入し、舌を放す。
- メインステム気管支にグースネックを置き、気管を照らします。
注:気管は呼吸の作用によって見え、光の変動を引き起こします。 - 気管がはっきりと見えるとき、気管路に準備されたスピロメーター(PBSおよびカテーテルを含む注射器)を挿入する。
- 減圧器を取り除き、各呼吸で注射器中のPBSの上昇と下降を観察します。
注:これは、カテーテルが気管に正しく配置されていることを示す指標です。 - 気管内のカテーテルを前の位置として維持したままPBSを含むシリンジを取り外します。
- 20 μL CA2Cre-shp53 レンチウイルスをカテーテルの中央に沈着させます。
- カテーテルを所定の位置に保ちながら、空の注射器を使用してカテーテルに300μLの空気を注入し、肺中のレンチウイルスの適切な分布を確保する。
- カテーテルを所定の位置に保ち、カテーテルにスピロメーターを挿入し直します。
注: PBS バブルの上昇と下降はプロシージャが正常であることを保障する。 - カテーテルとテープを取り外します。動物が復活するまで、暖かく乾燥した場所に置きます。
3. マウスの肺腫瘍の超音波画像
注:超音波画像は、材料の表に記載されているシステムを使用してレンチウイルス挿管の7と18週間後に行われました。ただし、解析にはどのモデルでも使用できます。
- 撮像の1日前に、挿管マウスの胸部から毛皮を取り除く。
注:マウスは、3%イソフルランと2L /分O2の誘導室に置くことによって、このステップの間に鎮静する必要があります。 - イメージ作成の日に、図 2に示すようにワークスペースをセットアップします。超音波ゲルと温度モニターの加熱ポンプをオンにします。
- 33 °Cの温かいインキュベーターを設置し、マウスをポストイメージングに配置します。
- 3D (3D) モーターを統合されたレールシステム上に置きます(図2F)。
- 3Dモーターとトランスデューサ取り付けシステムがしっかりと設置されていることを確認します。
- 優先トランスデューサを接続します(周波数:40 MHz;図23Dモータに垂直な腫瘍測定用Eおよび材料表)
- 超音波ソフトウェアに関する新しい研究を開始します。
- [スタディ ブラウザ] を選択し、画面下部の [新規]を選択します。
- [新しい研究] を選択すると、研究に関する詳細情報(研究日、研究者の名前など)に加えて、スタディ名を追加できる新しいウィンドウが表示されます。
- シリーズ名、すなわち、動物ID、ひずみ、体重、生年月日などの情報を入力します。
- [完了]を選択すると、プログラムは B モードに変更されます。
- 動物のプラットホームの上の便利な位置に暖房ランプを置きなさい。
- マウスを誘導室(3.5%イソファフルラン)に入れます。
注:マウスの無意識、および2秒あたり約1呼吸の遅い呼吸速度によって適切な麻酔が確認されます。 - マウスが鎮静されると、麻酔機械の接続を動物のプラットフォームに向けて変更し、イソファフルランを2.5%に減らす。
- マウスを脳下腹側の動物のプラットフォームに置き、その口腔を麻酔管に向けます。
- マウスの目に潤滑剤を塗布します。
- マウスをデキュビタスの後方に置き、手と足をしっかりと動物のプラットフォームにテープで貼ります。
- マウスの胸に超音波ゲルの小さな層を適用します。
- 高さ調節ノブを使って取得プローブを下げて、マウスの胸面に触れます。マウスの心臓部がほぼ中央になるようにプローブを配置します。
- マイクロノブを使用して、両方の先端から胸全体の画像を取得し、横方向にマウスあたり500フレームを集めるのが理想的です(フレーム数は個人の選択によって異なる場合があります)。
- イメージングが完了したら、マウスの胸部からゲルを取り出し、マウスを温かいインキュベーターに入れてください。
4. 超音波画像の2D分析
- 超音波ソフトウェアで取得したフレームを開いた後、腫瘍のフレームをスキャンします。
- 小さな腫瘍を起用する場合は、取得した500フレームの全長について、10フレームごとにBライン数を定期的に数えます。
したがって、B線は合計50枚の画像に数えられ、各画像は10フレームで区切られる。B線は、画面を完全に横断する縦方向の白い直線によって特徴付けられる。 - 大きな腫瘍の2D測定では、線形ツールを選択し、腫瘍の幅と長さを測定します。
- 腫瘍の体積を計算するには、次の式を使用します。
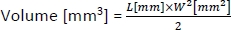
ここでLとWはそれぞれ腫瘍の長さと幅である。
Access restricted. Please log in or start a trial to view this content.
結果
〜2 x 106 TU/mLのレンチウイルス感染力を得た後(図1)、LSL-KRAS G12Dマウスが適切な年齢(6−8週間)9に達したときにCa2Cre-shp53レンチウイルスを気管内注射した。超音波画像は、腫瘍の開始時に感染の7週間後に行われた(図3B)。画像化は、LSL-KRASG12Dマウスモデルで生じる様々なタイプの前駆体病変を含むため7週...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
我々は、超音波によるCre-誘導性LSL-KRAS G12Dマウスモデルにおける肺腫瘍の成長を評価できる方法を実証する。この方法は、肺腫瘍の増殖に対する薬理学的阻害薬の効果を評価するために使用することができる。また、異なる遺伝的背景のマウス間の肺腫瘍の成長を比較するために使用することができます。この手法を使用すると、専門的な計算スキルは必要ありませんが、マウスの異なるグ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者たちは開示するものは何もない。
謝辞
レンチウイルスCa2Cre-shp53ベクターに対するI.ヴェルマ博士に感謝します。この作業は、カナダ保健研究所(CIHR MOP 137113)からAEKへの資金によって支えられていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
参考文献
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8(2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532(2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746(2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25(2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975(2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15(2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372(2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9(2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved