このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
中国ハムスター卵巣細胞培養におけるハイスループット自動マイクロバイオリアクターを用いたプロセス最適化
要約
ここでは、自動マイクロバイオリアクターで実験計画を実行し、その後にプロテインAカラムを用いた細胞収穫およびタンパク質定量を行う詳細な手順を提示する。
要約
バイオプロセスの最適化は、バイオ医薬品業界において、望ましい製品の収量を増やすために重要です。これは、ひずみの選択とバイオプロセスパラメータの開発によって達成することができます。この目的のために振るフラスコが使用されています。しかし、pHや溶存酸素(DO)などのプロセスパラメータを制御する能力がありません。この制限は、自動化されたマイクロバイオリアクターの助けを借りて克服することができます。これらのバイオリアクターは、より大きなスケールでの栽培を模倣します。このシステムの大きな利点の1つは、実験計画(DOE)をソフトウェアに統合することです。この統合により、複数のプロセスパラメータを同時に変更できる設計を確立できます。重要なプロセスパラメータと最適なバイオプロセス条件は、ソフトウェア内で分析できます。ここで紹介する作業の焦点は、ソフトウェアのプロセス設計に関わるステップと、栽培の過程におけるDOEの組み込みについて、ユーザーに紹介することです。
概要
世界のバイオ医薬品市場は2018年に2,500億米ドル以上の価値があり、継続的に拡大しています 1 .製薬会社は、小分子薬の製造から組み換えタンパク質などのバイオテクノロジーで製造された治療薬に移行しています。これらだけでも1,500億ドル以上の収益が1.5億ドルを超える。哺乳動物細胞は現在、これらの医薬組換えタンパク質の生産に広く使用されている。現在の期間において、哺乳動物細胞によって産生される68の承認された製品のうち、57は中国のハムスター卵巣細胞(CHO)2によって産生される。CHO細胞は、翻訳後修飾を必要とする組換えタンパク質の製造に特に使用されます。これらの細胞は、懸濁液中で増殖し、それによって血清フリーの化学的に定義された培地33、44で再現可能な結果を可能にする好ましい。CHO細胞を用いるもう1つの利点は、産物のグリカン構造がヒトモノクローナル抗体(mAb)に類似しており、遺伝子増幅による組換えタンパク質収率および特異的生産性の向上をもたらす5。
組換えCHO(rCHO)細胞培養の収量は、過去20年間で100倍に増加しました。この改善は、プロセスパラメータの最適化、摂食戦略および無血清化学的に定義された培地6の開発に起因する。医薬品の要求の増加に伴い、生産プロセス7の開発のためのコストと時間効率の圧力が高まります。製品品質を保証しながら圧力を軽減するために、製薬業界の焦点は設計品質(QbD)にリダイレクトされました。QbD は、製品の生産とプロセスを理解するために使用されます。ObD で使用される重要なツールは実験の設計 (DOE) です。さまざまな入力変数と結果の出力データの関係を明らかにすることで、プロセスの理解を深めるのに役立ちます。DOEアプローチを適用してバイオプロセスを最適化することは、プロジェクトの初期段階でプロセス条件を同化し、タイターの量と品質を高める上で有益です。このアプローチは、昔ながらの戦略と比較すると有益です: 一時1ファクター (OFAT)。古典、シャイニン、田口を用いたDOEに対する統計的アプローチはOFAT8よりはるかに優れている。
プロセスおよび媒体の最適化は、シェイクフラスコで行うことができる。フラスコは比較的安価です。しかし、温度、pH、溶存酸素(DO)などのパラメータを制御することはできません。これらの欠点を克服するために、0.5 Lから5 Lの働く容積から及ぶ多用のベンチトップバイオリアクターを使用することができる。原子炉は広範なインライン監視およびプロセス制御を提供する。しかし、多用途バイオリアクターの使用は時間と労力を要する。これらの欠点を克服するために、ベンチトップバイオリアクターを監視する包括的なプロセスとシェイクフラスコの容易な取り扱いを組み合わせた新しい単回使用バイオリアクターが使用されています。高スループットスクリーニングシステムとシングルユース技術は、プロセス性能と開発の効率を高める9.
この記事では、自動マイクロバイオリアクター(AMBR)ソフトウェアにレシピをロードするためのガイドラインをリストします。異なる攪拌機の速度とpHが生存細胞濃度(VCC)および力乗に及ぼす影響は、この実験の過程で検討される。実験結果及び分析は、実験用ソフトウェアMODDE12の設計を用いて行う。製品分析は、プロテインAカラムを備えた高圧液体クロマトグラフィー(HPLC)システムで行われます。mAbのFc領域は、高親和性10,11,11のプロテインAに結合するという原理に基づいている。この方法により、mAbを同定し定量することができる。定量は、280nmで測定された溶出ピーク領域上で行われる。
プロトコル
1. 前培養手順
注:このプロトコルには、生存細胞濃度が1 x 107セル/mLの組換えCHO DG44細胞が使用されます。
- 細胞1.2mLを含むバイアルを室温まで解凍し、10mLのコールドシード培地を含む15mL円錐遠心管に細胞懸濁液を直ちに移す。
- 円錐状遠心管を190xgと室温で5分間遠心しg、上清を捨てる。
- 500mLの振れフラスコでシード培地の150mLを36.8°Cに予熱する。
- 細胞ペレットを10mL前温めの種子培地で静かに再懸濁し、細胞をシェイクフラスコに移します。
- フラスコからサンプルの1 mLを使用して、セルカウンターを使用して初期のVCCと生存率を測定します。
注:成功した栽培のために解凍した後、生存率は70%を超える必要があります。 - 36.8 °Cの軌道シェーカー(シェーカー直径19mm)と7.5%CO2の揺れフラスコを120rpmの振れ速度でインキュベートします。2
注:これらの条件は、細胞株および培地によって異なる。 - 細胞を通過した3日後、シェーカーから振るフラスコを取り出し、層流キャビネットの下に置きます。1 mLのサンプルを採取し、最終的な細胞濃度を測定します。新しい通路の初期細胞濃度が2 x 105細胞/mLになるように、新鮮な事前温められた種子培地に移す容積を計算する。
- 細胞を5回通過してから、主培養のためにバイオリアクターに移した。
2. 主な栽培
- 前培養の最終細胞濃度を測定する。リアクター内の初期細胞濃度が3 x 105細胞/mLになるように、バイオリアクターに転送される体積を計算します。
- 接種の前日に生成媒体で反応器を充填し、反応器を平衡化し、温度、pHおよびDOなどのプロセスパラメータを設定します。
注:栽培条件は36.8°C、溶存酸素濃度60%(DO)です。6.9、7.1、7.3のpHと共に1050 rpmと1300 rpmの攪拌機速度をテストしました。培養の全持続期間は、細胞が収穫されるまで12日間である。バッチ処理は 72 時間実行され、その後、フィード メディアが 24 時間ごとに追加されます。栽培に使用するプロトコルは、次のセグメントに詳細に記載されています。
3. 自動マイクロバイオリアクターソフトウェアでのレシピの作成
注:AMBR 細胞培養ソフトウェアでレシピを記述する方法は 2 つあります。このプロトコルの目的のために、ウィザードを使用する手順が表示されます。
- 新しい実験の作成
- AMBR 細胞培養ソフトウェアを開き、[はじめに] タブで[新規実験の作成] をクリックします。
- レシピの読み込み
- [新しい実験] タブで、実験の名前と、実験を実行する日付を入力します。
- 栽培中に使用する培養ステーションと容器のチェックポイントを有効にします。DOEの自動追加タグは、DOE実験のプログラミング中に簡単に移行するためにも有効になります。[次へ] をクリックして次のタブに切り替えます。
- 消泡剤、接種剤、飼料およびグルコースとともに容器への培地の添加に関する情報を設定します。
- メディアプレート追加チェック ポイントをアクティブにします。プレートタイプ、名前、およびメディアを含むプレートの場所を定義します。
注意:プレートの種類に応じて、プレートに蓋が含まれている場合は、液体ハンドラの円滑な機能を確保するために[Lidded]のチェックを有効にします - [船舶にメディアを追加]をクリックします。船舶に追加する媒体の容積を入力します。プレートから船舶への媒体の転送のマッピングを定義します。[次へ] をクリックして次のタブに切り替えます。
- メディアプレート追加チェック ポイントをアクティブにします。プレートタイプ、名前、およびメディアを含むプレートの場所を定義します。
- 反応器の栽培条件を設定します。
- メディア情報をソフトウェアに供給した後、栽培条件を割り当てます。コンディションメディアをクリックし、温度、目標DO、上のpHリミットを埋め、RPM(アップ攪拌またはダウン攪拌)を埋めます。
- 容器に接種物の付加を設定します。
- [セル プレートの追加]をアクティブにします。プレートの種類、名前、およびメディアを含むプレートの場所を定義します。
- [細胞を容器に追加]をクリックします。接種の時間と、船舶に追加する媒体の体積を入力します。
- 液体ハンドラがプレートから船舶にセルを移動する経路を定義します。[次へ] をクリックして次のタブに切り替えます。
注:クロスコンタミネーションと誤った初期生存細胞濃度を避けるために、リユースピペットチップが非アクティブになっていることを確認してください。
- 飼料、ブドウ糖、消泡剤の添加を設定します。
注:飼料、グルコースおよび消泡剤の添加手順は、互いに類似している。このプロトコルのために、この手順は「フィード」に記載されています。これは、グルコースおよび消泡剤のために複製することができます。- [フィードプレートを追加]をアクティブにし、プレートのタイプ、名前、および場所を定義します。「容器に飼料を追加」をクリックし、容器に追加するフィードの量を入力します。プレートから容器へのフィードの転送のマッピングを定義します。
- 栽培に応じて、飼料添加数を加えます。この栽培のために、反応器は24時間ごとに72時間後に供給される。
- データを追加したセルから遅延に入力して、フィードの間の時間遅延を手動で追加します。摂食の最初の日は接種の72時間後であり、次の日は96時間後などである。
注:消泡剤の添加は、栽培中の発泡を避けるために毎日追加されるようにプログラムされています。
- 栽培中にサンプリングを設定します。
- サンプルプレートを追加をアクティブにし、プレートのタイプ、名前、および場所を定義します。
- 「サンプルを船舶から採取」で確認し、船舶から取り出すサンプルの体積を入力します。容器からプレートへのサンプルの移動のマッピングを定義します。栽培の全過程で、体積が10mL以下にならないようにしてください。
- 栽培中に採取するサンプル数を加えます。供給と同様に、各入力サンプルポイントについて容器から取り出されるサンプルの時間を追加します。
- プロセスを保存します。これで実行の準備が整いました。
注:プロトコルの円滑な実行を確実に行うために、AMBR 細胞培養ソフトウェアの「プロセス・ステップ」タブに切り替え、「プロセス・ステップ・ビュー 」を選択して、レシピのフローを視覚化します。
- [新しい実験] タブで、実験の名前と、実験を実行する日付を入力します。
- 自動マイクロバイオリアクターにおける実験の設計
- バイオリアクターのDOEソフトウェアを実行するために、メインソフトウェアのレシピが保存され、使用する準備ができていることを確認してください。
- AMBR 15 DOEソフトウェアを開き、[調査] をクリックして [新規] を選択します。
- [調査の作成] ダイアログ ボックスに新しい DOE調査の名前を入力します。
- DOE 調査に実験を割り当てるには、作成したレシピを開いて、異なるパラメータを調べます。[参照]をクリックし、それぞれの実験を選択します。
- DOE 係数を定義します。
- 容器タグは、すでに列に入っています。目的の DOE 係数を定義するには、パラメータを選択し、DOE 係数というラベルの付いた列をクリックします。新規を選択し、単位、略語、因子の下限と上限(温度、DO、pHなど)を追加します。
- 応答係数を定義します。
- DOE因子を定義したら、実験分析を構造化する応答を定義します。
- [応答] タブで、データの分析に考慮する値を定義します。
- [DOE 応答の編集] をクリックし、応答の名前、略語、単位、最小値と最大値(例えば、タイター、生存可能な細胞濃度)を定義します。
- 応答が定義されたら、各応答の AMBR 変数を選択し、変数を定義します。応答は、マイクロバイオリアクター変数に自動的に関連付けることができます, ドロップダウンリストから必要な変数を選択します.
- 要件に応じて、各応答の式を変更します。選択は、最小、最大、最初、最後、平均のデータの間で行われます。
- デザインを作成します。
- [デザインの開始ウィザード]を使用して、実験計画の種類を選択し、反復数と中心点を追加または削除します。
- 目的を選択して、設計とモデルの選択を決定します。
スクリーニング: 線形モデルと相互作用モデルを使用して重要な要因を見つける
最適化(RSM)、詳細なモデリングと最適化のための二次モデルと3次モデルを使用
分割目標: 定式因子とプロセス因子のモデルは個別に選択可能 - 目標が決定されたら、モデルと設計を中心点と反復の数と共に選択します。
- [完了] をクリックし、次のタブに切り替えます。
- 実験を定義します。
注:DOE の要因は、ソフトウェアの右側の列にリストされています。目的の因子を選択すると、目的のパラメータを使用して実験を実行している船舶が強調表示されます。培養ステーション内の容器は、容器を右クリックして目的の場所に移動させることで移動できます。- AMBR 細胞培養ソフトウェアでインポートできる作業パケットを作成します。実験の数に応じて、異なる作業パケットが作成され、さらなる実装のために保存されます
- AMBR制御ラップトップ上で作成された作業パケットでの実験の実行
- [実験]タブで、[DOE実験を作成]をクリックし、DOEソフトウェアを使用して作成された作業パケットを参照します。
- [開始] をクリックしてプロセスを初期化します。
- 実験結果の分析
- 実験を実行したら、[DOE 結果をエクスポート] を使用してデータをエクスポートします。[DOE 結果のエクスポート]ウィンドウが開き、カルチャ容器とステーションを示す行が表に一覧表示されます。
- 目的の行を選択し、[選択した行をエクスポート]または[実験データをエクスポート]をクリックして、すべての結果を保存し、さらに分析するためにファイルを保存します。
- [結果] タブに切り替えて [結果のインポート] を選択して、AMBR DOE モジュールにデータをインポートします。
- 目的のデータ ファイルを参照し、 [ 解析結果] をクリックします。
- MODDE でさらに結果を分析します。
4. 自動マイクロバイオリアクターにおける栽培の実施
注:以下の手順は、前述のソフトウェアに書かれたプロトコルの助けを借りてユーザーによって実行されます。手順は、特に明記されていない限り、ユーザーによって実行されます。
- 船舶の積み込み
- 図 2に示すように、ラミナル フロー キャビネットの下でガンマ滅菌培養容器を開き、培養ステーションで配向します。
- 70%エタノールと二重蒸留水でクランププレートを洗浄します。次に、プレートをオートクレーブし、容器の上に置きます。
- クランププレートをスターラープレートで取り付け、各ピンをしっかりと固定します。
- 攪拌板とクランププレートの両方を攪拌アセンブリに締めます。
- マイクロバイオリアクターソフトウェアの実行
- 3項で書かれたプログラムを使って栽培を実行します。
- [プロセス]タブでスケジュールまたは完了したプロセスステップを視覚化します。
- 発泡剤が始まる前に容器に消泡剤を加えて、栽培中に過度の発泡がないようにします。消泡剤は定期的に添加され、泡は視覚的に検出されます。
- 容器への媒体の付加
- マイクロバイオリアクターに付属する24ウェルプレートを滅菌媒体で手動で充填し、システムの指定デッキに配置します。書かれたプログラムによって指定されたデッキに版が置かれていることを確認してください(セクション3)。容器の充填はセクション3.2.2で設計されたとおりに行われます。
注:温度と攪拌機は、メディアと消泡剤の添加直後に開始します。センサーの読者は容器が満たされた1時間後に作動する(開始モニターステップ)。各容器へのガスは読者が作動させた後に始まる。培地は、pH再較正および接種前に最低6時間平衡化する。プロセスパラメータは、セクション3.2.3で説明したようにソフトウェアで変更することができます。
- マイクロバイオリアクターに付属する24ウェルプレートを滅菌媒体で手動で充填し、システムの指定デッキに配置します。書かれたプログラムによって指定されたデッキに版が置かれていることを確認してください(セクション3)。容器の充填はセクション3.2.2で設計されたとおりに行われます。
- 接種
- 5回目の通過後に生存細胞濃度を測定する。すべての血管の初期細胞濃度が3 x 105細胞/mLであることを確認するために、血管に移される細胞の数を計算します。
- 細胞を24深いウェルプレートに移し、懸濁液の体積が必要な体積の少なくとも1.6倍になるようにします。接種液の2mLの必要な容積のために、3.2 mLの細胞懸濁液をプレートの各ウェルに移す。
- 指定されたデッキに24の井戸の版を置く。船舶はセクション3.2.4のように接種されます。
- 毎日のサンプリングと分析
- 液体ハンドラを使用して、毎日460μLのサンプルを容器から取り出します。サンプル200 μLを800 μLの濾過済み1x PBSバッファー(5x希釈)で希釈し、セルカウンターに入れます。
- 残りのサンプルを190xgおよび室温で5分間遠心gし、さらに分析のために上清(グルコース、乳酸、グルタミンおよびグルタミン酸)を保存する。
- タンパク質定量のための培養終了まで-20°Cで上澄みの100μLを凍結する。
- 栽培終了
- プロセスパラメータ制御(すなわち、温度、攪拌、pHおよびDO)が終了すると、プロセスの監視を停止する。
- スターラープレートとクランププレートを緩めます。
- 培養容器を取り除き、文化ステーションを清掃します。乾燥プレートを培養ステーションに置き、それらをねじ込みます。
- 一方、70%エタノールと二重蒸留水でクランププレートを十分に洗浄してください。
- 乾燥サイクルが完了したら、バイオリアクターソフトウェアで[停止]をクリックします。
- 細胞培養収穫
- 50 mL遠心分離管に容器の含有量を手動で除去することにより、培養の12日目に細胞を収穫する。細胞スープを190xgで30分間遠g心分離する。
- 細胞ペレットを捨て、上清を-20°Cに保存します。
5. mAb濃度の測定
- 1.7 mLタンパク質Aカラムを使用して、栽培走行中のタンパク質を定量します。
-
サンプルを解凍する前に、平衡および溶出バッファーを準備します。
- 平衡バッファーとして7.9のpHを有する0.5 M Na2 NaClを含む0.5 MNa2HPO4の溶液と、溶出バッファーとして2のpHを有する0.5 M NaClを含む100 mMのグリシンの溶液を使用する。4
- 0.2 μmの膜を通して両方のバッファーをフィルターし、分析のために配置される前に脱気します。
- 新しく調製した平衡バッファーで、高速液体クロマトグラフィーシステム(HPLC)をパージします。
- タンパク質AカラムをHPLCシステムにロードします。
- 流量1 mL/minのクロマトグラフィーを実施し、カラムオーブン温度を30°C、オートサンプラー温度を10°Cに設定します。
- 冷凍サンプルを室温で解凍し、各サンプルの225 μLを0.22 μmのPVDF膜を通して濾過します。目的のタンパク質の濃度が高いサンプルを希釈すると、平衡バッファーと1:20の比率で、オートサンプラーに入る前に膜を通してフィルターします。
- オートサンプラーにサンプルを配置します。ソフトウェアでメソッドとシーケンスをロードし、シーケンスを開始します。
注:この方法は、3 つのフェーズで構成されています (図 1を参照): 最初の 2 分間の列へのサンプルの注入。その後、8分間の溶出バッファーと平衡バッファーを持つカラム再生を10分間行います。
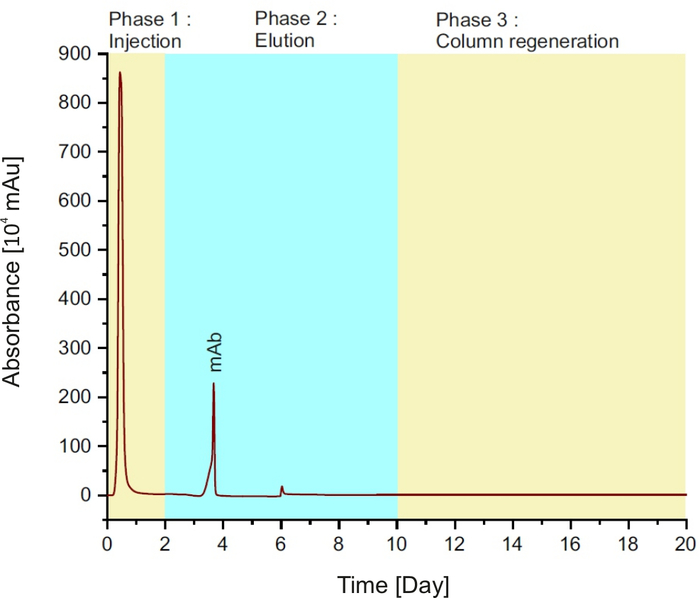
図1:タンパク質Aクロマトグラムは、単一の実行中に異なる相を表す。この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
この研究で行われた栽培の概要を図2に示す。
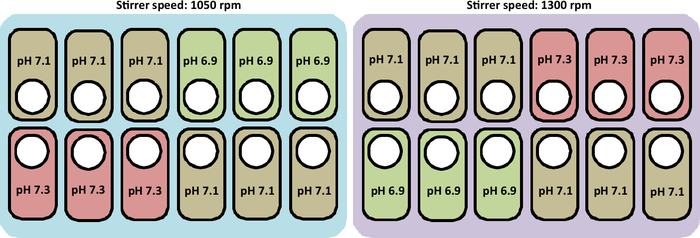
図2:培養局におけるpHおよび撹拌速度プロファイルを試験するための実験条件の概略表現。図はまた、船を配置するための正しいレイアウトを表しています。
ディスカッション
収量を増やすためにプロセスの最適化は、バイオ医薬品業界で非常に重要です。シェイクフラスコは、潜在的に株のスクリーニングに使用することができます。ただし、pH や DO などのプロセス パラメータの監視はフラスコでは使用できません。マイクロバイオリアクターは、プロセスの継続的な監視と制御を可能にする利点があります。マイクロバイオリアクターにおけるこれらの制御ル?...
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ドイツの連邦教育研究省(BMBF)、ドイツのサルトリウス・ステディム・バイオテック社のバイオプロセッシングチームの支援に感謝したいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
参考文献
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136 (2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. . Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved