Method Article
直交トピック膵腫瘍の生成と腫瘍浸潤T細胞細胞傷害のEx生体内特性評価
要約
このプロトコルは、正形外科膵腫瘍の外科的生成と、新たに単離されたマウス膵腫瘍の急速な消化について説明する。消化後、生存可能な免疫細胞集団は、フローサイトメトリーによる細胞内サイトカイン検出のためのT細胞のex生体内刺激を含むさらなる下流分析に使用することができる。
要約
膵臓癌の生体内モデルは、疾患のダイナミクス、免疫浸潤および新しい治療戦略を研究するための貴重なツールを提供する。オルソトピックマウスモデルは、免疫担当マウスの大きなコホート上で同時に行うことができ、比較的安価であり、認知組織の微小環境を維持する。直交腫瘍内のT細胞浸潤および細胞傷害活性の定量は、抗腫瘍応答の有用な指標を提供する。
このプロトコルは、膵臓に直接5μL基底膜に再懸濁された少数の同種腫瘍細胞の注射による正形性膵腫瘍の外科的生成のための方法論を記述する。オルソトピック腫瘍を有するマウスは、エンドポイントに到達するまでに約30日かかり、その時点で腫瘍が収穫され、腫瘍浸潤T細胞活性の特徴付けのために処理することができる。コラゲナーゼとDNaseを用いた迅速な酵素消化により、腫瘍から単細胞懸濁液を抽出することができます。腫瘍から抽出された免疫細胞の生存率および細胞表面マーカーが保存される。したがって、培養またはRNA抽出のための免疫細胞のフローアシスト細胞選別、免疫細胞集団のフローサイトメトリー分析を含む複数の下流アプリケーションに適しています。ここでは、細胞内サイトカイン定量(IFNγおよびTNFα)および脱顆粒活性(CD107a)に対するT細胞集団のex vivo刺激を、全体的な細胞毒性の尺度として説明する。全腫瘍消化は、サイトカイン産生および脱顆粒をアップレギュレートするために抗CD107a抗体の存在下で、5時間のホモル筋酢酸およびイオノマイシンで刺激された。最後の4時間にブレフェルジンAとモネンシンを添加し、細胞外輸送を遮断し、サイトカイン検出を最大化するために行った。次いで、フローサイトメトリー分析のために細胞の余分および細胞内染色を行い、そこでIFNγ+、TNFα+およびCD107a+CD4+およびCD8+T細胞の割合を定量した。
この方法は、腫瘍微小環境の包括的な分析を行う開始塩基を提供する。
概要
この方法の詳細は、開始から終了まで、最小限の細胞材料を用いて正形性膵腫瘍を生成するための外科的処置およびT細胞機能のex vivo分析を含む免疫細胞集団の包括的なフローサイトメトリー分析のための確立された腫瘍のその後の急速解離を行う。
膵管腺癌(PDAC)は、5年1を生存する患者のわずか8%を有する積極的な癌である。患者の20%未満は外科的切除2の対象であるため、新鮮な患者サンプルは研究のために容易にアクセスできないため、生体内モデルはこの疾患を調査するのに不可欠なツールを提供します。PDACの複数のマウスモデルがある:オルソトピック、皮下、トランスジェニック、静脈内および患者由来異種移植片(PDX)、ここで広く説明する3。ここで説明するオルソトピックモデルは、免疫担当マウスの膵臓に同系PDAC細胞を注入することを可能にする。これは、野生型または変異型マウスの大規模なコホートで行うことができ、従って治療薬の比較のための費用対効果が高く、一貫したモデルを提供する。重要なことに、オルソトピックモデルは、腫瘍細胞の増殖および転移のための認知微小環境を、臨床的に関連する部位(例えば肝臓)に、臨床的に関連する部位(例えば肝臓)に提供し、皮下または化学的に誘発されたモデルよりも臨床的に関連する。直交トピック腫瘍は、線維芽細胞および細胞外マトリックス沈着5の豊富さとの強力なデスモプラスチック反応のようなPDACの主要な特徴を示す。PDACのトランスジェニックモデルは、マウスモデルのゴールドスタンダードであり、最も一般的に使用されるKPCモデルは、膵臓特異的Pdx-1-Creプロモーター6の下で変異クラスG12D/+およびTrp53R172H/+を発現するKPCモデルである。追加の KPC およびその他の生体内PDAC モデルについては、ここでは7を確認してください。KPCマウスは、ヒトPDAC6の特徴を忠実に複製する疾患進行を有する膵腫瘍を自発的に発症する。しかし、すべてのトランスジェニックモデルに関しては、繁殖プログラムは高価であり、腫瘍の進行は可変であり、したがって、多くの場合、マウスの大きなコホートを必要とする。PDXモデルは、免疫不全マウスにおいて直交またはより頻繁に皮下に増殖される患者由来の腫瘍細胞または断片を使用する。異種移植片モデルは、治療化合物をスクリーニングするための有用なツールを提供し、患者の不均一性を説明します。しかし、それらは完全な免疫微小環境を提供しないので、彼らのアプリケーション8、9を制限します。
いったん確立されると、オルソトピック腫瘍は、通常、(使用される細胞株に応じて)成長するのに約1ヶ月以上かかり、超音波またはMRIによって容易に画像化され、進行を追跡し、治療有効性を決定することができる大きな腫瘍を形成する。しかし、一度指数関数的な成長で、腫瘍増殖の最終段階は迅速であり得るので、ほとんどの治療レジメンは比較的早く(例えば、14日)11、12に開始される。免疫系は、T細胞の相対的な貧弱性および骨髄細胞13の頻繁な存在を有する免疫抑制腫瘍浸潤を特徴とするPDACを含む腫瘍発達において重要な役割を果たす。PDACにおけるT細胞の高い存在は、より良い予後14、15を与える。しかしながら、単一剤として、抗CTLA-416および抗PD-L117などのT細胞免疫抑制を緩和する免疫チェックポイント阻害剤は、PDAC患者において臨床的利益を示しておらず、全体的なT細胞反応性が非常に低いためである可能性が最も高い。しかしながら、抗CD40などの主要なT細胞応答が抗PD-L1/CTLA-4耐性18、19およびGM-CSF分泌同種PDACワクチン(GVAX)によるワクチン接種を克服できる薬剤は、PDAC腫瘍20の免疫原性を高めることができ、T細胞応答を増強することが重要な治療手段を形成することを示す。
抗腫瘍T細胞応答に重要なのは、T細胞受容体(TCR)を介した腫瘍由来抗原の認識および細胞傷害性サイトカインおよび顆粒のその後の産生である。T細胞抗原認識はTCRシーケンシングによって決定できるが、このアプローチはコストと時間がかかる。しかしながら、腫瘍浸潤T細胞サブセットの定量は、抗腫瘍応答の良好な指標を提供する。脱顆粒、サイトカイン産生および他の細胞傷害因子の観点からT細胞活性ex vivoのさらなる検討は、より深い機能分析を提供する。これらのアッセイは、新鮮な腫瘍サンプルに対して行うことができ、T細胞機能の多くのパラメータは、フローサイトメトリーによって迅速に測定することができる。
CD8+およびCD4+T細胞は、免疫応答21を増強するIFNγおよびTNFαなどのサイトカインを産生する。IFN>は、標的細胞に対するMHCIアップレギュレーションを誘導し、免疫細胞の分化とリクルートを誘導し、細胞死を助ける。CD8+T細胞によるIFNγ産生は、抗腫瘍応答の一部であることを十分に特徴付け、腫瘍回帰22、23と相関する。TNFαは、CD8+およびCD4+T細胞の両方によって産生される別の炎症性サイトカインである。それはTCR依存的な活性化およびT細胞の増殖を高め、抗腫瘍応答を助する。TCR関与時に、細胞傷害性CD8+T細胞は脱顆粒を受けることができ、そこで細胞傷害性分子を含む分泌リソソームが免疫学的シナプスに放出され、標的細胞分解を引き起こす21。これらの分子には、標的細胞膜に結合するタンパク質であるPerforinが含まれ、膜の完全性を破壊し、グランザイムBのような他の細胞傷害性分子の拡散21またはエンドサイトーシス24を標的細胞の細胞質に直接浸着させる毛穴を形成する。グランザイムBは、標的細胞内の複数のタンパク質の分解を行うプロテアーゼであり、細胞死21につながる。このような分子の放出は、エンドソームの細胞表面へのエキソソームのエキソサイトーシスを必要とし、そこでエンドソームマーカーCD107a(LAMP−1とも呼ばれる)が細胞膜25に一時的に組み込まれる。
T細胞によるサイトカイン分泌の測定には、フローアシスト細胞選別またはビーズベースの分離アッセイによる単離が必要であり、多数のサンプルに対して同時に容易に行うことができない。しかし、細胞内サイトカインの測定は、事前分離ステップを必要とせず、一度に複数のサンプルに対して簡単に実行できるため、よりスループットの高いアプローチが可能です。サイトカインはT細胞によって急速に分泌されるため、細胞内レベルは検出不能であり、したがってT細胞は基底サイトカイン産生を増加させる刺激を必要とする。抗原駆動サイトカイン産生を評価するには、TCRによって認識される抗原をインビトロでプライミングされたAPCによってT細胞に提示されなければならない。抗原特異性が不明な場合には、広範な刺激アプローチが必要である。TCR刺激は、サイトカイン産生および増殖を誘発するTCR活性化および共刺激の両方を提供する抗CD3/28ビーズを用いて模倣することができる。しかし、より費用対効果の高い代替手段は、PMAとイオノマイシンの使用であり、細胞内サイトカインの合成および放出につながるシグナル伝達経路を広く活性化する。具体的には、PMAはプロテインキナーゼC(PKC)を活性化し、イオノマイシンは細胞内Ca2+イオンを上昇させ、細胞シグナル伝達の増加につながる。サイトカインの細胞内含有量を維持するために、この刺激は、ゴルジ内のタンパク質を遮断し、細胞外放出を防ぐタンパク質輸送阻害剤ブレフェルディンAおよびモネンシンと効果的に組み合わせることができる。PMA/イオノマイシンの使用は、T細胞を刺激するための確立された方法であり、細胞外放出と細胞内サイトカイン26との間に強い相関がある。PMAおよびイオノマイシンを用いたT細胞の刺激はまた、細胞膜へのリソソーム密売を増加させ、したがってCD107aは細胞表面に一過性に統合され、細胞内にリサイクルされる。刺激中に抗CD107a抗体を含むまでに、脱顆粒活性25のマーカーとして用いることができる。
この方法は、単細胞懸濁液を提供するために腫瘍を迅速に消化する。この時点で、個々の集団は、フローサイトメトリーのために直接染色されるか、または下流の方法によって精製することができる:フローアシスト細胞選別または磁気ビーズ分離。フローサイトメトリー分析のための単細胞懸濁液の調製は、複数の免疫細胞集団とその表現マーカーのハイスループット分析を可能にし、免疫細胞数および表現型の正確な定量を提供する。
最後に、ここで説明する消化プロトコルは、細胞表面マーカーの損失を防止し、免疫細胞の生存率を維持し、免疫細胞が必要に応じてさらなる細胞精製工程および培養を受けることを可能にする。しかしながら、この方法は、この消化から上皮細胞を導出するための試験されていない。
プロトコル
正形の膵腫瘍は、1986年の英国内務省動物科学処置法および欧州指令2010/63/EUに従って、前述の10に従って生成された。すべてのマウスは、体重減少(任意の期間で72時間または20%)を含むがこれらに限定されない痛みや苦しみの徴候のために周術的に監視された。ピロ勃起、目の狭窄、上げられた歩行、ハンチングされた外観、ならびに出血、発赤および潰瘍を含む創傷感染の徴候の徴候。腫瘍の増殖は触診によって監視され、終点の徴候に達したかどうかを評価するために、労体呼吸、黄疸および冷たい四肢のような追加の臨床徴候も監視された。すべての手順は、無菌条件で行う必要があります。フローサイトメトリー染色の前に使用されるすべての試薬は、無菌条件で調製されるべきである。
1. 注射用腫瘍細胞の調製
- -20°Cから基底膜のアリコートを取り、一晩4°Cで氷の上に置きます。
注:基底膜濃度はバッチごとに異なる場合があります。したがって、ロット特異的基底膜バッチは、再現性を確保するために生体内でテストする必要があります。基底膜の新しいバッチは、一晩で4°Cで氷上で解凍され、次いで、ユーザー定義のアリコート、氷上で引用し、さらに必要になるまで-20°Cで保存します。これにより、基底膜を使用する際のピペットや凍結解凍を最小限に抑えることができます。- 滅菌PBSを一晩4°Cに置き、冷やします。
- 滅菌200μLと1000 μLピペットチップを-20°Cで一晩冷やします。
- マイコプラズマフリーの腫瘍細胞を使用し、解凍後、収穫前の増殖の対数期に少なくとも2〜10の通路で増殖する。このプロトコルは、女性のマウスC57BL /6 KPC由来細胞株を使用しています: TB32048は、デビッド・トゥーブソンの研究室によって寛大な贈り物として提供されます.
- 腫瘍細胞が収穫に必要な場合は、フラスコから培地を取り出し、PBSで2回洗浄します(37°Cに予温)。
- 2xトリプシン(37°Cに予温)をフラスコに37°Cで10分間加えます(T175フラスコに5mLを加えます)。
- 10分後、フラスコを軽くタップし、培地でよく再サスペンドすることにより、フラスコと解細胞に完全な培地(10%FBS、1xペニシリン、DMEMの1xストレプトマイシン)の等量を追加します。
- 細胞をチューブに移し、遠心分離機を300 x gと室温(RT)で5分間移動します。
- 上清を取り除き、細胞カウント用の完全な培地で細胞を再サスペンドします。
- 細胞を300xgおよびRTで5分間再び遠心分離し、上清を除去した。
- 1x106細胞/mLの濃度を達成するために、事前に冷却されたPBSで細胞を再サスペンド。
注:このストック濃度は、5μlで1000細胞の最終的な注入濃度を達成するために調製される。我々は、低い注射量でより少ない数の細胞の注射が細胞漏れを最小限に抑え、したがって再現性を高めることがわかったが、腫瘍の増殖は細胞株に依存する可能性があるため、ユーザーは各細胞株を最適化する必要がある。
- これに沿って、氷の上に、事前に引用された地下膜アリコートをフードに置きます。
- 注射のために調製されたPBSにおける基底膜、PBSおよび腫瘍細胞の最終溶液の比率は5:3:2である。従って基底膜の500 μLのアリコートに、予め冷めた1000°Lピペット先端を使用して300°LのプレチルドPBSを加える。
- PBSを基底膜アリコートに直接加えて、ピペットを最小限に抑えます。
- p1000を300°Lに設定し、PBSと基底膜を再サスペンドし、液体状態の基底膜を維持するために氷上にチューブを保つようにしてください。
- p1000チップからすべての基底膜を排出し終わったら、チューブに先端を残して、任意の基底膜/PBSがピペット先端を下りるようにします。
- 5-10分後、p1000先端からより多くの基底膜をチューブに放出し、チューブを氷の上に置いたままにします。
- PBSで再懸濁腫瘍細胞の200 μLを取り、予め冷めた200°Lピペットチップを使用して基底膜に直接追加します。
- 新鮮な予冷p1000ピペットチップを取り、ピペットを300°Lに設定し、30〜40回再サスペンドします。低い容積に置かれるより大きいピペットの先端は、基底膜が先端を上に移動し、再中断の間にピペット先端フィルターに触れることができるので好ましい。
- 腫瘍細胞は注射の準備ができている。手術中は腫瘍細胞/基底膜を氷の上に置いてください。
2. 腫瘍細胞の直交局所注射
- 動物施設内のマウスを7日間順応させる。
- 手術前の約2時間は、腹部と背中の左側を剃り、その後、頸部の擦り傷の下で皮下に術前鎮痛薬を投与する(50-100μg/kgでブプレノルフィン)。
- 周囲の機器やマウスの上にマウスを置くためにヒートマットで、外科フィールドを準備します。すべての外科用具を殺菌する;マウスごとに十分なツールセットを用意します。
- マウスを5%のイソフルランにO2室で無意識になるまで置きます。
- マウスを背中に置き、ヒートマットの上に移し、マスクを使用して麻酔を維持します。
- 深い麻酔を確認します。後足がつままれ、呼吸数を監視するときのペダル離脱反射の損失によって識別されるように。
- 剃った部分だけを露出させたドレープで体を覆います。マウスが麻酔マスクにしっかりと入っていることを確認します。
- 滅菌綿棒を使用して、剃った領域の上に円形の動きでヨウ素溶液を追加します:中央から始まり、エッジに循環します。新鮮な綿棒とヨウ素でもう一度プロセスを繰り返します。
- メスを使用して、膵臓/脾臓の位置(左上の象限)の真上に1cmの切開を行います。滅菌は、好ましい場合は切開を行うために使用することもできる。
- 鉗子を使用して皮膚を引き離します。新しい鉗子を使用して、腹壁を見つけ、腹壁壁を通して別の1 cmの切開を行うためにはさみを使用しています。
- 脾臓に付属している可能性のある膵臓を、2番目の鉗子を使用して体から抽出する。
- 腫瘍細胞/基底膜のバイアルを数回軽く反転して混合します。
- 地下膜に1,000個の腫瘍細胞を含む5μLのガラスシリンジを準備し、ヒートマットの上に数秒置いて暖かくします。
注:シリンジの短い温暖化は、漏れることなく注入しやすくするために、基底膜が固化を開始することを可能にします。しかし、あまりにも長く放置すると、基底膜は完全に固化し、注入されません。ガラスシリンジの使用は低い容積を精密に注入することを可能にする。 - 膵臓を尾部に持って伸ばし、目に見える血管を避けるために膵臓自体と平行に膵臓の中心に直接針を挿入します。
注:膵臓の中心は広い面積があり、注入するのが最も簡単です。しかしながら、膵臓の頭部または尾部は、好ましい場合には特異的に注射され得る。 - 5°Lの基底膜を膵臓にゆっくりと注入し、注射後少なくとも30sは膵臓に針をしっかりと保持し、基底膜が固化して漏れを防ぎます。基底膜は、小さな透明な気泡が形成されているように見える必要があります。ただし、表示されない場合があります。
注:腫瘍細胞/基底膜のより大きなボリュームを注入することができます。ただし、漏れが発生しないように正確なボリュームをテストする必要があります。 - 膵臓から針を取り出し、出血が起こっていないか確認するのを待ちます。膵臓を腹腔にそっと挿入し、基底膜の泡に触れないように注意してください。
- 腹壁を一緒に引っ張り、必要に応じて単一の縫合糸、または2つの中断された縫合糸を実行します。
- 皮膚切開の両側を一緒に引っ張り、必要に応じて複数の中断された縫合糸を実行するか、2つの外科クリップを挿入します。
- ブプレノルフィンの別の皮下注射をスクラップに投与する。
- 新鮮なケージに戻す前に体温を維持するために、少なくとも30分間手術後に加熱された37°Cケージにマウスを移します。
- ケージで利用可能なマッシュダイエットを準備し、水分補給と体重を確保します。
- 推奨どおりに術後鎮痛を再投与し、創傷の開口部、痛みや感染症や体重減少の兆候を注意深く見守ります。外科クリップを使用する場合、これらはクリップ除去剤を使用して7〜10日後に除去することができる。
- 約14日後、瘢痕組織は腹部の触診を開始するのに十分に治癒しているであろう。マウスがエンドポイントに到達するまで触診を介して腫瘍サイズを注意深く監視します。
- エンドポイントでは、マウスは頸部脱臼を介してカリングされ、その後に切断されます。皮膚と腹腔は、はさみを使用して開かれ、膵腫瘍は鉗子を使用して切除し、周囲の組織を取り除くためにはさみを取り除く。
3. 膵腫瘍の消化
- 解剖した膵臓腫瘍、転移部位腫瘍、または健康な膵臓組織を氷冷PBSに入れ、氷の上に保存する。
- 鉗子を使用して、ペトリ皿に腫瘍を移します。
- 50 mL チューブに 5.0 mL の消化培地 (2 mg/mL コラゲナーゼ、 0.025 mg/mL DNase RPMI) を追加します。酵素活性の発生を防ぐために氷の上に保存します。
注:このプロトコルは、≥1単位/mg FALGPAと>125コラーゲン消化ユニット(CDU)/mg固体の活性を有するコラゲターゼタイプVを使用しています。コラゲナーゼおよびDNaseアリコートは-20°Cで保存し、使用前に氷の上で解凍することができます。両方とも滅菌RPMIで完全に可溶化されると、0.2μmフィルタを通して汚染物質を除去することができます。コラゲラゲアゼは、材料の損失を避けるために濾過する前に完全に可溶化する必要があります。 - ペトリ皿の腫瘍をカバーするために、この溶液の小さなアリコートを取ります。
- 無菌メスと鉗子を使用して腫瘍を小さく切断し、長さ約3mm未満にします。
- 腫瘍片をチューブに削り取り、すべての部分が消化媒体に沈むまでチューブを穏やかに反転します。他の腫瘍サンプルをバッチで調製する必要がある場合は、氷の上に保存します。
- 37°Cで20分間振とう装置に移す。腫瘍のすべての部分が水没し、チューブの端にくっついないことを確認します。振るのが不可能な場合は、消化を助けるために5分ごとにサンプルを渦。
4. 消化腫瘍からの単細胞懸濁液の調製
- 消化工程の直後に、氷の上にチューブを置いて酵素活性を遅くします。
- EDTAを加え、20mMの最終濃度を達成し、混合する簡単に渦サンプルを得ます。これは、酵素活性をさらに遅らせる。
- チューブを開き、新鮮なRPMI培地でチューブのふたから腫瘍消化をすすいでください。
- 氷上の50 mLのオープンチューブに70μmのストレーナー(ストレーナーのμmサイズを必要に応じて変更できます)を準備します。
- フィルターを中程度で事前に濡らします。
- 消化された細胞を再サスペンドし、25 mL以上のストライプを使用してチューブの側面を洗浄します。ストライネットの広い開口部は、厚いダイジェストが容易に通過できるようにするために重要です。
- 25 mL のストライプを使用して、すべてのダイジェストをストレーナーに転送します。
- 1 mLシリンジプランジャーを使用して、フィルターの上に腫瘍をマッシュ。マッシュアップは、細胞へのせん断応力を最小限に抑えるために、直接上下にだけ。
- RPMIでストレーナーを通して細胞を連続的に洗浄します。細胞を押し通すのに十分な力で洗ってください。
- まだマッシュする材料があるが、RPMIがフラッシュを停止した場合、ストレーナーは飽和状態になります。したがって、サンプルを新しいフィルターに転送し、続行します。
注:最終的には、細胞外マトリックス成分のみがフィルタに残り、すべての単一の細胞が通過する必要があります。
- 300 x gと 4 °C で 5 分間チューブを遠心分離します。
- 細胞ペレットを完全なRPMIで慎重に再懸濁し、別のフィルターを直接通過して、十分に再懸濁できない細胞外マトリックスまたは大きな細胞塊を除去します。
- この時点で、刺激が不要な場合は、ステップ6.1にスキップしてフローサイトメトリー分析のために単離された細胞を直ちに染色する。または、凍結培地(FBSでは10%DMSO)で再サスペンドし、-80°Cに保存し、その後、液体窒素中の長期保存を行います。
注:凍結ステップは、後日免疫細胞の精製を可能にすることができます。しかし、免疫細胞サブセットの定量化は、細胞番号と表現型が凍結/融解プロセスの影響を受けないことを確認するために最適化を必要とする場合があります。ex vivo T細胞刺激は、新鮮な腫瘍サンプルに対して行われるのが最善です。この時点で、試料は、必要に応じてビーズベースの死細胞除去または免疫細胞濃縮アッセイによってさらに精製することができる。
5. ex vivo刺激のための細胞の準備
- 細胞をカウントして、完全な培地(RPMI10%FBS、1Xペニシリンおよび1Xストレプトマイシン)で2x 10 6/100°Lの濃度を達成する。
注: めっきされた総セル数が多いため、このサンプル内に分析に適した T セルが存在することが保証されます。ただし、サンプルの可用性と関心のある T 細胞サブセットのまれな性質に応じて、数値をスケールアップまたはスケールダウンできます。- U底付き96ウェルプレート中の細胞のプレート100μL。
- PMA/イオノマイシンの2倍の調製物を含む100μLの完全な培地を追加します(メーカーの推奨に従って、それぞれ最終濃度0.081μMと1.34 μMを達成します)。
注:脱顆粒/エキソサイトーシスを測定する場合は、ここでも蛍光共役抗マウスCD107aを媒体に含める。CD107a を含まない制御サンプルも実行する必要があります。 - 37 °Cのインキュベーターに5%CO2を1時間入れ込んだ。
- ブレフェルジンAとモネンシンの10倍の調製物の20μLを追加し(最終的な濃度1.06μMと2.0 μMを達成するために、それぞれ(製造業者が推奨)完全な媒体に加えます。
注:ブレフェルディンAおよびモネンシンはタンパク質輸送阻害剤であり、したがってサイトカイン等の細胞外放出を遮断し、フローサイトメトリーによる検出を可能にする。ELISAまたは同様の方法によって上清へのサイトカイン放出を測定する場合 – このステップはスキップすることができます. - プレートを37°Cのインキュベーターに5%CO2で入れ、さらに4時間待ちます。
6. フローサイトメトリーのための細胞外および細胞内染色
- プレートを取り外し、各ウェルを再サスペンドして、すべての材料を氷の上に置いたV底のプレートに移します。
注:上皮細胞、マクロファージおよび他の付着細胞は、再中断によって完全に取得されない場合がある。しかし、下流解析はT細胞上のみであるため、これは問題ではありません。- 6.1.1 300 x gおよび 4 °C でプレートを 5 分間遠心分離します (特に記載がない限り、後続の手順にこれらの条件を使用します)。
- 1回の鋭い動きでプレートを逆さまにフリックして上清を取り除きます。
- 固定可能な生存率色素を50μLで再サスペンドし、氷冷PBSで調製する。再サスペンドする場合は、ピペットを低いボリュームに設定して、泡を作らないようにします。
- 暗闇の中で4°Cで20分間インキュベートする。
- 洗浄工程:FACS緩衝液を100μL加え、遠心分離機を加え、上清を取り除きます。
- FACSバッファー(PBSでは0.5%BSA、2.0 mM EDTA)で50μLの抗CD16/CD32(2.5μg/mL)で各ウェルを再サスペンドし、Fc受容体に対する検出抗体の非特異的結合をブロックします。
- 暗闇の中で4°Cで15分間インキュベートする。
- FACSバッファーにフルオロクロム共役抗マウスCD45、CD3、CD4およびCD8(さらに細胞外マーカーを必要に応じて追加することができます)の2xマスターミックスを各ウェルに直接追加します。
- 暗闇の中で4°Cで30分間インキュベートする。
- 洗浄工程:FACS緩衝液を100μL加え、遠心分離機を加え、上清を取り除きます。
- 1x細胞内(IC)固定バッファーの100 μLを追加し、暗闇の中でRTで30分間インキュベートします。
- RTで遠心分離機を準備します。
- FACSバッファを100μL加え、300 x gとRTで5分間遠心分離機を加え、上清を取り除く。1x透過バッファーと遠心分離機を 300 x gで 5 分間繰り返します。その後、上清を削除します。
- フルオロクロム共役抗マウスIFNγ、TNFα、および1x透過バッファーで調製した他の細胞内マーカーの1xマスターミックスの50μLを追加します。
- 暗闇の中で、RTで1時間インキュベートします。
- 100 μLの透過バッファーを加えた洗浄液を洗浄します。その後、300 x gとRTで5分間遠心分離し、上清を除去する。
- 100 μLのFACS緩衝液を加えて洗浄し、300 x gとRTで5分間遠心分離機を行い、上清を取り除きます。
- この最終遠心分離の後、フローサイトメーターと互換性のある体積で細胞を再サスペンドする。FACSチューブの大きさによって異なる場合があります。
- このボリュームを適切な FACS チューブに転送して取得します。
- 光から覆い、冷蔵庫に保管し、24時間以内にサンプルを入手してください。
結果
膵臓に1000 TB32048細胞を注入した後、直交話題性腫瘍の発症には約30日かかります(図1A,B)。手術中の基底膜漏出は、皮膚を通して顕著に見える腹膜壁に直接大きな腫瘍を形成させる可能性がある(図1C)。我々はこれらのマウスを研究から取り除くだろう。しかし、良好な外科的スキルを有する場合、漏出の発生率は最小限に抑えられる。エンドポイントで採取された直交腫瘍は、C57BL/6野生型マウスにおいてかなりの大きさに成長する可能性がある(図1D)。収穫されたオルトトピック腫瘍は、単一細胞懸濁液を達成するために20分間コラゲナーゼ/DNaseで消化を必要とする(図2)。この時点で、腫瘍由来細胞は、2 x 106細胞/ウェルでU底板にめっきすることができる。めっきされた細胞の数は、サンプル内のT細胞の有病率に応じて変更することができます。T セルの密度が高い場合は、セル番号を小さくすることができます。コントロール脾臓またはリンパ節サンプルは、刺激のためにこの時点でめっきすることもできる。各ウェルは、5時間のPMAおよびイオノマイシンで刺激され、1時間インキュベーション後に、ブレフェルジンAおよびモネンシンがサイトカインの細胞外放出を遮断するために添加される(図2)。インキュベーション後、フローサイトメトリーによる分析のために細胞外エピトープおよび細胞内サイトカインのサンプルを染色する(図2)。
正形トピック腫瘍を有するマウス由来の脾臓および腫瘍のサンプルをフローサイトメトリーにより分析した。脾臓および正形トピック腫瘍のフローサイトメトリー分析で使用されるゲーティング戦略は、FSC-A、SSC-A、FSC-A/FSC-HおよびSSC-A/SSC-Wによるダブレットを使用して破片を除外し、その後、固定可能な生存性色素の陽性として死細胞またはアポトーシス細胞を除く(図3A)。次に、免疫細胞を CD45+としてゲートし、さらに CD3+ としてゲートされた T 細胞は、そこから CD4+および CD8+サブセットが定義されます (図 3A)。蛍光マイナス1(FMO)は、ゲーティングのためのバックグラウンド蛍光を決定するために行われ、ブレフェルジンA/モネンシンのみの制御は、サイトカインの基底産生を決定するために行われる(図3B-D)。
IFNγの場合、ブレフェルニンA/モネンシンによるインキュベーションは、脾臓および腫瘍サンプルの両方でFMO制御上のIFNγの増加を生じなかった。しかし、PMAとイオノマイシンの添加は、脾臓および腫瘍由来CD4+およびCD8+T細胞の両方で検出可能な細胞内IFNの%を増加させた。
脾臓CD4+およびCD8+T細胞は、陽性対照として使用され、腫瘍浸潤T細胞サブセットよりも比較的高いIFNγ産生を有し、平均6.60±1.5%および12.97±3.4%と比較して、4.81±1.0%および4.13±1.3%と比較して、腫瘍内で免疫抑制が起こることを示す(B3および図3)。TNFαについても同じ戦略を用いて、脾臓CD4+T細胞の割合が高い割合で細胞内TNFα(65.93±2.3%)が腫瘍浸潤CD4+T細胞(22.45±5.4%)と比較して陽性であることを可視化しました。脾臓および腫瘍浸潤CD8+T細胞は、TNFα(25.15±3.7%および19.91±5.1%それぞれ)の類似レベルを産生する(図3C、図4B)。
最後に、CD107aは、細胞傷害性顆粒およびサイトカインのエキソサイトーシスの間に細胞表面上に一過性に発現される内染色マーカーであり、そのように、細胞傷害性の代理マーカーとして使用される。刺激中のCD107aの染色の利点は、すべての一過性細胞表面発現CD107aが蛍光抗体によって捕捉されることです。CD107aの基底レベルは、ブレフェルジンA/モネンシンのみ処理された細胞に示されている。脾臓CD8+T細胞の場合、PMA/イオノマイシンによる刺激は検出されたCD107aのレベルを増加させ、CD8+細胞において最も強いアップレギュレーションが23.95±3.5%CD107a+であったが、腫瘍浸潤CD8+細胞では5.8±1.9%と比較して、脾臓CD8+より大きな減少率を有していた。一方、脾臓および腫瘍浸潤CD4+CD107a 9.37±1.5%及び11.50±1.8%の同等のレベルを発現した(図3D及び4C)。
全体的にこれらの結果は、膵臓への腫瘍細胞の非常に低い数(1,000)の注入から直交トピック腫瘍を生成できることを明示する。これらの腫瘍は、ex vivo刺激のためのT細胞の単離のために迅速に消化することができる。細胞内サイトカインの検出が可能であり、二次リンパ球器官におけるT細胞と比較して、浸潤T細胞の免疫抑制の基礎レベルを強調する。
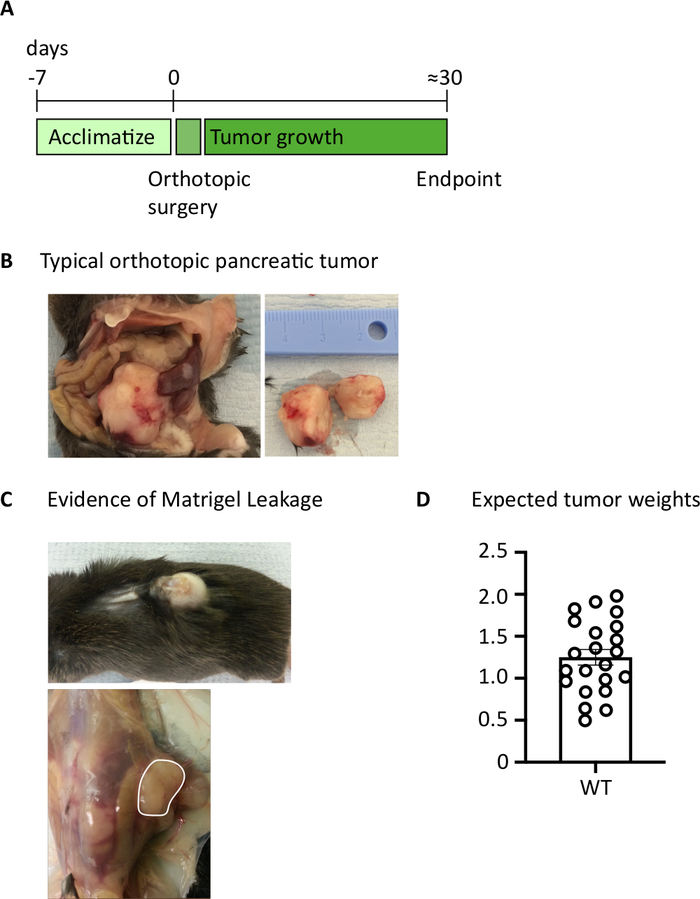
図1:正形性膵腫瘍の生成(A)生体内実験のスケジュール。(B)示された腫瘍が半分に切断された腹腔内の直交腫瘍(左)および切除後(右)のマクロ的な外観。(C)手術中の基底膜漏れの証拠は、皮膚を通して見える腫瘍を発症させ(上の写真)、腹膜壁に形成する(下の写真)。(D)終点に達したマウスから採取した直交膵腫瘍重量(n=22)。各データ点は個々のマウスを表し、棒グラフは平均±SEMを示す。この図のデータは、以前に公開された作品10から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
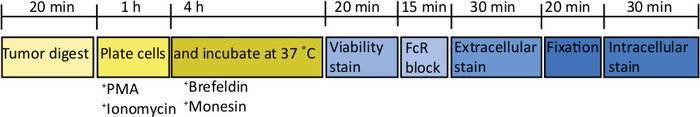
図2:ex vivo T細胞刺激のための直交トピック腫瘍の処理の概略図収穫後、膵臓腫瘍はコラゲナーゼ(2mg/mL)およびDNase(0.025 mg/mL)で37°Cで20分間急速に消化されます。その後、細胞は完全なRPMI媒体で2 x 106/mLで再懸濁され、U底のプレートでめっきされる。PMAおよびイオノマイシンの刺激カクテルを5時間添加し、その時点で抗マウスCD107a抗体を培養物に添加することもできる。細胞内輸送遮断薬を1時間インキュベートした後、ブレフェルジンAおよびモネンシンが添加される。ex vivo刺激後、細胞は固定可能な生存率色素(PBS中)で染色するためのV底板に20分間4°Cで移される。細胞をFACS緩衝液で洗浄し、抗CD16/32(FcRブロック)で15分間(FACS緩衝液中)インキュベートし、さらに30分間細胞外蛍光共役抗体でインキュベートする(FACS緩衝液中)。細胞は再びFACS緩衝液で洗浄され、細胞内固定緩衝液中で20分間再中断される。この後、細胞はFACS緩衝液で1回、1x透過バッファーに1回洗浄される。細胞は、細胞内蛍光共役抗体中のRTで1時間(1x透過緩衝液中)に再懸濁される。細胞は1x透過バッファーで1回洗浄され、FACSバッファで1回、24時間以内のフローサイトメーターで取得するためにFACSバッファに再サスペンドする前に1回洗浄されます。
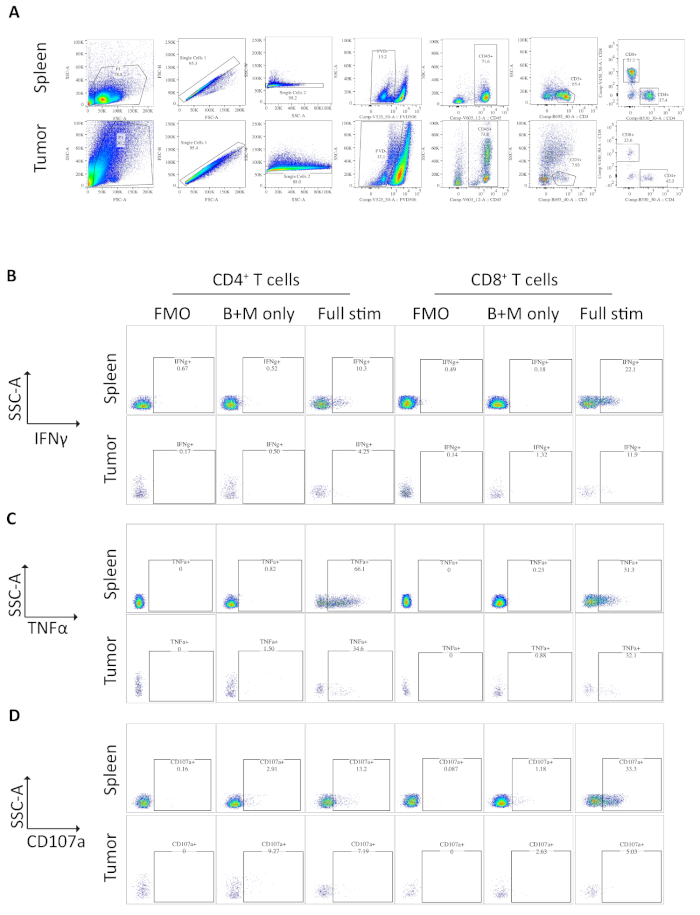
図3:ex vivo刺激脾臓および腫瘍由来T細胞のフローサイトメトリー分析(A)脾臓(陽性対照)および正形腫瘍サンプルに使用されるフローサイトメトリーゲーティング戦略。細胞はFSC-A/SSC-Aを使用して破片から分離され、単一の細胞はFSC-A/FSC-HおよびSSC-A/SSC-Wを使用してさらに単離される。死んだ細胞またはアポトーシス細胞は、固定可能な生存率色素-FVD506を使用して除外され、免疫細胞はCD45+によってゲートされる。このCD3+T細胞およびCD4+およびCD8+サブセットの後に定義される。データはBDフォルテッサで取得されました。(B) IFNγ+ CD4+および CD8+ T細胞を定量するために使用されるゲーティング戦略。蛍光マイナス1(FMO)コントロールは、完全に刺激されたサンプル(PMA/イオノマイシン/ブレフェルディンA/モネンシン)で使用され、バックグラウンド蛍光を決定します。ブレフェルジンA/モネンシンのみの制御(B+Mのみ)は、基底サイトカイン産生を決定するために使用される。その後、完全に刺激されたサンプルを使用して%IFNγ+T細胞を計算します。(C)TNFα+ CD4+および CD8 + T細胞を定量するために使用されるゲーティング戦略。FMOコントロールは、完全に刺激されたサンプル(PMA/イオノマイシン/ブレフェルディンA/モネンシン)で使用され、バックグラウンド蛍光を決定します。ブレフェルジンA/モネンシンのみの制御(B+Mのみ)は、基底サイトカイン産生を決定するために使用される。その後、完全に刺激されたサンプルを使用して、% TNFα+T細胞を計算します。(D) CD107a + CD4+および CD8+ T 細胞の定義に使用されるゲーティング戦略。FMOコントロールは、完全に刺激されたサンプル(PMA/イオノマイシン/ブレフェルディンA/モネンシン)で使用され、バックグラウンド蛍光を決定します。ブレフェルジンA/モネンシンのみのコントロール(B+Mのみ)を使用して基礎脱顆粒を決定します。その後、完全に刺激されたサンプルを使用して%CD107a+T細胞を計算します。フローサイトメトリーデータはすべてFlowJoバージョン10.6.1で分析されました。この図のデータは、以前に公開された作品10から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
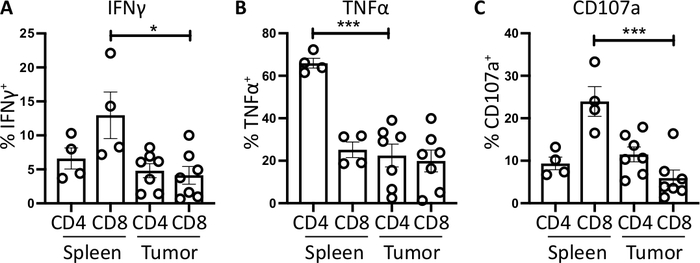
図4:ex vivo脾臓および腫瘍由来T細胞活性の定量。CD4+及びCD8+T細胞の陽性(A)IFNγ+及び(C)CD107a+に対する陽性の割合を、正形腫瘍軸受マウスの脾臓(n=4)及び腫瘍(n=7)で定量した。各データポイントは個々のマウスを表し、誤差範囲は平均±SEMを表示します。すべてのデータはプリズム8を使用して分析された。この図のデータは、以前に公開された作品10から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
膵臓癌の生体内モデルは、疾患の進行を理解し、新しい治療薬の標的を評価するための貴重なツールを提供します3.特にオルソトピックモデルは、マウスの大きなコホートに同時に適用できる費用対効果の高い再現性の高いモデルである4、27である。オルソトピックモデルはまた、腫瘍増殖のための認知微小環境および無傷の免疫系を提供し、皮下およびPDXモデルよりも適切である。しかしながら、免疫浸潤のいくつかの要素は、オルソトピックモデルとKPCマウスとの間で異なっていくことができることを発見した、金標準マウスモデル10。この理由の1つは、オルソトピックモデルに見られる加速腫瘍増殖である可能性がある。免疫細胞サブセットの密度のさらなる違いは、オルソトピックモデルと皮下モデル3、28との間に記載されている。したがって、トランスジェニックKPCモデルはより高価で可変6ですが、可能であればKPCマウスの小さなコホートで主要な所見を検証する必要があります。
オルソトピック手術のための腫瘍細胞の調製は、プロトコルの重要なステップである。細胞は常に増殖の対数段階にあり、マイコプラズマと感染のないものでなければなりません。腫瘍細胞の増殖に懸念がある場合は、直交外科手術を延期すべきである。基底膜の使用は、それ29なしで注射細胞上の腫瘍発生率を改善し、したがって、細胞漏出を減少させ、したがって腹膜広が27。しかし、一度基底膜に懸濁すると、腫瘍細胞は細胞損失を避けるために迅速に注射されるべきである(2時間以内)。腫瘍を生成するために必要な腫瘍細胞の数は、細胞株依存性である可能性が高く、細胞番号の範囲(例えば、100〜100,000から)をテストする必要があり、これはエンドポイントに到達する時間を決定することもあります。注射のためにマウスあたり1,000細胞を準備する際に誤差のマージンがある可能性があります。したがって、複数の日数の手術が必要な場合は、バッチ効果を制御するために、グループの治療を数日にわたって均等に分散する必要があります。ほとんどの外科的ステップは、好みに応じて変更することができます。しかし、腹腔内の膵臓を交換したり、腹壁を閉じたりする際には、基底膜を乱さないように注意する必要があります。基底膜漏出は腹膜壁に腫瘍細胞の増殖を引き起こし、急速に形成され、動物を早期に犠牲にしなければならないことがある。
理想的には、膵臓腫瘍は、収穫後に迅速に消化し、すぐにex生体内刺激のために調製されるべきである。しかし、収穫する腫瘍の大きなバッチがある場合、これは不可能な場合があり、この場合、腫瘍は氷上に保持し、バッチで消化する必要があります。消化酵素への曝露の種類、濃度及び長さは、いずれも免疫細胞30、31、32上の多数の表面分子に影響を及ぼすことが示されている。消化時間も意図的に短く、細胞死33を制限する。消化された細胞は、長期保存のための凍結培地で凍結することができます。ただし、解凍時に一部の細胞損失が発生します。コラゲターゼインキュベーションの前に腫瘍片が十分にダイシングされていない場合、消化プロセスは最適以下であり、これは消化後に硬い腫瘍片がフィルターに残ることを明らかにするでしょう。コラゲターゼ濃度は、健康な膵臓または初期の腫瘍で働く場合に低下させることができる;健康な膵管細胞の抽出に関する報告は、有意に低い濃度34を使用する。高い程度の上皮細胞死は消化中に期待される。しかし、免疫細胞は、プロセスを十分に許容する必要があります。オルガノイド増殖35に対して生存可能な上皮細胞を単離するか、または組織アーキテクチャ36を保存するための代替方法が存在する。
刺激プロトコルに対する改変は、分析された所望の読み出しおよび免疫細胞(例えば、マクロファージまたはB細胞)に応じて容易に行うことができる。汎刺激試薬PMA/イオノマイシンの使用はTCR抗原特異性を区別せず、抗原が知られていない場合に有用である。しかしながら、IFNの産生はTCR関与37と密接に関連しており、IFN及びTNFα産生の両方がPDAC抗腫瘍応答38において重要である。PMA/イオノマイシン刺激は、腫瘍微小環境内のT細胞によって産生される場合と産生されない場合があるサイトカインを産生するT細胞の最大容量を反映する。内因性の生産は、刺激を必要とせずに測定することができます。ただし、レベルははるかに低いか、検出できない場合があります。T細胞を刺激する別の方法があります:抗CD3/28コーティングビーズは、抗原や実際に他の免疫細胞集団を必要としません。この方法の利点は、分離方法を必要とせずに特定のT細胞サブセットによるサイトカイン産生の定量を可能にする。細胞傷害性の他のマーカー(グランザイムBおよびペルフォーリンA)、活性(IL-2)または免疫抑制(IL-10)も21を添加することができる。しかし、高品質のフローサイトメトリー抗体は、すべてのサイトカインおよび関心のある因子を検出するために利用できるわけではありません。従って、ELISAのような他の用途がある場合、ブレフェルジンA/モネンシンを含めずに刺激を行うことができ、サイトカインを上清に放出することを可能にする。しかし、これは総細胞サイトカイン放出を可能にし、どの細胞集団が寄与しているかを決定することはできない。
IFNγ産生は、抗腫瘍T細胞応答の主要な特徴であり、TCR抗原認識37、38の代用としてしばしば用いられる。抗原特異的応答をより正確に定義する他の生体内法は、オボアルブミンまたはSV40などの公知の抗原を発現する腫瘍細胞を利用する。普遍的な抗原は、T細胞認識をテストするために、またはTCR制限された宿主マウスと組み合わせてテストするためにex vivoを使用することができる。あるいは、抗原が不明な場合には、T細胞クローン拡張の定量は、バルクTCRシーケンシング、または最近では単一細胞TCRシーケンシング39、40によって行うことができる。腫瘍内T細胞応答の状態を完全に理解するために、疲労または阻害受容体を示すマーカーも測定されるべきである:CTLA-4、PD-1、LAG-3、TIM3、2B4。エフェクターT細胞のマーカー(CD44 hi、CD62lo)および増殖活性と同様に、Ki67+またはCSFE希釈41、42、43、44。全体的に、オルソトピックモデルは、治療戦略を迅速にテストするための有用なプラットフォームを提供し、特に抗腫瘍T細胞応答を調節し得る、トランスジェニック、KPC、マウスのより小さなコホート上で検証することができる。
開示事項
著者たちは何も開示する必要はない。
謝辞
動物技術者サービスとアルツベタ・タラロヴィコワ博士(バーツがん研究所、ロンドン、ロンドン、イギリスのクイーンメアリー大学)は、オルソトピック手術中の彼らの援助に感謝したいと思います。また、ジェニファー・モートン博士(英国グラスゴー・グラスゴーがん研究所)の外科技術に関する指導をいただき、クリスティーナ・ギレリ博士(バーツがん研究所、ロンドン、ロンドン、ロンドン、イギリス)の腫瘍消化に関するアドバイスとファビエンヌ・マクラナハン博士(バーツがん研究所、ロンドンのクイーン・メアリー大学)に感謝申し上げます。 また、医学研究評議会(MRC)、膵臓がん研究基金(PCFR)、卵巣がんアクションのご協力にも感謝申し上げます。
資料
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542 (2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436 (2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120 (2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved