Method Article
消化管オルガノイドの遺伝子工学のための汎用的かつ効率的なエレクトロポレーションプロトコル
要約
このプロトコルは、より大きなプラスミドを有する4つの異なる胃腸オルガノイドエンティティのトランスフェクションのための効率的なエレクトロポレーション法を記述する(10kBの範囲)。それは1日以内に行うことができるし、広範な準備または特別な、費用を要するエレクトロポレーションの緩衝液を必要としない。
要約
エレクトロポレーションは、形質膜の電気透過による分子の種類の異なる種類を持つトランスフェクションのための一般的な方法です。近年、一次患者材料の培養方法としてオルガノイドの使用が増加する中、この3D培養システムにおける遺伝子工学のための成分の効率的な伝達方法が必要とされている。特にオルガノイドの場合、遺伝子操作の効率はトランスフェクションの成功に依存します。したがって、このプロトコルは、オルガノイドのエレクトロポレーションを促進し、異なるエンティティでその普遍的な機能を証明するために開発されました。ヒト大腸、膵臓、肝癌オルガノイドは、比較して小さくて大きなプラスミドで正常にエレクトロポレートされた。GFP符号化ベクトルに基づいて、トランスフェクション効率はFACSによって決定された。細胞の広範な調製または特別な、費用を要するエレクトロポレーションバッファーは必要とされず、プロトコルは1日以内に行うことができる。
概要
近年、オルガノイドと呼ばれた新しい3D細胞培養系が、種々の正常および癌組織に対して開発された。オルガノイドは、機能的および形態学的に起源の組織に非常に近い。それらは、異なる種から生成することができ、容易に拡張可能であり、遺伝的に安定し、遺伝的に変更可能であり、遺伝子調査1、2、3のための理想的なモデルシステムとなる。CRISPR(クラスター化された定期的に間隔を空けた短いパリンドロームの繰り返し)/Cas9システムのような遺伝子工学的な技術は、多様な操作を可能にする。クローンの選択は、定義された培地条件、例えば、APC(アデノマトーシスポリポシス・コリ)ノックアウトクローン4、5のWNTリガンド離脱によって実現することができる。あるいは、選択マーカーは、標的ベクトル6、7の相同指向修復によって導入されなければならない。多くの場合、複数のプラスミドを導入する必要があるという事実のために、効率的なトランスフェクションが重要なパラメータになります。さらに、非特異的なオフターゲット効果を低減するために、Cas9エンドヌクレアーゼの一過性発現が望ましい8。
エレクトロポレーションは、DNA、RNA、タンパク質、その他の高分子で細胞をトランスフェクトする比較的簡単な方法です。電気パルスによって、細胞膜はより透過性になり、取り込み増加を引き起こす9.以前に公表された大腸オルガノイドのエレクトロポレーションプロトコルではピギーバクGFP(緑色蛍光タンパク質)発現ベクター(7.4kB)を用いて30%効率で4日間の手順10に達した。以下のプロトコルは、単一ガイドRNA(sgRNA)およびCas9エンドヌクレアーゼ配列(例えば9.3kbのベクターとしてのpx458)をコードする大きなプラスミドを用いる癌性または健康なオルガノイドの効率的なトランスフェクションを促進するために開発されました。電気穿孔プロセス全体は、特別なエレクトロポレーションバッファーなしで、そして異なる胃腸小器官、すなわち膵管腺癌(PDAC)、大腸癌(CRC)、胆管癌(CCC)および胃癌(GC)オルガノイドの間で少なくとも同等の効率で、1日以内に行うことができる。
プロトコル
倫理承認は、TUドレスデン(#EK451122014)の倫理委員会から得られました。
1. オルガノイド培養とエレクトロポレーション前の準備
- 前述したように組織消化によってオルガノイドを確立し、それらを地下マトリックスに対応するエンティティ固有の培養培地で拡張する(概要表1および材料表を参照)11,12,13,14,15,16,17.
注:ヒト組織サンプルの場合は、倫理委員会による研究の同意と承認が必要です。 - プレウォーム 48 ウェルプレート 37 °Cで、後エレクトロポレーションシード用。
- 抗生物質を用いた基礎培地と、10 μM Y-27632および3 μM CHIR99021を含む、抗生物質を用いたエンティティ固有のオルガノイド培養培地(表1を参照)を準備する。
注:抗生物質の撤退は、毒性効果を減らすために重要です。Y-27632およびCHIR99021は細胞回復10を改善する。 -
オルガノイドの調製(図1参照)
- 培養液中のエレクトロポレーションサンプルあたり48ウェルプレートでオルガノイド5ウェルを培養する。
注:増殖性オルガノイドは(最後の分割後2〜3日)使用する必要があります。 - 1ウェルあたり10 μM Y-27632を含む解離試薬230μL(材料表を参照)を準備します。
- 各ウェルから培養液を取り出し、調製した解離混合物の230μLでオルガノイドを機械的に解離する。1つの15 mLチューブに電気ポレーションサンプルあたり5ウェルをプールします。
- ボルテックスを混合し、10-15細胞のクラスターが発生するまで、37°Cで5〜15分間インキュベートします。そこで、解離をマイクロスコピカルにチェックする。10 mLまでの抗生物質を使用して基底培地を添加して消化を停止します。
注: この手順は非常に重要です。インキュベーションが短すぎるとエレクトロポレーション効率が低下しますが、消化が長いと生存性が低下します。 - 室温で5分間450 x gで遠心分離し、上清を捨て、4 mLのエレクトロポレーションバッファーで2回洗浄します(材料表を参照)。
- 培養液中のエレクトロポレーションサンプルあたり48ウェルプレートでオルガノイド5ウェルを培養する。
2. エレクトロポレーション
注: 次のプロトコルは、正方形の波が可能なエレクトロポレーター、および分離されたポーリングおよび転送パルスシーケンス用に開発されています(図2を参照)。必要に応じて、インピーダンス値、ならびにサンプルに伝達される電圧、電流およびエネルギーを再現可能な実験のための制御として測定することができる。
- オルガノイドペレットを100 μLのエレクトロポレーションバッファーに再懸濁し(材料表を参照)、30 μgのプラスミドDNAを含む。
注:使用したプラスミドDNAの濃度は、エレクトロポレーションプロセス中に最適な塩濃度を得るための5μg/μLを超える必要があります。したがって、ベクトルの調製のためのendofreeプラスミドマキシキット(材料表を参照)をお勧めします。細胞毒性効果なしで、最大45μgのDNAを使用することができます。 - 完全なDNAオルガノイド混合物を、気泡を生成することなく、2 mmギャップ幅のエレクトロポレーションキュベットに分配します。
- Fujii et al.10に従ってエレクトロポレーションパラメータを設定します(表 2、図 2を参照)。
- カヴェットを指でたたき、泡を起こさずに細胞を少し混ぜます。キュヴェットをキュベットチャンバーに入れます。
- エレクトロポレーターのΩボタンを押し、インピーダンス値を書き留めます。
メモ:30~40Ωのインピーダンスが最良の結果を示しました。一般的には、30~55Ωの範囲にする必要があります。この場合、以下の側面を制御してください:使用するキュベットのギャップ幅、エレクトロポレーターのケーブル接続、可能な気泡、エレクトロポレーション混合物の正しい体積と塩濃度。 - スタートボタンを押してエレクトロポレーションプログラムを実行し、表示される電流、電圧、エネルギーの値を制御します。
注:測定された電圧、電流、エネルギーの値は、設定されたエレクトロポレーションパラメータに対応する必要があります。繰り返し実験の比較のために、これらのデータをメモすると役に立ちます。 - エレクトロポレーション後、直ちに500 μLの抗生物質を添加します(CHIR99021およびY-27632を使用)。白い泡を解きそめるために上下にピペットで混ぜます。
メモ:白い泡は、エレクトロポレーションプロセスの後に現れ、かなりの数のセルが付いています。だから、解離は細胞を失わないために非常に重要です。 - エレクトロポレーションキュベットに属するピペットを使用して、サンプルをキュベットから新しい15 mLチューブに完全に移します(材料表を参照)。基礎培地でキュベットを再度洗い込むには、残りの細胞を得ることをお勧めします。
- 細胞の再生のために、室温で40分間インキュベートする。
3. 細胞の播種
- 室温で5分間450 x gで細胞を遠心分離し、上清を捨てます。
- ペレットを地下マトリックスの100 μLに再懸濁し、前温された48ウェルプレートに20 μLの滴をシードします(ステップ1.2を参照)。重合のために37°Cで10分間インキュベートし、Y-27632とCHIR99021を加えた培養培地を250μL添加し、次に増殖したオルガノイドの分裂(約5〜7日)まで添加する。
4. トランスフェクション効率の測定
注:一般的に、トランスフェクション制御として蛍光マーカーを持つベクターを電解することをお勧めします。選択したマーカーとそのクロモフォア成熟に依存して、蛍光はトランスフェクション18の約24〜48時間以内に見える。
- トランスフェクションコントロールで24-48時間経過した後に蛍光をマイクロスコプで確認します(図4Bを参照)。
-
蛍光活性細胞走査(FACS)
- ステップ1.4.2-1.4.4に類似して細胞を収穫し、単一の細胞が存在するまで10〜20分程度消化します。リン酸緩衝生理食塩分(PBS)を最大10mL添加します。
- 室温で5分間450 x gで遠心分離し、上清を捨てます。
- 必要に応じて、生細胞の識別のために:1 mLのリン酸緩衝生理食塩基(PBS)にペレットを再懸濁し、適切な抗体(材料表参照)またはヨウ化プロピジウム(PI)を加える。非常に慎重にタップして、暗闇の中で室温で30分間インキュベートすることによって非常に慎重に混合します。10 mLのPBSで洗浄し、遠心分離機を使用し、上清を捨てます。
- 細胞ペレットを200 μLのPBSに再懸濁し、必要に応じて100μmの細胞ストレーナーを通してFACSチューブに懸濁液を濾過します。
- 適切なgating戦略を使用してFACSマシンでセルを分析する(図3を参照)。図4A)とトランスフェクション効率を決定する。
結果
4種類の癌体(CRC、CCC、PDAC、GC)のオルガノイドを、小さなプラスミド(pCMV-EGFP、4.2kb)または大きなプラスミド(px458、9.3 kb)の30μgを用いて少なくとも3回電気泳電を行った。両方のベクターはGFPカセットを運び、フローサイトメトリーによるエレクトロポレーション後のトランスフェクション効率48時間の決定を可能にする。生細胞のみを分析するために、スキャン前に死死性抗体で染色を行った。gating の方針を図 3に示します。
4.2 kBサイズのプラスミドを大きい方のプラスミドに比べて高い効率でトランスフェクトした4つの全てのオルガノイド体で(図4参照)。小プラスミドの最も効率的なトランスフェクションは、92.1 ± 5.2 % GFP陽性細胞を有するPDACオルガノイドで到達し、一方、大プラスミドは46.7±3.7%の効率でトランスフェクトされた(平均±標準偏差、n=3)。膵臓癌オルガノイドと比較して、より大きなプラスミドは、平均効率53.4±11.7%のCRCオルガノイドに効率よくトランスフェクションされ、小さなプラスミドは84.3±5.8%の平均効率でトランスフェクションされた。トランスフェクションする最も困難なエンティティは胃癌オルガノイドでした:大プラスミドと小プラスミドの両方について、このエンティティで最も低いトランスフェクション効率に達しました(それぞれ32.3±12.7%および74.1±5.5%)。CCCオルガノイドは、小プラスミドと大プラスミド39.5±10.4%に対して83.0±13.1%の平均トランスフェクション効率を示した。
概念実証として、ヒト正常胃オルガノイドは、Cas9、GFPおよびTP53を標的とする2つのsgRNAに対するpx458_Conc2プラスミドコードで電気泳動された。エキソン8でのCas9誘導二本鎖切断は、非相同的なエンド接合(NHEJ)によって修復され、フレームシフトと結果的に遺伝子のノックアウトをもたらした(補足図1参照)。
表1:基底培地、消化混合物および栽培媒体の組成。このファイルを表示するには、ここをクリックしてください (右クリックしてダウンロードしてください)。

表2:藤井らのエレクトロポレーション設定10.
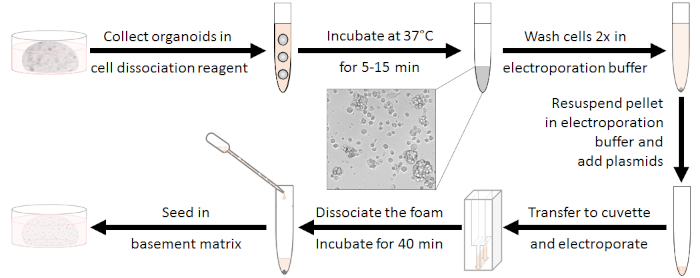
図1:エレクトロポレーション準備ワークフローまず、オルガノイドは10〜15個の細胞のクラスターに解ソシエスされるべきであり、抗生物質は洗い流されるべきである。エレクトロポレーション後、白い泡は解き起きする必要があります。細胞は、室温で40分間再生した後に播種することができる。この図の大きなバージョンを表示するには、ここをクリックしてください。
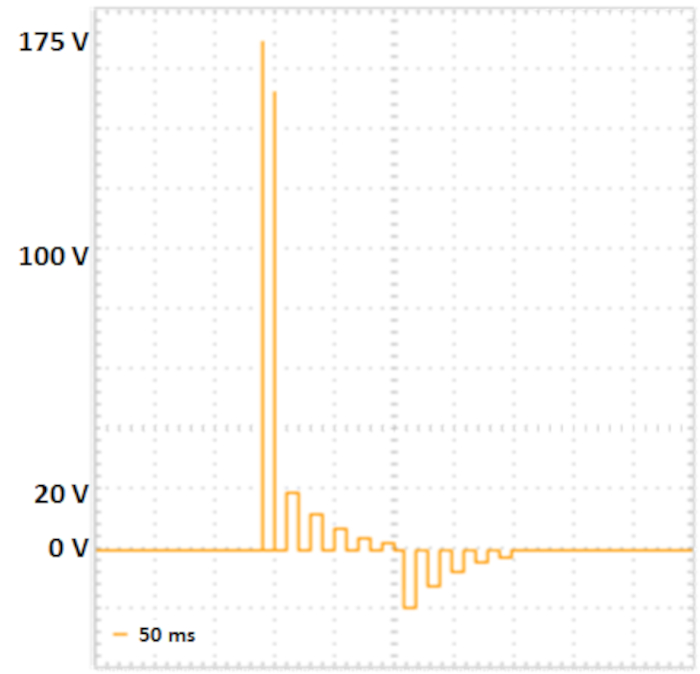
図2:2段階エレクトロポレーション。より高電圧のund短い持続時間(175 Vおよび157.5 V、それぞれ5 ms、50 ms、電圧減衰10%)の2つのポーリングパルス細胞膜の毛穴の形成につながる。次の伝達パルスは、細胞にDNAを送達します: 5つの正の伝達パルス (20 V、 12 V、7.2 V、4.32 V、2,592 V、それぞれ50 ms、50 ms、電圧減衰40%、5極性交換転送パルス(20 V、12 V、7.2 V、4.32 V、2,592 V、それぞれ50 ms、電圧40%)が続きます。この図の大きなバージョンを表示するには、ここをクリックしてください。
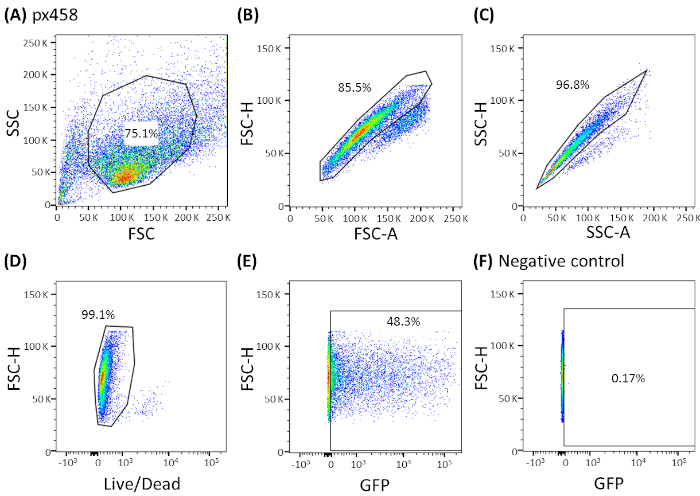
図3: CCCオルガノイドによる代表的なガッティング戦略全ての電気電解オルガノイドを、エレクトロポレーション後の48時間のフローサイトメトリーで分析した。プラスミドDNAを含まない電位化した細胞を陰性対照として用いた。ゲートは、(A)細胞形状のゲーティング、(B、C)単一細胞のゲーティング(ダブレット判別)、(D)生細胞のゲーティング(アポトーシス細胞の抗体で染色)、および(E,F)eGFP発現細胞(FITCチャネル)のゲーティングとして設定された。FSC = 前方散乱;SSC = 側散布。この図の大きなバージョンを表示するには、ここをクリックしてください。
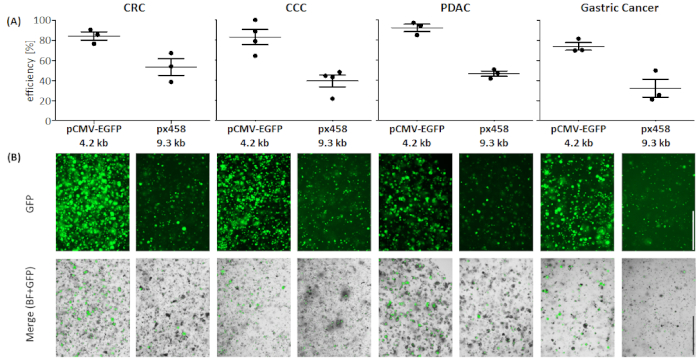
図4:4つのオルガノイドエンティティのエレクトロポレーション効率(A)FACS分析(n=34、平均標準偏差および各単一値が示されている)および(B)蛍光顕微鏡による視覚的比較。スケールバー = 1,000 μm. BF = 明るいフィールド;CCC = 胆管癌;CRC = 大腸癌;GC = 胃癌;PDAC = 膵管腺癌.この図の大きなバージョンを表示するには、ここをクリックしてください。
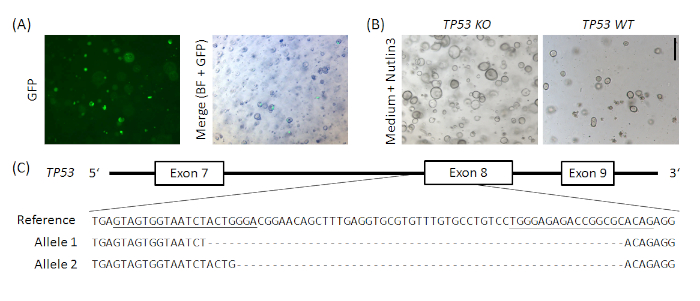
補足図1:正常なヒト胃オルガノイドにおけるTP53の例示的CRISPR/Cas9ベースのノックアウト。px458_Conc2ベクター(材料表参照)は、盆子クー19からの寛大な贈り物である2 gRNA連結ベクトルとpx45820を組み合わせてクローン化し、2つのsgRNA、Cas9およびGFPのプラスミドコードを生じた。TP53を標的とする2つのsgRNAは、ゴールデンゲートクローニング(アンダーソン-ロルフら19に類似)によってpx458_Conc2ベクトルで導入されました。10 μgのプラスミド DNA をヒト正常胃オルガノイド(A)で電気電位化した。クローンは、Nutlin3投与(B)およびTP53ノックアウトにより選択され、TOPO TAのアレのクローニングおよびシーケンシングにより確認されたが、ここでは1クローン(C)に対して例示された例示である。sgRNA は、リファレンス内で下線付きで表示されます。スケールバー = 200 μm. BF = 明るいフィールド。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、効率的で迅速かつ簡単に異なるオルガノイドエンティティのエレクトロポレーションを行うための詳細な指示を提供します。PDAC、CRC、CCCおよびGCからの提示された腫瘍オルガノイドに加えて、健康な組織に由来するオルガノイドにもうまく働く。プロトコルは 1 日以内に実行できます。公表されたオルガノイドトランスフェクションプロトコルでは、全手順は、異なる種類の栽培培地10、21で2日間の調製を含む4日間続いた。私たちのプロトコルでは、特別な前処理は必要ありません。エレクトロポレーション前にエレクトロポレーションバッファーで洗浄することにより、培地の抗生物質成分を洗い流し、最適なインピーダンス値を求める生理食分濃度の調整を行った。それにもかかわらず、エレクトロポレーションを成功させるためにいくつかの重要な側面を考慮する必要があります。
細胞
Fujii et al.10によるエレクトロポレーションプロトコルでは、オルガノイドを単一細胞に解なじ、20 μm のセルストレーナーを通してそれらをフィルタリングすることが推奨されます。私たちの手で単一の細胞への消化は、細胞の生存性を強く低下させます。メレンダら21で示唆されているように、我々はまた、10-15細胞のクラスターにオルガノイドを解離し、単一細胞解離と比較して効率の低下を決定することができなかった。エレクトロポレーション後、それは付着した細胞が失われないように、白い泡を解結することは非常に重要なステップです。
2D細胞培養では、10分を超える10分を40分以上のエレクトロポレーション後の再生時間が、特に大きなプラスミド22の生存性及びトランスフェクション効率を高めることが示されている。試験実験では、オルガノイドについて同じことが文書化され、このプロトコルでエレクトロポレーション後に40分のインキュベーションステップにつながる。エレクトロポレーションからの回収率を上げるために、Rho関連プロテインキナーゼ(ROCK)阻害剤Y-27632を5~7日間23で培養した。同様に、グリコーゲン合成酵素キナーゼ3(GSK3)阻害剤CHIR99021の追加補充は、単一細胞が10を回復するのを助けることを意味する。
設定
使用されるエレクトロポレーターの利点の1つは、最適な条件のためにエレクトロポレーションの前にインピーダンスを測定できることです。メーカーによると、インピーダンス値は30~55Ωである必要があります。私たちの手の中で、30-40 Ωのインピーダンス値は最適な効率を示しています。予備実験では、ポーリングパルスの異なる電圧およびパルス長値を変化させ、生存性に対する効率の最適な割合を見つけた。要約すると、ここで説明する異なるエンティティで藤井ら10の記載値を確認することができた。
Dna
異なるDNA量の効果を、サンプルあたり最大45μgのDNAの予備実験で試験した。細胞毒性の影響は検出できませんでした。トランスフェクション効率は、飽和度が30μgの用量依存的な方法で増加した。そこで、最終的なプロトコルではサンプルあたり30μgを使用しましたが、もちろん(例えば、より多くのプラスミドを並列にエレクトロポレーションするため)増加させることができます。さらに、DNAの純度と濃度は非常に重要であると思われます。5 μg/μLを超える濃度は、最適なトランスフェクション効率を示しています。
予想通り、9.3 kBプラスミドは小さい4.2 kBプラスミドよりも低い効率でトランスフェクトされる可能性があります(図4を参照)。10kBよりもさらに大きなプラスミドを使用すると、さらに効率が低下することが予想されます。将来のアプリケーションでは、これらの遺伝子キャリアはプラスミドの細菌骨格を欠き、24を小さくするので、ベクターとしてミニサークルDNAをテストすることは興味深いかもしれません。これにより、トランスフェクション効率が向上するはずです。さらに、オルガノイドのCRISPRベースの操作のために、リボヌクレオプロテイン(RNP)複合体としてCas9に結合したsgRNAの直接エレクトロポレーションは、代替または付加25であり得る。
開示事項
著者たちは開示するものは何もない。
謝辞
ジュリアン・フォグルフ、アン・クリスティン・メイネッケ、マックス・ハイドゥクの優れた技術支援に感謝します。ドイツ・クレブシルフェ(No 111350および70112925)、サンダー・スティフトゥン(No 2014.104.1)、ヘクター・スティフトゥン(No M65.2)、欧州連合(ERC No 639050)が資金を提供しました。
資料
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 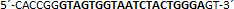 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 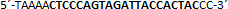 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 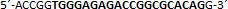 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 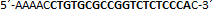 |
参考文献
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved