Method Article
蛍光系抗生物質プローブを用いた細菌耐性の可視化
要約
蛍光タグ付き抗生物質は抗菌性の複数の側面を研究するために使用することができる強力なツールです。この記事では、蛍光タグ付き抗生物質の調製と細菌における抗生物質耐性を研究するアプリケーションについて説明します。プローブは、分光光度測定、フローサイトメトリー、顕微鏡法によって細菌耐性(例えば、流出)のメカニズムを研究するために使用することができる。
要約
蛍光性抗生物質は、他の方法よりも大きな利点があるため、抗菌性の研究に容易に使用される多目的研究ツールです。これらのプローブを調製するために、抗生物質のアジド誘導体が合成され、次いで、クリック化学によるアジド-アルキネジポーラシクロ付加を用いてアルキン-フルオロフォアと結合される。精製後、蛍光抗生物質の抗生物質活性は、最小阻害濃度評価によって試験される。細菌の蓄積を研究するために、分光光度法またはフローサイトメトリーのいずれかを使用して、放射性抗生物質誘導体に依存する方法よりもはるかに簡単な分析を可能にする。さらに、共焦点顕微鏡を使用して細菌内の局在を調べ、耐性種で起こる作用様式および変化に関する貴重な情報を提供することができる。抗菌性の研究における蛍光抗生物質プローブの使用は、将来の拡大に大きな可能性を秘める強力な方法です。
概要
抗菌性(AMR)は、世界中の人間の健康に大きな脅威を与える危機の高まりです。ほとんどの抗生物質に対する耐性が報告されており、すべての臨床的に入手可能な薬物に耐性のある細菌によって引き起こされる感染症が出現している。AMRの台頭に対抗するためには、この多面的な現象と、抗生物質と細菌の間の根本的なメカニズムと相互作用についての理解を深める必要があります。歴史的に十分に理解されていなかった一つの側面は、蓄積と流出の現象と共に、細菌への抗生物質の浸透である。この知識は、新薬を設計し、抵抗性のメカニズムを理解する上で重要です。したがって、これはAMR研究において重要な役割を果たします。
抗生物質濃度を測定するために取ることができる2つの主要なアプローチがあります:薬物を直接測定するか、定量化を容易にするために設計された部分でタグ付けする。抗生物質をタグ付けすると検出が向上しますが、抗菌活性や透過性などの薬物の生物学的活性を乱す可能性があります。これは、タグなしメソッドの問題ではありません。ただし、検出は困難な場合があります。ここ数年、技術の進歩は、細菌1、2、3、4、5、6、7の抗生物質濃度を直接測定するために質量分析(MS)を利用した研究ブームにつながっています。これらの研究は、グラム陰性細菌が最も広く研究されている様々な細菌における細胞内蓄積を研究することが可能であることを示している。分子透過性の定量は、その後活性にリンクされ、薬剤開発2、3、4を知らせるために使用されているが、蓄積および標的活性5を直接連結する際には注意が必要である。MS開発前に、濃度を直接測定できる抗生物質は、テトラサイクリンおよびキノロン8、9、10、11のような固有蛍光を有するものであった。明らかに範囲は限定的であるが、蓄積および流出を調べ、定量し、蛍光系定量の有用性を示す。
タグ付き抗生物質は、分布、作用モード、耐性を研究するために何十年も使用されており、放射性および蛍光タグが一般的です。ラジオタグ付きプローブは、親化合物とほぼ同じであるという利点を有し、したがって生物学的活性が有意に異なる可能性は低い。3H、14C、および15Nなどの同位体は、抗生物質中のこれらの元素の顕著さのために頻繁に使用されており、1、10、12、13の様々な抗生物質足場が調べられている。 無線プローブの検出は簡単ですが、このアプローチの使用が制限されている多くの物流上の懸念(例えば、安全性、同位体の半減期)があります。もう一つの戦略は、蛍光タグ付き抗生物質です。これらのプローブは、MSよりも単純な技術を使用し、放射線8の物流上の問題なしに、親薬剤の分布および作用様式および抵抗性を調べるために使用することができる。このアプローチの主な欠点は、抗生物質は一般的に比較的小さな分子であり、したがって蛍光部分の導入は有意な化学的変化をもたらす。この変化は、物理化学的性質および抗菌活性に影響を与える可能性があります。従って、親抗生物質を代表する結果を生成するためにこれらの因子を評価するために注意を払わなければならない。
本研究では、蛍光抗生物質を合成、評価、使用する方法について説明しました。以前の研究を通じて、蛍光抗生物質の数が準備され、様々な目的のために使用されています(ストーンら8を参照してください)。生物活性に影響を与える可能性を最小限に抑えるために、ニトロベンゾキサジアゾール(NBD、グリーン)および7-(ジメチルアミノ)-2-oxo-2H-クロム4-yl(DMACA、青)という非常に小さなフルオロフォアが使用されています。また、マイクロブロス希釈抑制濃度(MIC)アッセイを用いた抗菌活性の評価が記載されており、その結果、活性に対する修飾の効果が測定可能となる。これらの蛍光タグ付きプローブは、分光光アッセイ、フローサイトメトリー、顕微鏡検査に使用できます。可能な適用の範囲は蛍光の抗生物質の利点があるところにある。細胞蓄積は、MSだけでは不可能なものを定量化、分類、可視化することができる。蛍光抗生物質の使用によって得られた知識が、耐性の理解とAMRとの闘いに役立つことを期待しています。
プロトコル
1. アルキン蛍光ホールの合成
- NBD-アルキエンの合成(7-ニトロ-N-(prop-2-yn-1-yl)ベンゾ[c[1,2,5]オキサジアゾール-4-アミン)
- テトラヒドロフラン(THF)の60 mLに4-クロロ-7-ニトロベンゾフラン(5.181 mmol)の1,031 mgを溶解します。1,857 mg の CsCO3 (5.696 mmol) を加え、その後 0.39 mL のプロパルギルラミン (6.1 mmol) を加えます。反応を50°Cに加熱し、茶色から緑に変わり、室温(RT)に冷却します。
- フィルター処理補助(材料表を参照)を使用して反応をフィルタリングし、酢酸エチル(EA)で洗浄します。減圧下で濾液を濃縮し、残渣を150mLのEAに溶解し、500mLの分離漏斗に移動します。
- EA溶液を水とブラインでそれぞれ100mLで洗浄します。その後、水相を組み合わせて、EAの100 mLで2倍洗浄します。
- 無水硫酸マグネシウムの上に結合された有機相を乾燥させ、次いで減圧下で濾過し、濃縮する。
- シリカゲルのフラッシュクロマトグラフィー(石油エーテル[PE]の20~30%EA)による粗精製、液体クロマトグラフィー質量分析法(LCMS、M+H+=219.1)、核磁気共鳴(NMR)分光法による純度チェック、化学シフト:以下のとおり:
1H NMR (CD3OD, 600 MHz) δ 8.54 (d, J = 8.7 Hz, 1H), 6.35 (d, J = 8.4 Hz, 1H), 4.31 (dd, J = 5.7 Hz, J = 2.5 Hz, 2H), 2.43 (t, J = 2.5 Hz, 1H); 13C NMR(CD3OD、150 MHz)δ 144.3、143.7、142.2、135.8、125.7、100.0、76.5、74.2、33.4。
注:シリカゲルクロマトグラフィーによる精製を行う場合は、記載されている溶媒の極性を低くしてカラムを準備してください。粗化合物は、溶解性がそれを許さない場合は、濃縮溶液としてロードされるか、またはシリカに吸着され得る。化合物をシリカの上部に添加した後、シリカ湿潤に使用したのと同じ溶媒の1~2カラムの体積を通して実行します。次に、記載されている溶媒比から始め、各溶媒の少なくとも1カラム体積を通して走り、溶媒組成に大きなジャンプをしないようにする。分数を収集し、LCMSまたはTLC(薄層クロマトグラフィー)によって純度/同一性を確認します。純粋な分画を組み合わせ、ロータリー蒸発によって減圧下で濃縮します。
- DMACA-アルキンの合成 (2-(7-(ジメチルアミノ)-2-オキソ-2H-クロム-4-yl)-N-(プロップ-2-yn-1-yl)アセトアミド。
- 3-(ジメチルアミノ)フェノール(36.6 mmol)の5.02gを30mLのエタノールに溶解し、6.7 mLのジエチル1,3-アセトネジカルボキシル酸(36mmol)を加えます。ZnCl2 (77.2 mmol) の 10.5 g を加え、赤の溶液を 42 時間還流します。
- 反応を冷却し、減圧下で濃縮します。得られた赤い固体をEAの200mLに分散させ、フィルターし、次いで500mL分離漏斗に移します。
- EAを水と塩水でそれぞれ200mLで洗浄し、無水硫酸マグネシウムで乾燥させます。乾燥した有機相をろ過し、減圧下で濃縮します。
- シリカゲルのフラッシュクロマトグラフィー(PEで0~100%EA)、LCMS([M+H]+=275.1)および/またはNMRによる純度をチェックすることにより、赤い固体(エチル2-(7-(ジメチルアミノ)-2-オキソ-2-クロム-4-yl)酢酸)を精製し、純度をLCMS([M+H]+=275.1)および/またはNMRで確認します。
1H NMR (CDCl3,600 MHz) δ 7.30 (d, J = 8.9 Hz, 1H), 6.52 (dd, J = 8.9 Hz, J = 2.6 Hz, 1H), 6.40 (d, J = 2.6 Hz, 1H), 5.87 (m, 1H), 2.96 (m, 8H), 2.25 (d, J = 1.2 Hz, 3H). - 488 mg の エチル 2-(ジメチルアミノ)-2-oxo-2H-クロム酸-4-yl)酢酸 (1.18 mmol) を THF の 10 mL に溶解し、157 mg の LiOH を加え水の15 mLのH2O(3.74 mmol)。RTで3時間反応をかき混ぜ、分離漏斗に移動し、さらに50mLの水で希釈します。
- 50 mLのジエチルエーテル(Et2O)で反応混合物2xを洗浄し、25mLの水で複合有機相2xを洗浄します。有機層で黄色の沈殿物を取ります。ロータリーエバポレーターを使用して、減圧下で有機相を濃縮します。
- 水相を濃縮HClでpH=2に酸性化し、一晩4°Cまで冷却した。酸性化水相をろ過し、濃有機相に黄色の固体を加えます。
注:2-(ジメチルアミノ)-2-oxo-2-oxo-4-yl)酢酸は、それ以上の精製なしで使用することができますが、これはLCMS([M+H]+=247.1)および/またはNMR、化学シフト、次のようにチェックすることができます。
1H NMR (CDCl3,600 MHz) δ 7.41 (d, J = 9.0 Hz, 1H ) 6.62 (dd, J = 9.2 Hz, J = 2.8 Hz, 1H), 6.52 (d, J = 2.8 Hz, 1H), 5.98 (d, J = 0.9 Hz, 1H), 3.05 (s, 6H), 2.35 (s, 0.9 Hz, 2H); 13C NMR(CDCl 3、150 MHz)δ 162.2、155.7、152.9、152.8、125.3、109.7、109.3、109.1、108.8、98.3、40.2、18.5。 - 466 mg の 2-(ジメチルアミノ)-2-oxo-2H-クロム酸-4-yl)酢酸 (1.89 ミリモル) を乾燥Nの 7 mL に溶解します。
- 窒素下の乾燥DMFの7 mLにプロピルラミン(5.1 mmol)を0.33 mL溶かします。色素溶液に1.30 mLのジイソプロピルエチルアミン(DIPEA,7.50 mmol)を加え、535 mg のO-(1H-6-クロロベンゾトリアゾール-1-yl)-1,1,3,3,3-テトラメチルロニウム六フッ素リン酸(HCTU,1.29mmol)を加えた。活性化染料溶液をRTで15分間かき混ぜ、アミン溶液を滴下し、一晩かき混ぜます。
- 翌日、35 mLの水で反応を薄め、減圧下で濃縮します。
- 得られたオレンジ色の固体をEAとブライン(それぞれ100 mL)の間に250 mLの分ける漏斗に分ける。層を分離し(2つの層を異なるフラスコに実行)、100mLのEAで水相を洗浄します。
- 複合有機相を減圧下に濃縮し、オレンジ色の固体を1:1アセトニトリル(ACN)/水(v/v)の3 mLに再溶解します。C18カートリッジカラム(溶剤A:水、溶剤B:ACN)を搭載した逆相中圧液体クロマトグラフィー(MPLC)系に注入して粗生成物を精製する。
- LCMS([M+H]+=284.1、NMR化学シフト以下)による純度を確認し、適切な画分を組み合わせて凍結乾燥して2-(7-(ジメチルアミノ)-2-oxo-2H-クロム-4-yl)-N -(prop-2-yn-1-yl)アセタミド、NMR化学シフトを以下のように与える:
1H NMR (600 MHz、 DMSO-d6) δ 8.65 (t, J = 5.4Hz, 1H), 7.52 (d, J = 9.0Hz, 1H)、6.72(dd、J = 9.1、2.6 Hz、1H)、6.55(d、J = 2.6 Hz、1H)、6.00(s、1H)、3.88-3.87(m、2H)、3.62(s、2H)、3.13(t、J = 2.5 Hz、1H)、6.0H(1H)、6.0H(1H)、6.55 13C NMR (125 MHz, DMSO-d6) δ 167.7, 160.7, 155.4, 152.9, 151.0, 126.0, 109.4, 109.1, 108.1, 97.5, 80.9, 73.3, 39.7, 38.4.
2. 蛍光性抗生物質の合成
- 前述の抗生物質のアジド誘導体を調製する14,15,16.
注:手順は各抗生物質に固有であり、機能化された抗生物質が親と同等の活性を保持していることを確認するために、親分子の構造活性関係(SAR)を慎重に調べる必要があります。(例えば、シプロフロキサシン16、リネゾリド14、トリメトプリム15)。公開された蛍光系抗生物質の例については、図1、および一般的な合成スキームを参照してください。 - クリック反応手順 A
注:ほとんどの抗生物質については、銅触媒されたハウスゲン[2+3]アジドのシクロ付加(ステップ2.1)と蛍光アルキン(ステップ1で準備)についてここで詳述する手順に従ってください。- 丸い底のフラスコにアジド抗生物質を入れ、tert-ブタノール(tBuOH)と水(1:1 v/v、mmolアジドあたり25 mL)を加えます。
- ステップ1.1(3 eq.)で調製したフルオロフォアアルキンを加え、反応を50°Cに加熱します。次いで、硫酸銅(水で100mM、0.6 eq.)を加え、続いてアスコルビン酸(水で500mM、2.4eq.)
- 50°Cで1時間か、反応完了の指示に従ってLCMSによる分析まで(開始アジドの完全な消費)。
- 反応を冷却し、抗生物質足場に適宜精製し、ステップ2.3または2.4のいずれかによって精製に進みます。
注:足場の極性と安定性に応じて、いくつかの異なる精製方法が可能です。
- クリック反応手順 B
注:ペプチドベースの抗生物質に対してこの手順に従い、より強い反応条件を提供します(未発表の研究、Phetsang、2019)。- 丸い底フラスコにペプチドアジド抗生物質を入れ、溶解するのに十分なDMF(750 mL/mmolアジド)を加えます。
- ステップ1(5 eq.)で調製したフルオロフォアアルキンを加え、反応を50°Cに1時間加熱する。
- 銅(I)ヨウ化物(20eq.)、次にDIPEA(120eq.)、酢酸(240 eq.)を加える。
- 反応を50°Cで1時間かき混ぜ、またはLCMSによる分析が反応完了を示すまで(すなわち、開始アジドの完全な消費)。反応を冷却し、方法1(ステップ2.3参照)による精製を進めます。
- 精製方法1(シプロフロキサシン、トリメトプリム、リネゾリドに使用)
- 冷却されたクリック反応を直接MPLC C18カートリッジカラムに注入します。
- ランの開始時に長い洗浄段階(約10分)を組み込み(100%溶媒A)、次いで100%溶媒Bまでの勾配を実行し、続いて溶剤Aに戻す。
注:水から溶剤A、水に0.05~0.1%、水に含まれる0.05~0.1%のトリフルオロ酢酸(TFA)から選択できます。溶媒Bはアセトニトリル(ACN)、ACNの0.05~0.1%FA、ACNで0.05~0.1%のTFAから選択でき、溶剤Aと一致します。溶出が困難であることが判明した場合、メタノールはACNの代わりに使用され得る。 - LCMSと色(正しい質量、特異なピーク)で示されるように、適切な画分を収集し、組み合わせて、凍結乾燥し、(半)純粋な蛍光抗生物質を得る。
- 必要に応じて、製品をさらに精製します。NMRおよび/またはLCMSおよび高圧液体クロマトグラフィー(HPLC)によって純度を評価し、足場に適したカラムおよび方法を使用して。
- 精製方法 2
注:溶解性が許す場合、前処理は水性ワークアップ(マクロライド、未発表の作品、ストーン2019に使用される)によって行うことができます。- 冷却されたクリック反応を水とEt2O(1:1 v/v、初期反応量から約10倍の希釈)で希釈し、適切な大きさの分離漏斗に移す。
- 層を分離し、Et2 Oで水相を2回洗浄します。
- 結合された有機相を水(有機相と等しい体積)で2x洗浄し、Na2SO4で乾燥させます。
- 乾燥した有機相をろ過し、減圧下で濃縮します。
- MPLCおよび/またはHPLCによって粗生成物を精製します(ステップ2.4.4で説明したとおり)。
注: 不完全、完全、および精製されたクリック反応 LCMS トレースの例については、図 2を参照してください。抗生物質-フルオロフォアクリック反応の典型的な精製収率は30~80%の範囲です。
注意:これらの合成物で使用される化学物質のほとんどは、特定の安全上の危険を有します。個人保護具の使用を含め、常時注意が必要です。Et2O, tBuOH, FA, 酢酸, PE, EA, THF, ACN, DMF, EtOH, DIPEA, プロパルギラミン, HCTU はすべて可燃性です;熱や火花源との接触を避けてください。THF, プロパルギラミン, DIPEA, tBuOH, FA, DMF, PE はすべて有毒です;露出を避ける。プロパルギラミン、 CsCO3、 ZnCl2、 LiOH-H2O 、 DIPEA、 CuI、 FA 、酢酸、および HCl はすべて腐食性です。接触を避け、表面接触に注意してください。ZnCl2、 CuSO4、 CuI 、および PE は環境の危険を提示します。廃棄条件に注意してください。THFは爆発性過酸化物を形成することができる;保管条件に注意してください。有機アジドは爆発性です。特に大規模生産に注意してください。
3. 抗菌活性の評価
注:細菌に関するすべての作業は、アッセイまたは実験室の汚染を避けるために無菌条件下で行われるべきです。すべての媒体は使用前にオートクレーブされ、プラスチック製品やピペットなどの機器は無菌にしておく必要があります。バイオ封じ込めフード(タイプ2)で作業することをお勧めします。
- 抗生物質足場に適した細菌株のストリークグリセロールストックをリソゲニースープ寒天(LB、メーカーの指示に従って調製)にし、37°Cで一晩成長する。
注:抗菌活性をテストする細菌の選択は、使用されている抗生物質足場に基づいて行われなければなりません。抗生物質の影響を受けやすいことがわかっている種から5~10個の細菌の代表範囲を選択し、ラボの物流能力を考慮する必要があります。可能であれば、耐性菌も検査する必要があります。以下のプロトコルは、ほとんどの細菌で動作しますが、特別な条件(例えば、CO2、特殊媒体)が必要かどうかを確認し、必要に応じて変更を加えます。これらの条件を用いて正常にアッセイされた細菌には、ブドウ球菌、連鎖球菌、バチル菌、大腸菌、肺炎桿菌、緑膿菌、およびエンテロコッカス・フェシウムが挙げられる。 - プレートから単一コロニーを選び、37°Cで5 mLのカチオン調整ミューラー・ヒントンブロス(CAMHB、メーカーの指示に従って調製)で一晩培養します。
- CAMHBで一晩培養を40倍に希釈し、600 nm(OD 600)=0.4~0.8、体積5mLで中ログ相の光密度まで成長します。
- 滅菌水中の1.28mg/mLで各蛍光抗生物質のストック溶液を調製し、96ウェルプレートの最初のカラムに10μLの抗生物質をピペット状に調製します。
- 最初のカラムに90 μLのCAMHBを加え、他のすべてのウェルに50 μLを加えます。次いで、プレートを横切って連続2倍希釈を行う。
- 完全に混合し、その後、〜106コロニー形成ユニット(CFU)/mLに中間相培養を希釈し、すべての井戸に50 μLを加え、〜5 x 105 CFU /mLの最終濃度を提供します。
カルチャのボリューム(mL) = (mL のメディアボリューム)/(OD600 x 1,000)
例えば、12 mL の所望の媒体容積で OD600 = 0.5 カルチャの場合、(12/(0.5 x 1,000) = 12 mL の培地に対して 0.024 mL の培養を追加します。 - プレートを蓋で覆い、37 °Cで18~24時間、揺らせずにインキュベートします。
- MICが目に見える成長のない最も低い濃度であるプレートを視覚的に検査します。
注:活性および非アクティブ蛍光抗生物質の例については表1を参照してください。
4. 分光光測定とフローサイトメトリーによるプローブ蓄積解析
注:これらの遠心時間は大腸菌用に最適化されているので、他の種にはわずかな変更が必要な場合があります。NBD標識シプロフロキサシンプローブに対するプローブ蓄積の代表データが報告されています。
- LB寒天上の細菌株のストリークグリセロール株と37°Cで一晩成長します。
- プレートから単一コロニーを選び、37°CでLBで一晩培養する。
- 一晩培養を培地で50倍に希釈し、中ログ相(OD600 = 0.4~0.8)まで成長させる。
- 文化を1,470 x gで25分間遠心分離し、メディアをデカントします。
- 1 mLのリン酸緩衝生理食塩水(PBS)で細菌を再懸濁し、1,470 x gで15分間遠心分離します。
- 培地をデカントし、洗浄したペレットをPBS中で最終OD600=2に再懸濁する。
- 必要に応じて、10.1 μLのカルボニルシアン化3-クロロフェニルヒドラゾン(PBSで10 mM)を1mLの細菌(最終濃度100μM)に加え、37°Cで10分間インキュベートします。
注:CCCPはエフラックスポンプ阻害剤です。CCCPを添加すると、流出の影響を調べる。 - 20°Cで4分間18,000 x gで培養物を遠心分離し、メディアをデカントします。
- 1 mLの蛍光抗生物質溶液(PBSで10~100μM)をペレットに加え、37°Cで30分間インキュベートします。
- 4°Cで7分間18,000 x gで培養物を遠心分離し、メディアをデカントします。
- 1 mLの冷たいPBSで細菌を再懸濁し、ステップ4.9を繰り返す。
- 手順 4.10 を合計 4 倍繰り返します。
- 必要に応じて、180 μLのリシスバッファー(20 mM Tris-HCl、pH 8.0、および2 mMナトリウムEDTA)を加えて、リゾチーム(H2O中72mg/mL)の70μLを加えて、細菌をリゼします。
- 37°Cで30分間インキュベートし、3xを凍結解凍します(-78 °Cは5分、34°Cは15分です)。
- サンプルを20分間超音波処理し、30分間65°Cまで加熱します。
- 中に、18,000 x g、8分のサンプルを遠心分離し、10 kDa フィルター膜をフィルターします。
- フィルターを4xに100μLの水で洗います。
- ライセートをフラットボトムブラック96ウェルプレートに移し、蛍光色素に適した励起波長と発光波長を有するプレートリーダー上の蛍光強度を測定する(すなわち、DMACA:λex = 400 nm、λem = 490 nm;NBD: λex = 475 nm, λem = 545 nm)。
注:蛍光NBD標識シプロフロキサシン系抗生物質を用いた細菌の分光光分析の例については、図3を参照してください。 - フローサイトメトリーによる分析では、同じ成長条件と染色条件(ステップ4.1~4.17)を使用し、最終調製時にのみ変更を加えます。
- 合計ボリュームを PBS の 1 mL にします。
- データ取得用の対数増幅を使用して、約60 μL/分の流量でフローサイトメーター上のサンプルを読み取ります(F1励起 = 488 nm; 放出 = 525/20 nm)。
- 合計 10,000 件のイベントを記録し、適切なソフトウェアを使用してデータを分析します。
- F1からの蛍光強度を事象数数に対してプロットし、細菌が染色された後のヒストグラムピークからの蛍光強度の中央値を推定する。
注: NBD標識シプロフロキサシン系抗生物質を用いた細菌のフローサイトメトリー分析の例については、図4を参照してください。
5. 顕微鏡分析の準備
- MIC評価の場合は、サブカルチャーをOD600 = 0.4に成長させ、3~5分で18,000 x gで1mLのアリコートと遠心分離に分割します。
- デカントと廃棄メディアを、その後、HBSSの500 μLで細菌ペレットを再懸濁します。
- 18,000 x gで3分間遠心分離し、メディアをデカントして廃棄します。
- HBSSの抗生物質プローブの溶液を1~100μMの濃度で調製します。
- 洗浄した細菌をプローブ溶液の500μLで再懸濁し、37°Cで30分間インキュベートする。
- 手順 5.3 を繰り返します。多重標識実験の場合、ペレットを直交色付き核酸色素の500μLに再懸濁します。グリーンの場合は、Syto9(HBSSで5 μM)を使用します。青の場合は、HOEchst 33342(HBSSでは20 μg/mL)を使用します。RTで15〜30分間インキュベートします。
- ステップ5.3を繰り返し、FM4-64FX(HBSSで5μg/mL)の500 μLで再サスペンドし、RTで5分間インキュベートします。
- ステップ5.3を繰り返し、500 μLのHBSSで再サスペンドし、ステップ5.3をもう一度繰り返します。
- ステップ5.8を繰り返し、最後に洗浄した染色された細菌を15μLの取り付け媒体でサスペンドします(材料表を参照)。
- 顕微鏡のスライドおよび高性能カバースリップと上にピペット取り付け媒体、次に明確なマニキュアで端を密封する。
注: NBD標識シプロフロキサシンおよびトリメトプリム系抗生物質で撮影された共焦点顕微鏡画像の例については図5を、DMACA標識オキサゾリジオン(リネゾリド)抗生物質の場合は図6を参照してください。
結果
図1蛍光系抗生物質の調製のための主要なクリック化学反応(A)と、シプロフロキサシン(cipro)、トリメトプリム(TMP)、およびリネゾリドに基づく当社の公開蛍光抗生物質の構造の例(B)を用いて説明します。これらのプローブは、アジド中間体を介して対応する抗生物質から全て合成した。その後、NBDおよびDMACA蛍光色素に結合され、それぞれがアルキンで機能化された。
図2は、シプロフロキサシン-N3およびNBD-アルキンクリック反応からのLCMSトレースの例を示し、アジドが3.2分で溶出し、1.8分で生成された。1と2を比較すると、クリック反応の進行がアジドピーク(UVまたはMS検出器)の消失にどのように続くかを示しています。スペクトル3は、MSおよびUVトレースから誤ったピークが消え、精製の影響を示す。純度と反応の進歩は、製品のピークと任意の不純物ピークの積分によって定量化することができます。
図3は、流出の有無に関する蛍光分光法による細胞内蓄積の評価から典型的な結果を示す。本実験では、大腸菌を、プロトン動機力(PMF)を崩壊させたCCCPの添加の有無にかかわらずTMP-NBDで処理した。CCCPで前処理した場合、細菌の細胞内蛍光は有意に高く、これらの細菌の蓄積を減少させたことを示す。この実験を、tolCに欠損した細菌を用いて繰り返し、このアッセイの容量を表示し、個々の流出ポンプ成分の影響を調べた。この場合、野生型細菌に比べて細胞内蛍光の増加があったものの、CCCP蓄積は依然として増加している。これらの知見は、tolCがInTMP流出に関与するが、唯一のPMFドライブポンプではないことを示している。
図4は、図2と同じ実験の結果を示しているが、分光法の代わりにフローサイトメトリーによって測定された蓄積を用いる。同じデータ傾向が観察され、どちらの技術も細胞内蓄積を媒介する流出現象の研究に使用される可能性があることを実証した。
図5は、それぞれ、グラム陽性(S.アウレウス)およびグラム陰性菌(大腸菌)をTMP-NBD(1)およびcipro-NBD(2+ 3)蛍光プローブで標識した代表的な共焦点顕微鏡画像を示す。いずれの場合も、同局在化を比較するために、赤色の膜色素FM4-64FXを添加した。TMP-NBDの場合、青色核酸色素のホーチスト-33342も使用した。これらの画像を重ね合わせて、細菌中の抗生物質の局在化を可視化した。パネル2と3を比較すると、流出の影響を調べた方法を示し、2で使用された流出抑制剤CCCPを用いて、細胞内蓄積をもたらす。パネル3では、CCCP は追加されません。したがって、流出は活性であり、プローブ蓄積は見られなかった。
図6は、DMACA標識オキサゾリジオンプローブLz-NBDで標識されたグラム陽性(S.アウレウス)細菌の代表的な共焦点顕微鏡画像を示す。赤色の膜色素FM4-64FXを共局在化を比較するために添加し、緑色核酸色素ヘエヒト-33342も使用した。これらの画像を重ね合わせて、細菌中の抗生物質の局在を可視化し、膜および核酸とは異なる内部局在を示した。
表1は、3つの一連の蛍光抗生物質、シプロフロキサシン、トリメトプリム(TMP)、およびリネゾリド(Lz)のMIC値を示し、それぞれの親抗生物質、NBDおよびDMACA誘導体について提示されたデータを示す。各抗生物質の代表的な種は、グラム陽性およびグラム陰性の両方を含む選択された。シプロフロキサシンシリーズの場合、両方の蛍光プローブは、親薬と比較して抗生物質活性を失ったが、すべての種に対していくつかの活性を保持した。同様に、リネゾリドプローブは何らかの活性を失ったが、中等度から弱い抗生物質のままであった。TMPプローブは、野生型細菌に対するほぼすべての活性を失ったが、流出欠乏性大腸菌に対して活性であったが、抗菌活性の喪失は蓄積の欠如によるものであることを示す。

図1:抗生物質由来プローブの合成と構造(A) アジド系抗生物質およびアルキン-フルオロフォアからの蛍光系抗生物質プローブの合成に関する一般的な反応体。(B) シプロフロキサシン、トリメトプリム、およびリネゾリドに基づく当社の公開プローブの構造。この図の大きなバージョンを表示するには、ここをクリックしてください。
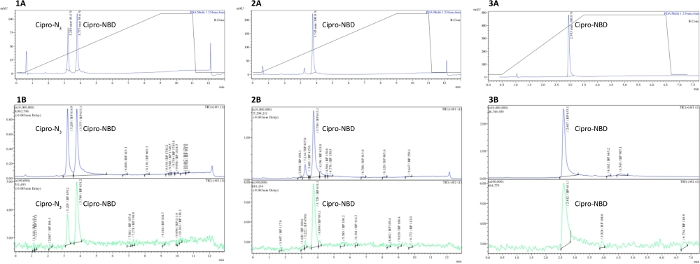
図2: LCMSによる抗生物質由来プローブ純度測定(1)不完全、(2)完全、および(3)反応終了時に出発物質の消失を示す(2)完全、および(3)HPLC精製されたシプロフロキサシン-N+NBDアルキンクリック反応、および精製時のその他のピークから分析的なLCMSトレース。A = UV-Vis トレース (250 nm での吸光度) B = MS トレース (正および負のモード)。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:抗生物質由来プローブ蓄積のプレートリーダー測定野生型(1,ATCC 25922)およびΔtolC(2,ATCC 25922)をインキュベートしたTMP-NBD(50μM)の細胞蓄積の蛍光分光測定(A)および(B)をCCCP(100μM)を添加せずにインキュベートする。統計的有意性(**p ≤ 0.01;***p ≤ 0.001)は、CCCPの不在または存在と野生型とΔtolC大腸菌の間で示される。報告されるデータは、3回の実験での平均±SDである。この図は、我々の以前の出版物15から適応され、細胞内蓄積に対する流出の役割を解明するための分光法の使用を示している。この図の大きなバージョンを表示するには、ここをクリックしてください。
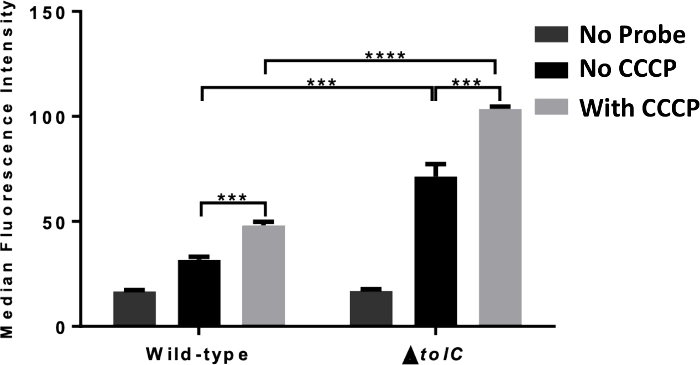
図4:抗生物質由来プローブ蓄積のフローサイトメトリー測定野生型(1,ATCC25922)およびΔtolC(2,ATCC25922)をCCCP(100μM)の添加に伴わずにインキュベートした大腸菌においてTMP-NBDを用いた細胞蓄積のフローサイトメトリー測定。蛍光の中央値は10,000個の細菌事象から示され、統計的有意性(***,p≤ 0.001;****, p ≤ 0.0001)は、CCCPの不在と存在と野生型とΔtolC大腸菌の間で示される。報告されるデータは、3回の実験での平均±SDである。この図は、我々の以前の出版物15から適応され、細胞内蓄積に対する流出の役割を解明するためのフローサイトメトリーの使用を示している。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:NBDプローブ局在化の共焦点顕微鏡可視化1)ヘーヒト-33342(青、核酸)、TMP-NBD(緑)、FM4-64FX(赤、膜)、および重ね合わせたS.アウレウスを生きたS.アウレウスの共焦点顕微鏡画像;2)CCCP(エフラックス阻害剤)で処理された生きた大腸菌は、cipro-NBD(グリーン)、FM4-64FX(赤、膜)、およびオーバーレイで標識した。3)生きた大腸菌は、cipro-NBD(緑)、FM4-64FX(赤、膜)、および重ね合わせた。この図は、我々の以前の出版物15、16から適応され、流出の影響を含むプローブの局在を調べるために顕微鏡を使用することを示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:DMACA-プローブ局在化の共焦点顕微鏡可視化オキサゾリジノネプローブLz-DMACA(青)、シトックスグリーン(緑色、核酸)、FM4-64FX(赤、膜)で標識された生きたS.アウレウスの共焦点顕微鏡画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
| マイク (μg/mL) | |||||||||||
| 種 | ひずみ | シプロ | シプロ-NBD | シプロ-ドマカ | Tmp | TMP-NBD | TMP-DMACA | リネゾリド (Lz) | Lz-NBD | Lz-DMACA | |
| 黄色 ブドウ 球菌 | ATCC 25923 | 0.125 - 0.5 | 32 - ≥64 | 16 | 1 | 16 | >64 | ||||
| ATCC 43300 | 1 | 16 | >64 | ||||||||
| 肺炎球菌 | ATCC 700677 | 1 | 4 | 64 | |||||||
| エンテロコッカス・フェシウム | ATCC 35667 | 1 - 8 | 32 | 32 - ≥64 | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| 肺炎クレブシエラ | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| 緑膿菌 | ATCC 27853 | 0.25 - 1 | 32 - ≥64 | 32 - ≥64 | |||||||
| 大腸菌 | ATCC 25922 | ≤0.004 | 8 | 2 | 0.5 | >64 | >64 | ||||
| 変異型ΔtolC | 0.125 | 0.25 | 2 | ||||||||
表 1.ブロスマイクロ希釈MICアッセイによって測定される適切な臨床的に関連する細菌株に対するシプロフロキサシン、トリメトプリム、およびリネゾリドに基づく蛍光抗生物質プローブの抗生物質活性。ほとんどの場合、プローブは親薬と比較していくつかの活性を失ったが、いくつかの測定可能な抗生物質の効力を保持した(さらなる研究に有用であるのに十分)。
ディスカッション
成功した蛍光抗生物質プローブの作成は、親薬のSARの慎重な計画と検討から始める必要があります。SARが知られていないか、または完全に探索されていない場合、生物学的活性を廃止することなく選択的に修飾され得る部位を見つけるためにいくつかの選択肢をテストする必要があるかもしれません。サイト/sが特定されると、リンカー部分の設置は、しばしば、作用部位と不活性な蛍光動植物との間に立間間隔を提供するために不可欠である。リンカーを抗生物質に付着させるために使用される反応が、生体安定官能基を残し、例えばインビボでエステラーゼによる切断を受けやすいエステルを避けることを注意しなければならない。抗生物質の薬物力学および薬物動態プロファイルに応じて、単純なアルキルリンカーを使用してもよいし、あるいはポリエチレングリコール(PEG)リンカーのようなより少ない親油性の選択肢を考慮すべきである。リンカーを取り付けた状態で、抗菌活性を評価して、関連する細菌に対するMICsが親化合物と類似していることを確認する必要があります。
この研究では、いくつかの理由から、フッ素色を抗生物質にリゲートするために、Huigsenアジジアルキン[3+2]双極性シクロ付加(クリックケミストリー、図1参照)を使用することを推奨します。クリック反応は、抗生物質に対する反応性基の保護が必要でないことを意味する、非常に選択的であり、さらに、反応は安定した、生体適合性のトリアゾール部分を残す。アジド成分は、アルキンの導入よりも様々な構造タイプで一般的に容易に達成されるように、我々の手順で抗生物質部分に導入される。2つのアルキン誘導体化蛍光体の合成は、必要に応じて他の人を探索することができるが、ここで説明されている。NBDとDMACAは、その小さなサイズのために選択され、細胞の浸透および標的相互作用を妨げる可能性を最小限に抑えた。このクリック反応自体は銅触媒を用いて行い、ここでCu2+(CuSO4、アスコルビン酸還元剤を有する)またはCu+(CuI)のいずれかを出発試薬として用いてもよい。精製 (図 2)の後、MIC はアジドと同様にテストする必要があります。蛍光性フォアの選択や付着部位を慎重に考慮しても、抗生物質の活性が悪くなる可能性があります。ただし、これは非アクティブなプローブが使用されないことを意味するものではありません。TMPプローブで示されるように、抗菌活性の悪い化合物は、依然として親薬と同じ標的に結合し得る。これにより、作用のモードに関する研究と、流出などの抵抗につながる現象の検討が可能になります。
プロトコルセクションで概説されているように、単純な分光光測定アッセイ(図3)またはフローサイトメトリー(図4)のいずれかを用いて蛍光抗生物質による細菌標識を分析することができる。どちらの方法も細胞蓄積を定量化することができ、細胞をリセートして蛍光局在化を調べることにより、細胞内蓄積を評価することができる。このプロトコルでは、細胞のリソザイムの使用は、これが迅速で普遍的な技術であるように記述される。グリシン-HCl7による一晩処理などの他のリシス条件も、正常に使用されている。この技術を用いて、抗生剤の細胞蓄積に対する流出の影響を研究することが可能であり、これは抵抗性の主要なメカニズムである。もし細菌に流出が実際に存在するならば、細胞内蓄積の欠如は観察されるが、これはCCCPのような流出抑制剤を使用して救うことができる。
顕微鏡検査は、異なる細菌におけるプローブ局在化、作用様式に関する情報、および潜在的に抵抗性を視覚的に検査するために行われることもあります(代表的な例については図5を参照)。細菌内の局在を見るためには、SIM(構造照明顕微鏡)、SR-SIM(超解像度SIM)、エアリスカン、またはSTED(刺激された排出枯渇)などの機能を備えた高解像度の共焦点顕微鏡が必要です。さらに、高性能のカバースリップを使用し、適切なソフトウェア(例えば、フィジー、Zen、イマリス)でイメージング後の分析を行う必要があります。プローブの局在化は、Hoechst-33342(青、核酸)、Syto-9(緑色、核酸)、FM4-64FX(赤、膜)などの特定のアーキテクチャを染色する染料と比較されます。色素の選択は、蛍光抗生物質に一致するように行われるべきであり、使用される各色は、最小のスペクトルの重なりを有する。可能な限り最高の画像を得るためには、最適化が必要な場合があります。例えば、細菌がスライド上で混雑しすぎている場合は、懸濁ペレットの一部のみを取り、より多くの取り付け培地で希釈します。対照的に、細菌がスライド上であまりにもまばらである場合は、単により多くの細菌から始めます。このプロトコルでは、生細胞と互換性のある熱可逆性ゲル(例えば、Cygel)を使用して、細菌(可動菌を含む)を固定化するため、生細胞イメージングに推奨されるが、他の取付け培地またはアガロースも使用されている。
全体的に、生物学的に活性な蛍光系抗生物質誘導体の調製において直面する可能性のある課題にもかかわらず、その使用のシンプルさと汎用性は、これらのプローブをAMRの研究のための魅力的なツールにします。蛍光抗生物質を使用する将来の研究は、抗生物質耐性のメカニズムに関する洞察を提供し、現在の抗生物質がどのように動作するかを理解し、より良い薬物の開発を支援する可能性を秘めています。
開示事項
著者は宣言するものは何もありません。
謝辞
MRLSは、オーストラリア大学院賞(APA)と分子生命科学研究振興研究所賞によって支援されています。ワニダ・フェツァンは、UQ国際奨学金(UQI)とIMB大学院賞(IMBPA)の支援を受けました。MACはNHMRCの原則研究員(APP1059354)であり、また、炎症性疾患の臨床アンメットニーズに対処するための薬を開発しているインフラゾメ株式会社のCEOとしての残りの時間で、クイーンズランド大学で分数教授研究員の任命を保持しています。MATBは、ウェルカムトラスト戦略助成金WT1104797 / Z / 14 / ZおよびNHMRC開発助成金APP1113719によって部分的にサポートされています。顕微鏡検査は、オーストラリア癌研究財団(ACRF)/分子生命科学研究所で行われた、ACRFの支援を受けて設立されました。
資料
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
参考文献
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299 (2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved