このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ウィーディライスのアロパシーポテンシャルにアクセスするための繰り返し可能な階段ステップアッセイ(オリザサティバssp.
要約
Allelopathyは、トリミングシステムにおける有用な補足雑草制御戦略として約束を示しています。所望の植物標本の全能的電位を決定するために、階段ステップスクリーニング法が提供される。
要約
雑草競争は、世界中の作物システムの損失をもたらす大きな貢献をしています。多くの除草種における抵抗性の進化は、継続的に適用された除草剤に対する耐性の必要性を示している。アレロパシーは、いくつかの植物種が有する生理学的プロセスであり、植物がその近隣よりも優位に立つ。アレロパシー作物の品種は、周囲の競合他社の成長を抑制する能力を備えているため、雑草の干渉による潜在的な収量損失を減らします。本論文は、温室環境における受け葉の雑草種(エキノクロロア・クルース・ガリ)に対するドナー種(Oryza sativa)のアエロパシーポテンシャルのスクリーニングに用いられる階段ステップアッセイの構築と運用に焦点を当てている。本論文に記載された構造は、植物サンプルのスタンドとして機能し、allelochemicalsの蓄積と流通のための時限散水システムを組み込んでいます。植物の根によって生産されたアレロケミカルは、一連の4つのポットを通って回収タンクに別々に流れ、電動ポンプを通じてトッププラントにリサイクルされます。このスクリーニング方法は、ドナープラントからのallelochemicalsが資源競争なしで受信機プラントに到達するための道を提供し、選択されたドナープラントの有数のアエロパシー電位の定量的測定を可能にする。このとき、このアエロパシーの電位は、受信機の植物の高さ低減を通じて測定可能である。この方法の有効性に関する予備スクリーニングデータは、受信機種の高さ低下を実証し、バーンヤードグラス(E.crus-galli)、ひいてはドナー植物からのアエロパシー残基の存在、雑草米(Oryza sativa)
概要
アレロパシーは、過去数十年の間に多くの植物科学者の焦点となっている自然で複雑な現象です。作物に使用するためのallelopaths症に関するメカニズムは、モリッシュが環境1への化学化合物の生産および分泌を通じて近隣の植物に直接的または間接的な影響を及ぼすことを観察した1930年代以来、多くの研究の対象となっている。アレロパシーは、いくつかの植物種の成長と発芽に阻害効果を有する二次代謝産物の生産である。放出された同種同種化合物は、それらの周囲の環境にフィトトキシンを加えることによって、ドナー植物に競争上の優位性を提供するのに役立つ2。多くの要因が全能活動に寄与する。それは、その有効性に選択的であり、品種、環境条件、成長段階、ストレス、環境、栄養素の可用性3.
近年, アレロパシーは、絶え間なく成長雑草制御の危機に可能な補足として研究で強調されています。.世界人口の増加に伴い、持続可能な食料と繊維生産の需要は4.雑草の管理は、農学者5、6が直面する生産に最大の脅威の一つです。従来の雑草の制御方法は、機械的、化学的、文化的な慣行に焦点を当てています。除草剤の連続的な使用は、有効、有用、かつ効率的である一方で、驚くほど速いペース7で耐性雑草集団の進化を促進している。遺伝子工学と繁殖の慣行は、彼らの隣人が生き残ることができない化学用途に耐えるようにそれらを設計することにより、雑草よりも作物の競争上の優位性を与えるために効果的に使用されています7,8.効果的ではあるが、これらの技術は常に持続可能であるとは限らず、時には9.食糧生産を増やすという目標が10を達成するならば、補足的な雑草管理の方法を導入する必要があります。Allelopathyは、作物の品質を向上させ、競合他社の1、7を超える新しい防衛ツールとして優れた約束を示しています。
アレロケミカルは、多くの場合二次製品であり、その生産は環境要因によって大きく影響されるため、植物抑制に関連する特定の化合物を同定することは困難である3.生産因子は遺伝学と相乗的に作用し得る二次代謝産物の共同作用を含む11,12.藻仕掛けの活動を作物雑草の相互作用の中に自然に存在する競争から切り離すのは困難であり、このため、allelopath症のスクリーニングには、アッセイを有効かつ反復可能と見なす標準的な結果セットが必要です。以下は、オロフォパチーの所見を修飾する一連の基準であり、Olofsdotterら12 1)1つの植物はパターンで別の植物の抑制を実証しなければならない。2)生物活性量で環境に放出される化学物質は、ドナー植物によって生成されなければならない。3)製造された化学物質は、受信機工場に輸送可能でなければなりません。4)取り込みのメカニズムは、受信機工場に存在する必要があります。6)観察される阻害のパターンは、他の排他的な説明(例えば、資源の競争)12を持ってはならない。
エロパシーを支えるメカニズムの知識不足と多様な発達との間の障壁を克服するために、エロパシーの品種に関連する形質の特徴を同定し、さらなる研究と使用のために選択することができる。アエロパシーの性質を持つことを知られているいくつかの植物は、ライ麦、ソルガム、米、ヒマワリ、菜種、小麦13です。作物におけるアエロパシーの初期の観察では、フィールド実験における雑草の成長の顕著な境界のために、資源14の競争ではなく化学物質が関与することが提案された。しかし、ほとんどの研究は、第14因子として競争を排除することを不可能にしたフィールド実験であった。競争の排除の努力は、米や他の作物のテロパシー活動を証明し、定量化しようとする試みで、実験室と温室の実験に道を譲った。カロパシーのために植物をスクリーニングする場および温室方法は、両方の成長条件11、15において、アエロパシー傾向が存在することを示す。一部の批評家は、実験室でのスクリーニングは、自然条件の欠如のために限られた価値しか持たないかもしれないと考えています, 結果に影響を与える可能性があります15.
植物におけるテロパシーの可能性をスクリーニングするための提案された方法は、十分な資源とスペースを提供し、階段ステップ構造11、17を使用して資源競争を排除する。この方法は、ターフグラスおよび大麦17、18におけるアエロパシーを探索する以前の実験から適応および改変された。これらの研究は、同様のシステムが、観測が自然競争に起因する可能性があるという疑いを取り除きながら、標的植物の有理性ポテンシャルに関する正確な結果を生み出すことができることを発見した。階段ステップ法は、貯水池からの栄養溶液がいくつかのステップを経て各植物をインキュベーショントレイに循環できる循環系を作成します。その後、電動ポンプは、18を生産した任意のアロケミカルと一緒にソリューションをリサイクルします。このような方法は、時間、空間、リソースの両方で効率的です。また、植物に同様のフィールド条件を提供し、リソースの競合を排除します。スクリーニングに使用される方法およびツールは、所望の研究目標、条件、および特定の種に合わせて容易に操作されます。本研究の目的は、階段ステップ法を用いて、納屋草の高さ抑制測定を通じて雑草米のアエロパシーを確認することです。
プロトコル
1. スタンド建設
注: 木材の測定値は、厚さ (cm) x 幅 (cm) x 長さ (m) として示されます。
- 木材を適切な大きさと量に適切にカット:5つの10.16 cm x 5.08 cm x 0.91 m木製ピース、10.16 cm x 5.08 cm x 0.76 m木製ピース3個、10.16 cm x 5.08 cm x 0.61 m木製ピース、10.16 cm x 5.08 cm x 0.06 cm x 0.46木製の作品3つの10.16 cm x 5.08 cm x 0.3 mの木製部分、および3つの10.16 cm x 5.08 cm x 0.15 mの木製部分。
- 最も高いレベルでは、エッジの両端に2つの0.91 mピースに2つの2.44 mボードを立て、2本のネジをそれぞれ0.91ピースに垂直にドリルします。サポートのために両端から1つさらに0.91 mピース1.22 mをねじ込み、0.91 mスタンドの背面に2.44 mのボードを配置し、サポート用の位置にネジを入れします。
注:8つの3.175 cm x 15.24 cm x 2.44 mは、各ベンチレベルのベンチトップとして機能するように、そのままノーカットに保たれています。 - ステップ 1.2 を、0.76 m ピースで次のベンチ レベルに対して繰り返します。
- 次のベンチに対してステップ 1.2 を繰り返し、0.61 m ピースを 0.15 m の 6 番目のベンチまで下ろします。
メモ:ベンチ3~6に2.44mボードを支える必要はありません。最後のスタンドには6つのベンチがあり、それぞれ3つの垂直サポートがあり、各端に1つと中央に1つずつがあります。 - 下降高さのラインベンチは、裏側に向けて張り出した唇が上のベンチに触れ、レベル間のギャップを可能にします。
- 地面に沿ってベンチの下端のそれぞれに0.91 cmの板を並べ、ベンチを所定の位置にねじ込みます。
- 構造物の両側の最も高い 3 つのベンチを地面から 0.61 m に支える場合は、0.46 m ボードを水平にねじ込みます。
- 3 つのコーナー ブレースを最も高いベンチの前向きの端と中央にねじ込みます。
- ベンチの底部からブレース2.54 cmを横切って1つの2.54 cm x 5.08 cm x 20.32 cmの木製部分をねじ込みます。
注: 0.91 m と 2.44 m の構造を 1 つずつ作成します。最終基本製品については、図 1を参照してください。寸法は実験のニーズに応じて変化する可能性があります。説明された構造は15.24 cmの鍋に合うように設計されていた。ベンチ間の高さは、重力によってベンチの下にあるポットから下の鍋に対するallelochemicalsと溶液の安定した流れを維持するために、この実験で使用される鉢と植物材料に合うように設計されました。

図1:木製ベーススタンドの正面図。木の基盤は植物のサンプルのための立場として役立つ。実験に必要なサンプル数に応じて、システム用の材料を組み立てて追加する必要があります。この研究では、2つのスタンドが31サンプルのベースとして役立った。この図の大きなバージョンを表示するには、ここをクリックしてください。
2. システムアセンブリ
- 1 L ソーダボトルからキャップを取り出し、黒い塗料でスプレー塗料を塗ります。
注:ソーダボトルは、1つの列のシステムの上部にある貯水池として機能します。塗料は、藻類の成長を減少または防止し、光のためのブロックを提供します。 - 各ソーダボトルの底に、ちょうど0.35 cmの内径(ID)、0.64 cmの外径(OD)、5.08 cmの長いプラスチックPVCチューブを埋め込むのに十分な大きさの小さな穴を開けます。
- 漏れを防ぐために、挿入後の穴の縁の周りにシリコーン防水シーラントの層を塗ります。完全に乾燥させます。
- ポットを保持するために使用される各プラスチック皿に手順2.2と2.3を繰り返します。
注:1つの列に4つの料理が必要になります。 - 蓋を取り外し、黒い塗料で2.27 Lプラスチックキャニスターの外側にスプレー塗料を塗ります。これらのキャニスターは各列の底部のコレクションタンクとして機能する。
- キャニスターの上部の裏側に小さな穴を開けます。
注: ステップ 2.1 ~2.6 で示した供給は 1 列になります。列数は、目的の実験に必要なサンプル数に左右されます。1 つのサンプルには 2 つの列が必要です。すべての次元は実験の必要性によって変わる。 - 供給が準備され、乾燥した後、PVCチューブが階段に面したリムの上にぶら下がるように、ソーダボトルを最も高いベンチに置きます。
- 次のベンチのソーダボトルのすぐ下に、ベンチの縁にチューブを掛けたプラスチック皿を1つ置きます。
- 次の 2 つのベンチについて、手順 2.8 を繰り返します。
- キャニスターを下部のベンチに置き、穴を背面に向けます。
- キャニスターの後ろの穴を通して皿からチューブをひもでつなぐことで、キャニスターをその上の皿に接続します。
- 漏れを防ぐためにチューブが通るキャニスターの端の周りに防水シーラントを塗抹します。
- 21 W 1,000 L/hr 水中電動ポンプを下部キャニスターの内側に置きます。
- 長さ1.07m、1.27cm ID、1.59cm OD PVCチューブを電気ポンプのノズルに接続します。
- ベンチ間の隙間から、そしてシステムの上部にあるソーダボトルの裏面にチューブをひもでつなぎます。
- ポンプをデジタルタイマーに差し込み、必要に応じてタイマー設定を行います。
注: タイマーは、実験全体を通して 3 時間ごとに 1 分間実行するように設定されました。選択されたタイミングは、収集タンク内の最大量の液体を循環させ、あふれや波及を避けながらポンプをオンにするたびに約10分間の流れを可能にしました。
3. 植栽
- 70%エタノールを30個の間ですすいで、5%の漂白剤を20分間浸し、蒸留水で6倍すすいで必要なすべての米の種を殺菌します。
- 25°Cに設定した成長チャンバーに5mLの蒸留水を充填した濾紙が並ぶペトリ皿の殺菌された米の種を前駆。
- 種子が発芽した後、各ポットの底に2つの大きなコーヒーフィルターを並べ、天然のカップ状のポットの中に入れます。
- 各ポットをフィルターの上部(ポットの約75%)にオートクレーブ、洗浄、および特別に採点された石英砂で充填します。砂の上に水を注ぐか、植え付けトレイにポットをわずかに入れた植え付けトレイにポットを入れ、ポットが水を浸して湿らせたままにして、蒸留水で砂を湿させます。6つの先入観ドナー植物苗を砂に移植し、均等に間隔をあけた。
- 苗を砂で覆う。
- 苗を3週間確立しましょう。
注:砂は非常に迅速に乾燥します。したがって、ポットをトレイに入れることが効率的な散水技術です。常に水を交換すると、カビを防ぐのに役立ちます。 - ペトリ皿にレシーバ植物の苗(E.crus-galli)を植え付けた後3週間、皿の底を濾紙で裏打ちし、5 mLの蒸留水を用いて、プレジャーミネートします。3~5日間、25°Cの成長室に皿を置きます。
- ステップ3.1-3.2の説明に従ってポットを準備します。
- 苗が発芽した後、3本の苗を準備した鉢に移植し、砂で覆う。
注:実験は、治療(DAT)の翌日、または受け手植物の苗が出現し、移植され、システムに配置された日に始まります。
4. サンプルの配置
- 1列目の4つの料理にドナー植物の1つの加盟の4つのポットを置きます。列1はドナー植物のみから構成される。
- 列の1行目と3列目の列2の皿にドナー植物の同じ加盟の2つのポットを置きます。
- 列の2行目と4列目の列2の皿に受信機植物のポットを2つ置きます。
- レプリケーションごとに、レシーバプラントの 1 行のみが追加されていることを確認します。2つの列は、第1のドナー植物のみからなる、第2の交互ドナーおよび受け手と、1つの処理を行う(図2)。
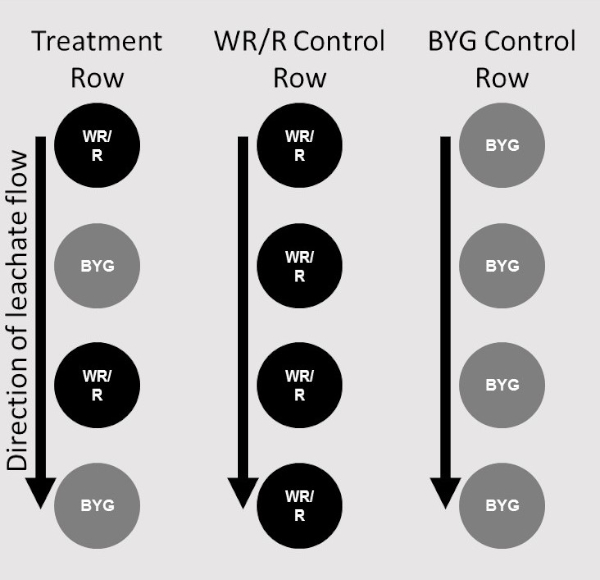
図2:配置マップ階段ステップシステム内のそれぞれの位置におけるドナー(WR/R)および受信機プラント(BYG)の配置を示す図。植物を備えた階段ステップシステムの2つの列は、1つの処理を含む。受信機植物の単一列は、1つの複製(右端)、各加盟のための制御としてドナー植物の単一列(中央)、および治療列は交互のドナーと受信機植物(左端)で構成されていました。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 各治療またはドナー植物の加盟について、ステップ 4.1 から 4.4 を繰り返します (図 3)。
注: 各レプリケーションでは、1 つのレプリケーションのコントロールとして機能するレシーバプラントサンプルの1列が必要です。治療は、無作為化完全ブロック計画で3倍に複製した。

図 3: 最終階段ステップ構造階段ステップシステムは、所定の位置に植物と組み立てられました。システムは、各ポットを通して重力によってトップボトルと下向きに循環するソリューションのための底部に植物サンプルの4列と回収タンクを含んでいた。この図の大きなバージョンを表示するには、ここをクリックしてください。
5. 操作
- DAT 1では、蒸留水中の半分強度ホアグランド溶液17、約1,500mLで各カラムの底部に回収タンクを充填する。
- 自動オフ設定で、タイマーを必要に応じて実行するように設定します。
- 収集タンクを黒いプラスチックで覆い、光の露出と蒸発を制限します。
- システムを常に流し続けるためにHoaglandのソリューションの500 mLで2日ごとにタンクを充填します。
- 温室温度を日中は28°C、夜間は24°C、湿度16/8分を53%に保ちます。
6. データ収集
- DAT 1の階段ステップシステムで各プラントの高さを測定し、各プラントのベースに定規を配置し、最も高い葉のスタンドを観察することにより、DAT 21まで毎週1回を記録します。
- クロロフィル含有量計を用いて、DAT 7および14上の各植物のクロロフィルレベルを測定し、記録します。
- 実験の最終日(すなわち、DAT 21)は、各ポットに対して1枚の紙袋にラベルを付ける。
- ベースで植物サンプルをカットし、別々の袋に入れます。
- すべてのサンプルをオーブン乾燥機に入れ、60 °Cに設定し、48時間16に設定します。
- 乾燥したサンプルと空の内容をスケールに個別に取り除き、体重をグラムで記録します。
7. データ分析
- この式を使用して、受光器のパーセント阻害に基づいてドナー植物の有理症電位を計算します。
高さ減少(%)=[コントロールの高さ(cm)-処理の高さ(cm)×100 - ドナー植物の高さの減少を、受信機プラントが対象プラントに及ぼす可能性のある逆効果のチェックとして計算します。
- レプリケーションと実行がランダム効果である間、固定効果としてアクセスを分析します。
- 統計ソフトウェアの0.05確率レベル以下でフィッシャーの保護された最小有意差(例えばJMP 14)を使用して分離された平均値を使用してデータを分析する。
- データをアップロードしての主成分分析を使用して、元の変数間の相関関係を視覚化します。
- ツールバーの [分析] タブを選択し、[ Y に X でフィット]を選択します。列の下で、応答を強調表示(つまり、高さの縮小率) をクリックし、Y に対して観察される因子を指定する応答 (つまり、高さの縮小率) をクリックします。X ファクターの場合は、ハイトライトの受け入れをクリックし、[X、係数] をクリックして、[OK] を選択します。
- [一方向分析] バーの赤い下向き矢印を選択し、[平均 / 分散分析] を選択します。もう一度ワンウェイ分析バーの下矢印を選択し、比較手段をハイライトし、各ペア、学生のTを選択します。
結果
この方法を用いた2つの予備スクリーニングは、9つの雑草米の加盟(B2、S33、B83、S97、S94、B81、B88、B8、B8、5つの栽培された稲のライン)と5つの栽培された稲のライン(PI338046、レックス、ロンド、PI312777、CL163)で行われました。雑草米の加盟と米のラインは、シュレスタ(2018)18によって行われた以前の全能的スクリーニングにおけるそれらのパフォーマンスに基づいて選択された...
ディスカッション
allelopathyを利用することは、1、7、13を管理することが困難である雑草の生物学的制御として潜在的に役立つ可能性があります。Allelopathyは、米の雑草危機に対する可能な解決策として大きな可能性を示しており、化学物質や手動雑草管理プラクティス5、13、19
開示事項
著者たちは開示するものは何もない。
謝辞
このプロジェクトの資金は、ミシシッピ州農林実験所が後援する特別研究イニシアチブ補助金によって提供され、米国国立食品農業研究所の支援を受けた作業に基づいています。農業、ハッチプロジェクトの加盟番号230060。
資料
| Name | Company | Catalog Number | Comments |
| 1.25 in by 6 in by 8 ft standard severe weather wood board | Lowe's, Mooresville, NC | 489248 | N/A |
| 2 in by 4 in by 8 ft white wood stud | Lowe's, Mooresville, NC | 6005 | Cut into appropriate sizes |
| 63 mm (2.5 in) corner braces | Lowe's, Mooresville, NC | 809449 | N/A |
| Asporto 16 oz Round Black Plastic To Go Box - with Clear Lid, Microwavable – 6.25 in by 6.25 in by 1.75 in - 100 count box | Restaurantware.com, Chicago, IL | RWP0191B | black |
| ATP vinyl-flex PVC food grade plastic tubing, clear, 0.125 in id by 0.25 in od, 100 ft | Amazon, Seattle WA | B00E6BCV0G | N/A |
| Ccm-300 chlorophyll content meter | Opti-Sciences, Inc. Hudson, NH | ccm/300 | N/A |
| Common 1 in by 2 in by 8 ft pine board | Lowe's, Mooresville, NC | 1408 | N/A |
| Contractors choice contractor 24-pack 42-gallon black outdoor plastic construction trash bag | Lowe's, Mooresville, NC | 224272 | Cut to cover collection tanks |
| EURO POTS | Greenhouse Megastore, Danville, IL | CN-EU | 15 cm short black 6 in diameter 4.25 in height 1.37 qt volume |
| Fisher brand petri dish with clear lid | Fisher Scientific, Waltham, MA | FB0857513 | N/A |
| Aexit Ac 220 V-240 V electrical equipment US plug 21 W 1,000 L/hr multipurpose submersible pump | Amazon, Seattle WA | B07MBMYQNT | Nozzle size should fit tubes and can be repaced |
| Woods 50015 WD outdoor 7 day heavy-duty digital outlet timer | Walmart, Bentonville, AR | 565179767 | 20 settings |
| GE silicone 2+ 10.1 oz almond silicone caulk | Lowe's, Mooresville, NC | 48394 | Sealant for edges of any attached tubing |
| Great Value Distilled Water | Walmart, Bentonville, AR | 565209428 | N/A |
| Great Value White Basket coffee filters 200 count | Walmart, Bentonville, AR | 562723371 | Size may vary |
| Grip-rite primgaurd plus #9-3 in pollimerdex screws | Lowe's, Mooresville, NC | 323974 | N/A |
| Hoagland’s No. 2 basal salt mixture | Caisson Laboratories, INC. Smithfield, UT | HOP01/50LT | ½ strength rate |
| JMP (14) | SAS Institute Inc. North Carolina State University, NC | N/A | |
| Project source flat black spray paint | Lowe's, Mooresville, NC | 282254 | N/A |
| Project source utility 1.88 in by 165 ft gray duct tape | Lowe's, Mooresville, NC | 488070 | N/A |
| Rubbermaid 2 qt square food storage canister clear | Walmart, Bentonville, AR | 555115144 | Collection tank discard lid |
| Sealproof unreinforced PVC clear vinyl tubing, food-grade .5 in id by .625 in od, 100 ft | Amazon, Seattle WA | B07D9CLGV3 | Connects to pump |
| Short Mountain Silica 50 lb Play sand | Lowe's, Mooresville, NC | 10392 | Sand should be purified |
| Steve Spangler's 1 L Soda Bottles - 6 Pack - For Science Experiment Use | Amazon, Seattle WA | UPC 192407667341 | Top step tank discard lid |
参考文献
- Weston, L. A. History and Current Trends in the Use of Allelopathy for Weed Management. HortTechnology. 15 (3), 529-534 (2005).
- Pratley, J. E. Allelopathy in annual grasses. Plant Protection Quarterly. 11, 213-214 (1996).
- Bertin, C., Yang, X., Weston, L. A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil. 256 (1), 67-83 (2003).
- Stevenson, G. R. Pesticide Use and World Food Production: Risks and Benefits. Environmental Fate and Effects of Pesticides. American Chemical Society. , 261-270 (2003).
- Chopra, N., Tewari, G., Tewari, L. M., Upreti, B., Pandey, N. Allelopathic Effect of Echinochloa colona L. and Cyperus iria L. Weed Extracts on the Seed Germination and Seedling Growth of Rice and Soybean. Advances in Agriculture. 2017, 1-5 (2017).
- Jabran, K., Mahajan, G., Sardana, V., Chauhan, B. S. Allelopathy for weed control in agricultural systems. Crop Protection. 72, 57-65 (2015).
- Worthington, M., Reberg-Horton, C. Breeding Cereal Crops for Enhanced Weed Suppression: Optimizing Allelopathy and Competitive Ability. Journal of Chemical Ecology. 39, 213-231 (2013).
- Sudianto, E., et al. Corrigendum to "Clearfield (R) rice: Its development, success, and key challenges on a global perspective.". Crop Protection. 55, 142-144 (2014).
- Gressel, J., Valverde, B. E. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds. Pest Management Science. 65, 723-731 (2009).
- Muthayya, S., Sugimoto, J. D., Montgomery, S., Maberly, G. F. An overview of global rice production, supply, trade, and consumption. Annals of the New York Academy of Sciences. 1324, 7-14 (2014).
- Chung, I. M., Kim, K. H., Ahn, J. K., Lee, S. B., Kim, S. H. Allelopathy Comparison of Allelopathic Potential of Rice Leaves, Straw, and Hull Extracts on Barnyardgrass. Agronomy Journal. 95 (4), 1063-1070 (2003).
- Olofsdotter, M., Jensen, L. B., Courtois, B. Improving crop competitive ability using allelopathy Ð an example from rice. Journal of Plant Breeding. 121, 1-9 (2002).
- Olofsdotter, M., Navarez, D., Rebulanan, M., Streibig, J. C. Weed-suppressing rice cultivars-does allelopathy play a role. Weed Research. 39 (6), 441-454 (1999).
- Jensen, L. B., et al. Locating Genes Controlling Allelopathic Effects against Barnyardgrass in Upland Rice. Agronomy Journal. 93 (1), 21-26 (2001).
- Kuijken, R. C., Eeuwijk, F. A. V., Marcelis, L. F., Bouwmeester, H. J. Root phenotyping: from component trait in the lab to breeding. Journal of Experimental Botany. 66 (18), 5389 (2015).
- Lickfeldt, D. W., Voigt, T. B., Branham, B. E., Fermanian, T. W. Evaluation of allelopathy in cool season turfgrass species. International Turfgrass Society. 9, 1013-1018 (2001).
- Liu, D. L., Lovett, J. V. Biologically active secondary metabolites of barley: Developing techniques and assessing allelopathy in barley. Journal of Chemical Ecology. 19, 2217-2230 (1993).
- Shrestha, S. . Evaluation of Herbicide Tolerance and Interference Potential among Weedy rice germplasm. , (2018).
- Kim, K. U., Shin, D. H., Olofsdotter, Rice allelopathy research in Korea. Allelopathy in Rice. IRRI. , (1998).
- Quasem, J. R., Hill, T. A. On difficulties with allelopathy. Weed Research. 29, 345-347 (1989).
- Singh, S., et al. Evaluation of mulching, intercropping with Sesbania and herbicide use for weed management in dry-seeded rice (Oryza sativa L.). Crop Protection. 26, 518-524 (2007).
- Kong, C. H., Li, H. B., Hu, F., Xu, X. H., Wang, P. Allelochemicals released by rice roots and residues in soil. Plant and Soil. 288 (1-2), 47-56 (2006).
- Ervin, G. N., Wetzel, R. G. Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae). American Journal of Botany. 87 (6), 853-860 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved