このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
免疫蛍光を用いたTNBS誘発クローン病を用いたマウスの結腸におけるエストロゲン受容体の可視化
要約
このプロトコルは、クローン病の完全に検証されたTNBS誘導マウスモデルと、パラフィンに埋め込まれたホルマリン固定結腸切片の免疫蛍光を用いた免疫体化学によるエストロゲン受容体の視覚化方法を提示する。
要約
クローン病は炎症性腸疾患の最も診断されたタイプです。腸内で発症する慢性炎症は、蠕動障害および腸粘膜の損傷を引き起こし、結腸新生物の変態のリスクの増加に関連していると思われる。蓄積された証拠は、エストロゲンとエストロゲン受容体がホルモン感受性組織だけでなく、肺や結腸などのエストロゲンに直接関係しない他の組織にも影響を与えることを示しています。ここでは、TNBS誘発クローン病のマウスモデルから得られた結腸におけるエストロゲン受容体の免疫蛍光染色に成功するためのプロトコルについて説明する。マウスおよび腸の準備におけるクローン病の誘導のための詳細なプロトコルと、ホルマリン固定パラフィン埋め込み腸切片を用いたステップバイステップの免疫ヒストリカル手順が提供される。記載された方法は、生体内でのエストロゲン受容体検出およびエストロゲンシグナル伝達の調査に有用であるだけでなく、大腸炎の発症に関与する可能性のある他のタンパク質にも適用することができる。
概要
クローン病(CD)は、慢性腸炎として現れる炎症性腸疾患(IBD)である。CDの病因は十分に理解されていないが、腸内微生物叢、食事やストレスなどの遺伝的および環境的要因を含むCDの発達を担っているように見えるいくつかの主要な要因がある1。クローン病の病因をよりよく理解するために、腸の炎症のいくつかのモデルが22、3、4、5、6、73,4,5,6を7使用されています。本稿では、CDの2,4,6-トリニトロベンゼンスルホン酸(TNBS)誘導型マウスモデルから得られた結果を提示する。
エストロゲンは慢性腸炎88、9、10、11、129,10,11を調節できることが12文書化されている。エストロゲンの生物学的活性は、コグネイト受容体によって媒介され、その中でも核エストロゲン受容体(ER)、すなわち、ERα(遺伝子ESR1)およびERβ(遺伝子ESR2)、ならびにGタンパク質結合エストロゲン受容体、すなわちG.GPER(遺伝子GPER1)と呼13,ばれる。エストロゲン受容体のレベルを決定するためのいくつかの方法がありますが、腸内でそれらを視覚化するために使用できるのはごくわずかです。
免疫組織化学(IHC)は、フルオロクロム共役抗体を用いた細胞または組織における特定の抗原の検出に関する臨床および基礎研究で広く使用されている方法です。IHCは、組織構造の可視化や特定のタンパク質の同定と局在化において重要な方法であると考えられるため、大腸炎の発症を理解する上で重要な場合があります。ここでは、免疫蛍光を用いた腸内のエストロゲン受容体の免疫物質化学的可視化のための完全かつ検証されたプロトコルを提示する。
プロトコル
動物研究は、欧州議会および2010年9月22日の理事会の指令2010/63/EUに従って、地方倫理委員会(28/ŁB29/2016)の同意を得て実施されました。
1. クローン病のTNBS誘導マウスモデル
注:このプロトコルは、25〜28 gの雄BALB / Cマウスを使用しています。動物は一定の温度(22〜24°C)で収容され、相対湿度55±5%で収容され、標準的なチャウペレットと水道水アドリビタムへの自由なアクセスを持つ12時間の明暗サイクルで維持されます。
- 誘導室にマウスを置き、蓋をしっかりと閉じます。イソフルラン(1.5-2 L/分でO2流量で25%O2)でマウスを短時間麻酔します。
注意:呼吸数は通常よりもリズミカルで遅く、有害な刺激に反応して変化してはならない。 - カテーテルを介して遠位結腸に車体制御として0.9%NaClまたは0.9%NaClの0.1mLの30%エタノールで0.1mLの30%エタノールの4mgを植え付ける。
注:カテーテルは約3cmのアヌスに慎重に導入する必要があります。 - 体重、直腸出血、便の一貫性および死亡率を含む臨床パラメータのために2日目から8日目まで毎日マウスを監視する。
- 8日目に、頸部脱臼でマウスを安楽死させる。
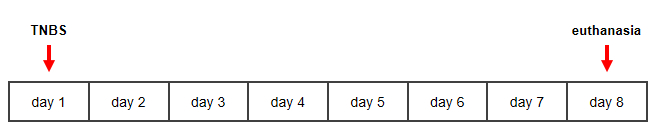
図1:クローン病のTNBS誘発ネズミモデルのタイムラインこの図の大きなバージョンを表示するには、ここをクリックしてください。
2. 結腸の分離と巨視的評価
注:結腸分離の1日前に、1mLのリン酸緩衝塩水(PBS)で抗生物質100μLを希釈し、一晩4°Cで放置します。
- 75%エタノールと滅菌ガーゼを使用して腹部の上に皮膚をきれいにします。
- 無菌はさみとピンセットを使用して、胸骨からアヌスに腹壁を切断します。
- 結腸をできるだけ近くに切り取り、盲腸に近づけます。
- ペトリ皿の上にコロンを置きます。アヌスからセカムの端に沿って結腸をカットします。冷たい抗生物質-PBS溶液で2〜4回、結腸をきれいに洗浄し洗浄します。
- 表1に記載のキャリパーを用いて巨視的評価を行う。
注:組織接着*および紅斑/出血#、便血#および下痢#は視覚的評価の対象となります。*組織接着は3点スケール(0:組織接着なしの結腸、1:中等度の組織接着を伴う結腸、2:広範な組織接着を有する結腸)を用いて評価する。#紅斑/出血、便血および下痢の欠欠席(0)または存在(1)に基づく。
| 接着* | 紅斑/出血# | 胎児の血# | 下痢# | 潰瘍の長さ | コロンの厚さ | コロンの長さ |
| ポイント (0 ~ 2) | ポイント (0 ~ 1) | ポイント (0 ~ 1) | ポイント (0 ~ 1) | cm/ポイント | mm/ポイント | cm/ポイント |
| 0 – 不在 | 0 – 不在 | 0 – 不在 | 0 – 不在 | 0.5 cm = 0.5 ポイント | n mm = nポイント | 0 – <コントロールより 10% 短い |
| 1 – 中程度 | 1 – 現在 | 1 – 現在 | 0.5 – わずかな/緩い便 | 1 – コントロールよりも10~20%短い | ||
| 2 – 現在 | 1 – 現在 | 2 – コントロールよりも20%以上短い |
表1:クローン病のTNBS誘発モデルを用いたマウスの腸管のマクロスコピックスコアリング。
- 0.5cmの潰瘍を0.5ポイントとしてカウントされる、センチメートル単位の潰瘍の長さを1センチメートルに変換し、すなわち、0.5cmの潰瘍毎に数える。コロンの厚みをミリメートル単位でポイントスケールに変換します。すなわち、nmmごとにn点nに相当します。
- コロンの長さをセンチメートル単位で 3 ポイントスケールで変換します。TNBS誘発クローン病を有する各マウスから得られた結腸の長さは、対照群の平均結腸長に関連して評価される(0:<10%コントロールより短く、1:コントロールより10〜20%短く、2:20%以上短いコントロール)。
- 合計巨視スコア=接着(ポイント)+紅斑/出血(ポイント)+便の血液(ポイント)+下痢(ポイント)+潰瘍の長さ(ポイント)+結腸厚(ポイント)+コロン長(ポイント)に従って合計巨視スコアを計算します。
3. コロンサンプル調製
- コロンを1〜2cmの断片に切り、適切にラベル付けされた組織学的カセットにスポンジの上にそれぞれを置きます。
注:組織学的カセット用スポンジは、脱水中の結腸折りたたみを防ぎ、液体パラフィン中のインキュベーションを防ぎます。 - 4%ホルムアルデヒドにコロン断片を入れ、4°Cで少なくとも24時間インキュベートする。
- 50%、70%、90%、95%、100%エタノール、キシレン/100%エタノール(1:1;v/v)、キシレンのみ、および液体パラフィン中のインキュベーションの少なくとも3時間のために、1時間のインキュベーションのためのティッシュプロセッサを準備し、プログラムします。
注:脱水はエタノールとキシレンの濃度を上げる上で行う必要がありますが、エタノールの濃度は変更することができます。キシレン/エタノール混合物は推奨されるが、必須ではない。 - 大腸片を組織学的ボックスに移し、事前にプログラムされた組織プロセッサに入れる。
- ティッシュプロセッサを実行します。
- インキュベーションステップの後、コロンの両端が直立した位置になるように、コロンフラグメントを金属鋳型に入れ、金型の3分の1を液体パラフィンで満たします。
- 金型を冷却領域(-5°C)に数秒間置き、金型を加温領域(70°C)に移動させます。組織学的な箱の下部に置き、液体パラフィンで全体のコロン断片をカバー.
- 金属のカビをパラフィンに入れて、冷却区域に数分間放置します。パラフィンブロックから金属モールドを取り出し、4°Cで少なくとも24時間インキュベートします。
- ブロックから余分なパラフィンを取り除き、完全に自動化されたロータリーミクロトームに挿入します。
注:パラフィンブロックは、このステップの前に数分-20 °Cで保存することができます。 - コロンフラグメントを5μmのセクションに切ります。
- コロン部を40°Cに予熱した水浴に移す。
- ラベル付きガラススライドを使用して、水浴からコロンセクションを取り除きます。
注:コロンセクションは水の上に浮かびます。ラベル付きのガラススライドをコロンセクションの下の水に入れ、慎重にガラススライドを引き出します。 - ガラススライドを室温で24時間放置します。長期保存の場合は、室温で24時間インキュベーションした後、ガラススライドを4°Cに保ちます。
4. 免疫蛍光染色による免疫染色
メモ:手順中にコロンセクションを乾燥させないでください。
- ガラススライドをキシレンで5分間インキュベートしてパラフィンを取り除き、このステップを3回繰り返します。
- ガラススライドをキシレン/100%エタノール(1:1;v/v)に5分間置き、このステップを3回繰り返します。
- 一連の減少エタノール濃度で結腸部を水分補給し、すなわち、70%、50%、30%および10%エタノールを5分間、各ステップを3回繰り返す。
- ガラススライドを流水の下で5分間すすります。
- 抗原検索バッファー(10 mM クエン酸ナトリウム;0.05% Tween 20, pH 6.0)を 95~98 °C に予熱し、10 分間沸騰抗原検索液でガラススライドを加熱します。
注: 抗原検索の手順はオプションですが、推奨されます。マスキング解除液は、実験で使用される抗体に応じて最適化する必要があります。 - 疎水性ペンを使ってコロン部分の周りに円を描きます。
注: この手順はオプションですが、推奨されます。疎水性ペンは、液体を円とマークした内部の小さな体積にプールし続けることで、試薬の無駄を防ぎます。 - ペルオキシダーゼの水溶液を3%で10分間インキュベートします。
- 洗浄液(50 mM Tris-HCl、pH 7.4;150 mM NaCl;0.05%トゥイーン20)で5分間洗浄します。
- インキュベートインキュベート溶液(5%正常ヤギ血清;50 mM Tris-HCl、pH 7.4;150 mM NaCl;0.05%トリトンX-100)を室温で1時間培養する。
注:ブロッキング溶液では、正常血清は二次抗体と同じ種からでなければなりません。インキュベーションが必要な段階では、ガラススライドを湿度室に入れて過度の蒸発を防ぎます。 - ブロッキング溶液を除去し、50 mM Tris-HCl、pH 7.4、150 mM NaCl、0.05%トリトンX-100を用いて1%ウシ血清アルブミンで希釈したERα、ERβまたはGPERに対して20〜50μLの一次抗体を添加する。
注: 一次抗体の推奨希釈を表 2に示します。
| 抗体タイプ | に対する抗体 | クローン性 | 宿主種 | 種反応性 | 希釈 |
| プライマリ | ERα | ポリクローナル | ウサギ | 人間 | 1:100 |
| マウス | |||||
| カメ | |||||
| カピバラ | |||||
| ERβ | ポリクローナル | ウサギ | 人間 | ||
| 猿 | |||||
| ラット | |||||
| マウス | |||||
| 羊 | |||||
| 豚 | |||||
| グッパー | ポリクローナル | ウサギ | 人間 | ||
| ラット | |||||
| マウス | |||||
| セカンダリ | ダイライト 650 | ポリクローナル | ヤギ | ウサギ | 1:250 |
表2:抗体の特性。
- 一次抗体を暗闇の中で4°Cで一晩インキュベートする。
- 抗体溶液を取り除き、洗浄液(50 mM Tris-HCl、pH 7.4;150 mM NaCl;0.05%Tween 20)で5分間洗浄し、このステップを3回繰り返します。
- 1%のウシ血清アルブミンで希釈されたDyLight 650二次抗体の20-50 μLを加える(50 mM Tris-HCl、pH 7.4、150 mM NaCl、0.05%トリトンX-100を含む)。暗い温度で1時間色素と共役した二次抗体とインキュベートする。
注: 二次抗体の推奨希釈を表 2に示します。 - 抗体溶液を取り除き、洗浄液(50 mM Tris-HCl、pH 7.4、150 mM NaCl、0.05%Tween 20)を5分間洗浄し、このステップを3回繰り返します。
- 50 mM Tris-HCl、pH 7.4、150 mM NaCl に希釈した2%のDiOC6(3)を加え、暗闇の中で室温で10分間インキュベートします。
- 溶液を取り除き、洗浄液(50 mM Tris-HCl、pH 7.4、150 mM NaCl、0.05%Tween 20)で5分間洗浄し、このステップを3回繰り返します。
- DAPIを直接コロンセクションに入れたグリセロール系液体を数滴加え、カバースライドで慎重に覆います。4°Cで少なくとも24時間結腸部をインキュベートする。
メモ:カバースライドでティッシュを覆うときは気泡を避けてください。 - 20xまたは63xの目的を特徴とする共焦点顕微鏡の下で結腸セクションを分析し、専用のソフトウェアを使用して油浸漬を行います。
注:表 3は、この研究で使用される蛍光色素の特性を示しています。
| フルオロホホームタイプ | 波長 (nm) | 染料 | |
| 励起 | 排出 | ||
| ダピス | 405 | 460 – 480 | 青 |
| ディオク6 (3) | 485 | 538 – 595 | 緑 |
| ダイライト 650 | 654 | 660 – 680 | 赤 |
表3:フッ素色素の特性
結果
TNBS誘発クローン病を有するマウスにおける結腸のマクロ的特徴
コントロールマウスおよびTNBS処置マウスから採取したコロンの代表的な画像を図2に示す。クローン病のTNBS誘発モデルを有するマウスでは、結腸の幅が増加する間、結腸の長さが減少する。
ディスカッション
IBD病態生理学検査には、遺伝的、免疫学的または自発的なモデル、ならびに化学的に誘発されたモデル15を含む多数の動物モデルがある。大腸炎のいくつかのタイプの動物モデルの中でも、このプロトコルに記載されているTNBS誘導モデルのような化学的に誘発されたモデルは、比較的安価で入手しやすい。大腸炎のTNBS誘発マウスモデルには、CDの病理学的基礎に関連するい?...
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、ウッチ大学当局の財政支援のおかげで発表されました: 科学研究副学長, 国家と国際協力のための副学長と生物学と環境保護学部の学部長.ダミアン・ジャセニクは、ポーランド国立科学センターからの助成金(2017/24/T/NZ5/00045と2015/N/NZ5/00336)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Animals | |||
| BALB/C mice | University of Lodz | NA | |
| Equipment | |||
| Caliper | VWR | 62379-531 | |
| Cardboard block | NA | NA | |
| Confocal microscope - TCS SP8 | Leica Biosystems | NA | |
| Fully automated rotary microtome - RM2255 | Leica Biosystems | NA | |
| Glass slide | Thermo Scientific | J1800BMNT | |
| Heated Paraffin Embedding Module - EG1150 H | Leica Biosystems | NA | |
| Histological box | Marfour | LN.138747 | |
| Hydrophobic pen | Sigma-Aldrich | Z377821 | |
| Laboratory balance | Radwag | WL-104-0048 | |
| LAS X software | Leica Biosystems | NA | |
| Metal mold | Marfour | CP.5105 | |
| Sterile gauze | NA | NA | |
| Sterile scissor | NA | NA | |
| Sterile tweezer | NA | NA | |
| Tissue processor - TP1020 | Leica Biosystems | NA | |
| Reagents | |||
| 2, 4, 6-trinitrobenzene sulfonic acid | Sigma-Aldrich | 92822 | |
| Bovine serum albumin | Sigma-Aldrich | A3294 | |
| DiOC6 (3) | Sigma-Aldrich | 318426 | |
| DyLight 650 secondary antibody | Abcam | ab96886 | |
| ERα primary antibody | Abcam | ab75635 | |
| ERβ primary antibody | Abcam | ab3576 | |
| Ethanol | Avantor Performance Materials Poland | 396480111 | |
| Formaldehyde | Avantor Performance Materials Poland | 432173111 | |
| GPER primary antibody | Abcam | ab39742 | |
| Hydrochloric acid | Avantor Performance Materials Poland | 575283421 | |
| Hydrogen peroxidase | Avantor Performance Materials Poland | 885193111 | |
| isoflurane (forane) | Baxter | 1001936040 | |
| Normal goat serum | Gibco | 16210064 | |
| Paraffin | Leica Biosystems | 39602012 | |
| Petrie dish | Nest Scientific | 705001 | |
| Phosphate buffer saline | Sigma-Aldrich | P3813 | |
| Physiological saline | Sigma-Aldrich | 7982 | |
| Primocin (antibiotic) | Invitrogen | ant-pm-1 | |
| ProLong Diamond Antifage Mountant with DAPI (glycerol-based liquid with DAPI) | Invitrogen | P36971 | |
| Sodium chloride | Chempur | WE/231-598-3 | |
| Sodium citrate | Avantor Performance Materials Poland | 795780429 | |
| Tris | Avantor Performance Materials Poland | 853470115 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| Xylene | Avantor Performance Materials Poland | BA0860119 |
参考文献
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Morris, G. P., et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 96 (3), 795-803 (1989).
- Okayasu, I., et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98 (3), 694-702 (1990).
- Boirivant, M., Fuss, I. J., Chu, A., Strober, W. Oxazolone colitis: a murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. Journal of Experimental Medicine. 188 (10), 1929-1939 (1998).
- Morrissey, P. J., Charrier, K., Braddy, S., Liggitt, D., Watson, J. D. CD4+ T cells that express high levels of CD45RB induce wasting disease when transferred into congenic severe combined immunodeficient mice. Disease development is prevented by cotransfer of purified CD4+ T cells. Journal of Experimental Medicine. 178 (1), 237-244 (1993).
- Kühn, R., Löhler, J., Rennick, D., Rajewsky, K., Müller, W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 75 (2), 263-274 (1993).
- Sundberg, J. P., Elson, C. O., Bedigian, H., Birkenmeier, E. H. Spontaneous, heritable colitis in a new substrain of C3H/HeJ mice. Gastroenterology. 107 (6), 1726-1735 (1994).
- Harnish, D. C., et al. Beneficial effects of estrogen treatment in the HLA-B27 transgenic rat model of inflammatory bowel disease. American Journal of Physiology Gastrointestinal and Liver Physiology. 286 (1), 118-125 (2004).
- Pierdominici, M., et al. Linking estrogen receptor β expression with inflammatory bowel disease activity. Oncotarget. 6 (38), 40443-40451 (2015).
- Włodarczyk, M., et al. G protein-coupled receptor 30 (GPR30) expression pattern in inflammatory bowel disease patients suggests its key role in the inflammatory process. A preliminary study. Journal of Gastrointestinal and Liver Diseases. 26 (1), 29-35 (2017).
- Mohammad, I., et al. Estrogen receptor α contributes to T cell-mediated autoimmune inflammation by promoting T cell activation and proliferation. Science Signaling. 11 (526), eaap9415 (2018).
- Jacenik, D., et al. G protein-coupled estrogen receptor mediates anti-inflammatory action in Crohn's disease. Scientific Reports. 9 (1), 6749 (2019).
- Prossnitz, E. R., Barton, M. The G protein-coupled estrogen receptor GPER in health and disease. Nature Review Endocrinology. 7 (12), 715-726 (2011).
- Yaşar, P., Ayaz, G., User, S. D., Güpür, G., Muyan, M. Molecular mechanisms of estrogen-estrogen receptor signaling. Reproductive Medicine and Biology. 16 (1), 4-20 (2016).
- Pizarro, T. T., Arseneau, K. O., Bamias, G., Cominelli, F. Mouse models for the study of Crohn's disease. Trends in Molecular Medicine. 9 (5), 218-222 (2003).
- Neurath, M. F., Fuss, I., Kelsall, B. L., Stüber, E., Strober, W. Antibodies to interleukin 12 abrogate established experimental colitis in mice. Journal of Experimental Medicine. 182 (5), 1281-1290 (1995).
- Ikeda, M., et al. Simvastatin attenuates trinitrobenzene sulfonic acid-induced colitis, but not oxazalone-induced colitis. Digestive Diseases and Sciences. 53 (7), 1869-1875 (2007).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral Maxillofacial Pathology. 16 (3), 400-405 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved