このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リゾ脂質含有温度感受性リポソームのマイクロ流体生産
要約
このプロトコルは、千鳥ヘリンボーンマイクロミキサーマイクロ流体装置を用いて、熱感知リポソームを調製するための最適化されたパラメータを提示する。また、リポソームへのドキソルビシンとインドシアニングリーンの共封、および制御/誘発薬物放出のためのドキソルビシンの光熱誘発放出も可能になる。
要約
提示されたプロトコルは、ドキソルビシン(DOX)などの化学療法薬をロードすることができる低温感受性リポソーム(LTSLs)の高スループット連続調製を可能にする。これを達成するために、エタノール性脂質混合物および硫酸アンモニウム溶液を、ずらしたヘリンボーンマイクロミキサー(SHM)マイクロ流体装置に注入する。この溶液は、SHMによって迅速に混合され、リポソームの自己集合体に均質な溶媒環境を提供する。収集されたリポソームは、まずアニールされ、次いで透析して残留エタノールを除去する。サイズ排除クロマトグラフィーを用いて、外部溶液のバッファー交換により硫酸アンモニウムpH勾配を確立します。その後、DOXは高いカプセル化効率(>80%)でリポソームに遠隔負荷されます。得られたリポソームは、Z平均直径100nmのサイズが均一である。それらは穏やかな温熱(42 °C)の存在の封入されたDOXの温度誘発の破裂解放が可能である。また、近赤外線レーザートリガDOX放出のために、インドシアニングリーン(ICG)をリポソームに共装することもできる。マイクロ流体アプローチにより、高スループット、再現性、拡張性に優れたLTSLの準備が可能になります。
概要
LTSL製剤は、化学療法薬ドキソルビシン(DOX)を送達するために開発された臨床的に関連するリポソーム製品であり、臨床的に達成可能な軽度の温熱療法(T≈ 41°C)1での効率的なバースト薬物放出を可能にする。LTSL製剤は、1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC)、リソ脂質1-ステアロイル-2-ヒドロキシ-sn-グリセロ-3-ホスファチジルコリン(MSPC;Mは「モノ」)およびPEGylatelated脂質1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン-N-[メトキシ(ポリエチレングリコール)-2000](DSPE-PEG2000)を表す。相転移温度(Tm≈ 41°C)に達すると、リソリピッドとDSPE-PEG2000が共に膜細孔の形成を促進し、薬物2のバースト放出をもたらす。LTSLsの調製は、主にバルクトップダウンアプローチ、すなわち脂質膜水和および押出を使用する。臨床用途に十分な量と同じ特性を持つ大規模なバッチを再現可能に準備することは依然として困難です。
マイクロ流体はリポソームを調製する新しい技術であり、チューナブルナノ粒子サイズ、再現性、および拡張性3を提供する。製造パラメータが最適化されると、スループットは、ベンチスケール3、4、5で用意されたものと同じ特性で、並列化によってスケールアップすることができます。従来のバルク技術よりもマイクロ流体の主な利点は、小型化を通じて空間と時間の制御性が高い小さな液体量を処理する能力であり、6の連続的かつ自動化された方法で動作しながら、より速い最適化を可能にする。マイクロ流体デバイスを用いたリポソームの製造は、押出や超音波処理などの均質化プロセスが不要であるため、より時間とエネルギー効率が高いボトムアップナノ沈降アプローチによって達成される7。典型的には、脂質(例えばエタノール)の有機溶液(および疎水性ペイロード)は、混和性の非溶媒(例えば水および親水性ペイロード)と混合される。有機溶媒が非溶媒と混合すると、脂質に対する溶解度が低下する。脂質濃度は、最終的に沈殿プロセスが引き起こされる臨界濃度に達する7.最終的に脂質のナノ沈殿物は大きさに成長し、リポソームに近い。リポソームの大きさと均質性を左右する主な要因は、非溶媒と溶媒の比率(すなわち水性-有機流量比;;FRR)とリポソームへの脂質の自己集合中の溶媒環境の均質性を8にする。
マイクロ流体の効率的な混合は、したがって、均質なリポソームの調製に不可欠であり、および異なる用途9に使用されているミキサーの様々な設計。ずれたヘリンボーンマイクロミキサー(SHM)は、低希釈因子で(mL /分の範囲で)高いスループットを可能にするパッシブミキサーの新世代の1つを表します。これは従来のマイクロ流体流体混合装置8、10に優れている。SHMは、カオスの対流9、11によって流体を迅速に混合するヘリンボーン溝をパターン化しました。SHMの短い混合タイムスケール(< 5 ms、典型的な凝集時間スケール10〜100 ms未満)は、均一な溶媒環境で脂質自己集合が起こり、均一なサイズ分布3、12のナノ粒子を生成することを可能にする。
しかし、マイクロ流体を用いたLTSLsの調製は、コレステロール8の欠如による従来のリポソーム製剤に比べてそれほど簡単ではなく、脂質二重層がエタノール誘発間桁化を受けやすい13、14、15ではない。これまで、リポソームのマイクロ流体生産時に生じる残留エタノールの効果は十分に理解されていなかった。報告された製剤の大半は、本質的に、LTSLsとは異なり、飽和およびコレステロールフリーである(コレステロールまたは不飽和脂質を含む)間桁に耐性である。
本明細書に提示されるプロトコルは、温度誘発放出薬物送達のためのLTSLsを準備するためにSHMを使用する。この方法では、マイクロ流体調製LTSLsをナノサイズ(100 nm)および動的光散乱(DLS)によって均一(分散度<0.2)にすることを確認しました。さらに、LTSL脂質二重層の完全性の検証として、膜貫通アンモニウム硫酸勾配法(遠隔負荷とも呼ばれる)17を用いてDOXを封入した。DOXのリモートローディングでは、リポソームが高いカプセル化効率(EE)を達成するためにpH勾配を維持する必要があり、これはそのままの脂質二重層なしで起こる可能性は低い。この提示された方法では、典型的なマイクロ流体リポソーム調製プロトコルとは異なって、エタノールを除去して遠隔ローディング能力を可能にするために、アニーリングステップが必要である。すなわち、脂質二重層の完全性を回復する。
前述のように、親水性および疎水性ペイロードは、LTSLsの形成中にペイロードを同時にカプセル化するための初期溶液にも導入することができる。概念実証として、有望な光熱剤でもあるFDA承認の近赤外蛍光色素であるインドシアニングリーン(ICG)が最初の脂質混合物に導入され、LTSLsに共装することに成功しました。808 nmレーザーはDOX/ICG搭載LTSLsを照射し、5分以内にDOXの光熱加熱誘発バースト放出を誘発するのに使用される。
すべての機器と材料は、市販され、すぐに使用でき、カスタマイズの必要はありません。LTSLを処方するためのすべてのパラメータが最適化されているので、このプロトコルに従って、マイクロ流体の予備知識を持たない研究者は、熱感知薬送達システムの基礎となるLTSLsを準備することもできます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 機器のセットアップ
- 次のようにシリンジポンプとSHMを組み立てます。
- ポンプネットワークケーブルを使用して、二次シリンジポンプの「コンピュータへ」ポート(ポンプ02、水溶液用)をマスターシリンジポンプの「ネットワークへ」ポート(ポンプ01、エタノール脂質溶液用)に接続します(図1、黄)。
- コンピュータの「RS232 シリアル」ポートにマスターポンプの「コンピュータへ」ポートを接続し、PC to Pump ネットワークケーブル (図1、青) を使用します。
- ナットとフェルールを使用して、SHMの各入口と出口にチューブを接続します。別のナットとフェルールと組合アセンブリを使用して、両方の入口のチューブの端子をメスルアーに変換します。入口の長いチューブにより、シリンジへの取り付けが容易になります(図2)。
- ポンプ制御ソフトウェアをセットアップします。
- マスターシリンジポンプと二次シリンジポンプのアドレスを、それぞれ「Ad:01」と「Ad:02」に、注射器ポンプの「セットアップ」ボタンを使用して割り当てます。これは初めて行う必要があります。
- コンピュータでポンプ制御ソフトウェアを開きます。2つのシリンジポンプは自動的に検出され、ビープ音が鳴ります。それ以外の場合は、[ポンプと検索ポンプ]をクリックして接続を更新します。(図3)。
- 「HSW ノルムジェクト 5 cc (Dia=12.45)」を選択して、直径を 12.45 (mm) に割り当てます。
- ポンプ01(エタノール脂質溶液)の場合は0.25 mL/分、ポンプ02の場合は0.75 mL/分(水溶液)に割り当てます。流量は総流量(TFR)1mL/分、水対エタノール間流量比(FRR)は3です。
- ボリュームを 5 mL より大きい値に割り当てます。
注: ターゲットの注入量は、チューブの空隙体積を考慮して、ロードされた液体ボリュームよりも大きく設定されています。 - 両方のポンプに対して INF (注入) モードを選択します。
- 設定を押して設定を確定します。
2. LTSLs を準備する
- LTSL10またはLTSL10-ICG脂質混合物を調製する(表1参照)。
- 2つの5 mLルアーロックシリンジを用いて、1mLの脂質混合物と少なくとも3mLの(NH4)2SO4溶液を回収する。
- 2本の注射器を直立位置のシリンジポンプに取り付け、注射器のバレルフランジをポンプのシリンジリテーナーにスライドさせ、シリンジのプランジャーフランジをポンプのプッシャーブロックに取り付けます(図4)。
- 加熱テープの端を水溶液でシリンジに巻きます。加熱テープのもう一方の端とサーモスタットの温度プローブを脂質溶液でシリンジの周りに巻きます。アセンブリプロセスを容易にするために、空のシリンジを配置してこのステップを練習すると便利です(図5A)。
- SHMの対応する入口の女性ルアーアダプターに2本の注射器を接続します。脂質混合物と(NH4)2SO4溶液を含む注射器がそれぞれエタノール入口および水性入口に接続されていることを確認してください。プランジャの位置を調整して、シリンジから気泡を取り除きます(図5B)。
メモ:シリンジがポンプのシリンジリテーナーにしっかりと固定されていることを確認してください。 - 10 sの加熱セッションを使用して、加熱テープを使用して51°C以上に注射器を加熱します。サーモスタットに注射器の温度を更新させます。注入中の温度を維持するには、次の手順でこの手順を繰り返します。
注意: 温度のオーバーシュートを防ぎ、サーモスタットが実際の温度を更新できるように、10 s後に加熱テープをオフにします。加熱テープは、温度が非常に迅速に上昇するので、注意して処理する必要があります。連続的に加熱すると、測定温度を更新するためのサーモスタットの時間遅延により、機器およびシリンジが損傷する可能性があります。 - 温度が51 °Cを超えたら、ポンプ制御ソフトウェアで[すべて実行]を押してシリンジポンプを実行します(図3)。
- 流体の流れが気泡や漏れがないことを確認します。排出口から液体の初期量(約0.5mL)を廃棄物として処分します。
注:この初期廃棄物量は明確ではなく、液体がチューブとSHMを通ってコンセントに移動する流体の体積であるセットアップの内部容積に依存します。 - リポソームサンプルとして残りの液体をマイクロ遠心管またはビジューバイアルに回収します。
- 注射器のどちらかの液体がほとんど空の場合は、注入を一時停止/停止します。
注:ポンプは、注射器が空のときに正確に位置を検出しない可能性があるため、手動で停止する必要があります。 - 収集したリポソーム溶液を60°Cの水浴に入れ、1.5時間アニールします。
注:このステップは、リポソームへの薬物のロードを可能にするために不可欠です。 - 透析チューブにソリューションを転送します。240 mMの1 L(NH4) 2SO4で37°Cで少なくとも4時間の溶液を透析し、精製リポソームを得た。
注: ここでプロトコルを一時停止できます。この工程におけるリポソームはリン脂質の5mMである。精製されたリポソームは4°Cで保存することができる。 - 繰り返し使用するためにSHMを洗浄するには、脱イオン水、エタノール、窒素ガスで乾燥してSHMを順次洗い流します。
3. 膜貫通pH勾配によるLTSLsへのDOXのリモートローディング
- サイズ排除クロマトグラフィー(SEC)を用いて、LTSLsの外用緩衝液をHEPES緩衝生理食糸(HBS)に交換し、膜貫通pH勾配を確立する。
- SEC 列の上部に合計 25 mL の HBS を追加して、列を準備します。すべての溶出剤が柱を通して溶出し、溶出剤を処分できるようにします。
- ステップ2.12から調製した1mLの透析リポソームをカラムに加え、溶出した部分を処分する。
- 1.5 mLのHBSをカラムに追加し、溶出します。
- 3 mLのHBSをカラムに追加し、3 mLの溶出を集めます。
注: ここでプロトコルを一時停止できます。リポソームは、このステップで収集され、リン脂質の1.67 mMにある。バッファー交換リポソームは4°Cで保存することができる。
- ドキソルビシン(DOX)を使用してLTSLをインキュベートし、LTSLを精製します。
- DOX溶液を1:20 DOX-リン脂質モル比でビジューバイアルに含まれるバッファー交換リポソーム溶液(1.67 mmol)の1 mLに添加します。これは、1 mg/mL DOX溶液(83.4 μmol)の48.4 μLを添加することで達成できます。
- 37 °Cの水浴にビジューバイアルを1.5時間入れ、DOXをリポソームに装填できるようにします。
- 10 μL のリポソームと 170 μL の HBS と 20 μL の 1% (v/v) トリトン X-100 溶液を黒の 96 ウェルプレートに混ぜます。3つの井戸のために繰り返します。これらの井戸は、DOX含有量を「浄化前」に対応する。
- LTSL10-ICGを調製する場合は、リポソームの40 μLを160μLのDMSOと透明な96ウェルプレートに混ぜます。3つの井戸のために繰り返します。これらのウェルは、ICG含有量が「精製前」に対応する。
- ステップ3.1で説明したリポソーム溶液を精製する。
注: 後で精製するためにカラムを再利用するには、ステップ 3.1.1 を実行する前に、希釈した 0.5 M NaOH 溶液を 1 mL 追加して、フリー DOX からカラムをクリーニングします。赤の無料DOXは、素早く紫色の青と溶け出しを行います。 - 精製されたリポソーム溶液の30 μLを150 μLのHBSと20 μLの1%(v/v)トリトンX-100溶液を黒い96ウェルプレートに混ぜます。3つの井戸のために繰り返します。これらの井戸は、DOX含有量「精製後」に対応する。
- LTSL10-ICGの場合、精製されたリポソーム溶液の40μLをDMSOの160μLと透明な96ウェルプレートに混ぜ合わせます。3つの井戸のために繰り返します。これらのウェルは、ICG含有量「精製後」に相当する。
- マイクロプレートリーダー(λex = 485nm、λ = 590 nm)を用いて、精製前(ステップ3.2.3)および(ステップ3.2.5)後のウェルのDOX蛍光強度を測定します。
- 精製前後の蛍光強度の比を取り込んで、DOX(DOX EE)のカプセル化効率を算出します。
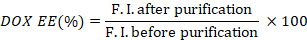
- マイクロプレートリーダー(600〜1000 nm)を使用して、精製前後のウェルのICG吸光度を測定します。
- ICG(ICG EE)のカプセル化効率を算出し、精製前後792nmでの吸光度の比をとり、精製中の希釈倍率(3回)を考慮に入れる。

4. ダイナミック光散乱(DLS)
- 50 μLのリポソーム溶液(ステップ2.12)を450μLの脱イオン水に添加します。
- DLS機器の内部にキュベットを入れ、メーカーの指示に従って測定を行います。
- 各サンプルの3つの測定値の平均Z平均直径と分散度を記録します。
5. 差動走査熱量測定(DSC)
- リポソーム試料の1mL(ステップ2.12)を0.5mL(最終脂質濃度10mM)に遠心フィルターユニットで濃縮した。固定角度ローターを使用して、7500 x gで約15分間スピンします。
- 20 μLの(NH4)2SO4溶液とリポソームサンプルを2つのそれぞれのDSCパンに移す。DSCサンプルプレスキットを使用して、DSCハーメチックリッドで鍋を密封します。
- 差動走査熱量計を用いて、1°C/分の加熱速度で30°Cから60°Cまでのサンプルを測定してください。
- 適切なソフトウェアでデータを分析します。最大勾配点の接線のx切片によって測定される相転移(融点)の発症として相転移温度(Tm)をとる。
6. ドキソルビシンの放出
- 湯浴を用いて、HBSを所定の温度(37または42°C)で予熱します。サンプルを焼き抜く氷水浴を準備します。
- 微小遠心分離管に1.9 mLのHBSに精製されたDOXを積載したリポソーム(ステップ3.2.5)を100μL加えます。指定温度の水浴にチューブを入れます。
- すぐに200 μLのサンプルをチューブから取り出し、すぐに氷水浴に入れ、その後の薬物放出を急いでください。このサンプルは、初期 (t = 0) の時間点に対応します。
- 200 μLのサンプルを、その後の時点(t = 5、10、15、30、60分)に引き出し、すぐに氷水浴に入れ、薬物放出を急いで消します。
- 各時点のサンプル50μLと150μLのHBSを黒い96ウェルプレートに混ぜます。プレートリーダーを使用してDOX蛍光強度を測定します。
- ステップ6.5で準備されたランダム選択された井戸に1%(v/v)トリトンX-100の20 μLを加えます。プレートリーダーを使用して、これらのウェルのDOX蛍光強度を測定します。これらの値は、完全リリース (t = ∞; 100% リリース) のタイム ポイントに対応します。
- 各時点 (I(t)) の蛍光強度を補間して放出される DOX の割合を計算し、初期 (I(0)) と比較して、完全に解放された値 (I(∞)) と比較してプロットします。
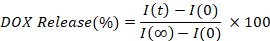
7. レーザー加熱とリリースのトリガ
- 水槽の温度を37°Cに設定し、温度を安定させます。
- 200 μL の DOX 搭載 LTSL10-ICG ([ICG] = 10 μg/mL) を透明の 96 ウェルプレートに加え、水浴に入れ、底部を水に浸しておいてください。
- レーザーシステムの電流を2.27 Aに設定し、レーザーシステムのコリメータを96ウェルプレートの表面より5cm上に垂直に置きます。
注意: レーザーシステムは、関連するレーザー安全対策に準拠して動作する必要があります。 - レーザーのスイッチを入れ、光ファイバー温度プローブを使用して毎分温度を監視します。
- 5分と10分で、透明な96ウェルプレートからレーザー照射リポソーム10μLを引き出し、黒い96ウェルプレートの3つの井戸に対して190 μLのHBSと混合します。
- 170 μL の HBS と 20 μL の 1% (v/v) トリトン X-100 溶液を黒の 96 ウェルプレートに 3 つのウェルに対して 10 μL 混合します。これらの井戸は「100%リリース」DOXコンテンツに対応しています。DOX蛍光強度を測定し、ステップ6.7で説明されているようにDOX放出を計算します。
Access restricted. Please log in or start a trial to view this content.
結果
マイクロ流体によるLTSLsの調製には、DPPC/MSPC/DSPE-PEG 2000(80/10/10、モル比;)LTSL10)。図7A(左)は、ステップ2.9から、透明で非粘性の液体として、そのまま調製したLTSL10の外観を示す。LTSL10製剤は、LTSL4(DPPC/MSPC/DSPE-PEG 2000、86/10/4、モル比)から開発され、サンプル中に閉じ込められた大量の気泡によって示されるように、ゲル状の粘性...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
提示されたプロトコルは、千鳥ヘリンボーンマイクロミキサー(SHM)を用いた低温感受性リポソーム(LTSLs)の調製を記述する。LTSL10製剤は42 °Cの臨床的に達成可能な高体温で5分以内にドキソルビシンの温度誘発バースト放出を可能にする。また、DOXの放出を引き起こした光熱加熱のために、インドシアニングリーン(ICG)を共装することもできる。この方法は、(i)SHM11におけるエ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者たちは開示するものは何もない。
謝辞
我々は、前立腺癌英国(CDF-12-002フェローシップ)、および工学物理科学研究評議会(EPSRC)(EP/M008657/1)に資金を提供してくれたことに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
参考文献
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved