Method Article
プロテオミクス施設提出のためのTMTサンプル調製とその後のデータ分析
要約
タンパク質抽出、定量、沈殿、消化、標識、プロテオミクス施設への提出、データ分析の各ステップの詳細情報を含む最適化されたタンデム質量タグ(TMT)標識プロトコルを提示します。
要約
プロテオミクス技術は、疾患、治療、その他の状態がプロテオーム全体に及ぼす影響をグローバルに把握することで、生物学的システムにおける作用機序の理解を助けることができる強力な方法論です。このレポートは、タンパク質サンプルの抽出、定量、沈殿、消化、標識、およびその後のデータ分析のための詳細なプロトコルを提供します。最適化されたTMTラベルプロトコルは、タグラベル濃度が低く、一貫して信頼性の高いデータを実現します。我々は、このプロトコルを用いて、様々なマウス組織(心臓、骨格筋、脳)ならびにインビトロで培養された細胞におけるタンパク質発現プロファイルを評価してきた。また、結果として得られるデータセットから何千ものタンパク質を評価する方法を示します。
概要
用語「プロテオミクス」は、まず、細胞、組織、または生物1のタンパク質補体全体の大規模な特性評価と定義した。プロテオミクス分析は、疾患の発生、治療経路、および健康システムに関与するメカニズムおよび細胞プロセスの調査を可能にし、タンパク質発現レベル2の相対的な定量を行う技術を用いた。このような研究の初期の説明は1975年に発表され、この目的のために2次元ポリアクリルアミドゲル電気泳動(2D-PAGE)の使用を実証した1,3。3この2D法は、電荷(等電集中、IEF)と分子質量(ドデシル硫酸ポリアクリルアミドゲル電気泳動、またはSDS-PAGE)4に基づいてタンパク質を分離4する。何年もの間、各ゲル成分に対して行われた2D-PAGEとそれに続くタンデム質量分析の組み合わせは、これまでに未知のタンパク質発現プロファイル5,6,6を多数同定した最も一般的な非標的タンパク質発現分析技術であった。2D-PAGEアプローチの一般的な欠点は、時間がかかり、疎水性タンパク質に対してはうまく機能せず、かつ感度が低い,7,8に起因して評価されるタンパク質の総数に7制限があることである。
細胞培養におけるアミノ酸による安定同位体標識(SILAC)法は、サンプル9におけるタンパク質の存在量を同定し定量する次の一般的なアプローチとなった。標準的な必須アミノ酸を欠く培地でインキュベートされ、その特定アミノ酸10の同位体標識バージョンで補われた細胞の代謝標識からなる。この技術の利点は、その効率と正確なラベリング9です。SILACアプローチの主な制限は、主に同位体標識の組み込みによって引き起こされる細胞増殖率の低下であり、これはヒト疾患11をモデル化する比較的感受性の細胞株において特に困難であり得る。
2003年には、タンデム質量タグ(TMT)アイソバリックラベルを含む新規かつ堅牢なプロテオミクス技術が分野12に導入された。TMT標識は、相対的なタンパク質発現レベルおよび翻訳後修飾13を検出する感度の増加による強力な方法である。この公開日の時点で、TMTキットは、同時に6、10、11、または16サンプルのラベルを付けることができる開発されています。その結果、生物学的複製を伴う複数条件でのペプチドの存在量を14、15、16,16と同時に測定することができる。14,我々は最近、TMTを使用して、バース症候群(BTHS)17のマウスモデルの心臓プロテオーム17プロファイルを特徴付ける。その結果、遺伝子治療で治療されたBTHSマウスの心臓プロファイルの広範な改善を実証し、BTHSの影響を受けた新しいタンパク質を同定し、心筋症に関与する新しい治療経路を明らかにすることができました。
ここでは、組織サンプルまたは細胞ペレットを用いてTMT定量プロテオミクスの多重化を行う方法について詳しく述べている。標識されたトリプティックペプチドは生の凍結サンプルよりも安定しており、すべてのコアがすべてのサンプルタイプを処理した経験を持っているわけではないため、コアに提出する前にサンプル調製とラベリングを行うと有益であり、実験室でサンプルを準備すると、多くの場合、長いバックログを持つコアの時間を節約できます。このプロセスの質量分析部の詳細な説明については、Kirshenbaumらおよびペルーマルら18,19を18参照してください。
サンプル調製プロトコルは、抽出、定量、沈殿、消化、標識の主要なステップで構成されています。この最適化されたプロトコルの主な利点は、標識のコストを削減し、タンパク質抽出を改善し、高品質のデータを一貫して生成することです。また、TMTデータを分析して、短時間で何千ものタンパク質をスクリーニングする方法を説明します。このプロトコルが、この強力な方法論を研究に組み込むことを他の研究グループに奨励することを願っています。
プロトコル
フロリダ大学の制度的動物ケアと使用委員会は、すべての動物研究を承認しました.
1. 試薬の調製
- CHAPSライシスバッファー(150 mM KCl、50 mM HEPES pH = 7.4、0.1%CHAPS、および1プロテアーゼ阻害剤カクテルタブレット/50 mLバッファー)を準備します。プロテアーゼ阻害剤を含まないバッファーは、4°Cで最大6ヶ月間保存するか、プロテアーゼ阻害剤を1年まで-20°Cで保存してバッファーに保存することができます。
- 100 mM トリエチルランモニウム重炭酸塩(TEAB):1 M TEABの500 μLを4.5mLの超純水に加えます。
- 200 mM トリ(2-カルボクセチル)のホスフィン塩酸塩(TCEP):変性試薬である0.5 M TCEPの70 μLを70 μLの超純水に加えます。その後、1 M TEABの35 μLを加えます。
- 5%ヒドロキシルアミンを調製:50%ヒドロキシルアミン50 μLを450 μLの100 mM TEABに加えます。
2. タンパク質抽出
- IACUC承認プロトコルに従って安楽死させたマウスから四頭筋を分離する。80°Cでフリーズして維持するか、プロトコルをそのまま使用してください。
- 切り取って、新鮮または凍結した四頭筋のマウス組織の約10mgを単離する。骨格筋を使用する場合は、ピンセットを使用して繊維を分離します。あるいは、細胞培養を行う場合は、300 μLのCHAPSライシスバッファーで~3 x 106個の細胞を再中断し、ステップ2.4に進みます。
- 約200 μLの1mmジルコニア/シリカビーズと500 μLのCHAPSライシスバッファーを充填した2 mLチューブを使用して、ビーズディスラプターを使用して組織を均質化します。適切にスケールアップまたはダウン(例えば、250 μLのCHAPSライシスバッファー内の組織の5mg)
- 超音波処理(50%振幅を持つ10 sの10xと氷上の30s間隔)を行い、DNAに結合したタンパク質を放出します。同じDNA分解結果は、1mLシリンジに取り付けられた21G針を通して10xのリセートを通過させること、または37°Cでベンゾナーゼインキュベーション(44 U/mL)で30分間のベンゾナーゼインキュベーション(44 U/mL)を通すことによって、シリンジリシスで達成することができます。
- 4°Cで10分間16,000xgでリgセートを遠心分離し、上清を新しい遠心管に移します。
3. タンパク質測定
- 確立されたプロトコルを使用して上清のタンパク質濃度を決定します (材料表を参照)。
注:2 μg/μLのサンプルを使用するのが最適ですが、濃縮されていないサンプルも使用できます。より少ない濃縮サンプルを使用する場合は、ステップ5.1で還元/アルキル化試薬の量を適切に調整する必要があります。 - CHAPS溶解バッファーを使用して BSA 標準曲線希釈を準備します。
- メーカーの指示に従い、15分後に750 nmで吸光度を読み取ります。
4. 還元・アルキル化試薬処理
- 新しい遠心分離管に条件ごとに200 μgのタンパク質を移し、CHAPSのリシスバッファーを使用して100 μLの最終容積に調整します。タンパク質濃度が低すぎると200μLまでスケールアップすることが可能ですが、還元/アルキル化試薬の量を適切に調整することを忘れないでください。
- 200 mM TCEP の 5 μL を加え、55 °C でサンプルを 1 時間インキュベートします。
- 使用直前に、1本のヨドアセトアセトアミド(すなわち9mg)のチューブを100mM TEABの132μLに溶解して、375mMのヨードアセトアセトアミドを調製します。このソリューションを光から保護します。
- サンプルに5μLの375 mMヨードアセトアセトアミドを加え、光から保護された室温(RT)で30分間インキュベートします。
5. メタノール/クロロホルム沈殿20
- 各100 μLのタンパク質および短い渦サンプルに400 μLのメタノールを加えます。
- RTで10 sのための9,000 x gで遠心分離機。これは、サンプルチューブの側面に堆積した液体を組み込むことである。
- 混合物にクロロホルムの100 μLを加え、短く渦を加えます。サンプルに高濃度のリン脂質がある場合は、200 μL のクロロホルムを使用してください。
- RTで10 sのための9,000 x gで遠心分離機。これは、サンプルチューブの側面に堆積した液体を組み込むことである。
- 300μLの水と渦を激しく加えます。均質な溶液を得ることが重要である。
- 9,000 x gの遠心分離機 RT で 1 分間、チューブをラックに移す際に、レイヤーが乱れないように非常に注意してください。
注:チューブには3つのフェーズが含まれているはずです:1)上層(すなわち、上清)、水とメタノールの混合物。2)中間層(すなわち、相間)、白色沈降タンパク質;3)ボトム層(すなわち、ボトム相)、クロロホルム。 - 上清を慎重に取り除いてください。
- 残りの相相と底相に300μLのメタノールを加えます。激しく渦を流す。
- 9,000 x gの遠心分離機 RT で 2 分間、チューブをラックに移す際に、レイヤーが乱れないように非常に注意してください。
- 上清を慎重に取り除いてください。
- ペレットが少し湿るまで、RTで空気の流れの下でできるだけ多くの液体を吸引する(例えば、真空濃縮器を使用する)ペレットがほんの少し湿るまで(10分程度)。必要な時間はサンプルごとに異なる場合がありますので、評価するために2分ごとにチェックしてください。ペレットは、さらに処理されるまで-80°Cで保管してください。
6. タンパク質消化
- 沈殿したタンパク質ペレットを100 μLのTEABライシスバッファーに再懸濁します。
注:このステップでタンパク質濃度を測定することは任意です。 - 使用直前に、100μgのトリプシンガラスバイアルの底部に100μLのトリプシン貯蔵溶液(50mM酢酸)を加えて1μg/μLトリプシンを調製し、RTで5分間インキュベートします。
- タンパク質100μgあたり2.5μLのトリプシンを加えます。37°Cで一晩サンプルを消化します。このステップは、タンパク質の完全な可溶化に不可欠です。これらの条件は変更しないでください。消化後、標準タンパク質アッセイを用いてタンパク質濃度を測定することは任意である。
7. ペプチド標識
- 使用直前に、TMTラベルキット試薬をRTに平衡化します。
- 各チューブに41μLの無水アセトニトリルを加えて、0.8mgのTMTタグバイアルを溶解します。RTで試薬を時折渦を起ぜて5分間インキュベートする。チューブを簡単に遠心分離します。
注: TMT タグの濃度は、通常、2 つのセットにラベルを付けるのに十分です。しかし、他の研究者は、この濃度をさらに低減し、信頼性の高いデータ15を得ることができることを実証しました。 - TMTラベル試薬の41μLを各100μLサンプルに慎重に加えます。
- RTで1時間反応をインキュベートする。
- サンプルに8μLの5%ヒドロキシラミンを加え、15分間インキュベートして反応を消毒します。
- サンプルを新しい遠心管で等量に分割し、-80°Cで保管します。
注: このステップではサンプルは安定しており、質量分析のために提出することができます。標準的なタンパク質アッセイを用いてこの時点での濃度を測定することは任意である。
8. 質量分析
- サンプルをプロテオミクス施設に提出し(この研究では、UF ICBRプロテオミクスコア施設を使用)、すべてのサンプルを組み合わせてC18スピンカラムを使用して精製します。
注: サンプルを準備する前にサンプルを提出する方法をコア施設と話し合い、提出に適した手順を確認してください。 - 結合された多重サンプルごとに、固相抽出、HPLC(SCX、SE)、ジップチップ、およびLC-MS/MS(タンパク質IDの2h勾配、10QE Plusの場合)の各手順を要求します。
- データが収集されると、コア施設はタンパク質の同定のためにベンダー提供のソフトウェアを使用してRAWファイルを処理します。
9. データ分析
- データは通常、コアからユーザーに 7z 形式で返送され、各データセットあたり約 16 GB のディスク領域が必要になる場合があります (この場合は 11 サンプル)。データ処理の場合は、3.4 GHz 以上のコンピュータが使用可能であることを確認します。
- 7-Zipファイルマネージャを使用してファイルを抽出します。これらの抽出されたファイルは、RAWデータ、pdStudy形式ファイル、およびpdResultView形式のファイルが含まれています。詳細な分析のためにすべてのファイルを保存します。
- プロテオームディスカバリー2.2ソフトウェアを使用してファイルを開きます。
注: ファイル形式は"ファイル名.pdStudy"です。"ファイル名.pdResultView" が開かれている場合は、コントロールのサンプルを選択できません。 - [サンプル] パネルでコントロールサンプルを選択します。
- [解析結果] パネルで[ID]を選択して[結果]を開きます。
- スプレッドシート ソフトウェアにエクスポートします。
- 生データを保存します(すべてのタンパク質が特定されます)。
- スプレッドシート ソフトウェア ファイルを開きます。これは、同定されたすべてのタンパク質を含むであろう。
- スプレッドシート ソフトウェア ファイルでは、 "フィルター" 機能を使用して、 "プロテイン FDR 信頼度 : 結合" を高い列B) " #Uniqueペプチド" 2 (列 K) より高い " および "存在率 "空白 " のどれか ( 列SからWまで ) をスクリーニングします。
- 関数を使用して "p 値" 計算の列を挿入します。
=TTEST(対照群、実験群、尾、タイプ) - 関数と共に "統計的有意性" の列を挿入します。
=IF(p値<0.05、「意義」、NS") - "フィルタ" 機能を使用して、 " 有意性 " を示す"統計的有意性" をスクリーニングします。結果は、対照群および実験群における統計的有意性を有する分析されたタンパク質を示す。
- 対照群と比較して実験群における有意に高いまたは低いタンパク質発現量を決定し、関数を持つ「規制」のカラムを挿入する
=IF(AVERAGE(コントロールグループ)>AVERAGE(実験グループ)、アップレギュレート"、ダウンレギュレート")
10. 有意なヒットを評価する方法
- TMT研究で同定された有意なヒットの間のタンパク質とタンパク質の相互作用を同定するには、相互作用遺伝子/タンパク質の検索用検索ツール(STRING)バージョン11.021: https://string-db.org/
- グループ別に分類するには(分子機能、生物学的プロセス、タンパク質クラスなど)、進化関係(Panther)上質分類ソフトウェア22を用いたタンパク質分析:http://www.pantherdb.org/
- 種々の経路におけるタンパク質相互作用を同定するために、経路解析ソフトウェア23を用いる。
11. リポジトリバンクへのプロテオミクスデータのアップロード
- プロテオミクスデータをプロテオミクスIDEntifcantionデータベース(PRIDE)または質量分析インタラクティブ仮想環境(MassIVE)に送信するには、ピークリストファイル(mzXML、mzML、MGFなどの標準フォーマットの処理されたマススペクトルファイル)、結果ファイル(mzIdentMLやmzTabなどの標準フォーマットのスペクトル識別)、生スペクトルファイル(標準スペクトルのスペクトルファイル)、および生スペクトルファイル(標準スペクトルの非標準形式のスペクトル形式)RAW ファイルまたは .WIFF ファイル)。
- 提出するには、アカウントを作成し、所属やプロジェクトの詳細などの情報を含めます。次に、ステップ 11.1 に記載されているファイルを選択してアップロードします。
- 公式データセットを作成するには、アップロードされたファイルに対して提出ワークフローを実行します。
注: 送信後、データセットはリポジトリ バンクでプライベートになります。プライベート オプションを使用すると、データは許可されたユーザーのみが使用できます。2 つの追加オプションがあります: 1) 共有データセット、ジャーナルレビュー担当者と共同作業者へのアクセスを提供します。または 2) パブリック データセット(パブリック データセット検索に表示されます)。これらのリポジトリのもう 1 つの重要な機能は、アップロードされたデータを更新し、後続のパブリケーションを既存のデータセットに関連付ける機能です。
結果
健康で病気の細胞は、TMTラベリング法に詳述されているように調製されたCHAPS緩衝液中で溶解し、タンデム質量分析を伴う液体クロマトグラフィーのためのフロリダ大学学際学際研究センター(UF-ICBR)プロテオミクスコアに提出されました。コアからのデータ取得と配信の後、データセットはベンダー提供のソフトウェアで開かれ、次のカットオフフィルタが適用されました:≥2ユニークペプチド、すべてのチャネルに存在する各タンパク質サンプルのレポーターイオン、および有意に変化したタンパク質のみを含みます(p ≤ 0.05)。表1は、データの要約:39,653のペプチドの合計は、そのうち7,211は2つのユニークなペプチドを有し、3,829は、すべてのチャネルのレポーターイオンを含む。これらの3,829ペプチドのp値は、スチューデントのt検定によって計算され、p ≤ 0.05は有意であると考えられた。さらに、ダウンレギュレート(青色)またはアップレギュレート(赤)(図1)の健康な細胞と比較して、病気からタンパク質の相対的な分布を決定するためにフォールドチェンジカットオフを使用しました。
有意に調節不調なタンパク質発現のリストを、PANTHERオントロジー分類システムおよびSTRING分析を用いて評価した。パンサー分析は、分子機能に基づいて著しく低い(図2A)または疾患細胞中のより高い存在量に基づいてタンパク質の分類されたリストを示した(図2B)。有意に低いタンパク質の文字列分析 (図 2C) および高い (図 2D) 存在量は、タンパク質間の複数の相互作用と強い関連を同定した。
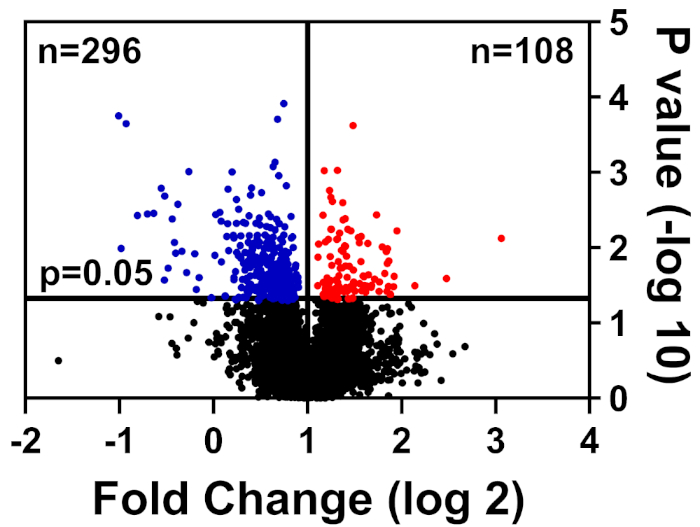
図1:有意に変化しなかったタンパク質(黒)、著しく低下(青)、または病気と健康なコントロール細胞で有意に増加(赤)を示す火山プロット。この図の大きなバージョンを表示するには、ここをクリックしてください。
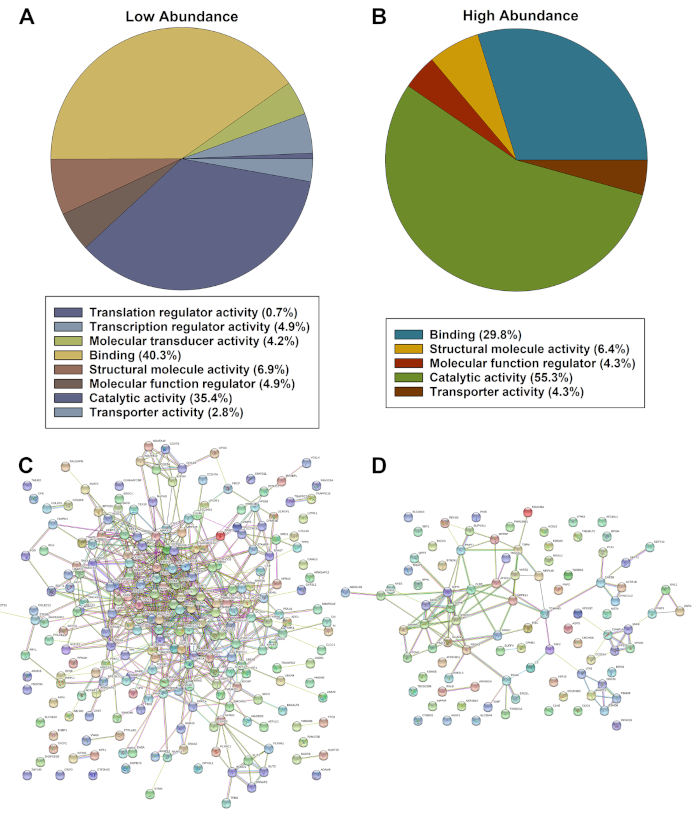
図2:パンサー(A、B)およびストリング(C、D)によって有意に低いまたはより高い存在量タンパク質の有意に調節不調整ヒットの代表的な評価。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 総ペプチド | 識別された合計 | ≥ 2つの独特なペプチド | 定量化されたタンパク質 | 著しく変化したタンパク質 | |
| 低 | 高 | ||||
| 39653 | 7211 | 4457 | 3829 | 296 | 108 |
表1:データセット分析ごとの定量化タンパク質の代表表
ディスカッション
TMTベースの同位体安定同位体標識法を用いたプロテオーム分析用のサンプルを調製するには、4°Cでタンパク質抽出を非常に慎重に行い、プロテアーゼ阻害剤カクテル24,25,25を含むリシスバッファーを使用することが重要です。プロテアーゼ阻害剤カクテルは、タンパク質消化中の予期しないタンパク質分解を避けるために重要な試薬です。当社のプロトコルとベンダーが提供する現在のプロトコルとの主な違いの1つは、哺乳類の細胞および組織に関する経験に基づいて、CHAPSライシスバッファの使用を強く推奨していることです。また、細胞ペレットと組織の両方にメタノール/クロロホルムタンパク質沈殿アプローチを用いることを提案します。
理想的には、タンパク質抽出、測定、還元/アルキル化試薬処理、およびメタノール/クロロホルム沈殿物はすべて同じ日に行われます。この勧告に従うと、その後の標識のためのより正確なタンパク質濃度が生じる。タンパク質沈殿ステップは、タンデム質量分析を妨げる試薬の除去に重要です。沈殿ステップを含む TMT26の分解能を著しく高める。要するに、当社のTMTプロトコルの主な利点は、異なる種類のサンプル、再現性、および取得した信頼性の高いデータに対するラベル作成の効率が高い点です。
このTMT非標的プロテオミクス戦略の多重性が拡大し続ける中で、多種多様な分野の研究者が新しい発見を行う能力を徐々に高めるでしょう。特に生物医学分野では、この技術が病気の新しい作用機序や様々な治療薬の相対的な影響を探求する研究においてますます有益であることがわかりました。これらの理由の全てのために、この強力な技術は現代の研究で使用される他のOMICSアプローチのレパートリーを補完し、さらなる治療開発を導くことができる重要な情報を提供する。
開示事項
著者らは開示するものは何もない。
謝辞
UF-ICBRプロテオミクスのサンプル処理について、その処理を認めたい。この研究は、国立衛生研究所R01 HL136759-01A1(CAP)によって部分的にサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium bicarbonate (TEAB), 50 mL | Thermo Fisher | 90114 | Reagent for protein labeling |
| 50% Hydroxylamine, 5 mL | Thermo Fisher | 90115 | Reagent for protein labeling |
| Acetic acid | Sigma | A6283 | Reagent for protein digestion |
| Anhydrous acetonitrile, LC-MS Grade | Thermo Fisher | 51101 | Reagent for protein labeling |
| Benzonaze nuclease | Sigma-Aldrich | E1014 | DNA shearing |
| Bond-Breaker TCEP solution, 5 mL | Thermo Fisher | 77720 | Reagent for protein labeling |
| BSA standard | Thermo | 23209 | Reagent for protein measurement |
| CHAPS | Thermo Fisher | 28300 | Reagent for protein extraction |
| Chloroform | Fisher | BP1145-1 | Reagent for protein precipitation |
| cOmplete, EDTA-free Protease Inhibitor Cocktail Tablet | Roche | 4693132001 | Reagent for protein extraction |
| DC Protein Assay | BioRad | 500-0116 | Reagent for protein measurement |
| Excel | Microsoft Office | Software for data analyses | |
| Heat block | VWR analog | 12621-104 | Equipment for protein digestion incubation |
| HEPES | Sigma | RDD002 | Reagent for protein extraction |
| Methanol | Fisher | A452-4 | Reagent for protein precipitation |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher | 90058 | Reagent for protein digestion |
| Potassium chloride | Sigma | 46436 | Reagent for protein extraction |
| Sigma Plot 14.0 | Sigma Plot 14.0 | Software for data analyses | |
| Sonicator | Fisher Scientific | FB120 | DNA shearing |
| Spectra Max i3x Multi-Mode Detection Platform | Molecular Devices | Plate reader for protein measurement | |
| Thermo Scientific Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher | 23275 | Reagent for protein measurement |
| Thermo Scientific Pierce Quantitative Fluorescent Peptide Assay | Thermo Fisher | 23290 | Reagent for protein measurement |
| Thermo Scientific Proteome Discoverer Software | Thermo Fisher | OPTON-30945 | Software for data analyses |
| TMT 10plex Isobaric Label Reagent Set 0.8 mg, sufficient reagents for one 10plex isobaric experiment | Thermo Fisher | 90110 | Reagent for protein labeling |
| TMT11-131C Label Reagent 5 mg | Thermo Fisher | A34807 | Reagent for protein labeling |
| Water, LC-MS Grade | Thermo Fisher | 51140 | Reagent for protein extraction |
参考文献
- Graves, P. R., Haystead, T. A. Molecular biologist's guide to proteomics. Microbiology and Molecular Biology Reviews. 66 (1), 39-63 (2002).
- Erdjument-Bromage, H., Huang, F. K., Neubert, T. A. Sample Preparation for Relative Quantitation of Proteins Using Tandem Mass Tags (TMT) and Mass Spectrometry (MS). Methods in Molecular Biology. 1741, 135-149 (2018).
- O'Farrell, P. H. High resolution two-dimensional electrophoresis of proteins. Journal of Biological Chemistry. 250 (10), 4007-4021 (1975).
- Rabilloud, T., Lelong, C. Two-dimensional gel electrophoresis in proteomics: a tutorial. Journal of Proteomics. 74 (10), 1829-1841 (2011).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Molecular & Cellular Proteomics. 1 (5), 376-386 (2002).
- Anderson, N. G., Anderson, N. L. Twenty years of two-dimensional electrophoresis: Past, present and future. Electrophoresis. 17 (3), 443-453 (1996).
- Haynes, P. A., Yates, J. R. Proteome profiling-pitfalls and progress. Yeast. 17 (2), 81-87 (2000).
- Bunai, K., Yamane, K. Effectiveness and limitation of two-dimensional gel electrophoresis in bacterial membrane protein proteomics and perspectives. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 815 (1-2), 227-236 (2005).
- Sury, M. D., Chen, J. X., Selbach, M. The SILAC fly allows for accurate protein quantification in vivo. Molecular & Cellular Proteomics. 9 (10), 2173-2183 (2010).
- Zhang, G., Neubert, T. A. Use of stable isotope labeling by amino acids in cell culture (SILAC) for phosphotyrosine protein identification and quantitation. Methods in Molecular Biology. 527, 79-92 (2009).
- Wang, X., et al. SILAC-based quantitative MS approach for real-time recording protein-mediated cell-cell interactions. Scientific Reports. 8 (1), 8441 (2018).
- Thompson, A., et al. Tandem Mass Tags: A Novel Quantification Strategy for Comparative Analysis of Complex Protein Mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
- Cheng, L., Pisitkun, T., Knepper, M. A., Hoffert, J. D. Peptide Labeling Using Isobaric Tagging Reagents for Quantitative Phosphoproteomics. Methods in Molecular Biology. 1355, 53-70 (2016).
- Navarrete-Perea, J., Yu, Q., Gygi, S. P., Paulo, J. A. Streamlined Tandem Mass Tag (SL-TMT) Protocol: An Efficient Strategy for Quantitative (Phospho)proteome Profiling Using Tandem Mass Tag-Synchronous Precursor Selection-MS3. Journal of Proteome Research. 17 (6), 2226-2236 (2018).
- Zecha, J., et al. TMT Labeling for the Masses: A Robust and Cost-efficient, In-solution Labeling Approach. Molecular & Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Bachor, R., Waliczek, M., Stefanowicz, P., Szewczuk, Z. Trends in the Design of New Isobaric Labeling Reagents for Quantitative Proteomics. Molecules. 24 (4), E701 (2019).
- Suzuki-Hatano, S., et al. AAV9-TAZ Gene Replacement Ameliorates Cardiac TMT Proteomic Profiles in a Mouse Model of Barth Syndrome. Molecular Therapy - Methods & Clinical Development. 13, 167-179 (2019).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. (40), e1954 (2010).
- Perumal, N., et al. Sample Preparation for Mass-spectrometry-based Proteomics Analysis of Ocular Microvessels. Journal of Visualized Experiments. (144), e59140 (2019).
- Wessel, D., Flügge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Analytical Biochemistry. 138, 141-143 (1984).
- Jensen, L. J., et al. STRING 8--a global view on proteins and their functional interactions in 630 organisms. Nucleic Acids Research. 37, D412-D416 (2009).
- Mi, H., Muruganujan, A., Casagrande, J. T., Thomas, P. D. Large-scale gene function analysis with the PANTHER classification system. Nature Protocols. 8 (8), 1551-1566 (2013).
- Cirillo, E., Parnell, L. D., Evelo, C. T. A Review of Pathway-Based Analysis Tools That Visualize Genetic Variants. Frontiers in Genetics. 8, 174 (2017).
- Plaxton, W. C. Avoiding Proteolysis during the Extraction and Purification of Active Plant Enzymes. Plant and Cell Physiology. 60 (4), 715-724 (2019).
- Ryan, B. J., Henehan, G. T., Walls, D., Loughran, S. T. . Protein Chromatography: Methods and Protocols. , 53-69 (2017).
- Fic, E., Kedracka-Krok, S., Jankowska, U., Pirog, A., Dziedzicka-Wasylewska, M. Comparison of protein precipitation methods for various rat brain structures prior to proteomic analysis. Electrophoresis. 31 (21), 3573-3579 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved