このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ルシファーゼベース成長アッセイを用いた細胞内トキソプラズマゴンディ成長に対する化学阻害剤の効率の測定
要約
ここで提示されるプロトコルは、ルシファーゼベースの増殖アッセイを用いたトキソプラズマゴンディの細胞内成長に対する化学化合物の阻害効果を評価するプロトコルである。この技術は、対応する標的遺伝子の遺伝的欠失による阻害特異性を確認するために用いられる。TgCPLプロテアーゼに対するLHVSの阻害を例として評価する。
要約
トキソプラズマゴンディは、ヒト集団に広く影響を与える原虫病原体である。臨床トキソプラズマ症の治療に使用される現在の抗生物質は限られています。さらに, 彼らは人々の特定のグループに悪影響を示します。.したがって、臨床的トキソプラズマ症に対する新規治療薬の発見が不可欠である。新しい抗生物質の開発の最初のステップは、高スループットスクリーニング戦略を用いて寄生虫増殖の阻害において高い有効性を示す化合物を同定することです。細胞内病原体として、トキソプラズマは宿主細胞内でのみ複製することができ、成長の迅速な指標として光学吸光度測定の使用を禁止しています。ここで提示されるルシファーゼベースの成長アッセイのための詳細なプロトコルです。一例として、野生型トキソプラズマ寄生虫の倍増時間を計算し、細胞内増殖の阻害に関するモルホリン尿素-ロイシル-ホモフェニルビニル・スルホンフェニル(LHVS、システインプロテアーゼ標的化合物)の有効性を測定するために使用されます。また、ホモロジー依存組換え(HDR)に50bp相同領域を用いたトキソプラズマにおけるCRISPR-Cas9ベースの遺伝子欠失プロトコルである。野生型およびTgCPL(トキソプラズマカテプシンL様プロテアーゼ)欠損性寄生虫におけるLHVSの阻害効果を定量化することにより、LHVSがΔcpl増殖よりも効率的に野生型寄生虫の増殖を阻害することが示され、TgCPLがThVSがトホソプラズマ中に結合する標的であることを示唆している。このルシファーゼベースの増殖アッセイの高感度かつ容易な操作により、トキソプラズマの増殖をモニタリングし、高スループットでの薬剤有効性の評価に適しています。
概要
トキソプラズマ・ゴンディは、ヒト集団の約3分の1に感染する、非常に成功した細胞内寄生虫です。その高い伝染率は、主に、調理されていない肉の消費、哺乳類の貯水池への暴露、出生時の先天性伝染を含む多様な伝染経路によるものである。T. gondiiは主に、免疫不全個体,,11、2、3、4、5、62,3において重度の罹患率および死亡率を引き起こす可能性のある日和見感染5を6引き起こす。4急性トキソプラズマ症の治療に現在使用されている抗生物質は、特に先天性および潜在感染の治療において非効率的であり、一部の個体33、7、87,8において重篤な反応を引き起こす。したがって、新しい治療法を同定する緊急の必要性が存在する。トキソプラズマとその宿主における細胞内プロセスの違いを理解することは、潜在的な薬物標的を特定するのに役立ちます。したがって、トキソプラズマ内の個々の遺伝子の役割を研究するために、効率的で便利なゲノム操作技術が必要である。さらに、トキソプラズマは、プラスモジウム属やクリプトスポリジウム属などの他のいくつかの重要なヒト病原体を含むフィラム・アピコンプレックスに属しています。したがって、トキソプラズマは、他のアピコンプレックス寄生虫の基礎生物学を研究するのに役立つモデル生物として使用することができます。
微生物病原体に対する新規の抗生物質を同定するために、化学化合物のライブラリーのハイスループットスクリーニングは、微生物増殖の抑制におけるその有効性を決定するために最初に行われる。これまでに、Tの細胞内成長を測定するために、マイクロプレートベースの成長アッセイがいくつか開発されてきました。 gondii(すなわち、放射性3H-ウラシル系組み込み定量9、T.ゴンディ特異的抗体10、11を用いた定量ELISAベースの寄生虫検出、β-ガラクトシダーゼまたはYFP発現トキソプラズマ株12、13、および最近開発された高画像化性の高画像化性株12、13、および最近開発された高画像化性の高画像化物を用いたT.ゴンディ特異的抗体12,10、11、レポータータンパク質ベースの測定を行う。13
これらの個々の戦略はすべてユニークな利点を持っています。ただし、一部の制限によってアプリケーションが制限されます。例えば、トキソプラズマは有核動物細胞内でのみ複製できるため、宿主細胞に対する抗T.ゴンディ抗体の自己蛍光および非特異的結合は、蛍光ベースの測定において干渉を引き起こす。また、放射性同位体の使用には、特別な安全コンプライアンスと潜在的な安全上の問題が必要です。これらのアッセイの中には、成長の継続的なモニタリングではなく、単一の時点で成長を評価するのに適したものもある。
ここで提示される細胞内トキソプラズマの増殖の定量化のためのルシメラーゼベースのプロトコルです。以前の研究では、NanoLucルシファーゼ遺伝子をトキソプラズマチューブリンプロモーターの下でクローニングし、このルシファーゼ発現構築物を野生型(RHΔhxg株)hxg寄生虫にトランスフェクトku80してRHΔhxgをku80作成しました::NLuc株(RHΔku80::NLuc以降)15。hxgNLucこの株は、この研究で細胞内増殖決定および遺伝子欠失のための親株として役立った。RHΔku80を用いて::NLuc株は、ヒト包皮線維芽細胞(HPF)の寄生虫増殖を96時間にわたってモニタリングし、寄生虫の倍増時間を算出した。
さらに、寄生虫増殖に対するLHVSの阻害効果は、IC50値を同定するために、シリアルLHVS濃度に対するトキソプラズマ増殖率をプロットすることによって決定することができる。以前の文献は、TgCPLが寄生虫におけるLHVSの主要な標的であり、LHVSによる治療が急性および慢性トキソプラズマ感染の発症を減少させることが報告されている16、17、18、19。16,17,18,19さらに、RHΔku80 ::NLucは、TgCPL欠損株(RHΔcpl::NLuc)を生成するゲノム改変のための親株cplとして使用され、NLucこの変異体に対するLHVSの阻害を測定した。ku80ku80WT株と比較してTgCPL-欠損性寄生虫におけるLHVSのIC50値のアップシフトを観察することにより、TgCPLがインビボのLHVSによって標的とされることを検証した。
このプロトコルにおいて、RHΔku80::NLucは、効率的な非相同的な末端結合経路(NHEJ)を欠く親株として使用され、それによって二重交差相同性依存組換え(HDR)20,21を促進する。20,21さらに、50 bpの相同領域は、PCRにより薬剤耐性カセットの両端に横たわっています。PCR製品は、CRISPR-Cas9ベースのゲノム編集ツールを使用してHDRを介して遺伝子遺伝子軌跡全体を除去するための修復テンプレートとして機能します。このような短い相同領域は、簡単にプライマーに組み込むことができるので、修復テンプレートの製造に便利な戦略を提供します。このプロトコルは、普遍的な遺伝子欠失および内因性遺伝子タグ付けを行うために変更することができる。
例えば、最新の出版物では、TgCPL、TgCPB(トキソプラズマカテプシンBTgCPB様プロテアーゼ)、TgSUB1(トキソプラズマサブチライシン様プロテアーゼ1)の3つのプロテアーゼ遺伝子が、TgCRT(トキソプラズマクロロキン耐性輸送体)で遺伝的に可軟化した。 TgSUB1また、TgAMN(推定アミノペプチダーゼN[TgAMN,TGGT1_221310])を内因的に15にタグ付けした。Louridoラボはまた、トキソプラズマゲノムにおける部位指向遺伝子変異および内因性遺伝子タグの導入に40〜43bpの範囲で短い相同領域を用いて、同様の方法22を用いて報告した。これらの成功したゲノム改変は、40-50bp相同領域がTgKU80欠損株における効率的なDNA組換えに十分であり、トキソプラズマ・ゴンディにおけるゲノム操作を大幅に簡素化することを示唆している。
プロトコル
トキソプラズマゴンディはリスクグループ2に分類され、バイオセーフティレベル2(BSL-2)で取り扱う必要があります。このプロトコルは、クレムソン大学の機関バイオセーフティ委員会によって審査され、承認されています。
1. ルシファーゼベースのトキソプラズマ成長アッセイ
- ヒト前皮線維芽細胞(HFF)を寄生虫接種の1週間前にシードし、宿主細胞が完全にコンフルエントなものであることを確認する。透明プレートで模擬アッセイを行い、評価期間を通して、寄生虫が細胞内に残ることを確認します。
注:ここでは、アッセイは96ウェルマイクロプレートで行われます。実験ニーズに応じて、384または1536ウェルマイクロプレートまでスケールアップすることができます。 - 完全に融和された寄生虫の約0.3-0.4 mLをT25フラスコに移すことによって、使用の2日前にトキソプラズマ寄生虫をコンフルエントHFFに渡す。37°Cで感染した宿主細胞を2日間5%CO2でインキュベートする。
- 21G安全針5xを介して5mLのしり出しが行われた新しい寄生虫を細胞内寄生虫を解放し、3μmのフィルターを通過して宿主細胞の破片を除去する。7 mLのフェノール赤色フリーD10培地を用いてフラスコから残留寄生虫をリンスし、再度フィルターを通過する。
- 遠心分離機寄生虫は室温(RT)で10分間1000xgで行う。 g上清を注ぎ、フェノールレッドフリーD10培地の10mLでペレットを再懸濁します。
- 濃度を決定するために、ヘモサイトメーターを使用して寄生虫を数えます。
- 野生型(WT)株に対して1 x104寄生虫/mLに寄生虫を希釈する。増殖欠乏性寄生虫株については、それに応じて濃度を上げ、ルシファーゼシグナルの有意な増加を観察する。
- HPFを事前に播種した96のウェルマイクロプレートから慎重に吸引メディアを吸引し、3つの技術的複製と5つのタイムポイントを表す3つの列と5行の形式で150 μLの寄生虫再懸濁液を井戸に接種します。
- マイクロプレートを37°C、5%CO2で4時間2インキュベートします。
- 吸気培地は、未侵入寄生虫を除去するために井戸から慎重に吸引し、その後、各行(最初の行を除く)のRTフェノール赤自由培地で井戸を埋める。
- PBSと2xルシファーゼアッセイバッファーの等量を混合し、ルシファーゼ基板を12.5 μMに希釈します。
- 上段の各ウェルに100μLの希釈ルシファーゼ基材を加えます。細胞が完全にlyseできるようにRTでマイクロプレートを10分間インキュベートします。
- マイクロプレートリーダーを使用してルシファーゼ活性を測定します。プレート リーダーの設定を表 1に示します。各読み取り値は、感染後4時間で侵入した寄生虫の初期数を表す。
- 24 時間ごとに、メディアを変更せずに、各行に対して手順 1.9 ~ 1.12 を繰り返します。これらの測定値は、感染後24時間、48時間、72時間、および96時間の複製寄生虫の総数を反映している。
- 各時点での平均測定値を計算し、4時間の平均測定値で割って、時間の経過に伴う寄生虫の成長の折り目の変化を決定します。
- グラフ作成ソフトウェアを使用してデータをプロットします。RHΔku80の代表的な成長読み取り表とプロット::NLuc寄生虫を図1A,Bに示します。
- 倍倍時間を計算するには、インキュベーション時間の個々のタイムポイントでの折り畳み変化の log2 値をプロットします。線形回帰関数を使用して、各歪みの倍加時間を表す傾きを計算します (図 1A,C)。
トキソプラズマ増殖に対する化学化合物阻害効果の評価
注:ここでは、トキソプラズマ成長におけるLHVSの阻害の評価を例に示す。LHVSの8つの異なる濃度がテストされ、3つの技術的複製がRHΔku80の両方に対して行われる::NLucおよびRHΔku80Δcpl::NLuc株NLuc。
- 寄生虫感染の前に、3行の形式で96ウェルマイクロプレートにHPFを播種し、株当たり1つの生物学的複製のための9つのカラムを得る。宿主細胞は、使用前に少なくとも7日間増殖することが許される。
- 合格 RHΔku80::NLucおよび RHΔku80Δcpl::NLuc寄生虫を使用前の 2 日間行う。寄生虫の精製と定量化の手順1.2~1.6に従ってください。フェノール赤不要培地中の寄生虫を1 x 104寄生虫/mLで再懸濁する。
- コンフルエントHFFを含むプレートから培地を吸引し、150 μLの寄生虫再懸濁液を用いて各ウェルを接種します。マイクロプレートを37°C、5%CO2で4時間2インキュベートします。
- シリアル希釈により、12ウェル貯留槽内の8つの異なる濃度でLHVSを調製します。一般的に、濃度は連続希釈方式で3倍に減少する。
注:最も低い濃度は最高濃度に対して6,561倍減少する。希釈のフォールド変化は、個々の化合物の異なる特性に基づいてそれに応じて調整することができる。 - 4時間の感染後に、吸引媒体は、非侵入寄生虫を除去し、異なる濃度でLHVSを補充した150μLの培地でカラム2-9から各井戸を充填する。最初の列は、非処理コントロールとして機能する通常のメディアで埋めておいてください。
- マイクロプレートを37°Cで、5%CO2でさらに96時間インキュベートします。2
- ステップ1.9-1.11を実行し、個々のウェルのルシファーゼ活性を測定する。
- 個々のLHVS濃度のウェルから3つの技術的複製のルシファーゼ活動を平均する。
- 各LHVS濃度の平均ルシファーゼ活性を非処置寄生虫由来の平均ルシファーゼ活性で割り、正規化されたルシファーゼ活性をパーセンテージで算出する。
- グラフ化ソフトウェアを用いて、個々のLHVS濃度に対して正規化されたルシファーゼの活動をプロットする(図2)。寄生虫の増殖に対するピリメタミンの阻害も対照として測定される。ピリメタミンは、トキソプラズマの葉酸代謝を阻害することによって急性トキソプラズマ症を治療するために使用される臨床抗生物質です。
- グラフ化ソフトウェアにおける組み込み方法を用いて個々の化合物に対するIC50値を計算し、正規化応答対[阻害剤]、回帰プログラム「用量応答阻害」の下で。IC50は、次の式を使用して計算されます。
Y = 100/(1 + X/IC50)
ここで:Yは異なる濃度の阻害剤の下での感染細胞の正常化されたルシファーゼ活性を表し、Xは阻害剤の個々の濃度を表す。
3.トキソプラズマ寄生虫におけるCRISPR-Cas9ベースの遺伝子欠失
- 目的の遺伝子を削除するためのガイドRNA(sgRNA)およびCas9を発現するプラスミド構築物の生成
- www.ToxoDB.orgに移動し、イントロンやエキソンを含む遺伝子コーディングシーケンス全体を1.5 kb 5'-UTRおよび3'-UTR(未翻訳領域)と一緒に取り出します。
注: ここでは、代表的な例としてTgCPL (TGGT1_321530) を対象とします。 - 取得したTgCPLシーケンスをシーケンス解析ソフトウェアにコピーし (名前とバージョンについては「材料表」を参照)、5'--UTR 領域と 3'-UTR 領域にラベルを付けます。
- 上部のメニューバーでツールアイコンを選択し、クローン作成を選択します。CRISPRサイトを検索します。
- PAMサイトの場所に3'(Cas9)'を選択し、特異性スコアリングセクションでトキソプラズマゲノム配列を含むフォルダを選択します。残りの設定はデフォルトのままにします。
- 次の2つの基準を持つsgRNAを選択してください:1)高い特異性スコアを示し、一般的に>98%、および2)NGGに続くGを欠いている、プロトスペースス隣接モチーフ(PAM)配列。選択されたsgRNAは、通常、対象遺伝子の開始および停止コドンに近い部位に位置する。
- 選択したsgRNAの配列をコピーし、次のプライマーテンプレートに貼り付けます。

赤色の部分は、選択されたTgCPL sgRNA配列を表す。これは、関心のある様々な遺伝子に対して異なるsgRNAに置き換えることができます。
注: 選択した sgRNA が G で始まらない場合は、G を sgRNA の先頭に追加して、その発現を強化します。 - 表2に示す設定でPCRプレミックスを用いて、トキソプラズマウラシルリン酸化転移酵素(TgUPRT)遺伝子23を標的とする既存のプラスミド発現sgRNA(図3A)を改変してPCR反応を行う。
- PCR産物をアガロースゲルで実行し、増幅が成功したことを確認します。10 kb PCR産物が増幅されると予想される(図3B)。
- DNAゲル抽出キットを使用してPCR産物を抽出し、部位特異的変異生成キットを使用してそれを円形化します。レシピについては、表 3を参照してください。RTで10〜20分間反応をインキュベートします。
- 循環PCR産物を大腸菌に変換し、10クローンを選んで設計されたsgRNAの組み込みをさらに検証します。
- 2つのクローンを成長させ、プラスミドを抽出します。精製プラスミドをBamHIとEcoRVで切ります。候補のプラスミドは、2.4 kb と 7.2 kb の 2 つのバンドを生成します (図 3C)。
- M13リバースプライマーを使用してサンガーシーケンシング用のプラスミドを送り、TgUPRT sgRNAを設計されたsgRNAと正常に交換したことを確認する(図3D)。
- www.ToxoDB.orgに移動し、イントロンやエキソンを含む遺伝子コーディングシーケンス全体を1.5 kb 5'-UTRおよび3'-UTR(未翻訳領域)と一緒に取り出します。
- HDR機構による遺伝子欠失の修復テンプレートの生成
- 選択されたsgRNAの標的部位に従って、5'-UTRの50bpまたは相同性依存組換えのための標的遺伝子の3'-UtDrを見つける(HDR、議論のセクションを参照)。領域の選択は、sgRNA標的の位置に応じて、以下に示す基準に従う。
- Cas9による切断部位が開始コドンから上流にある場合は、左HDR領域として切断部位から上流に50bpのDNA配列を、右HDR領域として停止コドンから下流に50bpのDNA配列を選択する。
- Cas9による切断部位が開始コドンとストップコドンの間にある場合は、開始コドンから上流の50bpのDNA配列を左HDR領域として、ストップコドンから下流の50bpのDNA配列を右HDR領域として選択します。
- Cas9による切断部位が停止コドンから下流に位置する場合は、開始コドンから上流の50bpのDNA配列を左HDR領域として、そして右HDR領域として切断部位から下流の50bpのDNA配列を選択する。
注:TgCPL遺伝子の場合、切断部位は開始コドンとストップコドンの間にあります。したがって、以下のプライマーは、pMDC64をテンプレートとして用い、ピリメタミン耐性カセットをコードする修復テンプレートを増幅するように設計されている。PCR増幅のためのpMDC64プラスミドに対する黒色アニールの配列。赤で標識された領域は、相同組換えのためのTgCPL特異的配列である。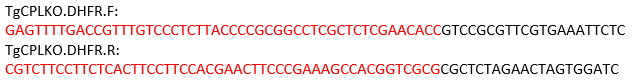
- 表4に記載されているPCR条件下でPCRプレミックスを使用してPCRを実行します。
- PCR産物をアガロースゲル(図3E)で実行し、続いてゲル抽出および標準的な核酸定量手順を実行します。
注: 期待される帯域が正常に増幅できない場合は、PCR 条件やスイッチプライマーペアを最適化してください。
- 選択されたsgRNAの標的部位に従って、5'-UTRの50bpまたは相同性依存組換えのための標的遺伝子の3'-UtDrを見つける(HDR、議論のセクションを参照)。領域の選択は、sgRNA標的の位置に応じて、以下に示す基準に従う。
- トキソプラズマトランスフェクション
- RHΔku80を渡す :: コンフルエントHFFを含むT25フラスコで2日間NLuc寄生虫を通過する。完全に溶出した寄生虫のT25フラスコは、2〜3回のトランスフェクションで十分です。
- シリンジおよびフィルター精製寄生虫は、ステップ1.2に記載されている。サイトミックスバッファー内の寄生虫を再中断し、RT で 10 分間 1,000 x gでスピン ダウンします。
- ペレット化された寄生虫を10 mLのサイトミックスバッファーで洗浄し、1,000 x gで RT で 10 分間、寄生虫をスピンダウンします。
- 上清を慎重に注ぎ、1 x 108個の寄生虫/mLの濃度で同じバッファー内の寄生虫を再中断します。
- 2 μgの修復テンプレートDNAをsgRNA/Cas9発現プラスミドの20 μgと混合します(質量比= 1:5、1:3モル比に相当)。修復テンプレートの増幅収率が低い場合は、それに応じて両方のDNA片の入力を減らします。最低0.5μgの修復テンプレートを使用できます。
- 400 μL の寄生虫リサスペンション、DNA、および 200 mM ATP/500 mM の 5 μL を 1.5 mL 遠心分離管に混合してグルタチオン (GSH) を減らします。必要に応じて、総体積をサイトミックスバッファで500 μLにします。
- 寄生虫とDNAの混合物をエレクトロポレーションキュベット(4mmギャップ幅)に移し、エレクトロポレーション装置を用いてエレクトロポレーション(2kV電圧、50Ω抵抗)を行います。
- 電気ポレートされた寄生虫を新鮮なD10培地中のコンフルエントHFFを含むT25フラスコに移す。24時間後に薬物選択に適切な抗生物質を適用する。
- トランスジェニック寄生虫の増殖が安定するまで、薬物選択的圧力を保つ。
- ノックアウト集団からゲノムDNAを精製し、PCRによりピリメタミン耐性カセットをTgCPL遺伝子座に統合することを確認します。確認後、セクション 3.4 に進みます。そうでなければ、寄生虫トランスフェクションと薬物選択の別のラウンドを行います。薬剤耐性カセットの正しい統合を検出できないことは、通常、標的遺伝子が不可欠であるか、または遺伝子座がアクセスできないことを示唆している。
- ノックアウト寄生虫のクローニング
- HFF細胞を含む2つの96ウェルマイクロプレートをシードし、寄生虫をクローニングする前に21週間、37°Cと5%CO2でインキュベートします。
- コンフルエントHFFを含むT25フラスコ中のトランスジェニック寄生虫の集団の〜0.3〜0.4mLを通過し、2日間増殖させる。突然変異体が成長欠陥を示す場合は、より多くの寄生虫を通過することを検討してください。
注:最高の収量と生存率を達成するために、宿主細胞は寄生虫によって強く感染し、寄生虫のほとんどは細胞内段階に保たれています。 - シリンジは、宿主細胞に感染し、ステップ1.3で述べたように、新たに精製された新たな寄生虫を精製する。D10培地で寄生虫を再中断し、RTで10分間1,000 x gで回転させます。
- ペレット化された寄生虫をD10培地の10 mLに再懸濁する。
- 寄生虫濃度を決定するために、ヘモサイトメーターを使用して寄生虫を数えます。
- 適切な抗生物質を添加したD10培地中の10の寄生虫/mLに濃度をもたらすために2段階希釈を行う。通常、初期の寄生虫再懸濁液は1,000倍希釈され、その後に10個の寄生虫/mLに2回目の希釈が続きます。
- コンフルエントHFFを含む96ウェルマイクロプレートからの吸気培地を吸引し、希釈された寄生虫の150 μLを各ウェルに接種します。
- 37°Cでプレートをインキュベートし、5%CO2で7日間、プラーク形成を可能にする乱れなく。2トランスジェニック寄生虫が増殖欠陥を示す場合、潜伏期間は長くなる可能性があります。
- 位相コントラストの顕微鏡を使用してプレートをスクリーニングし、単一のプラークを含むウェルのみをマークします。
- コロニーPCRを実行して、正しいクローンを同定します。
- ピペットチップを使用して、感染したHFFモノレイヤーを持ち上げるために各井戸の底部を削ります。
- 各細胞の再懸濁液のピペット75 μLは、1.5 mLマイクロ遠心チューブによくマークされています。
- 遠心管はRTで最高速度で10分間慎重に吸引し、キットに用意された希釈バッファーとDNA放出添加剤を含む溶解バッファーの10.25 μLでペレットを再懸濁する(材料表)。
- RTで4分間サンプルをインキュベートし、98°Cで2分間インキュベートします。その後、PCR用にサンプルを使用するか、使用するまで-20°Cで保存することができます。3セットのPCR反応を用いて、薬剤耐性カセットの統合と目的遺伝子の損失を試験する(図4A)。PCR 反応の設定については表 5、サーモサイクラーの設定については表 6を参照してください。
- 正しいクローンを特定し、コンフルエントHFFを含むT25フラスコに4つのクローンを移す。
- 個々のクローンが宿主細胞をライスした後、ゲノムDNAをさらにPCR検証のために精製する。
- 目的のタンパク質を認識する抗体が利用可能な場合は、標準的な免疫ブロット法に従って、正しいトキソプラズマノックアウトで標的タンパク質の損失を確認します。TgCPL-欠失変異体をスクリーニングするための代表的な画像を図4B,Cに示す。
結果
図1は、RHΔku80の成長曲線の例::NLuc歪みとその倍率の計算を示す。NLuc一般に、アッセイは、ルシファーゼ活性測定値の変動を考慮して、3つの生物学的複製のそれぞれについて3つの技術的複製で行われる。寄生虫の増殖の正常化された折り目変化を計算するために、感染後24〜96時間の各読み取り値を、アッセイ中の生きた寄生虫の開...
ディスカッション
++このプロトコルは、細胞内トキソプラズマの成長を評価し、寄生虫の成長に対する化学化合物の阻害効果を評価するルシファーゼベースのプロトコルを記述します。細胞内トキソプラズマの成長を測定するために利用可能な既存の戦略と比較して、この方法は高感度および特異性を示す。寄生虫の成長を監視している間、明確な96ウェルマイクロプレートの模擬アッセイは、試...
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、pSAG1-Cas9-SgRNA-TgUPRTプラスミドおよび抗TgCPLおよびTgActin抗体を共有してくれたシブリー博士とカルーサーズ博士に感謝したいと考えています。この研究は、クレムソンスタートアップファンド(Z.D.へ)、ナイツテンプラー眼科財団小児眼科キャリアスターター研究助成金(Z.D.)、NIH COBRE助成金P20GM109094(Z.D.)、NIH R01AI143707(Z.D.へ)によって支援されました。資金提供者は、研究デザイン、データ収集と分析、出版の決定、原稿の作成に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| Agarose gel extraction kit | New England BioLabs | T1020L | |
| BamHI | New England BioLabs | R0316S | |
| Biotek Synergy H1 Hybrid Multi-Mode Microplate Reader | BioTek Instuments | ||
| BTX Gemini Twin Waveform Electroporation System | Harvard Apparatus | ||
| Chemically competent E. coli cells | New England BioLabs | C29871 | |
| CloneAmp HiFi PCR premix | Takara Bio | 639298 | |
| Coelenterazine h | Prolume | 301-10 hCTZ | |
| EcoRV | New England BioLabs | R3195S | |
| Phire Tissue Direct PCR Master Mix | Thermo Scientific | F170L | |
| Plasmid miniprep kit | Zymo Research | D4054 | |
| Q5 Site-Directed Mutagenesis kit | New England BioLabs | E0554S | |
| Software | |||
| Geneious software for sgRNA design (version: R11) | |||
| GraphPad Prism software (8th version) | |||
| SnapGene for molecular cloning (version: 4.2.11) |
参考文献
- Blader, I. J., Coleman, B. I., Chen, C. T., Gubbels, M. J. Lytic Cycle of Toxoplasma gondii: 15 Years Later. Annual Review of Microbiology. 69 (1), 1-23 (2014).
- Jones, J. L., Kruszon-Moran, D., Rivera, H., Price, C., Wilkins, P. P. Toxoplasma gondii Seroprevalence in the United States 2009-2010 and Comparison with the Past Two Decades. The American Journal of Tropical Medicine and Hygiene. 90 (6), (2014).
- Kieffer, F., Wallon, M. Congenital toxoplasmosis. Handbook of Clinical Neurology. 112, 1099-1101 (2013).
- Hoffmann, S., Batz, M. B., Morris, G. J. Annual cost of illness and quality-adjusted life year losses in the United States due to 14 foodborne pathogens. Journal of Food Protection. 75 (7), 1292-1302 (2012).
- Dubey, J. Toxoplasmosis. Journal of the American Veterinary Medical Association. 205 (11), 1593-1598 (1994).
- Lindsay, D., Dubey, J. Toxoplasma gondii: the changing paradigm of congenital toxoplasmosis. Parasitology. 138 (14), 1-3 (2011).
- Deng, Y., Wu, T., Zhai, S., Li, C. Recent progress on anti-Toxoplasma drugs discovery: Design, synthesis and screening. European Journal of Medicinal Chemistry. 183, 111711 (2019).
- Butler, N. J., Furtado, J. M., Winthrop, K. L., Smith, J. R. Ocular toxoplasmosis II: clinical features, pathology and management. Clinical & Experimental Ophthalmology. 41 (1), 95-108 (2013).
- Pfefferko, E., Pfefferko, L. C. Specific Labeling of Intracellular Toxoplasma gondii with Uracil. Journal of Eukaryotic Microbiology. 24 (3), 449-453 (1977).
- Merli, A., Canessa, A., Melioli, G. Enzyme immunoassay for evaluation of Toxoplasma gondii growth in tissue culture. Journal of Clinical Microbiology. 21 (1), 88-91 (1985).
- Derouin, F., Chastang, C. Enzyme immunoassay to assess effect of antimicrobial agents on Toxoplasma gondii in tissue culture. Antimicrobial Agents and Chemotherapy. 32 (3), 303-307 (1988).
- McFadden, D., Seeber, F., Boothroyd, J. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Gubbels, M. J., Li, C., Striepen, B. High-Throughput Growth Assay for Toxoplasma gondii Using Yellow Fluorescent Protein. Antimicrobial Agents and Chemotherapy. 47 (1), 309-316 (2003).
- Touquet, B., et al. High-content imaging assay to evaluate Toxoplasma gondii infection and proliferation: A multiparametric assay to screen new compounds. PLoS ONE. 13 (8), e0201678 (2018).
- Thornton, L. B., et al. An ortholog of Plasmodium falciparum chloroquine resistance transporter (PfCRT) plays a key role in maintaining the integrity of the endolysosomal system in Toxoplasma gondii to facilitate host invasion. PLOS Pathogens. 15 (6), e1007775 (2019).
- Larson, E. T., et al. Toxoplasma gondii cathepsin L is the primary target of the invasion-inhibitory compound morpholinurea-leucyl-homophenyl-vinyl sulfone phenyl. The Journal of Biological Chemistry. 284 (39), 26839-26850 (2009).
- Dou, Z., McGovern, O. L., Cristina, M., Carruthers, V. B. Toxoplasma gondii Ingests and Digests Host Cytosolic Proteins. mBio. 5 (4), e01188-14 (2014).
- Cristina, M., et al. Toxoplasma depends on lysosomal consumption of autophagosomes for persistent infection. Nature Microbiology. 2, 17096 (2017).
- Parussini, F., Coppens, I., Shah, P. P., Diamond, S. L., Carruthers, V. B. Cathepsin L occupies a vacuolar compartment and is a protein maturase within the endo/exocytic system of Toxoplasma gondii. Molecular Microbiology. 76 (6), 1340-1357 (2010).
- Huynh, M. H., Carruthers, V. B. Tagging of endogenous genes in a Toxoplasma gondii strain lacking Ku80. Eukaryotic cell. 8 (4), 530-539 (2009).
- Fox, B. A., Ristuccia, J. G., Gigley, J. P., Bzik, D. J. Efficient gene replacements in Toxoplasma gondii strains deficient for nonhomologous end joining. Eukaryotic Cell. 8 (4), 520-529 (2009).
- Sidik, S. M., Hackett, C. G., Tran, F., Westwood, N. J., Lourido, S. Efficient Genome Engineering of Toxoplasma gondii Using CRISPR/Cas9. PLoS ONE. 9 (6), e100450 (2014).
- Shen, B., Brown, K. M., Lee, T. D., Sibley, D. L. Efficient Gene Disruption in Diverse Strains of Toxoplasma gondii Using CRISPR/CAS9. mBio. 5 (3), e01114-14 (2014).
- Radke, J. R., et al. Defining the cell cycle for the tachyzoite stage of Toxoplasma gondii. Molecular and Biochemical Parasitology. 115 (2), 165-175 (2001).
- Ran, A. F., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44 (W1), W272-W276 (2016).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 2812 (2014).
- Peng, D., Tarleton, R. EuPaGDT: a web tool tailored to design CRISPR guide RNAs for eukaryotic pathogens. Microbial Genomics. 1 (4), e000033 (2015).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Sidik, S. M., et al. A Genome-wide CRISPR Screen in Toxoplasma Identifies Essential Apicomplexan Genes. Cell. 166 (6), 1423-1435 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved