このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラット中の僧帽弁逆流による制御容積過負荷の画像誘導型僧帽弁リーフレット穿刺モデル
要約
僧帽弁逆流による左心容積過負荷のげっ歯類モデルが報告される。制御された重症度の僧帽弁逆流は、超音波指導を用いて、鼓動心臓において、僧帽弁の前葉に定義された寸法の針を進めることによって誘発される。
要約
僧帽弁逆流(MR)は、心臓のリモデリングを引き起こし、うっ血性心不全を引き起こす広く流行している心臓弁病変である。未補正のMRとその予後不良のリスクは知られているが、心臓機能、構造および改造の縦方向の変化は不完全に理解される。この知識のギャップは、MR矯正の最適なタイミングと、早期MR矯正と後期MR矯正が左心室に与える可能性のある利益に関する我々の理解を制限している。MRの設定における左心室リモデリングの根源となる分子機構を調べるには、動物モデルが必要である。従来、大orto-Caval瘻モデルは、MR.MRのような臨床的に関連する病変とは異なる体積過負荷を誘導するために使用されてきたが、これはこの状態を模倣する動物モデルを必要とする低圧体積過負荷血力学的ストレッサーを表す。ここで、ラット僧帽弁の前葉が23G針で穿穿される重度MRのげっ歯類モデルを、鼓動画像ガイダンスを用いて鼓動心臓で説明する。MRの重症度を評価し、心エコーで確認し、モデルの再現性を報告する。
概要
僧帽弁逆流(MR)は、一般的な心臓弁病変であり、米国の一般人口の1.7%および65歳以上の高齢者の9%で診断された。この心臓弁病変では、収縮期の僧帽弁葉の不適切な閉鎖は、左心室から左心房への血液の逆流を引き起こす。MRは、さまざまな病因のために発生する可能性があります。しかし、僧帽弁(プライマリMR)の一次病変は、二次MR2と比較してより頻繁に診断され、治療される。孤立した一次MRは、しばしば僧帽弁の粘液腫変性の結果であり、リーフレットまたは脊索子上天の伸び、またはいくつかの脊索帯の破裂をもたらし、そのすべてが弁の収縮期的凝生の喪失に寄与する。
このような弁病変に起因するMRは、各心拍の左心室を満たす血液量を上昇させ、末側拡張期壁応力を増加させ、心臓適応およびリモデリングを扇動する血行力学的ストレッサーを提供する。この病変における心臓のリモデリングは、多くの場合、有意なチャンバー拡大33、4、4軽度の壁肥大、長期間の収縮機能の保存によって特徴付けられる。吐出率がしばしば保存されるので、手術または経カテーテル手段を用いたMRの矯正は、呼吸困難、心不全、不整脈などの症状の発症まで遅れる場合が多い。しかし、未補正のMRは心臓有害事象のリスクが高いと関連しているが、これらの事象の根底にある超構造的変化に関する現在の知識は不明である。
MRの動物モデルは、このような心臓の超構造変化を調査し、疾患の縦方向進行を研究するための貴重なモデルを提供する。これまで、研究者は、豚、イヌ、およびヒツジを含む大型動物においてMRを誘導し、外部腹腔-心房シャント5、心内索破裂6、またはリーフレット穿孔7を作成した。手術技術は大型動物では容易であるが、これらの研究は、大型動物でそのような研究を行うための高いコストのために、小さなサンプルサイズでのサブ慢性的なフォローアップに限定されている。さらに、これらのモデルからの組織の分子解析は、限定的な種特異的抗体およびアコード化されたゲノムライブラリーによるアライメントのためにしばしば困難である。
MRの小動物モデルは、この弁病変と心臓リモデリングへの影響を研究するための適切な代替手段を提供することができる。歴史的に、心臓容積過負荷の大小騎兵瘻(ACF)のラットモデルが使用されてきた。最初に述べられた最初の1973年にStumpeら8で、動脈静脈瘻は、下降大動脈から低圧下の静脈に高圧動脈血をバイパスするために外科的に作成される。瘻孔の高い流量は、心臓の両側に劇的な体積過負荷を引き起こし、ACF9を作成してから数日以内に顕著な右および左心室肥大および機能不全を引き起こす。その成功にもかかわらず、ACFはMRのヘモダイナミクス、低圧のボリューム過負荷を模倣しません, これは、プリロードを上昇させるが、また、後負荷を減少させます.このようなACFモデルの制限により、低圧の積もり過多を模倣するMRモデルの開発と特徴付けを模索しました。
ここで、ラット10,11,において重症MRを作成するための僧帽弁リーフレット穿刺のモデルのプロトコルについて説明する。皮下注射針を鼓動ラットの心臓に導入し、リアルタイムの心エコーガイダンスの下で前僧帽弁リーフレットに進入した。この技術は非常に再現性が高く、患者に見られるようにMRを模倣する比較的良いモデルです。MR重症度は、僧帽弁リーフレットを穿穿するために使用される針の大きさによって制御され、MRの重症度は、経食道心エコー検査(TEE)を用いて評価することができる。
プロトコル
手続きは、プロトコル番号EM63Rr、承認日06/06/2017の下でエモリー大学の動物ケアと使用プログラムによって承認されました。
1. 手術前の準備
- スチームは処置の前に外科用器具を殺菌する。
- 処置の日に、ラットを住宅から手術に移し、体重を量る。
- 体重に応じて術前および術後の薬物を引き出す:カルプロフェンの2回の用量(それぞれ2.5mg/kg)、ゲンタマイシン(6mg/kg)の1回投与、ブプレノルフィン(0.02mg/kg)の1回投与。
- ガスミキサーでイソフルランの十分な量を確保し、タンク内の酸素は手術のために利用可能です。酸素の1つの完全なタンク(24フィート3)はしばしば十分である。
2. 動物の準備
注:350-400 gの体重の成人スプレイグ・ドーリー雄ラットは、この研究で使用されました。外科的技術は、必要に応じて、わずかに小さいかより大きな動物に適しています。
- 1LPM(リットル/分)の100%酸素を混合した5%イオブルランを用いた誘導チャンバーでラットを鎮静する。目視下の呼吸速度が遅く、ラットのつまみでぴくぴくが失われると、適切なレベルの沈下を決定する。
- 気管チューブとして使用するために合う16 G血管を用いてラットを挿管する。
- 眼管を使用して気管と声帯を可視化し、綿の先端アプリケーターを使用して咽頭分泌物をクリアします。
- 0.034インチのガイドワイヤーの気管チューブを声帯に導入します。チューブが気管に適切に配置されたら、チューブを内側に押し、ワイヤーを引き出します(図1)。
- 37°Cに保たれる加熱された外科用パッドにラットを置き、気管内チューブを機械式人工呼吸器に接続します。換気速度と潮流を計算する換気装置制御ソフトウェアにラットの重量を入力します。この研究では、1 mL/100 g体重の潮量を伴う毎分66回の呼吸を使用した(図1D)。
- 吸入麻酔薬として2-2.5%イオブルランと混合100%酸素(1 LPM)を使用し、顎の音の損失とつま先ピンチへの応答の損失と麻酔のレベルを確認します。
- 適切に挿管する場合は、胸の動きが人工呼吸器と同期する必要があることに注意してください。
- 不適切に挿管した場合、胸の動きは人工呼吸器と同期しません。不適切な挿管をテストするには、ラットの腹部を圧縮し、人工呼吸器に背圧を発生させ、過圧アラームを発生させます。このシナリオでは、血管を緩やかに引き込み、ラットを5%イソフルランで誘導チャンバーに数分間戻し、ラットが十分に麻酔され、ラットを再挿管することを確認します。
- 適切に挿管したら、口当ての間に挿管を避けるために、4-0シルク縫合糸でラットの頬にチューブの近位端を縫合することによって気管内管チューブを固定します。
- 体温を監視する直腸温度プローブと、全手順中に心電図を監視するための4端子心電図を挿入します。
- 外科プラットフォームからの熱が不十分な場合は、オーバーヘッド加熱ランプを使用してください。体温が37°Cを超えた場合はランプを消してください。
- 心筋の不整脈や心筋虚血の徴候について心電図を視覚的に評価する。何も存在しない場合は、ベースライン心電図を記録します。
- ベースライン心機能に対して経胸部心エコー検査(TTE)を行う(図2A)。
- ラットをスピーヌの位置に回し、胸郭の左側を剃ります。明確なエコービューを得るために、脱毛クリームを使用して髪を取り除きます。
- 高心拍数画像撮影には、適切な周波数の超音波システムを使用してください。本研究では、ラットの心臓イメージングに適した21MHzプローブを備えたVisualsonics 2100システムを使用しました。
- 寄室長軸平面でBモード画像を取得し、左心室容積を計算する。同じ平面で、M モードイメージを取得して壁の寸法を測定します。
- プローブを90°回転させ、BモードとMモードの準船骨短軸図を中乳頭レベルで取得して、断面壁の寸法を測定します。
- ベースラインイメージングに対して経食道心エコー検査(TEE)を行う(図2B)。
- ラットを右の褥瘡の位置に置き、8 Frの心臓内超音波プローブ(8 MHz)をラットの食道に挿入し、少量のゲルを先端に塗布します。ICE(心内心エコー検査)プローブの周波数は、弁の動きを視覚化するのに十分な心拍当たり4〜6フレームを得るのに十分である。
注: GE ビビッド I またはシーメンス SC2000 プライム システムは ICE イメージングに使用できます。 - 高い食道図を得て、心臓の左側の2室のビューを得る。このビューは、左心房、僧帽弁、左心室を可視化するのに理想的です。前葉と後部のチラシが可視化され、凝集が中心となるようなプローブを配置します。この角度はまた、角度補正なしで、僧帽弁全体のドップラー測定を可能にする。
- このビューで左心房面積と僧帽弁アヌラス寸法を測定します。
- ベースラインで弁の能力とMRの欠如を確認するために色ドップラーのイメージ投射を行う。脈波と連続波ドップラーイメージングを行い、ミトラル流入量を定量化し、逆流流の欠如を確認します。
- 大動脈のBモードおよびパルス波ドップラーイメージングを行い、大動脈根径を測定し、大動脈流量を計算する。
- 肺静脈のパルス波ドップラーイメージングを行い、肺静脈の流れを測定する。
- ラットを右の褥瘡の位置に置き、8 Frの心臓内超音波プローブ(8 MHz)をラットの食道に挿入し、少量のゲルを先端に塗布します。ICE(心内心エコー検査)プローブの周波数は、弁の動きを視覚化するのに十分な心拍当たり4〜6フレームを得るのに十分である。
- カルプロフェン(2.5mg/kg、SQ、非ステロイド性抗炎症)、ゲンタマイシン(6mg/kg、SQ、抗生物質)、滅菌生理食糸(1mL、SQ)を1回投与して、処置中の失血を先制的に補償する。
- 必要に応じて胸郭の左側を剃り、外科分野から残りの毛を取り除きます。下頸部領域からキシフォイド、および左腕から中胸骨までシェービングは、毛が欠けている分野を確保し、外科的部位汚染のリスクを低減するのに十分であるべきである。
- ベタジンに浸したガーゼで外科領域をスクラブし、続いて70%エタノールに浸したガーゼをスクラブします。ガーゼが以前にスクラブされた領域に接触しないように、皮膚の円形の動きで領域をスクラブします。
- 手術のための十分な無菌フィールドを達成するために、このステップを3回繰り返します。
- 滅菌カバーで動物をドレープし、無菌の外科的領域にアクセスするために窓を開ける。
3. 左口内術
- 酸素の1 LPMで2-2.5%に維持されるイオブフルランを用いて、無菌技術を用いて外科手術全体を行う。すべての器具を滅菌トレイに入れ、使用後にトレイに戻します。
- 手術全体のために外科医による滅菌手袋、マスクおよび外科用帽子を着用する。無菌の外科用ガウンも着用できますが、汚染が予想されない限りオプションです。
- #15刃なしの外科用メスを使用して、胸郭の左側に皮膚切開を行い、約1cm近位のキシフォイドを作ります。鈍い解剖先端はさみを使用して、皮膚層を筋肉層から分離し、縦切開を行います。
- 肋骨が露出するまで、同じ方法で筋肉層を解剖します。
- 慎重にリトラクタを挿入し、心臓を露出するのに十分な5番目の肋間空間で2〜3センチメートルの縦切開を行います。
- 細かい先端の鉗子を使用して心膜を持ち上げ、マイクロハサミを使用して心臓の頂点を取り巻く領域で切除します。このステップは、胸壁および横隔膜への心臓の手術後の癒着を避けるのに役立つ。
注:出血を最小限に抑えるために胸骨に近い外科的切開を避けてください。胸骨に沿って走る内乳腺動脈を移管すると、過度の出血を引き起こすことがある。そのような出血に遭遇した場合は、ブリーダーを識別し、それを焼灼する。
4. エコーガイド MR 手順 (図 3および図 4)
- 6-0プロレン縫合糸とマイクロニードルホルダーを使用して、左心室の頂点に財布のひも縫合糸を配置します。必要に応じて、心臓を安定させるためにマイクロ鉗子を使用してください。
- 頂部を安定させ、財布の弦縫合糸の中央に23Gの針(生理食糸で洗い流し、遠位端にストップコックを入れる)を左心室腔にそっと刺します。
- 針を安定して保持して導くために片手を使用し、もう一方の手を使用して、前述のように針を可視化するための最適なエコービューを実現するために、経食道エコープローブを同時に操作します。
- リアルタイム超音波ガイダンスを使用して、前僧帽弁リーフレットの心室側に針を進めます。針の位置が超音波で確認されたら、弁のリーフレットを通して1つの細かい動きで針を進める。抵抗が感じられる場合は、針をリーフレットに進めて穿穿るようにひねります。
注:針を左心房に進めすぎると、心房穿裂が起こり、過度の出血や動物の死を引き起こす可能性があります。針は常に超音波で視覚化されるべきです。 - 僧帽弁から離れて左心室に針を引っ込み、色ドップラーイメージングをオンにしてMRを確認します。
- カラードップラーイメージングでMRが見られない場合は、手順4.4と4.5を繰り返します。必要に応じてエコープローブを調整して、より良いビューを得る。少数のラットで練習した後、針の1つの運動でリーフレット穿刺を誘発し、針の外径の大きさである穴を誘導することができる。これはラットの心臓の壊死後に確認された。
- MRが確認されたら、左心室腔から針を引き込み、財布のひも縫合糸をそっと結びます。
- 無菌ガーゼを使用して、頂点と胸腔に血液を浸します。
注意:外科用手袋でエコープローブに触れると、滅菌環境が汚染される可能性があります。手袋に70%エタノールをスプレーするか、手袋を新しいものに適切に交換します。
5. 動物の回復と術後ケア
- 5~10分間の安定した心機能(正常心電図および心拍数)の後、4-0ビクリルの層で胸部切開術を閉じ、イソフルランをステップで減少させる。
- イオブルランを2%に維持して、肋骨を近似するために中断された縫合線を使用してください。胸管を第6肋間空間に挿入し、生殖不能のドレープに固定して、チューブが胸腔に不注意に進行するのを避けます。
- 連続縫合糸を使用して、イオブルランを1.5%に保って筋肉層を閉じます。
- 連続縫合糸を使用して、イオブルランを1%に保って皮膚層を閉じます。
- 10 mL Luer ロックバルブのチップ付きシリンジを胸管に接続し、胸腔から 10~12 mL の空気を排出してから、胸管を取り外します。
- カルプロフェンの最終用量を投与する (2.5 mg/kg, SQ) イオブルランをオフにします。.
- ラットが麻酔から離れながら機械的換気を続け、バイタルサイン(SpO2および心拍数)を監視する。自然呼吸の発症時に、呼吸と良好なSpO2を維持するラットの能力をテストするために換気をオフにする。
- SpO2レベルが90%を下回り始める場合は、人工呼吸器をオンにします。ラットが換気なしでSpO2レベルを維持できるようになると、気管内チューブへのアンカー縫合糸が切断され、動物は抜管のために準備されます。
- ラットがウィスカーや目の動きを含む覚醒の兆候を示したら、動物を排泄します。
- ラットが外来になるまで100%酸素で鼻コーンを置きます。
- 最小限の寝具できれいなケージにラットを移し、ラットが歩行するまでラットの足または尾に置かれたハンドヘルドSpO2モニターを使用してバイタルサインを監視し続けます。
注:手術による悪影響が認められると、動物は回復時間が長くなり、高いSpO2レベルを保持するのに時間がかかる場合があります。これが発生した場合、SpO2レベルが安定するまで、100%酸素を有するノーズコーンを適用することができます。 - 手術部位への傷害のリスクを軽減し、感染のリスクを回避するために、手術後のシングルハウスラット。
- ラットが目覚め、十分に歩行後3時間以内にブプレノルフィンを投与する。ブプレノルフィンは、術周回復期間の早い段階で投与すると呼吸困難を引き起こし、したがってラットが困難なく呼吸するまでそれを遅らせる。
- 手術後、すべての動物は以下の薬を受け取ります: ゲンタマイシン (6 mg/kg, SQ, SID POD 1-3) およびリマジル (5 mg/kg, SQ, SID POD 1-3).すべての動物は、切開部位の検査のために手術後5日間毎日1回、痛みの評価のために手術後最初の2週間は毎日1回観察される。
6. 心エコー検査を用いてMR重症度の検証 (図 5)
- セクション2.7で指定したのと同じステップを使用して、手術後2週間でTEEを繰り返します。手術後2週間は、行力学が安定するのに十分な時間です。
- 経食道超音波画像を用いて2室のビューで色ドップラーイメージングを取得し、左心室と左心房を可視化する。左心房とMRジェットの面積を測定します。を使用してMRジェットエリアの分率を計算します
 (1)
(1)
重度のMRは、MRジェット面積≥30%として定義される。 - 針の外径を用いて23G針の面積を計算することにより逆流オリフィスの面積を近似する。この式は、逆流オリフィスの面積が23G針の面積と等しいことを前提としています。
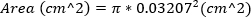 (2)
(2) - 逆流ジェットのオリフィスでドップラーゲートを用いた連続波ドップラーイメージングを取得します。逆流ジェットのVTIを計算するために波形をトレースします。MRボリュームは、使用して推定することができます
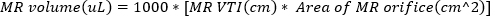 (3)
(3)
重度のMRはMRボリューム≥ 95 μLとして定義されます。 - エコープローブを時計回りに横方向に回転させることにより、肺静脈のパルス波ドップラー画像を得る。収縮期波速度と拡張波速度を測定し、次の式を使用して比率を計算します。
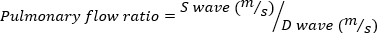 (4)
(4)
負の肺流量比は、重度のMRを示す。
7. シャム手術
- セクション 1 ~ 3 を、説明に従って実行します。
- 修正部4は、左心室に23G針を挿入するように修正し、左心室の頂点の財布ひも縫合を介して、僧帽弁に進んでMRを作成するが、MRを作成するために僧帽弁に進み、左心室に針を挿入し、その後すぐに引き込み、後に心室の先端を引き締め、閉じるようにした。
- 説明に従ってセクション5を実行します。
- セクション6で説明したように僧帽弁評価を行う。しかしながら、MRはいずれの動物にも存在してはならないので、従って記載された定量は必要ない。
結果
実現可能性と再現性
提案されたMRモデルは、この研究で使用されるラットの100%で達成された僧帽リーフレットに明確に定義された穴を有し、非常に再現性が高い。図6Aは、僧帽弁に挿入される針の方向を示している。図6BBは、処置後2週で剥離した代表的なラットからの僧帽弁リーフ...
ディスカッション
良好な生存率(手術後の生存率93.75%)および術後合併症のない重症MRの再現性のあるげっ歯類モデルが報告されている。経食道心エコー検査によるリアルタイムイメージングと、鼓動心臓への針の導入は、僧帽弁リーフレットを穿刺することが可能であり、かつ、教えることができる。この研究では、23Gの針サイズで重症のMRが製造され、これはより小さいまたはより大きい針を使用して所望に?...
開示事項
M.Pは心臓修理技術(HRT)のアドバイザーであり、コンサルティング料を受け取っています。HRTはこの研究に何の役割も持っていなかったし、この研究を支援するための資金も提供しなかった。
謝辞
この作品は、米国心臓協会からDへの助成金19PRE34380625と14SDG20380081によって資金提供されました。 コーポランとM.パドラはそれぞれ、国立衛生研究所からM.パダラにHL135145、HL133667、HL140325を付与し、エモリー大学ミッドタウンのカーライルフレイザーハートセンターからM.パダラにインフラ資金を提供しています。
資料
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
参考文献
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved