このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インビボにおける拡張型心筋症のドキソルビシン誘発性マウスモデル
Erratum Notice
要約
記載は、ドキソルビシンの長期腹腔内注射を介してマウスにおけるドキソルビシン誘発拡張型心筋症(DCM)モデルを確立するためのプロトコルである。
要約
拡張型心筋症(DCM)は、高血圧、弁膜、先天性、または虚血性心疾患がない場合の心室拡張およびうつ心臓のパフォーマンスを特徴とする異種心筋障害のスペクトルを指し、感染、自己免疫性または代謝異常、または家族の遺伝に関連する可能性がある。予後が悪いとうっ血性心不全に進行する可能性があります。ドキソルビシン(Dox)は化学療法薬として広く採用されているが、心筋のDCM様変化を引き起こすのでその使用は限られている。その心筋毒性は、酸化ストレス、慢性炎症、心筋細胞アポトーシスに起因する。これらのDox誘発DCM症状を利用するDCMのモデルは確立されていない。
概要
心不全の最も一般的な原因の1つは、DCMは心室拡張と心機能の低下を特徴とし、世界中の心臓移植の最も一般的な理由である1。その病因をさらに調査し、効果的な治療法を見つけるためには、成熟した動物モデルへのアクセスが特に重要です。本記載の実験の目的は、ヒトDCMに似たDCMの安定したマウスモデルを確立することにある。
DCMの複雑な病因により、対応する動物モデルを作るための多くの異なる方法があります。自発的なDCMモデル2 は比較的安定していますが、高価で簡単には利用できません。遺伝子組み換え動物モデル3 は確立されておらず、より実験的な使用が必要である。ウイルス感染4 または自己免疫欠損5 によって誘導されるDCM動物モデルは容易に得られるが、完全にDCMを代表するわけではない。心筋毒性に関連するモデルには、アルコール誘導DCMモデルおよびDox誘発DCM動物モデルが含まれる。
Dox誘発型心筋症モデルは、Dox6の腹腔内注射により得られる。このモデルは、Doxの最も重篤な慢性副作用を利用する:Dox暴露後、患者は臨床均一性を有する後期発症DCM症状を発症する7.心筋細胞アポトーシスを引き起こすドックス誘導酸化ストレス8 およびミトコンドリア損傷9は、DCMの病因における症状である。急性および慢性のDox治療モデルがあります:単一の高用量のDox(15mg/kg)は心筋症の短期モデルを誘発します10,繰り返し低用量のDox注射 (6 週, 3 mg/kg) 心筋症の長期モデルを誘導します。本研究に基づき、野生型マウスは週に1回、1ヶ月間、5mg/kgの用量で腹腔内注射を行い、治療の終了までにDCMの特性と一致する心臓の形態および組織学を表示し、DCMモデルを確立するための理想的な方法を提供する。
プロトコル
動物実験は、南京ドラムタワー病院の施設動物のケアと使用委員会(IACUC)によって承認されました。
試薬及び動物の調製
- ドキソルビシン塩酸塩(ファイザー、米国)を殺菌水に溶かします。ボルテックスは、1 mg/mLのドークス溶液を得て、4°Cに保つ。
- C57BL/6マウス(8~10週齢、体重25~30g)を使用してください。この研究のために、マウスは南京大学モデル動物研究センターから購入し、南京ドラムタワー病院の動物室に保管されました。
- 病原体を含まないマウスケージは、23°Cの一定温度で12時間の明暗サイクル下で維持した。 すべての動物は通常のチャウダイエットで餌を与えられ、食べ物と水のアドリビタムを得ました。
2. DCM動物モデルの確立
- マウスを正常(n=5)群とDox(n=5)群に無作為化する。
- Dox群に対して週1回1mL滅菌シリンジを用いて、5mg/kgの用量で腹腔内溶液を投与する。同量の生理液で同じ方法でコントロールマウスを治療する。
- 週に2つのグループの体重を測定します。したがって、体重に基づいて毎週、合計4週間、累積用量20mg/kgを調整します(図1)。
注:4週目の心エコー検査は、2つのグループ間の心機能に有意な差を示したので、4週間の期間が選択されました。
3. 心エコー検査
- 第4週の終わりに、マウスの心エコー検査を行う。
- マウスを2%イオブルランを鼻腔内に麻酔します。マウスが歯付きピンシーザーで皮膚のピンチに反応しない場合、またはつま先と尾を刺激する場合は、プロトコルを続行します。
- 動物の取り扱いプラットフォーム上のマウスを、サピーヌ位置に置きます。麻酔を維持するには、動物の鼻と口を鼻コーンで覆い、2%のイオブルランを送達する。
注:IP麻酔の場合は、0.2 mL/20 gの用量で4%塩素水和物を注入してください。 - 電動の剃り機で胸の毛皮を慎重に取り外します。胸部心エコー検査を用いて生体内の心機能を評価する。
- 233 Hzのフレームレートで、パラスターナル長軸ビューと短軸ビューの両方でLV心エコー図を行います。
- Mモードトレースでは、平均LV末端収縮期直径(LVIDd)、LV末端拡張期直径(LVID)、心室内隔壁厚(IVS)、LV後壁厚(LVPW)を3~5回の心臓拍から測定します。また、心エコー検査に基づいて、放出分数(EF)と分数短縮(FS)も計算します。
4. 組織学的染色
- 心エコー分析の後、10%塩化カリウムの心室内注射によりマウスを犠牲にする。
- 肝臓と肺が青白くなるまで、解剖後に約30mLの生理液で心臓を浸透する。
- 心臓を切除し、血液を押し出すためにリン酸塩緩衝液で十分に洗浄します。
- 24時間室温で4%ホルマリンで心臓を固定し、パラフィンワックスが冷却して固化するようにパラフィンボックスで組織を処理します。
- 心臓を5μmの厚さのスライスに切り、病理学的染色を行います。
- 乳頭筋を含む脱ワックスおよび水分補給の切片。
- 55°Cで30分間のインキュベートスライド。次に、キシレン2xで2分ずつインキュベートします。100%エタノール2x各2分間;95% エタノール 2 x 各 2 分;2分間の80%エタノール;75% エタノール 2 分間;50%エタノールを2分間使用します。
- ヘマトキシリンとエオシン(H&E)とマッソンの汚れを使用したステイン。
結果
心臓機能
拡張型心筋症は、進行性心室拡張および収縮機能障害を特徴とする。 図2 は、2つのグループの代表的な心エコー画像を示す。ドックス処理マウスは、左心室駆出率および左心室分画短縮を著しく減少させた(図3A,B)。また、LV径は拡張期および収縮期の両方で増加した(図3C,D)。...
ディスカッション
Doxは、臨床実践12で一般的に使用される非特異的周期的な抗腫瘍性化学療法薬である。その主な副作用は、心筋症とその後の心不全13によって特徴付けられる心毒性である。基になる機構は、心筋脂質過酸化の損傷、心筋サルコプラスミックリチラムCa2+-ATPase活性の阻害、および心筋局所レニンアンジオテンシン系の活性化を含み、AT II産生および細...
開示事項
利益相反は宣言されていません。
謝辞
この研究は、南京省保健局(No.YKK16098)の主要プロジェクト医学技術開発財団によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
参考文献
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
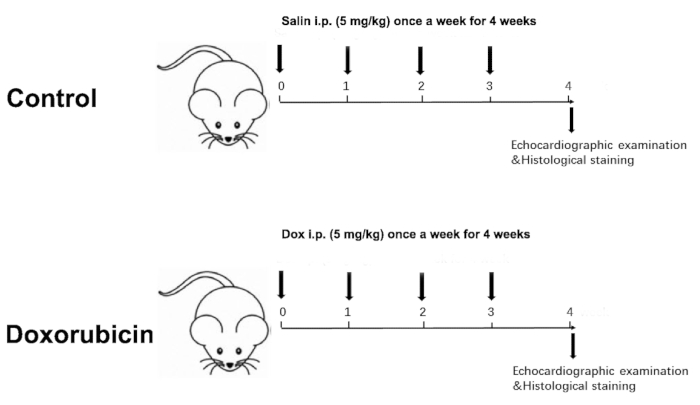
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
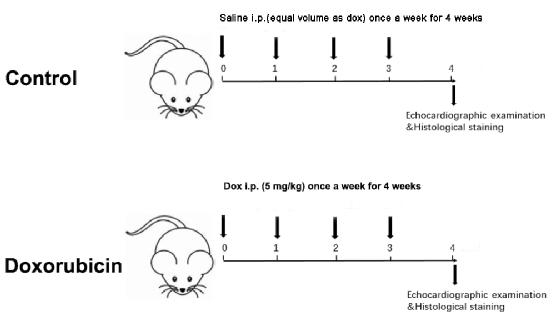
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved