このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞内膜特異的レドックス感受性緑色蛍光タンパク質を用いた細胞酸化の評価
要約
このプロトコルは、細胞内の細胞内区画特異的な酸化還元状態の評価を記述する。レドックス感受性蛍光プローブは、無傷の細胞でのレシオメトリック分析を可能にします。
要約
細胞内酸化/還元バランスを測定すると、生物の生理学的および/または病的な生理学的なレドックスの状態の概要を提供します。チオールは、ジチオールと酸化ジスルフィド比を使用して細胞の酸化還元状態を照らすのに特に重要です。設計されたシステイン含有蛍光タンパク質は、レドックス感受性バイオセンサーの新しい時代を開きます。そのうちの一つは、酸化還元感受性緑色蛍光タンパク質(roGFP)を、アデノウイルス伝達を伴う細胞に容易に導入することができ、細胞内のレドックス状態を細胞内プロセスを中断させることなく評価することができる。roGFPの減少したシステインおよび酸化シスチンは、それぞれ488nmおよび405nmで励起最大量を有し、525nmで発光する。これらの還元および酸化形態の比率を評価することで、細胞内の酸化還元バランスの計算が便利になります。この方法記事では、ヒト三重陰性乳癌細胞(MDA-MB-231)を使用して、生細胞内の酸化還元状態を評価した。プロトコルステップには、細胞細胞群roGFPを発現させるアデノウイルスによるMDA-MB-231細胞株の伝達、H2O2による治療、2およびフローサイトメトリーおよび蛍光顕微鏡の両方を用いたシステインおよびシスチン比の評価が含まれる。
概要
酸化ストレスは、1985年にヘルムート・シーズによって「前者に有利なプロキシダント抗酸化バランスの乱れ」として定義され、多くの研究が行われ、生物1、2、32,の疾患、栄養、および老化特異的な酸化還元状態を得1るために多くの研究が行われている。3それ以来、酸化ストレスの理解はより広がっています。病気や老化に対して抗酸化物質を使用する仮説をテストすると、酸化ストレスが害を引き起こすだけでなく、細胞内の他の役割も持っていることを示しています。さらに、科学者たちは、フリーラジカルがシグナル伝達に重要な役割を果たしていることを示している。これらの研究のすべては、高分子の還元酸化(酸化還元)比の変化を決定することの重要性を強化します。酵素活性、酸化防止剤、酸化産物、酸化生成物は、様々な方法で評価することができます。これらの中で、チオール酸化を決定する方法は、細胞内の抗酸化物質とプロオキシド物質のバランス、ならびに生物4とのバランスについて報告するので、間違いなく最も使用されている。具体的には、グルタチオン(GSH)/グルタチオンジスルフィド(GSSG)および/またはシステイン(CyS)/シスチン(CySS)との比率が、生物の酸化還元状態をモニタリングするためのバイオマーカーとして使用される2。
プロオキシド剤と抗酸化物質のバランスをアッセリングするために使用される方法は、主に還元/酸化タンパク質または細胞内の小分子のレベルに依存します。ウェスタンブロットおよび質量分析は、還元/酸化された高分子(タンパク質、脂質など)の比率を広く評価するために使用され、GSH/GSSG比は分光光度測定5で評価することができる。これらの方法の一般的な特徴は、細胞のリシスおよび/または組織均質化によるシステムの物理的摂動である。これらの分析は、異なる細胞コンパートメントの酸化状態を測定する必要がある場合にも困難になります。これらの摂動はすべてアッセイ環境で人工物を引き起こす。
レドックス感受性蛍光タンパク質は、細胞内の妨害を引き起こすことなく酸化還元バランスを評価するための有利な時代を開いた6.それらは異なる細胞内区画を標的とすることができ、細胞小器官間のクロストークを調査するためにコンパートメント特有の活動(例えば、ミトコンドリアとサイトゾルのレドックス状態をアッサイル)の定量化を可能にする。黄色蛍光タンパク質(YFP)、緑色蛍光タンパク質(GFP)、HyPeRタンパク質が、マイヤーと同グループの研究グループによってレビューされる。これらのタンパク質の中で、酸化還元感受性GFP(roGFP)は、そのCyS(例えば488 nm/em.525 nm)およびCySS(例えば405 nm/525 nm)残基の異なる蛍光読み出しに起因するユニークであり、YFP77、88などの他のレドックス感受性タンパク質とは異なり、比量分析を可能にする。レシオメトリック出力は、式レベル、検出感度、およびフォトブリーチ8の差を相殺するので、価値があります。細胞の細胞内区画(細胞ゾル、ミトコンドリア、核)または異なる生物(細菌ならびに哺乳類細胞)は、roGFP7、9、109,を修飾7することによって標的とすることができる。10
roGFPアッセイは、特にリアルタイム可視化実験のために、蛍光イメージング技術を用いて行われる。また、所定の時間ポイントを用いた実験では、roGPSのフローサイトメトリック解析も可能です。現在の記事では、アデノウイルス伝達を介してroGFP(細胞質を標的とする)を過剰発現する哺乳類細胞におけるレドックス状態の比率評価を行う蛍光顕微鏡とフローサイトメトリーの両方について説明しています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注: このプロトコルは、70%~80% コンフルエント MDA-MB-231 セルに最適化されました。他の細胞株の場合、細胞数と感染の多重度(MOI)を再最適化する必要があります。
1. 細胞の調製(1日目)
- MDA-MB-231細胞株を、5%CO2加湿雰囲気で37°Cで10%の胎児ウシ血清(FBS)を添加したダルベックコの改変イーグル培地(DMEM)10 mLの75 cm2フラスコで維持します。2
注:DMEMは10%FBS、37 °C、および5%CO2加2湿雰囲気を補い、プロトコル全体のすべてのアタッチメントおよび処理インキュベーションに使用されます。 - MDA-MB-231 細胞を実験用に準備します。
- フラスコ内の培地を吸引し、2 mLの0.25%トリプシン-EDTA溶液で細胞を2分間剥離し、6 mLの完全培地(DMEM、10%FBS)でトリプシン活性を不活性化する。150 x gで細胞を 5 分間遠心分離し、上清を吸引し、完全培地の 5 mL で細胞を懸濁します。
- 等量のセルサスペンションと0.4%のトリパンブルーを混ぜます。この混合物の10 μLを取り、自動化された細胞カウンターで細胞を数える。
メモ:セルカウントにはコールターカウンターまたはヘモサイトメーターも使用できます。 - フローサイトメトリー分析のために細胞を6ウェルプレートに播種し、150,000個の細胞を1ウェルあたり培地1mLでシードします。セルのアタッチを 16 時間待ちます。
- 細胞を蛍光イメージング用の4ウェルチャンバースライドに播種し、ウェルあたり0.5 mLの培地で25,000個の細胞をシードします。セルのアタッチを 16 時間待ちます。
注:加工井戸に加えて、種子制御井戸。コントロールウェルの1つを使用して細胞数を決定します(オプション:細胞の取り付け期間が倍加時間よりも短い場合、細胞数は播種密度と同じであると仮定することができます)、もう1つは感染していないコントロール(0 MOI)です)。
2. アデノウイルスroGFPの導入(2日目と3日目)
注意:アデノウイルスは病気を引き起こす可能性があります。細胞をトランスデューシングしながら、フィルターを使用して、チップを除染チップ、パスツールピペット、および10%漂白剤とマイクロ遠心チューブ。
注:このプロトコルは、サイトゾル特異的なroGFPで実証されたが、他の細胞コンパートメント(例えば、ミトコンドリアまたはミトコンドリア膜間空間)は、この同じプロトコルで標的とすることができる。
- MDA-MB-231細胞株の各MOI値に必要なアデノウイルス(mL)の体積を計算することにより、MOIの用量応答曲線を生成し、最高のトランスダクション効率を得る(表1):
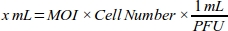
注:アデノウイルスストックの各バッチの機能力力は、mL当たりのプラーク形成単位(PFU)として表され、会社によって提供される。細胞タイプによって、最適なMOIが異なります。ほとんどの哺乳類細胞にとって、最適なMOI範囲は10〜300の間である。細胞応答によれば、MOI値を再計算する必要があります(例えば、細胞が細胞傷害反応を有する場合はMOI範囲を減らすか、細胞のトランスダクション効率が低い場合は範囲を増やすべきです)。 - 信頼性の高いピペッティングのために、細胞培養培地(10%FBSのDMEM)を用いて、6 x10 10 PFU/mLアデノウイルスroGFP溶液の1:100希釈を行います。
- ピペットを加え、0.0125 mL(12.5 μL)、0.025 mL(25 μL)、0.05 mL(50 μL)のアデノウイルスroGFP希釈液を6ウェルプレートの各ウェルに加え、50、100、および200MOIの各ウェルをトランスデュースして、50、100、および200MOIの各細胞を測定します。
- ピペットを加え、4チャンバースライドウェルにアデノウイルスroGFP希釈液0.0042 mL(4.2 μL)を加えて、蛍光イメージング用に100 MOIで25,000個の細胞をトランスデュースする(表1)。
注:アデノウイルスroGFPコンストラクトと細胞との間の最も高い相互作用を確保するために、ウェル内で最小限の量の培地を使用する必要があります。高レベルの血清が一部の細胞タイプにおける減産効率に悪影響を及ぼす可能性があるため、培養培地の血清含有量は、異なる細胞株に対して減少させる必要がある。 - 細胞の維持条件下で16〜24時間細胞をインキュベートする。翌日(3日目)、培地を細胞培養培地(10%FBSのDMEM)に変更して、さらに24時間の細胞回復を可能にする。細胞は、形態変化があってもroGFPを発現することができる。
注:3日目に、セルはroGFPを表現し始めるはずです。したがって、蛍光顕微鏡(ex. 488/em. 525のフィルタ)を用いて、トランスダクション効率を監視することができます。一貫したアッセイ結果を得るには、位相差顕微鏡で形態変化を把握し、形質の評価を行いながら形態を観察します。 - ステップ2.3で調製した50、100および200のMOIサンプルと、フローサイトメトリー分析から得られたそれらの伝達効率結果を用いて用量応答曲線を構築する(ステップ3.1および4.1)。形態学的変化(ステップ2.5)およびMOIの線量応答曲線の文書化により、最適なトランスダクション効率を評価します。
注:100 MOIおよび200 MOIエクスプレスroGFPでの細胞集団の98%以上が(代表結果を参照)、200 MOIグループはMDA-MB-231細胞の細胞形態に大きな変化を示した。その結果、MDA-MB-231細胞に対する最も有効性の高いMOIは100 MOIであると判断した。 - MDA-MB-231細胞株に最適なMOI(ここでは100 MOI)を選定した後、試験材料(10μMH2O2及びその車両0.1%脱イオン水)を用いて実験を行います。2
- セクション 1 に従って細胞を準備し、シードします。ステップ2.1で計算した100 MOIのアデノウイルス伝達量を使用して、100 MOIアデノウイルス伝達についてステップ2.2-2.4を繰り返します。次に、ステップ2.5に従ってプレートとチャンバースライドをインキュベートする。
3. CyS/CySS残高の取得
- フローサイトメトリー(4日目)
- 4日目に、ステップ2.7.1の細胞を10μMH2O2で21時間インキュベートします。
注:10μMH2O2を被験物質として使用し、0.1%脱イオン水をこのプロトコルで車両処理として使用しました。2他の酸化剤は、ここで正のコントロールとして使用することができます。 - 6ウェルプレートから吸引媒体を吸引し、0.25%トリプシン-EDTA溶液の750 μLに交換し、細胞が取り外されるまで2分待ちます。完全な媒体の2 mL(10%FBSのDMEM)とトリプシンを不活性化し、15 mL円錐形の管にボリュームを集める。
- 4ºCで5分間150 x gでチューブを遠心分離します。上清を捨て、リン酸緩衝生理食塩分(PBS)の500μLで細胞を一時停止します。
- ステップ 3.1.3 を繰り返す
- 40 μmメッシュを使用して、細胞懸濁液をフローサイトメトリー適合チューブにフィルターします。チューブを氷の上に置いて光から離し、データ分析のためにステップ4.1に従ってください。
- 4日目に、ステップ2.7.1の細胞を10μMH2O2で21時間インキュベートします。
- 顕微鏡イメージング(4日目)
- 4日目に、10μMH2O2で2細胞を処理し、処理後すぐに画像(タイムポイント0)と1時間を取得し、データ分析のためにステップ4.2に従います。
4. データ分析
- フローサイトメトリー定量
- サンプル取得ソフトウェアを介して3つの異なる分析のためのフローサイトメトリー法を設定します(材料表を参照): X軸上の前方散乱(FCS)とy軸上の側面散乱(SSC)細胞のサイズと複雑さを評価します(SSCは死細胞と生細胞の粗い識別に使用できます)。488 nm/em.525 nm (フルオレセインイソチオシアネート [FITC]) X軸のバンドパスフィルタとY軸上の SSC による CyS-roGFP の評価1.405 nm/em。525 nm (ブリリアントバイオレット 510 [BV510])バンドパス フィルター x 軸と SSC を Y 軸で X 軸に、CySS-roGFP を評価します。
- 0 MOI制御を取得し、サンプル取得ソフトウェアで細胞を可視化します。残りのサンプル(50、100、200 MOI群、および後に10 μMH2O2処理細胞および車両処理細胞)に対してこのステップを繰り返します。2データ分析用にファイルを保存します。
- データ分析ソフトウェアを開き(表を参照)、0 MOIサンプルファイルを開きます。対象の細胞集団を評価する(ゲート1)。488 nm/emのバックグラウンド蛍光を最小限に抑えるために、次の格言を設定します。525 nm (ゲート 2) および例. 405 nm/em.525 nm (ゲート 3) バンドパス フィルターと非感染 (0 MOI) コントロール セル。
- データ解析ソフトウェア内で50、100、および200のMOIサンプルファイルを開き、線量応答曲線を評価します。各サンプルについて、ゲート2と3で平均蛍光強度を分析します。試験サンプル(10μMH2O2処理細胞2および車両処理細胞)に対してこのステップを繰り返します。
- 酸化型とroGFPの還元形態との平均蛍光強度比を以下の式で計算する。

- 画像評価
- CyS-roGFPおよびCySS-roGFP用の蛍光フィルターを含む顕微鏡を使用してください(例: 488 nm/em. 525 nm および405 nm/em. 525 nm フィルター)。
- チャンバースライドの各ウェルで、4倍の目的を使用して大きな領域を視覚化し、画像を取得するために4つのランダムな領域を選択します。
注:20xの目的は、画像表示にも使用できます。 - ImageJ ソフトウェア11でイメージを開きます。分析を適用する |各画像のコマンドを計測し、ステップ 4.1.5 の式を使用してデータを定量化します。
注: 画像の定量はレシオメトリックです。したがって、プロトコルにはバックグラウンドの減算は含まれません。ただし、画像を比較できるようにするには、明るさ、コントラスト、彩度を各画像で同じにする必要があります。一方向分散分析(ANOVA)とTukeyのポストホック検定で統計的有意性を評価した。
Access restricted. Please log in or start a trial to view this content.
結果
CyS/CySSのレドックス状態は、トランスデューセロフェスで簡単にアッセイされます。蛍光プローブは、還元型と酸化形態(励起波長488nmおよび405nm)の比率を定量化します。蛍光データは、フローサイトメトリーと顕微鏡の両方で得ることができます。
多数の細胞がフローサイトメトリーを用いて一貫してかつ便利に獲得できる。分析は3つの主要なステップで構成されてい?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
生物におけるチオール/ジスルフィドバランスは、細胞の酸化還元状態を反映する。生物はグルタチオン、システイン、プロテインチオール、低分子チオールを有し、そのすべてが細胞4の酸化レベルに影響され、酸化状態をエコーする。工学的roGFPはCyS残基7を介してチオール/ジスルフィドバランスの無停止定量化を可能にする。roGFPのレシオメトリック特?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もない。
謝辞
細胞内の細胞ゾル特異的roGFPを発現するための構築および組換えアデノウイルスは、それぞれポール・T・シューマッカー博士、フライベルク医学部、ノースウェスタン大学、ViraQuest Inc.の研究室で生成された。この研究は、NIH国立一般医学研究所生物医学研究優秀センター(COBRE NIGMS)、国立総合医療科学システム薬理学および毒物学トレーニングプログラム助成金T32 GM106999を通じて、がん治療に対する宿主反応研究センターが支援しました。 UAMS財団/医学研究基金賞AWD00053956、UAMS年末首相賞AWD00053484。フローサイトメトリーコア施設は、微生物病態および宿主炎症反応センターがCOBRE NIGMSを通じてP20GM103625を付与することによって部分的に支えられた。コンテンツは著者の責任であり、必ずしもNIHの公式見解を表すものではありません。ATAはトルコ科学技術研究評議会(TUBITAK)2214-A奨学金によって支援されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
参考文献
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved