このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
カチオンペプチドキャリアの軟骨内輸送特性の特性
要約
このプロトコルは、軟骨中のカチオン性ペプチド担体の平衡取り込み、浸透深度および非平衡拡散率を決定する。輸送特性の特性評価は、効果的な生物学的応答を確保するために重要です。これらの方法は、負に荷電した組織を標的にするための最適に荷電した薬剤担体の設計に適用することができる。
要約
軟骨のような体内のいくつかの負帯電組織は、負に帯電したアグリカンの高密度化のために標的薬物送達に障壁を提示し、したがって、治療応答を高めるために改善された標的化方法を必要とする。軟骨は負の固定電荷密度が高いため、正に荷電した薬物キャリアで薬物を改変して静電相互作用を利用し、軟骨内薬物輸送を強化することができます。したがって、薬物キャリアの輸送を研究することは、生物学的応答を誘導する際の薬物の有効性を予測する上で極めて重要である。軟骨外植におけるカチオン性ペプチド担体の平衡取り込み、浸透深さ、非平衡拡散率を定量化できる3つの実験の設計を示す。平衡取り込み実験は、周囲の浴と比較して軟骨内の溶質濃度の尺度を提供し、軟骨における薬物の治療濃度を高める薬物キャリアの可能性を予測するのに有用である。共焦点顕微鏡を用いた浸透深度研究は、軟骨の表面から深いゾーンへの1D溶質拡散の視覚的表現を可能にし、これは溶体がマトリックスおよび細胞標的部位に到達するかどうかを評価するために重要である。カスタム設計の搬送チャンバーを用いた非平衡拡散率研究は、組織全体にわたって蛍光標識された溶質の拡散率を特徴付け、組織マトリックスとの結合相互作用の強度を測定することを可能にする。これは軟骨との最適な結合強度のキャリアを設計するために有益である。3つの輸送実験から得られた結果は、薬物送達用途に対する弱く可逆的な電荷相互作用を利用する最適に荷電した薬物キャリアを設計するためのガイドラインを提供する。これらの実験方法は、薬物および薬物薬物キャリアコンジュゲートの輸送を評価するために適用することもできる。また、これらの方法は、半月板、角膜および膜炎のユーモアのような他の負帯電組織を標的にする場合に使用するために適合することができる。
概要
体内の負に帯電した組織への薬物送達は、薬物が細胞およびマトリックス標的部位1に到達するために組織の深部に浸透することができないため、依然として課題である。これらの組織のいくつかは、組織内に高負固定電荷密度(FCD)2を作成し、ほとんどの高分子2,3,4の送達の障壁として作用する、密に詰まった負電荷アグリカンからなる。3しかし,、正に荷電した薬物キャリアの助けを借りて、この負に帯電した組織バリアは、実際には持続的な薬物送達1、5、6、75,6のための静電電荷相互作用を介して薬物貯蔵所に変換することができる(図1)。17
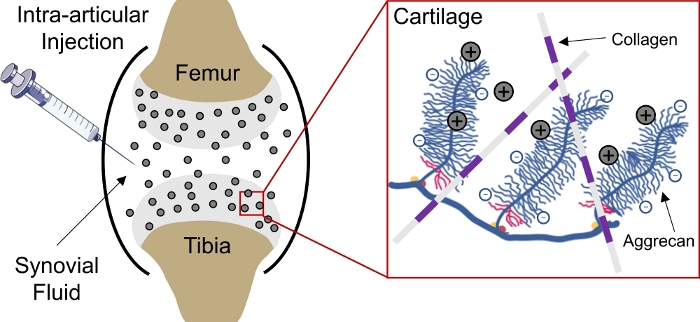
図1:CPCの軟骨内送達に基づく充電膝関節腔へのCPCの関節内注入。正に帯電したCPCと負の帯電アグリカングループ間の静電相互作用により、軟骨を通して急速かつ完全な深さの浸透を可能にします。この図は、ベダッガヴァサミら4から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
最近、短長カチオン性ペプチドキャリア(CPC)は、負に帯電した軟骨4に送達するためのより大きなサイズの治療薬を運ぶことができる小さなカチオンドメインを作成することを目的として設計された。流行88、9および9変形性関節症(OA)10などの変性疾患を治療するための軟骨への効果的な薬物送達のために10は、軟骨細胞(軟骨細胞)の大部分が11である組織内の深部に薬物の治療濃度が浸透することが重要である。利用可能ないくつかの潜在的な疾患修飾薬がありますが、これらは効果的に軟骨12、13を標的にすることができないので、13誰もFDAの承認を得ています。したがって、薬物キャリアの輸送特性の評価は、治療応答を誘導する際の薬物の有効性を予測するために必要である。ここでは、CPC4の浸透率と非平衡拡散率の平衡取り込み、浸透の深さ、非平衡拡散率の評価に利用できる3つの別々4の実験を設計した。
最適な治療応答を提供できる軟骨内に十分な薬物濃度があることを保証するために、取り込み実験は軟骨4における平衡CPC濃度を定量化するように設計した。この設計では、軟骨とその周囲浴との間の平衡に従って、軟骨内部の溶質の総量(マトリックスに結合するか、または自由に)を取り込み率を用いて決定することができる。この比率は、軟骨内部の溶出物の濃度を平衡浴の濃度に正規化することによって計算される。原則として、軟骨を通る拡散が電荷相互作用によって補助されない中性溶体は、取り込み率が1未満であろう。逆に、静電相互作用によって輸送が増強されたカチオン性溶体は、1より大きい取り込み率を示す。しかし、CPCで示されるように、最適な正電荷を使用すると、取り込み率(300を超える)4がはるかに高くなる可能性があります。
軟骨内の高い薬剤濃度は治療上の利益を達成するために重要であるが、薬剤が軟骨の完全な厚さを通して拡散することも重要である。したがって、薬剤が軟骨内の深部に到達し、マトリックスおよび細胞標的部位に到達できるように、より効果的な治療法を提供するために、浸透深さを示す研究が必要である。この実験は、軟骨を介した溶物の一方向拡散を評価し、生体内での関節内注射後の軟骨への薬物の拡散をシミュレートするように設計された。共焦点顕微鏡を用いた蛍光イメージングにより、軟骨への浸透深度の評価が可能となる。正味粒子電荷は、マトリックスを通して深い薬物がどのように拡散するかをモデレートする上で重要な役割を果たします。組織FCDに基づく最適な純電荷は、カチオン粒子と陰イオン組織マトリックスとの間の弱い可逆的結合相互作用を可能にするために必要とされる。これは、粒子がマトリックスから切り離すことができるように、いかなる相互作用も十分に弱く、本質的には可逆的であり、組織4の奥深くにある別のマトリックス結合部位に結合できることを意味する。逆に、粒子の過剰正正の正の電荷は、あまりにも強いマトリックス結合が軟骨の表面的なゾーンにおける初期結合部位からの粒子の剥離を防ぐので、拡散に向けて有害であり得る。これは、標的部位の大部分が組織11内に深くあるため、生物学的応答が不十分になる。
結合相互作用の強度をさらに定量するために、軟骨を介した薬物拡散率の分析が有利である。非平衡拡散解析研究は、異なる溶体間のリアルタイム拡散率の比較を可能にする。軟骨の表面的、中期および深いゾーンを通して薬物が拡散するにつれて、結合相互作用の存在は拡散率を大きく変えることができる。結合相互作用が薬剤と軟骨マトリックスとの間に存在する場合、それは有効な拡散性(DEFF)と定義される。この場合、すべての結合部位が占有されると、薬物の拡散率は定常拡散(DSS)によって支配される。異なる溶質のDEFF 間の比較は、マトリックスを有する溶質の相対的結合強度を決定する。特定の溶質について、DEFF とDSS が同じ桁の範囲内にある場合、拡散中に薬物とマトリックスの間に存在する結合が最小限であることを意味する。しかし、DEFF がDSSより大きい場合、マトリックスへの粒子の実質的な結合が存在する。
設計された実験は個々に軟骨を通る溶質輸送の特徴付けを可能にするが、最適に荷電した薬物キャリアを設計するためには全ての結果を含む総合的な分析が必要である。電荷相互作用の弱く、可逆的な性質は粒子拡散速度を制御し、高平衡取り込みおよび軟骨を通して急速な完全な深さの浸透を可能にする。平衡取り込み実験を通じて、非平衡拡散速度研究を用いて検証できる電荷相互作用の結果として高い取り込みを示すキャリアを探す必要があります。しかし、これらの結合相互作用は、軟骨を通して溶質の完全な厚さの浸透を可能にするために、自然界で弱く可逆的であるべきです。理想的な薬剤キャリアは、取り込みおよび高い軟骨内薬物濃度に十分な強い結合を可能にする最適な電荷を有するが、完全な厚さの拡散を妨げるほど強すぎない4。提示された実験は、薬物キャリアを標的とする電荷ベースの組織の設計特性を支援する。これらのプロトコルは、軟骨4を介してCPC輸送を特徴付けるために使用されたが、これらはまた、軟骨および他の負帯電組織を通じて様々な薬物および薬物キャリアに適用することができる。
プロトコル
死んだ組織で実験を行うための大学の承認を得た。牛の関節は食肉処理場から商業的に得られた。
1. 軟骨外植の抽出
- メス(#10刃)を使用して、切断し、牛の膝関節のフェモロペラー溝から軟骨を露出するために脂肪、筋肉、靭帯、腱および他のすべての結合組織を除去します。
- 3 mm および 6 mm の真皮パンチを使用して、垂直パンチを軟骨に入れ、円筒形のプラグを抽出します。すぐに1%v/v抗生物質抗ミキサンキを補充1xリン酸緩衝生理食塩分(PBS)の500 μLを含む48ウェルプレートの個々の井戸にプラグを入れます。
- 軟骨プラグの表面側を、スライス器具のウェルに下向きに置きます(図2)。カミソリの刃を使用して、スライス器具の表面に沿ってプラグをスライスし、表面的なゾーンを含む1mmの厚い軟骨外植体を得る。各軟骨プラグに対して繰り返します。
- 軟骨外植体は、プロテアーゼ阻害剤(PBS-PI、50 mL 1x PBSあたり1 PIミニタブレット)を補った1x PBSの500μLを含むポリプロピレンチューブに、それぞれ-20°Cで個別に保存します。
- 以下の輸送実験を行う前に、37°Cの水浴中で30分間、外植含有バイアルを解凍する。
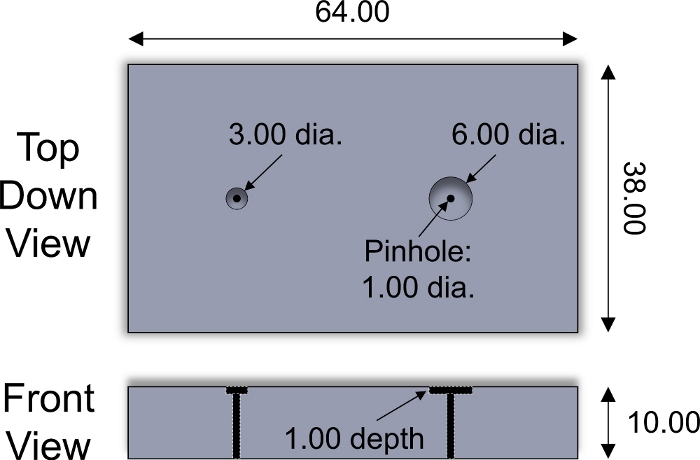
図 2: カスタム設計のスライスフィクスチャ3および6 mmの直径の軟骨の外植木をスライスするために使用されるステンレス鋼のスライスの据え付け具の設計の変数。様々な厚さのプラスチック製のインサートを、スライスした外植の厚さを調整するために井戸の中に置いた。<1 mm直径のステンレス鋼の円筒形ピンは、外植をフィクスチャから押し出すために使用されました。すべての数値はmmで表示 されます。
軟骨におけるCPCの平衡取り込み
- 軟骨の外植(3mm dia.X 1 mm厚)を軽く垂らし、余分な1x PBSを外植表面から取り除く繊細な作業ワイプを行います。バランスを使用して、各外植の湿った重量を素早く記録し、脱水を防ぐためにすぐに1倍のPBS浴に入れます。
- 蛍光標識CPCの30μM溶液(外植あたり300μL)を1x PBS-PIで調製します。再構成のためにRNaseフリーポリプロピレンチューブを使用してください。
- 96ウェルプレートでは、30μM CPC溶液のピペット300μLを別々のウェルに入れられます。蒸発を防ぐためにプレートの端近くの井戸を使用しないでください。スパチュラを使用して、各外植物を井戸を含む溶液に移す。
- 周囲の井戸に300 μLの1x PBSを充填し、井戸板を蓋で覆います。蒸発を最小限に抑えるために、プレートの縁を柔軟なフィルムで密封します。
- 37°Cインキュベーターの内部で、プレートをプレートシェーカーの上に置き、粒子沈積を制限します。軟骨中のCPCの平衡取り込みが可能となる穏やかな回転(15mm軌道で50rpm)で24時間インキュベートする(図3)。
- 蛍光とCPC濃度の相関に関する標準曲線を生成する
- ポリプロピレンチューブで30 μM ~ 0 μM (10 2 倍希釈) の CPC ソリューションのシリアル希釈液を 1x PBS-PI で調製します。各希釈液の少なくとも500 μLが存在することを確認してください。
- 黒い96ウェルプレートで連続したウェルに各希釈液の200 μLを追加します。別の行に複製して、サンプルサイズを大きくします。
- プレートリーダーを用いた蛍光ラベルの励起波長と発光波長でプレートリーダーを用いて、各サンプルの蛍光測定値を得る。
- 蛍光読み取りとCPC濃度をプロットし、曲線の線形部分の方程式を導出します。
注: 蛍光測定値の変動を制限するには、標準曲線の生成前に、サンプルプレートと同じ条件でCPCストック溶液をインキュベートします。
- 24時間のインキュベーションの後、平衡浴を各ウェルから別々のポリプロピレンチューブに集める。
- 各溶液の200 μLを黒い96ウェルプレートの別々のウェルに移します。標準曲線と同じ蛍光設定で各サンプルの蛍光測定値を取得します。必要に応じて、サンプルを1x PBS-PIで希釈して、測定値が標準曲線の直線部分内に収まるようにします。
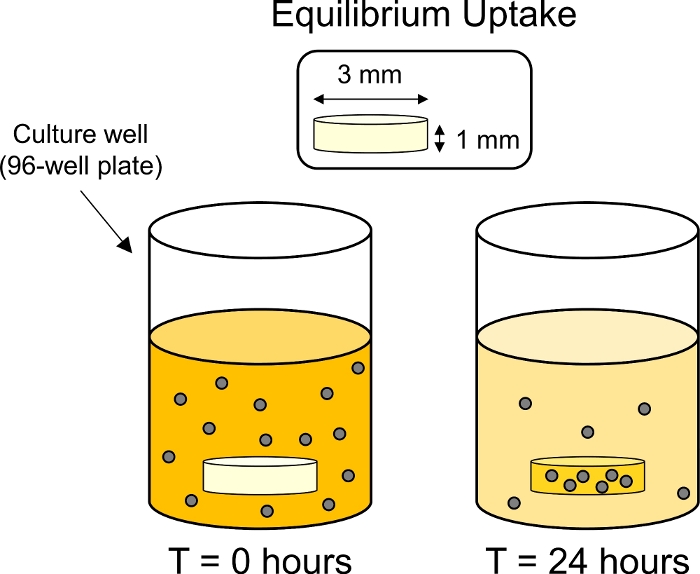
図3:平衡取り込み実験の概略図。軟骨外植体(3mm dia.x 1 mm厚)は、蛍光タグ付きCPC溶液を含む96ウェルプレート内の個体井戸に入れた。24時間後にCPCを軟骨で取り込み、周囲浴の蛍光を低減した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
軟骨におけるCPCの浸透深さ
- 蛍光標識CPCの30μM溶液(外植あたり300μL)を1x PBS-PIで調製します。再構成のためにRNaseフリーポリプロピレンチューブを使用してください。
- メスを使用して、半円盤を作るために半分に軟骨の外植(直径6ミリメートル×1ミリメートルの厚さ)をカット。切削中に1x PBS-PIの層で外植を水分補給してください。
- エポキシを使用して、カスタム設計の1次元輸送室の1つの井戸の真ん中にハーフディスク外植を接着します(図4、図5)。エポキシが外植体の周面(湾曲)側に適用されていることを確認します。軟骨の拡散表面積との接触を防ぐために井戸から余分な接着剤を除去し、外植の表面的な側面をメモします。
- 1x PBS-PIの80 μLを外植の両側に加えます。出plantの片側から液体を上下にピペットし、もう一方の側に漏れをチェックします。漏れが生じた場合は、外植を再び取り付け、必要に応じてエポキシを適用します。
- 軟骨の表面(上流)に面した側から1x PBS-PIを30 μM CPC溶液の80 μLに交換します。軟骨の深いゾーン(下流)に面した側の1x PBS-PIの80 μLを維持します。
- 慎重にカバー可能な容器に輸送室を置きます。溶液の蒸発を避けるために、層1x PBSで容器の基部を覆います。上流および下流の部屋からの解決間の直接接触がないことを保障する。
- プレートシェーカーの上に覆われた容器を置き、粒子沈着を制限します。穏やかな回転の下で室温で4または24時間(15のmm軌道で50のrpm)のためのインキュベート。
- インキュベーション後、外植をチャンバーから取り出し、外植の中心から約100μmのスライスを切ります。
注:この断面は軟骨の表面的、中間および深いゾーンを含んでいます。 - ガラススライドとカバースリップの間にスライスを置きます。1x PBS-PIの層でスライスを水和します。
- 10倍倍率で、スライスの全厚を通して画像を画像化し、共焦点顕微鏡を用いて蛍光画像のZスタックを得る。
- ImageJ プロジェクトを使用して、Z スタック内のイメージの平均強度を決定するために軟骨における CPC の浸透の深さを決定します。
- [ファイル] をクリックしてイメージ スタックを開く |を開きます。
- タスク バーの [イメージ] をクリックし、[ イメージ |スタック |Z プロジェクト ドロップダウンメニューから。
- 1 から最後のスライスまでのスライス番号を入力します。[投影タイプ] の下の [平均強度] を選択します。[OK] をクリックします。
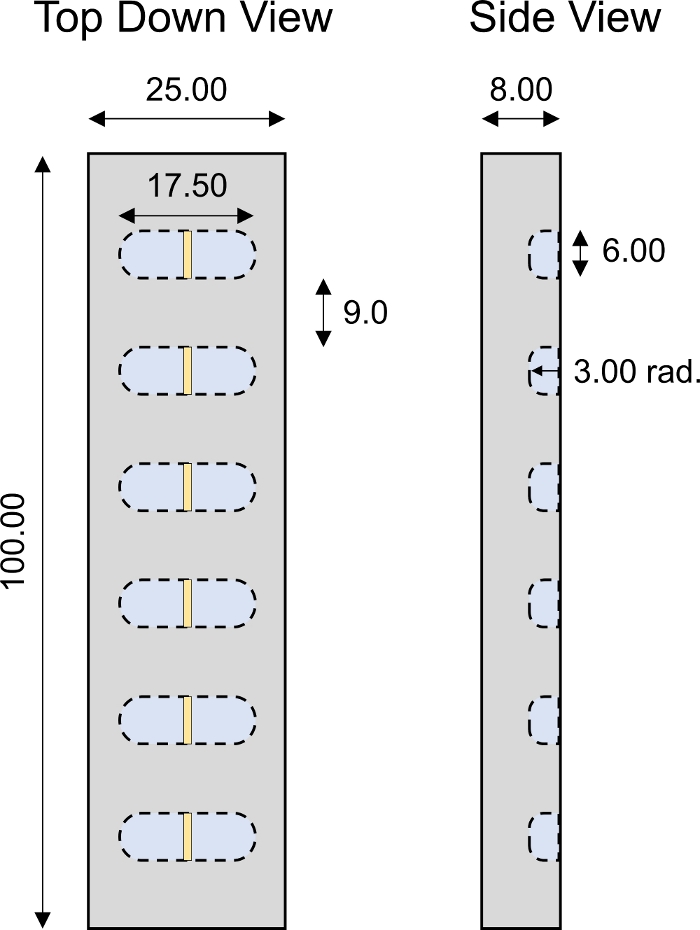
図4:カスタム設計の1次元輸送室。6つの個々の井戸が付くPMMA 1Dの輸送室の設計変数。すべての数値はmmで表示 されます。
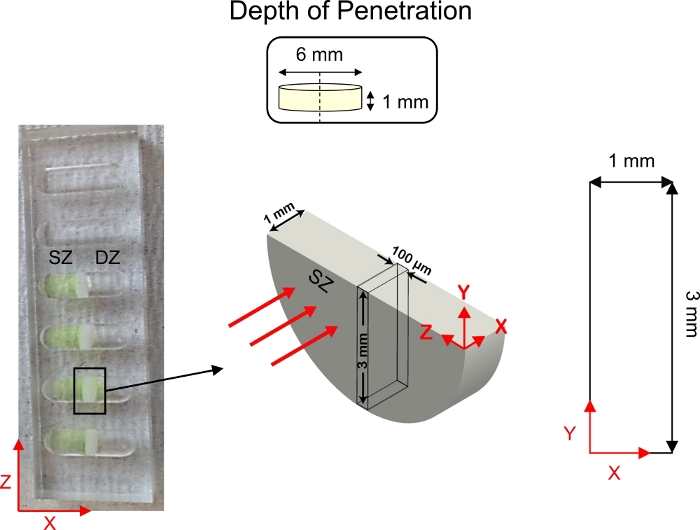
図5:浸透研究の深さの概略図。軟骨の外植体(直径6mm×厚さ1mm)を半分に切断し、1次元拡散輸送井戸の中心に固定した。蛍光タグ付きCPC溶液を軟骨の表面領域(SZ)と接触するウェルの側面に添加した。1x PBS-PIを軟骨の深層帯(DZ)と接触するウェルの側面に添加した。拡散後、共焦点顕微鏡を用いて軟骨の断面(3mm×1mm)を画像化した。この図は、Vedadghavamiら4および Bajpayee らから変更3されています 3この図の大きなバージョンを表示するには、ここをクリックしてください。
4. 軟骨中のCPCの非平衡拡散速度
- カスタム設計の搬送チャンバー(図6)の2つの半分を組み立てて、チャンバーを閉じます。レンチでチャンバーをしっかりと閉じるために洗濯機、ナット、ボルトを使用してください。
注:輸送室は、蛍光読み取りを妨げないように半透明でなければなりません。このプロトコルで使用される輸送室は、ポリメチルメタクリレート(PMMA)から作られています。 - チャンバー壁への非特異的な結合を防ぐために、チャンバーの内部空間に0.5%w/v非脂肪ウシミルク溶液を1x PBS(各チャンバに対して2 mL)で15分間コーティングします。その後、1x PBS(各チャンバに対して2 mL)でチャンバーをすすきます。
- カスタム設計のスライスフィクスチャ(図2)とカミソリの刃を使用して、直径6mmの軟骨外植体(横面)を表面ゾーンを含む厚さ500~800μmにスライスします。1x PBSで外植を水分補給してください。
- ハンマー駆動および真皮パンチを使用して、 図7に示すようにゴムシートからガスケットを作成します。
- 各半分の輸送室を1つの大きいゴムガスケット、1つのPMMAの挿入物および1つの小さいゴムのガスケットをそれぞれ含むように組み立てる。外植をプラスチック製のインサートの井戸に置き、表面ゾーンを上流のチャンバーに向けます。2つの半分を挟んで組み立て、レンチを使用してしっかりとねじ込みます(図7)。
- 上流チャンバーに2mLの1x PBS-PIを充填し、上流チャンバーからの流体の漏出について下流チャンバーを観察します。漏れが存在する場合は、チャンバーを組み立て直し、ガスケット位置とネジの締め付けを調整します。漏れがない場合は、下流チャンバーに2 mL 1x PBS-PIを充填してください。
- 上側と下流の両方のチャンバーにミニスターバーを追加し、攪拌プレートにチャンバーを置きます。分光光度計からのレーザーが下流チャンバーの中心に向かって焦点を合わせるようにチャンバを合わせます。分光光度計の信号受信機部分を下流チャンバーの後ろに置く(図8)。
注:分光光度計のレーザーと受信機には、蛍光標識タンパク質からの信号を励起、放出、送信するための適切なフィルタが装備されている必要があります。蛍光信号の干渉を避けるために実験中にブラックボックスを使用して光から輸送室を保護します。蒸発を避けるために柔軟なフィルムでチャンバーの上に開口部を密封することがベストプラクティスです。 - リアルタイムの下流蛍光発光測定値を収集し、少なくとも5分間安定した信号を確保します。
注:下流チャンバからのアリコートは、カスタム設計の分光光度計または半透明輸送室が利用できない場合、プレートリーダーを使用して蛍光を得て評価することができます。 - ピペットは、上流チャンバ内に3μMの最終的な濃度を確保するために、蛍光タグ付きCPCのストック溶液の事前計算された体積をアップストリームチャンバーに入れます。下流蛍光信号を観察し、溶質輸送が斜面の着実な増加に達することを可能にする。
注:軟骨の外植子が厚い場合は、定常状態に達するまでに長い時間がかかります。 - 定常状態に達したら、上流チャンバーから20μLを取り、下流チャンバーに追加します(「スパイクテスト」)。
注:下流蛍光のスパイクが観察されます。これにより、蛍光測定値とCPC濃度の相関が可能になります。 - リアルタイムの下流蛍光測定値を収集します。
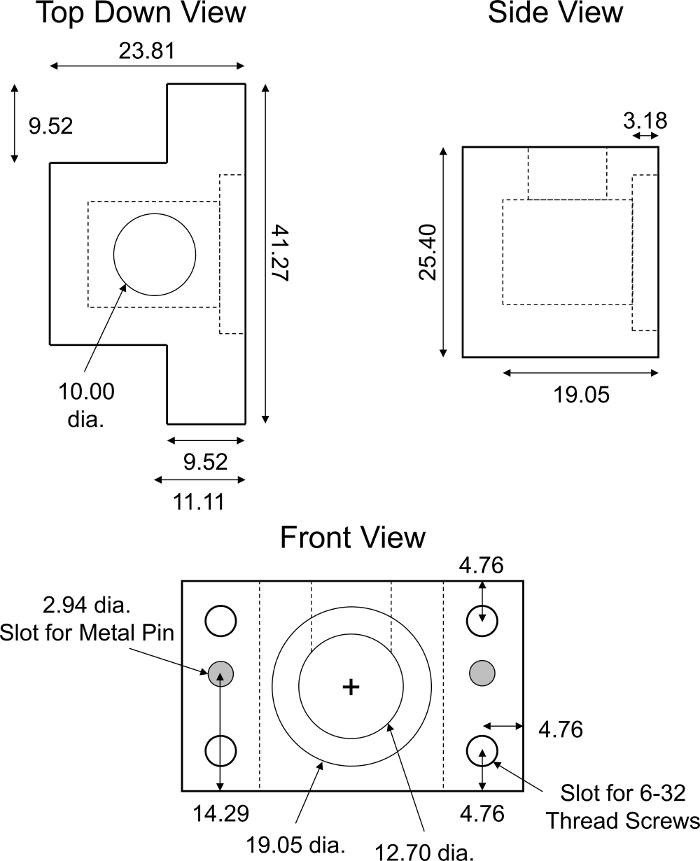
図6:カスタム設計の非平衡拡散輸送室。PMMA非平衡拡散輸送チャンバの設計パラメータ。チャンバーは、蛍光測定値を妨げないように半透明でなければならない。完全な輸送室は示された据付具の2つの同一の半分から成っている。2つの円筒形のステンレス鋼ピン(直径2.94mm、長さ約18mm)は、チャンバの半分の整列と完全な閉鎖を確実にするために必要とされました。6-32ねじねじのための4つの同一のスロットはねじ堅いアセンブリのための部屋の各コーナーでなされた。すべての数値はミリメートルで表されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
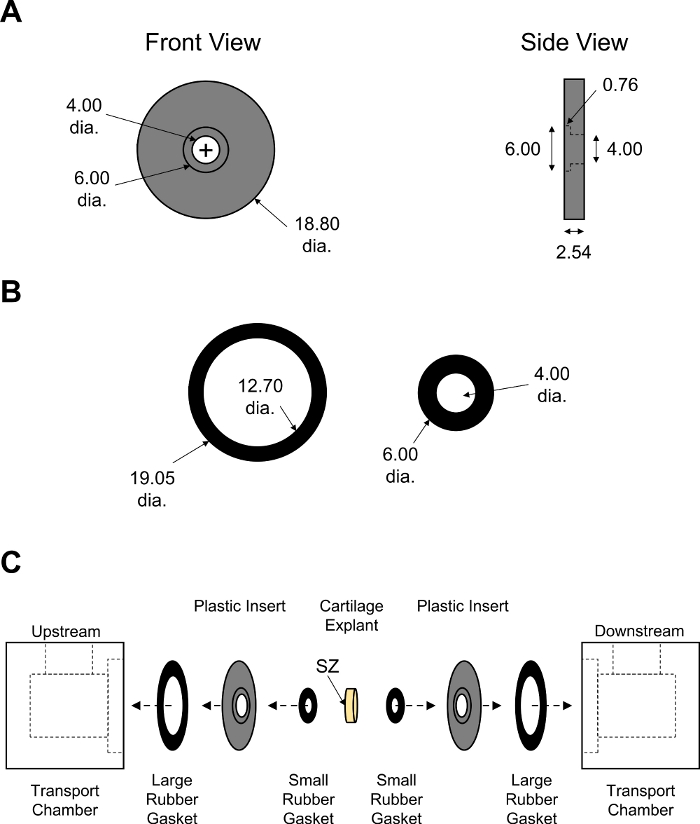
図7:非平衡拡散輸送室の組み立て。(A)黒色PMMA挿入物の設計パラメータと(B)大小のゴム製ガスケット。ゴム製ガスケットの厚さは、チャンバーの密閉を確実にするために調整しました。すべての数値はmmで提示されます(C) 中央に配置された軟骨外植を有する輸送チャンバーの2つの半分のアセンブリの順序を示す図現い。SZは、上流室に面していた軟骨の表面的なゾーンを示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
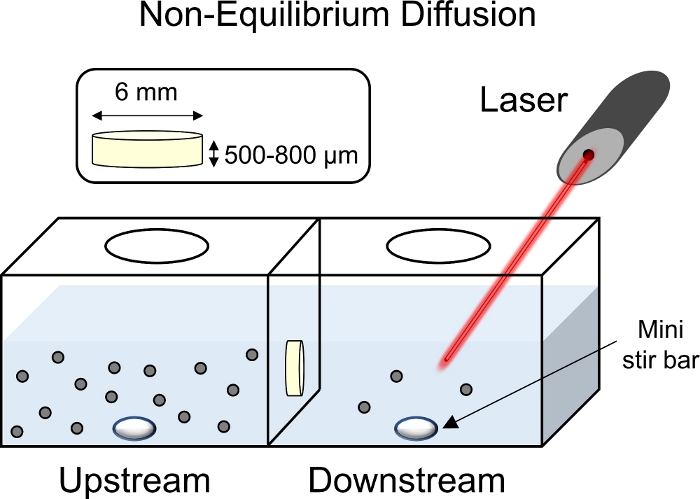
図8:非平衡拡散実験の模式図。軟骨外植体(直径6mm×厚さ1mm)を、上流チャンバに面した表面を有する搬送室の中央に配置した。チャンバーの上下側を1x PBS-PIで満たし、ミニスターバーを使用して混合した。下流チャンバに向けて蛍光測定値を集めるレーザーを使用して、蛍光タグ付きCPC溶液を上流チャンバーに添加した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
軟骨によるCPCの平衡吸収に続いて、溶質が組織によって取り込まれると浴蛍光が減少する。しかし、最終浴の蛍光値が初期値と同様のままである場合、溶質の取り込みが無いか、または最小であることを示す。溶質取り込みの別の確認は、組織が蛍光色素の色に色を目に見えて変化した場合である。軟骨中の溶物の定量的取り込みは、蛍光値を標準曲線を用いて濃度に変換した後の取り込み?...
ディスカッション
ここで説明する方法およびプロトコルは、負に荷電した組織への標的薬物送達の分野にとって重要である。これらの組織に存在する負の帯電アグリカンの密度が高いため、障壁が生じ、マトリックス内の深い細胞標的部位に薬物が到達するのを防ぎます。この顕著な課題に対処するために、薬物は、輸送速度、取り込みおよび組織内の薬物の結合を高めることができる積極的に荷電した薬物?...
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、議会主導の医学研究プログラム(CDMRP)契約W81XWH-17-1-0085、および国立衛生研究所R03 EB025903-1を通じて米国国防総省によって資金提供されました。AVは、ノースイースタン大学の工学部学部長フェローシップによって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
参考文献
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved