Method Article
ヒト人工多能性幹細胞から誘導されるインビトロ神経筋接合
要約
ここでは、ヒト人工多能性幹細胞(iPSC)からインビトロNJを生成するプロトコルを提供します。この方法は、成熟した形態と機能を有するMJを1ヶ月で単一のウェルで誘導することができる。結果として生じるNmJは、関連する疾患のモデル化、病理学的メカニズムの研究、または治療のための薬物化合物のスクリーニングに使用される可能性がある。
要約
神経筋接合部(NMJ)は、運動ニューロンから骨格筋に機械的な動きのためのアクションの電位を伝達する特殊なシナプスです。NMJ構造のアーキテクチャは、ニューロンの機能、筋肉および相互相互作用に影響を与える。これまでの研究では、複雑な誘導プロセスと長い培養期間を持つNMJ in vitroを生成するために運動ニューロンとミオチューブを共同培養することによって多くの戦略が報告されていますが、成熟したNMJ形態および機能を再現するのに苦労してきました。当社のin vitro NMJ誘導システムは、ヒトiPSCを単一の培養皿で分化することによって構築されています。誘導のための筋原性および神経原性誘導培地を切り替えることによって、得られたNMJは、1ヶ月間培養中に運動ニューロン、骨格筋およびシュワン細胞を含むシナプス前およびシナプス後の成分を含んでいた。NMJの機能的アッセイはまた、NmJを介して刺激シグナルが伝達されるアセチルコリン受容体(AChR)阻害剤であるキュラレによって、その後、カオチューブ 収縮を引き起こすことを示した。このシンプルで堅牢なアプローチは、機能的な接続性を備えたNMJの複雑な構造をうまく導き出しました。このインビトロヒトNMJは、その統合された構造と機能を有し、病理学的メカニズムおよび化合物スクリーニングを研究するための有望な可能性を有する。
概要
神経筋接合部(NMJ)は、運動ニューロンからの信号を骨格筋に伝達して自発的な筋肉の動きを制御する特殊なシナプス11,22である。このシナプスは、シナプス前およびシナプス後の部分で構成されています。シナプス前の部分では、運動ニューロンは、興奮によってシナプス小胞からアセチルコリン(ACh)を放出する。AChはシナプスの裂け目を横断し、筋収縮の作用電位を引き起こすためにシナプス後部のAChRに結合するためにシナプス小胞から放出される33、4。4この繊細な構造の機能不全は、脊髄性筋萎縮症(SMA)、先天性筋無力症候群(CMS)、筋無力症(MG)5、6、7、6,7等を含むNMJ疾患を引き起こす可能性がある。5これらの疾患は患者の生活の質を大きく損ない、病的メカニズムを理解していないため、残念ながら効果的な治療アプローチはありません。本研究では、ヒトiPSCからヒトiPSCからヒトのインビトロヒトNMJを生成し、正確な疾患モデル化および治療化合物スクリーニングを目指した。
これまでの研究では、共培養戦略によりインビトロNMJを生成する可能性が実証されています。運動ニューロンと骨格筋管はそれぞれ生成される。この2種類の細胞は、ヒトまたはマウスの一次組織培養物から生成されるか、または幹細胞88、9、10、119,10から誘導され、11次いでNMJ形成のために共培養することができる。さらなる用途としては、共同培養されたNMJをマイクロ流体3Dデバイスにマージすること、および定量化可能な機能的アッセイ12,13,13に光遺伝学的ユニットを使用することが含まれる。しかし、これらの戦略は長い培養期間を要し、同時に運動ニューロンまたは骨格筋管のNMJの主要な構成要素を得るために苦労を必要とします。NMJのさらに別の重要な成分であるシュワン細胞は、これらの培養系では生成できない。nmJ研究のための信頼でき、強いモデルを提供することができるので、ミオチューブ、運動ニューロンおよびシュワン細胞を含む高度な培養システムは望ましい。
筋原性分化1(MYOD1)は、筋形成14に対するよく知られた筋形成調節因子である。iPSCをミオチューブに駆動するためにMYOD1を適用した効率的な筋原性分化法は、以前の研究15で構築されました。そこで、iPSC15でMYOD1を過剰発現させることでミオチューブを15誘導し、高効率の筋原性分化が示された。興味深いことに、ニューロン細胞は10日後に自然に筋管と一緒に現れた。筋原性培養におけるニューロン細胞の出現により、単一の皿でインビトロNMJを生成する戦略を開発しました。ここでは、同じ培養皿での筋原性および運動ニューロン誘導用のヒトiPSCでMYOD1を過剰発現させることにより、MJを生成する戦略を提供します。運動ニューロンは、いくつかの神経栄養因子(GDNF、BDNF、NT3など)で自発的に誘導される。8、及び、その間に、シュワン細胞も16,17を17誘導することができる。ミオチューブ、運動ニューロンおよびシュワン細胞との相互作用を通じて、成熟したNMJが18に形成される。この方法は機能的NMJを効率的に生成することができ、病理学的メカニズムおよび治療化合物スクリーニングの潜在的な研究を可能にする。
プロトコル
1. 細胞外マトリックス(ECM)コーティングプレートの調製
- 氷冷1x PBSを2%の最終濃度に希釈ECM( 材料表を参照)
- 50 mL プラスチックチューブに1x PBSの49 mLにECMの1 mLを加えます。何度か上下にピペットを入れ、よく混ぜます。
- 6ウェルプレートの各ウェルに1つのカバースリップを入れる。各ウェルに2%ECMの1.5 mLを加えます。
- ウェルプレートを2%ECMで2時間37°Cでインキュベートします。
- ウェルプレートからECMを吸引し、使用前に4°Cで保管してください。
2. NMJに対するiPSCの差別化
- セクション1で準備された6ウェルプレートの井戸当たり4 x 105 のiPSC。ウェルにあらかじめ堆積したカバースリップの細胞を播種してください。
注:この研究では、201B7MYOD iPS細胞株、桜井博士の研究室からの贈り物は、15を使用しました。- 6cm培養皿のiPSCから培地を取り出し、1x PBSでiPSCを1回洗います。
- 1 mLの細胞剥離液を皿に加え、37°Cで10分間インキュベートします。
- 3 mLの霊長類胚茎(ES)細胞培地を皿に加え、ピペットを3回軽く加えます。
- 取り外しされたiPSCを含む上清を50mLのプラスチックチューブに集め、4°Cで160×gの遠心分離機を5分間回収します。 g
- 上清を慎重に吸引し、iPSCを10μM Y27632で3mL霊長類ES細胞培地に再懸濁し、ヘミック計を用いて細胞数をカウントする。
- 霊長類ES細胞培地と10 μM Y27632でiPSCを2 x 105 細胞/mLの濃度に希釈します。セクション1に記載されているウェルにあらかじめ堆積したカバースリップに2mLのiPSCを追加します。
- NMJへのiPSCの誘導
- iPSCを6ウェルプレートに播種した1日目、24時間、培養培地を取り除き、各ウェルに1μg/mLのドキシサイクリンを含む新鮮な霊長類ES細胞培地2mLに交換します。
- 1 μg/mLドキシサイクリン(最終濃度)を含有する2mLの筋形成分化培地(MDM)(表1)を各ウェルに交換します。毎日 2 日目から 10 日目までメディアを更新します。
- 11日目から、培地をNMJ培地(表1)の2mLに各ウェルに切り替えます。3\u20124 日ごとにメディアを更新してから 30 日目まで更新します。
- 30日目に相反転顕微鏡で分化されたNMJを観察します。NMJは、以下の分析に使用できます。
3. 免疫蛍光(IF)染色
- 30日目に、培養液を6ウェルプレートから吸引する。室温で30分間、4%パラホルムアルデヒドを2mLずつウェルウェルに加えてNMJ培養を修正します。
- 各ウェルに2mLの1xPBSを加えてサンプルを3回洗浄します(各洗浄ごとに3分)。
- 0.1%トリトン/PBSで10分間透過します。
- ステップ 3.2 を繰り返します。
- 室温で1時間0.5%BSAでサンプルをブロックします。
- ステップ 3.2 を繰り返します。
- 一次抗体を一晩4°Cでインキュベートします。抗体の希釈は次のとおりです: 膵虫1(1 μg/mL),ミオシン重鎖(MYH)(1/300)、神経フィラメント(NF)(1 μg/mL)、S-100(1/300)、シナプス小胞タンパク質2(SV2)(1μg/mL)、Tuj11L
- ステップ 3.2 を繰り返します。
- 2次抗体を室温で1時間インキュベートします。使用する二次抗体の濃度は以下の通りです:抗マウスIgG 488コンジュゲート(0.1 μg/mL)、抗ウサギIgG 488コンジュゲート(0.1 μg/mL)です。
- ステップ 3.2 を繰り返します。
- AChR染色用のaBTX-647(0.5 μg/mL)と核染色用のDAPI(1 μg/mL)でサンプルをインキュベートします。
- ステップ 3.2 を繰り返します。
- 6ウェルプレートから鉗子のペアでカバースリップをピックアップし、顕微鏡スライド上の50%グリセロール/PBS溶液に取り付けます。
4. 走査型電子顕微鏡(SEM)
- 室温で0.1 Mリン酸カリウムバッファーに調製した4%パラホルムアルデヒドと1%グルタルアルデヒドを1時間でNMJ培養を修正します。
- 試料を0.1Mリン酸カリウムバッファーに室温(洗浄ごとに10分)に浸漬して3回洗浄します。
- エタノールの上昇濃度(50%、70%、90%、95%、100%2回)でサンプルを脱水します。エタノールの各濃度にサンプルを10分間浸漬します。
- 臨界点乾燥機(-30°C、0.1 Torr)でサンプルを乾燥させます。
- サンプルをPt(プラチナ)イオンコーター(30mAで3分間、Ptの厚さは約20nm)でコーティングします。
- 5 kVでSEMでサンプルを観察してください。
5. 透過型電子顕微鏡(TEM)
- NMJ培養プレートから組織を収穫するために細胞スクレーパーを使用してください。組織を小さなペレット(3mm3)に小さなペレットに形成し、カミソリの刃で接着し、ゲル包装された部分を形成します。ゲル包装片を2%パラホルムアルデヒドと2%グルタルアルデヒドで固定し、0.1 Mリン酸カリウムバッファーで一晩で4°Cで調製したグルタルアルデヒドを固定します。
- 試料を0.1Mリン酸バッファー(洗浄ごとに15分)に室温で浸漬して3回洗浄します。
- 試料を1%オスミウム四酸化窒素で1時間分の2蒸留H2Oで室温で後置する。
注意:このステップは、化学フードで行う必要があります。 - ステップ 5.2 を繰り返します。
- エタノールの上昇濃度(50%、70%、90%、95%、100%2回)でサンプルを脱水します。エタノールの各濃度にサンプルを10分間浸漬します。
- 100%エタノールを吸引する。エポキシ樹脂の上昇体積比を100%エタノール混合物(1:3、1:1および3:1)でサンプルに浸潤します。各混合物を室温で1時間10rpmで穏やかに攪拌する。
- エポキシエタノール混合物を純粋なエポキシ樹脂に置き換え、室温で10rpmでゆっくり攪拌します。
- 4時間後、エポキシ樹脂をフレッシュエポキシ樹脂でリフレッシュし、室温で10rpmで穏やかに攪拌します。
- 新鮮なエポキシ樹脂と埋め込みカプセルにサンプルを埋め込み、一晩で65°Cでオーブンでサンプルを硬化させます。
- 超音波顕微鏡
- サンプルブロックを解剖顕微鏡で粗くトリミングし、正しい方向を取り付けます。
- 粗くトリミングされたブロックを超ミクロトームのガラスナイフで細かくトリミングし、滑らかな表面を得ます。
- ダイヤモンドナイフでよくトリミングされたブロックから70 nmの超薄セクションを準備します。200メッシュカーボンフォームバーコーティング銅グリッドで超薄型セクションを取得します。
- 飽和ウラニル酢酸と格子を含む極薄切片を30分間二重蒸留H2Oで調製し、二重蒸留H2O(洗浄ごとに10分)でグリッドを3回洗浄します。
- さらに、超薄いセクションをレイノルズのクエン酸鉛19(2.5%) と対比する5分間、ゆでたH2Oで室温3回(洗浄ごとに10分)に予熱して洗浄します。染色領域の周りにいくつかの水酸化ナトリウムペレットを入れて、切片上のCO2 沈殿を防ぎます。
- 70 kVで TEM で超薄セクションを観察します。
6. 筋肉収縮とキュア治療
- 筋管収縮を引き起こすために、ステップ2.3の培養培地に25mMCaCl2 を加える。ミオチューブの動きは1\u20122分で観察することができる。
- 6ウェルプレートを反転した顕微鏡のステージに置きます。ライブ細胞顕微鏡による筋管収縮の動画を記録する。
- 筋管収縮を止めるには、培養培地(300ng/mL)にキュレを加える。次に、ムービーをステップ 6.2 として録画します。
- モーションベクトル解析ソフトウェアでムービーファイルを開き、「 モーション解析」 ボタンをクリックしてムービーを解析します。
メモ:筋管収縮は、タイムモーショングラフィックとして表示されます。映画は、ミオチューブの動き速度を示すために色分けされています。色分けされたキラキラ信号は、赤い色が最も速い移動速度を示し、青色の色が最も遅い移動速度を示すmyotubesの動きを示します。
結果
当社の分化戦略を用いて、培養は30日目にNMJのシナプス前およびシナプス後成分を示した。NMJ成分は単一のウェルで誘導され、よく発達し、その形態とNMJの位置はIF顕微鏡で実証された(図1)。図1Aのフローチャートは、NMJ分化進行の経時経過を要約している。神経フィラメント(NF)、シナプス小胞(SV2)およびAChR(図1B,C)の染色はニューロンを示す。NF および SV2 の単一染色イメージを補助図 1に示します。α-ブンガロトキシン染色はAChR(図1C)を示す。合成された画像は、NMJにおける運動ニューロンとAChRの相対的な位置を示しています(図1D,E)。IF染色の第2のセットは、Tuj1およびIslet 1(図1G,H)およびミオシン重鎖によるシナプス後筋管による運動ニューロンを示す(図1I)。また、シュワン細胞をNMJ培養中のS-100抗体によって標識した(補足図2)。
NMJ成分のアイデンティティをさらに確認するために、詳細な形態学的解析にSEMを用いた。拡張軸索端子、軸索および筋線維を有する成熟したNMJ形態は、図2A、BにB示されている。TEMは、シナプス小胞を有するシナプス前軸索末端およびシナプス裂目で分離されたシナプス後部分を含むNMJ成分の成熟した超構造を明らかにするために行われた(図2C\u2012E)。接合折は、黄色の破線で示され、ニューロンと筋線維の接合部を示す(図2C)。シナプス小胞を含む成熟した軸索端子を図2D、E(黄色の矢印E)に示します。形態学的結果は、NMJ成分が良好に誘導され、成熟したことを示す。
in vitro NMJの機能を評価するために、我々は、筋管収縮を引き起こすCaCl2 で運動ニューロンを刺激することによって運動解析を行った。結果は、Ca2+ が筋肉収縮を引き起こすことができることを示した。収縮はキュラレによって中断される可能性があります。NMJは、キュラレ治療で消失した顕著な運動信号を示した(図3)。この効果は、運動ニューロン信号が筋肉収縮を引き起こすためにNMJを介して送信されたことを確認します。一緒に、IF顕微鏡、SEMおよびTEMデータは、上記のプロトコルによって生成されたin vitro NMJにおけるNMJ成分の空間分布、形態および成熟度を実証した。モーション解析は、治療戦略の開発への潜在的な応用を意味するin vitro NMJの機能を検証しました。

図1:NMJの誘導およびNMJ培養のIF画像のフローチャート。(A) NMJ の分化進行のフローチャート。(B\u2012F)NMJ成分の検出は、神経フィラメント(NF)、シナプス小胞(SV2)およびAChRである。パネルDの白い矢印は、NMJを示しています。(G\u2012K)NMJのシナプス前および後の成分。Tuj1およびIslet1は運動ニューロンを示し、ミオシン重鎖(MYH)はミオチューブを示す。a-BTX、アルファバンガロトキシン。 この図の大きなバージョンを表示するには、ここをクリックしてください。
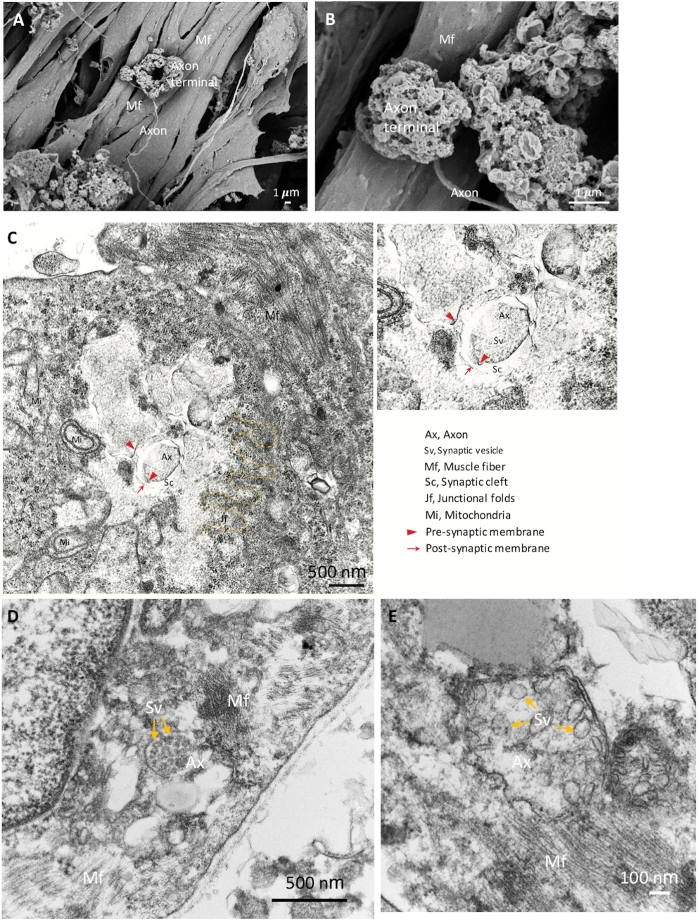
図2:成熟NMJのSEMおよびTEM画像。(A) NMJ成分の空間分布は、筋線維の表面に固定された軸索端子を示す(Mf)。(B)NMJの倍率が高い方が軸索端子を示す。(C)シナプス前軸索末端(赤矢印)とシナプス小胞(Sv)、シナプス裂傷(Sc)およびシナプス後の部分(赤い矢印)を有する成熟したNMJの超構造。接合折(jf)は黄色の破線で示されます。斧、軸索。(D, E)高倍率画像は、軸索端子(黄色の矢印)のシナプス小胞を示しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
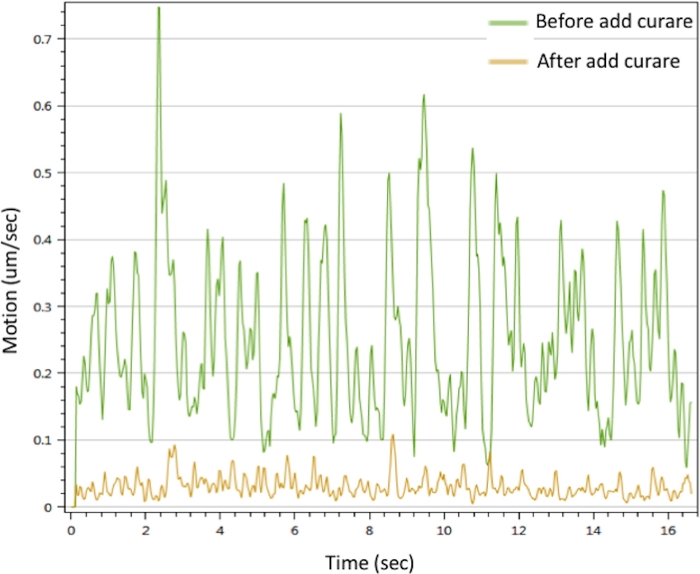
図3:インビトロNMJの筋管収縮解析ミオチューブ収縮は25 mMCaCl2 溶液(緑色線)で引き起こされた。収縮は、クレア(黄色の線)で処理した後に阻害された。 補足ムービー 1 と 補足ムービー 2も参照してください。 この図の大きなバージョンを表示するには、ここをクリックしてください。
補足映画1:Ca++によって引き起こされる筋チューブ収縮.こちらをクリックして、このビデオをダウンロードしてください。
補足ムービー2:キュア治療後の筋管の収縮が大幅に弱い。こちらをクリックして、このビデオをダウンロードしてください。
補足図1:NMJ培養における神経フィラメント(NF、白矢印)の単染色画像。 NMJ培養におけるシナプス小胞(SV2、白矢印)の単染色画像。 こちらをダウンロードしてください。
補足図2:NMJ培養におけるS-100抗体により標識されたシュワン細胞を示す。こちらをダウンロードしてください。
| 筋原性分化培地(MDM) | メムアルファ | 500mL |
| 100mM 2-ME | 1117μL | |
| ドキシサイクリン | 1μg/mL | |
| KSR | 56mL(決勝から10%) | |
| ペン/ストレップ | 2.5mL | |
| 合計 | 560mL | |
| 100mM 2メルカプトエタノール | 2-メルカプトエタノール | 7μL |
| d.d. 水 | 993μL | |
| 合計 | 1000μL | |
| NMJ培地 | 神経基底培地 (NB) | 500mL |
| B27 | 1x(50xの在庫) | |
| Bdnf | 10ng/mL | |
| GDNF | 10ng/mL | |
| N2 | 1x(100xの在庫) | |
| NT3 | 10ng/mL | |
| ペン/ストレップ | 2.5mL | |
表1:中程度の式。
ディスカッション
これまでの研究では、NMJの形成方法は、長期,培養,8、10、12、13、2010,12を必要とする洗練された方法を用いてインビトロで報告されている。81320これらの成果は、in vitro NMJの進歩をリードしています。しかし、複雑な方法論は、NMJ研究のアクセスを妨げた。当社のプロトコルは、単一の井戸で効率的かつ堅牢にNmJを生成するための共文化を回避します。NMJの3種類の細胞は、ミオチューブ、運動ニューロンおよびシュワン細胞18を含む我々の誘導系において観察された。また、成熟形態および機能が検証された。
我々の前の研究に基づいて、初期細胞密度はNMJ形成のための重要な因子であり、異なる細胞密度は培養18において様々な数のNMJを誘導する。低い細胞密度(< 1 x 104/cm2)は、NMJ形成には好ましくないニューロンの数が少ない。セルの密度を高くする場合は、より多くの時間とリソースを必要としますが(> 1 x 105/cm2)、セル密度はプロトコルを使用して 1.5 x 104/cm2 と 5 x 104/cm2 の間にすることをお勧めします。このプロトコルによって生成されるNMJは、生理学的条件を模倣する近い複数の細胞タイプを有する異種組織である。ミオチューブは培養皿に均等に分布することが判明しているが、運動ニューロンはランダムに現れ、その現象は培養中のNmJの不均一な分布をもたらす。このNMJは、均質な培養系を必要とする分析の代わりに定性的研究に適しています。また、他の細胞株、eq.、H9(ES細胞株)18 およびA11(iPS細胞株、図示しないデータ)を用いて、このプロトコルによりNMJを生成した。NMJは形態学および機能で正常に発生することができる。培養条件は、それにもかかわらず、異なる細胞株に最適化する必要があります。
化学的に引き起こされた筋管収縮およびキュラレ依存的な阻害は私達のin vitro NMJが機能し、実用的なアッセイのために適用される可能性があることを確認した。3\u20124週の培養で自発的な筋肉収縮がランダムに観察されたが、培養時間を2ヶ月まで延ばすことで回避できた。
異なる成熟段階のインビトロNMJを生成するための様々な戦略が公開されているが、我々のシステムで生成されたin vitro NMJは、培養18中にAChRのイプシロンサブユニットへのガンマの移行を観察することができるように、有意な成熟を示した。成熟度は、in vitro NMJ21を用いた疾患モデリングに関する重要な検討事項である。結論として、統合された構造成分、成熟度および機能を有するin vitro NMJは、治療開発のための潜在的な使用である。
開示事項
著者らは開示するものは何もない。
謝辞
201B7MYODを提供してくださった桜井博士に感謝します。電子顕微鏡研究は、岡本恵子・古田恵子と小田春康(京都大学大学院医学研究科解剖学研究センター電子顕微鏡研究部門)の支援を受けた。モノクローナル抗体は、NIHの国立衛生・人間開発研究所が作成した発生研究ハイブリドーマ銀行から得られたHHMI/コロンビア大学によって開発され、アイオワ大学生物学部で維持されています。また、大島美織、中川和弘、松井理恵子のモーションベクトル解析に感謝します。この研究は、日本科学振興協会の資金援助によって支えられ、16H05352および20H03642(MKSへ)を付与しました。iPS細胞研究基金(CYLおよびMKSへ)。薬学医学研究記念財団(MKSへ)武田科学財団(MKSへ)日本医学研究開発機構(17935400~CYL・MKS)の支援を受けた疾患特異的iPS細胞を活用した難病研究プログラム(17935400~CYL・MKS、MKS)からの助成金。
資料
| Name | Company | Catalog Number | Comments |
| Medium, growth factors and reagents | Item | Brand | Cat. Number |
| 2-mercaptoethanol | Nacalai tesque | 21418-42 | |
| B27, Gibco | Gibco | 12587-001 | |
| BDNF | R & D Systems | 248-BD | |
| Cell detachment solution, Accumax | STEMCELL Technologies | #07921 | |
| Critical point dryer | Hitachi | ES-2030 | |
| Doxycycline | Takara | 631311 | |
| ECM, Matrigel (growth factor reduced) | Corning | 356230 | |
| GDNF | R & D Systems | 212-GD | |
| Gelation, IP gel | Geno Staff | PG20-1 | |
| Ions coater | JEOL | JEC3000FC | |
| iPSC medium, mTeSR | STEMCELL Technologies | 85850 | |
| KnockOut SR (KSR) | Gibco | 10828-028 | |
| live cell microscopy | Nikon | Eclipse Ti microscope | |
| MEM-alpha | Gibco | 12571-071 | |
| Motion vector analysis software | Sony | SI8000 | |
| N2, Gibco | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| NT3 | R & D Systems | 267-N3 | |
| Primate ES cell medium | ReproCell | RCHEMD001 | |
| SEM | Hitachi | S-4700 | |
| TEM | Hitachi | H7650 | |
| Y27632 | Wako Chemicals GmbH | 253-00513 | |
| Antibodies | Brand | Cat. Number | Dilutions |
| Molecular Probes | B3545 | 0.5 ug/ml | |
| Islet 1 | DSHB | 40.2D6 | 1/100 |
| Myosin heavy chain (MYH) | MilliporeSigma | A4.1025 | 1/300 |
| Neurofilaments (NF) | MilliporeSigma | MAB5254 | 1/500 |
| S-100 | Abcam | ab14849 | 1/300 |
| Synaptic vesicle protein 2 (SV2) | DSHB | SV2 | 1/50 |
| Tuj1 | Covance | MMS435P | 1/1000 |
参考文献
- Hong, I. H. K., Etherington, S. J. Neuromuscular Junction. eLS. , John Wiley & Sons, Ltd. (2001).
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Slater, C. R. The Structure of Human Neuromuscular Junctions: Some Unanswered Molecular Questions. International Journal of Molecular Sciences. 18 (10), 2183(2017).
- Comley, L. H., Nijssen, J., Frost-Nylen, J., Hedlund, E. Cross-disease comparison of amyotrophic lateral sclerosis and spinal muscular atrophy reveals conservation of selective vulnerability but differential neuromuscular junction pathology. Journal of Comparative Neurology. 524 (7), 1424-1442 (2016).
- Shigemoto, K., et al. Muscle weakness and neuromuscular junctions in aging and disease. Geriatrics & Gerontology International. 10, 137-147 (2010).
- Abicht, A., Müller, J., Lochmüller, H. Congenital Myasthenic Syndromes. GeneReviews. , (2016).
- Faravelli, I., et al. Motor neuron derivation from human embryonic and induced pluripotent stem cells: experimental approaches and clinical perspectives. Stem Cell Research & Therapy. 5 (4), 87-100 (2014).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Yoshida, M., et al. Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs. Stem Cell Reports. 4 (4), 561-568 (2015).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 143 (13), 2464-2477 (2016).
- Uzel, S. G. M., et al. Microfluidic device for the formation of optically excitable, three-dimensional, compartmentalized motor units. Science Advances. 2 (8), 1501429(2016).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), 61540(2013).
- Furlan, A., Adameyko, I. Schwann cell precursor: a neural crest cell in disguise. Developmental Biology. 444, 25-35 (2018).
- Jessen, K. R., Mirsky, R. Schwann Cell Precursors; Multipotent Glial Cells in Embryonic Nerves. Frontiers in Molecular Neuroscience. 12 (69), (2019).
- Lin, C. Y., et al. iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), (2019).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journal of Cell Biology. 17 (1), 208-212 (1963).
- Steinbeck, J. A., et al. Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease. Cell Stem Cell. 18 (1), 134-143 (2016).
- Bucchia, M., Merwin, S. J., Re, D. B., Kariya, S. Limitations and Challenges in Modeling Diseases Involving Spinal Motor Neuron Degeneration in vitro. Frontiers in Cellular Neuroscience. 12, 61(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved