Method Article
アエデスアエジプティ蚊における微小胞体寄生虫・エダリア・アダイスの伝播
要約
ミクロスポリド寄生虫 エダリアシア・アダイスを培養するプロトコル.寄生虫は、幼虫段階で水平移動を介して Aedes aegypti 蚊の1世代から次の世代に継がれ、その後成人期に垂直伝達が行われます。生きた卵質は感染した卵で長期的に生き残る。
要約
エダリアアダイス は、毎年何百万もの疾患症例を引き起こす複数のアルボウイルスを媒介する疾患ベクターである Aedes aegypti 蚊の微小胞体寄生虫である。 E.aedisは 蚊ベクターの死亡率と生殖適性の低下を引き起こし、バイオコントロール剤としての可能性について探求されてきた。 E.aedis を培養するために我々が提示するプロトコルは、蚊の宿主の異なる生命段階で水平および垂直の両方の伝達を伴う自然感染サイクルに基づいている。 ae. aegypti 蚊は幼虫の段階で胞子にさらされます。これらの感染した幼虫は、その後、成人に成熟し、彼らの子孫に垂直に寄生虫を送信します。感染した子孫は、将来の水平感染のための胞子の源として使用されます。 E.aedisの 培養は、寄生虫のライフサイクルの複雑さを考えると、初心者に挑戦することができ、このプロトコルは明確化のための詳細なガイダンスと視覚補助を提供します。
概要
Aedes aegyptiは、複数のアルボウイルス(例えば、デング熱、ジカ、黄熱病)の蚊ベクターであり、毎年数億人の疾患症例を占め、30,000人以上の死亡1,2を占めると推定される。これらの病原体によって引き起こされる疾患の治療は、支持的なケアに限定され、追加のアルボウイルスが将来出現する可能性が高い 3.蚊のベクターの制御は、事実上、現在および新興病原体4の伝染を防ぐので、主に重要である。従来、ベクター制御戦略は主に化学殺虫剤を利用するが、多くの一般的に使用される殺虫剤に対する耐性が、ベクター制御の新しい方法の需要を牽引してきた。Ae. aegyptiに対するバイオコントロール特性について探求されてきた潜在的な薬剤の1つは、寄生虫のエダリア・アダイス5,6である。
E.アエディスは、1930年に工藤によって最初にノセマ・アデシスと同定され、Ae.aegypti蚊7の微小胞体寄生虫である。E.aedisの開発と再現は比較的複雑であり、そのライフサイクルは、複数の方法で進めることができます7,8,9.一般的な発達サイクルの1つは、Becnelら、19897に深く記載されており、実験室の伝播のために利用される(図1)8。簡単に言えば、Ae.aegypti卵がE.aedisに垂直に感染し、脂肪体内で単核胞子胞子を発症する感染した幼虫に孵化し、通常は幼虫や子犬として死ぬときにサイクルが始まります。死んだ幼虫から放出された単核胞子は生息地を汚染し、健康なAe.aegypti幼虫によって摂取される。これらの胞子は主に消化管で発芽し、露出した幼虫の消化組織に感染し、水平伝達をもたらす。水平に感染した幼虫は、二核胞子が形成される成人(親の世代)に発達する。女性では、これらの二核胞子は生殖管に侵入し、関連する胞状胞子は卵細胞の発達に感染する。これらの卵は、感染した幼虫(親膜生成)に孵化し、寄生虫の垂直伝達および上記のサイクルの継続をもたらす。
複数の研究は、バイオコントロールのためのE.アダイスの可能性を調査しています。E.アデシスによる感染は、Ae.aegypti女性10の生殖能力の低下をもたらすことが実証されている。さらに、半フィールド実験では、E.aedisの放出がスクリーニングされた囲いの中に保たれた試験Ae.aegypti個体数の全根絶をもたらした6。多様な蚊種のセットで開発のいくつかの段階を受けることができるが、E.aedisはAe.aegyptiで垂直にしか伝染し、高い程度の宿主特異性11、12を示す。同様に、E.aedisに関連する潜在的な環境リスクの実験室評価では、微小胞子寄生虫は、E.aedis13に感染したAe.aegypti幼虫を摂取した捕食者を含む非標的水生動物相に感染しなかった。これらの結果は、E.aedisが自然なAe.aegypti集団を標的とした生物学的制御戦略に使用される可能性を強調している。
E.aedisがベクター制御で使用する約束を示しているにもかかわらず、それを広い規模で培養して展開するには課題があります。E.aedis胞子は、寒い温度(すなわち、5°C)で1日未満で感染性を失う。暖かい温度(すなわち、25°C)でも、胞子は3週間14の間に急速に感染性を失う。さらに、E.aedisは生きたAe.aegypti蚊で培養する必要があり、健康な幼虫蚊の管理された注入は、ライフサイクルの完了を確実にし、培養8に使用される人口の崩壊を防ぐために必要である。生体内培養の要件は課題を提示します。しかし、最近の蚊の大量飼育とロボット工学(例えば、マッサロら15)の進歩は、E.aedis胞子の大規模な生成を可能にする可能性がある。この方法論を可視化することで、E.aedis飼育プロトコルへのアクセス性が向上し、より多くの研究者がこのシステムの基礎生物学と応用可能性を調査できるようになると予想されます。また、エンジニア、ロボット工学者、より広範なテクノロジーセクターとのコラボレーションの促進を促進し、E.aedisの大量飼育を改善する役割を果たすことも期待しています。
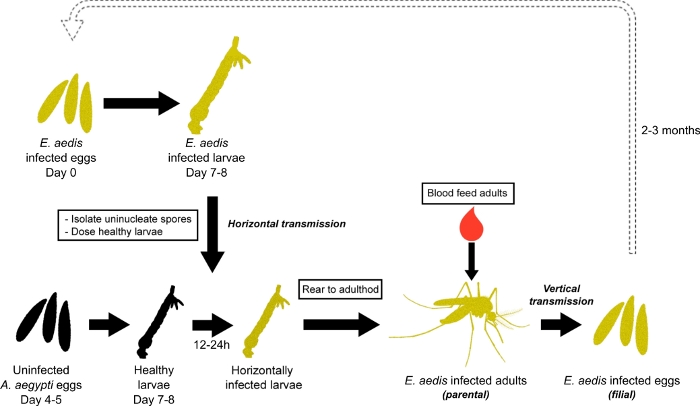
図1: Ae. aegyptiにおけるe. aedis伝播 E.aedisの伝播は、E.aedis感染した卵を孵化させることから始まる。感染した幼虫は4番目のインスターに飼育され、E.アディス胞子胞子はそれらの幼虫から隔離され、胞子は卵の感染していないクラッチから飼育された健康な2nd/3 ndインスター幼虫に経口感染するために使用される(水平感染)。これらの経口感染した幼虫は、その後成人期(親の世代)に飼育され、E.アデシス(垂直伝染)に感染した卵を産む。感染した卵(親性発生)は、感染サイクルおよび寄生虫培養を継続するために孵化する。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
1. 0日目
- ハッチ Ae. aegypti卵は 、1 L脱イオン化(DI)水で幼虫飼育トレイに入れることによって E.アデシス に感染した。魚の食べ物の50mgを追加します。
注:公開時点では 、E.aedis の実験室株は 、E.aedis が長期保存に適しておらず、感染した卵が現在リポジトリに保存されていないので、寄生虫を積極的に研究している実験室からしか利用できません。 E.aedis での作業に興味のある研究者は、感染した卵を要求するために対応する著者に連絡することができます。
注:感染した卵の多数を孵化することは、一般的に必要ではありません。10 E.aedis感染Ae.aegypti幼虫は、1000≥健康な幼虫を投与するのに十分である。
注:このプロトコルのすべての部分について、我々は次の条件で蚊を収容しました:14時間/10時間明暗サイクル、27 °C温度および80%相対湿度。
2. 1日目
- 孵化後、幼虫の密度をトレイあたり〜100個の幼虫に減らし、必要に応じて新しいトレイを作ります(1 L DI水でも)。
- 各トレイに乾いたキャットフードを1個ずつ加えます。食べ物を枯渇させたら補充するが、過剰な食料を提供しない。3日ごとに1個のキャットフード(約200mg)で十分です。
注:特定の飼育条件に応じて食品量を調整します(すなわち、水が濁ったり幼虫が死んでいる場合は食物を減らし、幼虫が発達に著しく遅れている場合は食物を増やします)。ここで提案されているものよりも他の摂食レジメンおよび/または飼育条件を使用することができますが、この標準プロトコルのタイミングの調整が必要な場合があります。
3. 日 4\u20125
- 感染した幼虫が3rd – 4th 星である場合、新しいトレイに健康/感染していない Ae.aegypti 卵を孵化させます。
- 健康な Ae.aegypti が48-72時間で2nd - 3rd instar に達するような密度でリア。私たちの手では、これは食品への アドリビタム アクセスを持つ水の1 Lあたり200\u2012300幼虫の密度を使用して達成することができます。複数の日にわたって健康な卵の孵化バッチは、幼虫が必要なときに正しい段階であることを保証することができます。
4. 7\u20128:水平伝送
注:E.aedisで健康な幼虫のドージングは、単核胞子が感染した幼虫で高い数になるまで行うことができません(1 x 104 - 1 x 10 6 106幼虫あたり)。これは4番目のインスターステージの後半で起こります(図2)。
- 単核胞子を収穫し、定量化する。
- 10の感染した幼虫を1.5 mLマイクロ遠心分離管に移すために、移管ピペット(先端を広い直径に切らなければならない場合があります)を使用してください。
- 移送ピペットで繁殖水を取り除き、1mLのきれいなDI水を加えて1回洗います。洗浄水をピペットで取り出し、500μLのきれいなDI水を10の幼虫に加え、害虫と機械ホモジナイザーを使用して均質化します。
- 400倍の倍率でヘモサイトメーターを使用して胞子を定量化します。
注:単核胞子は、その異なるピリ形状(すなわち、梨の形状)によって識別することができます。 図 2A)。
- E.アエディスで健康的なAe.アエジプティ幼虫を投与する。
- 肝臓パウダー1.2g、醸造酵母0.8g、水100mLを混合して新鮮な幼虫食品スラリーを作ります。
注:食品は、オートクレーブされ、使用するまで4°Cで保存されている場合は、新鮮である必要はありません。 - 100 2nd – 3rd instar ヘルシー Ae.aegypti 幼虫を150 mLビーカーまたは標本カップに移します。
- 5 x 104 – 1 x 105 5胞子で100の幼虫の各ビーカーを投与する。
- 100 mLの最終容積に2mLの幼虫食品スラリーとDI水を加えます。
- 肝臓パウダー1.2g、醸造酵母0.8g、水100mLを混合して新鮮な幼虫食品スラリーを作ります。
- 12-24時間の暴露の後、標準的な飼育プロトコル16に従って、幼虫を飼育トレイに移し、後部から成人期に移す。
5. 監視と垂直伝送
- 彼らはケージ内の出現カップに開発するように子犬と移動子犬のための監視幼虫。砂糖フィード大人のアドリビタム(16、17あたり)。閉鎖的な成人はE.aedisによって感染します。
- 血液は成人(16、17)に与え、卵を集める。E.aedisの垂直伝達は、このステップで発生する。
注:卵子が完了するとすぐに追加の血液食事が提供された場合、女性は成人が(しばしば突然の)高いレベルの死亡率に苦しむ前に、卵の少なくとも1つの追加クラッチを産むことができます。 - E.aedisに感染したこれらのAe.aegypti卵を使用して、このプロトコルのステップ1から始まる伝播を続けます。
注:卵は、適切な条件16の下で2〜3ヶ月間保存することができます。 - E.aedisに接触したすべての材料を10%漂白剤とオートクレーブ(可能であれば)で洗浄して汚染を防ぎます。
結果
E. aedis 感染 Ae. aegypti リバプール (LVP1b12)卵は、上記のプロトコルに記載されているように孵化した。4番目 のインスターステージでは、感染した幼虫の脂肪体全体に白い胞子嚢胞を含む感染の視覚徴候が観察された(この表現型の例を 図2Bに示す)。単核胞子は、500μL DI水中の10頭の幼虫を均質化することにより、4番目 のインスター幼虫から採取した。これらの胞子は、ピリホルム(梨の形)であり、400xで容易に見える(図2A)。ヘモサイトメーターを用いて、4.05 x 103 胞子/μLの胞子数を計算した。その後、100頭の健康な Ae.aegypti 幼虫が100mL水中に約50,000個の胞子に水平に感染し、最終的には500個の胞子/幼虫が最終投与された。幼虫は成人期(親の世代)に飼育され、脱脂ウサギの血液に1%(v/v)100 mMアデノシン三リン酸を加えて血液を供給した。垂直に感染した卵を採取(親孝行発生)させ、孵化して E.aedisの 伝播を継続し、感染の成功を定量化した。
孵化後7日間で、25頭の精液発生幼虫を個々の1.5mLマイクロ遠心分離チューブに移し、DI水で1回洗浄した。個々の幼虫は、250μLのDI水および感染状態で均質化され、E.aedis負荷は、ヘモサイトメーターを用いて評価した。親交生成におけるE.aedisの垂直感染率は96%であり、孵化後7日間の感染者の平均胞子負荷は3.31 x 105であった(範囲:3.25 x 104 – 1.47 x 106;図 3.
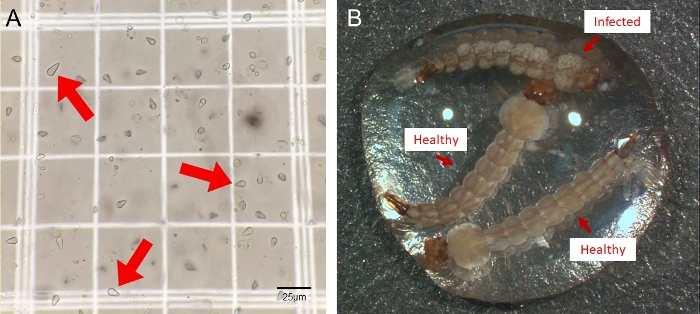
図2 Ae. aegypti蚊におけるE.aedis感染の可視化(A) Eedis単核ピリフォーム胞子。4番目のインスター幼虫に感染した10のE.アダイスは、孵化後約7日間のDI水500μLで均質化された。ホモジネートの10μLをヘモサイトメーターにロードし、400Xで見た。赤い矢印は、代表的な単核E.aedis胞子を示す。(B) E. aedis感染 4番目のインスター幼虫は、脂肪の体全体に特徴的な白い胞子嚢胞を開発します18.彼らはまた、一般的に奇形と歪んだ腹部セグメントを持っています。この図の大きなバージョンを表示するには、ここをクリックしてください。
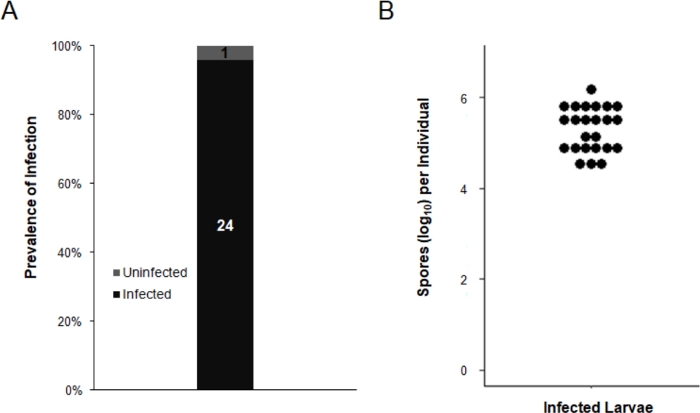
図3:培養プロトコルは、親孝行発生における効果的なE.aedis感染をもたらす。 ae. aegypti幼虫(n=25)は、250μL DI水で個別に均質化され、ホモゲネートの10μLをヘモサイトメーターにロードした。単核胞子の存在は陽性感染を示し、胞子はすべての陽性サンプルについて定量化された。(A) 親膜幼虫の感染の有病率灰色は感染していない幼虫に対応し、黒から感染する。各セグメントに表示される数値は、各グループの個人の絶対数を示します。(B) 感染した個人ごとに、胞毛の負荷が高い。黒い点は、各幼虫の丸太10形素形の単核胞子数を表す。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
我々は、もともとヘンブリーとライアン、Ae.アエジプティ蚊でE.アデシス微小胞子を飼育するための19828に記載された方法をここに提示します。この研究で使用されるE.アデディスの株は、1979年19年にタイのスティーブン・ヘンブリーによって元のフィールドコレクションに由来しました。この方法は、E.aedis7の伝達サイクルで自然に起こる水平伝送を利用して、制御された方法で寄生虫を伝播させる。この方法は、胞毛の外観、幼虫の感染の症状、または多段階の飼育/ドージングプロトコルを正常に完了するために必要な調整に精通していない新規参入者にとって困難な場合があります。私たちの希望は、このプロトコルに付随する視覚補助が、E.aedisを培養したい研究者の参入障壁を減らすことです。
上述したようにAe.aegyptiにE.aedisを伝播し、親孝行発生における寄生虫の成功を定量化した。簡単に言えば、E.aedis感染したAe.aegypti卵を孵化させ、4番目のインスターに飼育し、感染した幼虫から単核E.アディス胞子を採取した。その後、経口摂取を通じてこれらの胞子を持つ健康な幼虫に水平に感染し、水平に感染した幼虫を成人期まで飼育しました。私たちは、感染した成人(親の世代)に血液を供給し、卵(親性世代)を採取し、E.aedis寄生虫に垂直に感染すると仮定しました。我々は、卵を親膜から孵化させ、幼虫が4番目の星だったときに採取し、均質化した。我々は、E.aedisに感染した幼虫の割合と、感染したすべての個体の総胞子数を定量化した。大多数(96%)がの個体が感染し、感染した幼虫の平均胞胞負荷は〜105であった。我々は、我々の飼育プロトコルがAe.aegypti蚊におけるE.aedisの非常に成功した伝播をもたらしたと結論付ける。
このプロトコルには、初心者ユーザーにとって特に困難な複数の側面があります。以下に、お手伝いになる追加情報を提供します。一般的な蚊の飼育に関する質問については、Ae.aegyptiコロニーのメンテナンスの完全なガイドは、このプロトコルの範囲を超えています。しかし、多くの一般的な質問は、卵孵化、一般的な食事ニーズ、住宅と環境条件、および血液供給を含む17、バイオディフェンスと新興感染症研究リソースリポジトリ16、17からのリソースによって対処することができます。感染のタイムラインに関しては、感染した卵から孵化した幼虫は、4番目のインスター段階の後半まで感染の徴候を示さない。単核胞子は、1~2日間にわたって急速に現れる。幼虫は孵化後6日で事実上感染していないように見えるかもしれないが、7日目または8日目の孵化後には非常に感染する。さらに、E.aedis単核胞子と同様の大きさの他の真核単細胞生物(例えば酵母)を含む、蚊ホモジネート全体に存在する他の多くの微生物があるため、均質化サンプル中の胞子を視覚化することは困難です。E.aedis sporesの特徴的な形状(図2A)は、同定のための信頼性の高い方法であり、ホモジネート中の他の微生物からE.aedisを区別するのに役立ちます。同定や定量化には必要ではないが、胞子精製が望ましい場合、ホモゲネート内の他の汚染元素からのE.aedis胞子の分離を可能にするコロイド状シリカ密度勾配遠心分離を介して達成することができる。このプロセスについては、Solterら20で詳細に説明します。
飼育慣行で使用される温度と食事は一般的に実験室によって異なりますが、変動は依然として寄生虫の伝播に成功する可能性があります。幼虫の食品タイプのわずかな違いは、感染の成功を妨げないが、このプロトコルでは異なる食品タイプを明示的にテストしなかった。感染に対する温度の影響が試験され 、E.aedis 感染は、温度21の広い範囲で堅牢であることが判明した。最大胞胞数は30.8°Cで発生しましたが、20°Cの低い飼育温度では依然として堅牢でした。 より高い飼育温度(36°C)で胞子数が劇的に減少したため、このプロトコルではこれらの温度を避けるべきである。
寄生虫を扱う場合、汚染は常に懸念されます。 E.aedis は Ae.aegypti の正常な寄生虫であるため、汚染を防ぐために感染していない実験室コロニーから分離しなくてはならない。可能であれば、感染した蚊を別のインキュベーターに保管することをお勧めします。また、マイクロスポリディア作業に使用される材料(幼虫トレイ、トランスファーピレット、ケージ、卵の採取カップなど)は、微小胞子の作業に指定され、昆虫全体でより広く使用しないことをお勧めします。すべての飼育材料は、使用後10%の漂白剤で滅菌する必要があり、オートクレーブは漂白剤の滅菌を補うために使用することができます。
開示事項
著者らは開示するものは何もない。
謝辞
私たちは、蚊の飼育に協力してくれたスペンサー・ブランケンシップに感謝したいと思います。また、原稿に対する有益なフィードバックを受け入れたジェームズ・N・ラドルとM・ドミニク・マジストラドに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 120 mL Specimen cup | McKesson | 911759 | Inexpensive alternative to beaker |
| 150 mL beakers | VWR | 10754-950 | For larval dosing |
| 2 oz round glass bottle | VWR | 10862-502 | Bottle for 10% sucrose in adult cages |
| 3 oz. emergence cup | Henry-Schein | 1201502 | For transfer of pupae to cage |
| Adult mosquito cages | Bioquip | 1462 or 1450ASV | For adult housing |
| Autoclave | For sterilization | ||
| Bleach | For sterilization | ||
| Brewer’s yeast | Solgar | For feeding larvae during dosing | |
| Controlled rearing chamber | Tritech | DT2-MP-47L | Inexpensive small rearing chamber |
| Cotton roll | VWR | 470161-446 | Wick for sugar bottles |
| Defibrinated rabbit blood | Fisher | 50863762 | For blood feeding adults |
| Disodium ATP, crystalline | Sigma-Aldrich | A26209-5G | For blood feeding adults |
| Dry cat food | 9Lives | Indoor Complete | For general larval rearing |
| Fish food flakes | TetraMin | For general larval rearing | |
| Hemocytometer | Fisher | 267110 | For counting spores |
| Homogenizer/mixer motor | VWR | 47747-370 | For homogenizing infected larvae |
| Larval rearing trays | Sterillite | 1961 | Overall dimensions are 11" x 6 5/8" x 2 3/4" |
| Liver powder | NOW foods | 2450 | For feeding larvae during dosing |
| Pipette 1 - 10µL | VWR | 89079-962 | For larval dosing |
| Pipette 100 - 1000µL | VWR | 89079-974 | For food during larval dosing |
| Pipette tips 1 - 10µL | VWR | 10017-042 | For larval dosing |
| Pipette tips 100 - 1000µL | VWR | 10017-048 | For food during larval dosing |
| Plastic pestles | VWR | 89093-446 | For homogenizing infected larvae |
| Sucrose, crystalline | Life Technologies | 15503022 | For adult feeding |
| Transfer pipet | VWR | 414004-033 | For larval transfer, must trim ends |
参考文献
- Yellow fever. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/yellow-fever (2019)
- Dengue and severe dengue. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/dengue-and-severe-dengue (2020)
- Weaver, S. C. Prediction and prevention of urban arbovirus epidemics : A challenge for the global virology community. Antiviral Research. 156, 80-84 (2018).
- Rather, I. A., Parray, H. A., Lone, J. B., Paek, W. K., Lim, J., Bajpai, V. K., Park, Y. H. Prevention and Control Strategies to Counter Dengue Virus Infection. Frontiers In Cellular and Infection Microbiology. 7, 336 (2017).
- Becnel, J. J. Edhazardia aedis (Microsporidia: Amblysporidae) as a biocontrol agent of Aedes aegypti (Diptera: Culicidae). Proceedings and abstracts, Vth International Colloquium on Invertebrate Pathology and Microbial Control. , 20-24 (1990).
- Becnel, J. J., Johnson, M. A. Impact of Edhazardia aedis (Microsporidia: Culicosporidae) on a seminatural population of Aedes aegypti (Diptera: Culicidae). Biological Control. 18 (1), 39-48 (2000).
- Becnel, J. J., Sprague, V., Fukuda, T., Hazard, E. I. Development of Edhazardia aedis (Kudo, 1930) N. G., N. Comb. (Microsporida: Amblyosporidae) in the mosquito Aedes aegypti (L.) (Diptera: Culicidae). Journal of Protozoology. 36, 119-130 (1989).
- Hembree, S. C., Ryan, J. R. Observations on the vertical transmission of a new microsporidian pathogen of Aedes aegypti from Thailand. Mosquito News. 42, 49-54 (1982).
- Johnson, M. A., Becnel, J. J., Undeen, A. H. A new sporulation sequence in Edhazardia aedis (Microsporidia: Culicosporidae), a parasite of the mosquito Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 70 (1), 69-75 (1997).
- Becnel, J. J., Garcia, J. J., Johnson, M. A. Edhazardia aedis (Microspora: Culicosporidae) effects on the reproductive capacity of Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 32 (4), 549-553 (1995).
- Becnel, J. J., Johnson, M. A. Mosquito host range and specificity of Edhazardia aedis (Microspora: Culicosporidae). Journal of the American Mosquito Control Association. 9 (3), 269-274 (1993).
- Andreadis, T. G. Host range tests with Edhazardia aedis (Microsporida: Culicosporidae) against northern Nearctic mosquitoes. Journal of Invertebrate Pathology. 64 (1), 46-51 (1994).
- Becnel, J. J. Safety of Edhazardia aedis (Microspora: Amblyosporidae) for nontarget aquatic organisms. Journal of the American Mosquito Control Association. 8 (3), 256-260 (1992).
- Undeen, A. H., Becnel, J. J. Longevity and germination of Edhazardia aedis (Microspora: Amblyosporidae) spores. Biocontrol Science and Technology. 2, 247-256 (1992).
- Massaro, P., Sobecki, R., Behling, C., Criswell, V., Zha, T., Devenzengo, R. T. Automated mass rearing system for insect larvae. , (2018).
- Methods in Aedes Research. BEI Resources Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods_20in_20Aedes_20Research_202016.pdf (2016)
- Methods in Anopheles Research. BEI Resources Available from: https://www.beiresources.org/portals/2/MR4/MR4_Publications/Methods_20in_20Anopheles_20Research_202014/2014MethodsinAnophelesResearchManualFullVersionv2tso.pdf (2014)
- Desjardins, C. A., et al. Contrasting host-pathogen interactions and genome evolution in two generalist and specialist microsporidian pathogens of mosquitoes. Nature Communications. 6 (1), 1-12 (2015).
- Hembree, S. C. Preliminary Report of some mosquito pathogens from Thailand. Mosquito News. 39 (3), 575-582 (1979).
- Solter, L. F., Becnel, J. J., Vávra, J. Research methods for entomopathogenic microsporidia and other protists. Manual of Techniques in Invertebrate Pathology. , 329-371 (2012).
- Becnel, J. J., Undeen, A. H. Influence of temperature on developmental parameters of the parasite/host System Edhazardia aedis (Microsporidia: Amblyosporidae) and Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 60, 299-303 (1992).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved