このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
コルチの器官に向かう細胞の移動を探るインビトロタイムラプスライブセルイメージング
要約
本研究では、共焦点顕微鏡を用いて、コルチの器官を含む人工内皮上皮を用いてex vivoインキュベーションによって損傷組織に向かって移動する細胞を観察するリアルタイムイメージング法を提示する。
要約
間葉系幹細胞(MCs)が細胞再生および治療に及ぼす影響を調べ、人工内皮との共培養後のMSC移行および形態学的変化を追跡する。コルティの器官は、解剖中に発生したライスナーの膜の一部を押すことによってプラスチックカバースリップに固定化された。ガラスシリンダーで閉じ込められたMSCは、シリンダーが取り外されたときに人工内皮上皮に移行した。彼らの主な局在は、コルチの器官の透析で観察され、神経線維と同様の方向に整列した。しかし、いくつかのMSCは、手足の領域に局在し、水平に細長い形状を示した。また、毛細胞領域への移動が増加し、カナマイシン処理後にMSCの形態が様々な形態に変化した。結論として、この研究の結果は、人工内皮とのMSCの共培養が細胞移植による治療薬の開発および様々な条件および要因を調べることができる細胞再生の研究に有用であることを示している。
概要
難聴は先天的に起こり得るか、加齢、薬物、騒音を含むいくつかの要因によって徐々に引き起こされる可能性がある。難聴は、聴力を担う毛細胞が損傷した後に機能障害を回復することは非常に困難であるため、しばしば治療が困難である。世界保健機関(WHO)によると、世界の4億6,100万人が難聴と推定されており、これは世界人口の6.1%を占めています。難聴者のうち93%が成人で、7%が子供です。
多くのアプローチは、難聴を治療するために試みられてきた;特に、MSCを用いた再生アプローチが有望な治療法として登場している。組織が損傷すると、MSCは循環系に自然に放出され、損傷部位に移動し、そこで様々な分子を分泌して再生を促進する微小環境を形成する2。したがって、外部移植されたMSCを標的とする臓器への移行と、強力な免疫調節、血管新生、および抗アポトーシスを引き起こす分子のその後の分泌を通じて損傷した組織を治療する方法を開発することが重要であり、損傷した細胞機能3、4、5の回復を強化する。
MSCが損傷した組織に移行するホーミングプロセスは、克服すべき最も重要な障害である可能性があります。MSCには、テザリング/ローリング、活性化、逮捕、トランスマイグレーション/ダイアペデス、および移行6、7、8の順次ステップを備えた全身ホーミングメカニズムがあります。現在、これらのステップを改善する方法を特定するための取り組みが進行中です。遺伝子組み換え、細胞表面工学、インビトロプライミング、磁気誘導など、さまざまな戦略が6,7で試験されています。さらに、損傷した人工内毛部位にMSCをホーミングすることにより、聴覚毛細胞の保護と再生を促進するためにいくつかの試みがなされている。しかし、インビボでのMSCの追跡は時間と労力を要し、高度に専門的なスキルを必要とします 9.
この問題を解決するために、数時間にわたって細胞の移動を撮影するタイムラプス共焦点顕微鏡を介して、内腔内のMSCのホーミングを観察する方法が開発された(図1)。それは20世紀 初めに開発され、最近特定の細胞の移動を研究するための強力なツールとなっています。
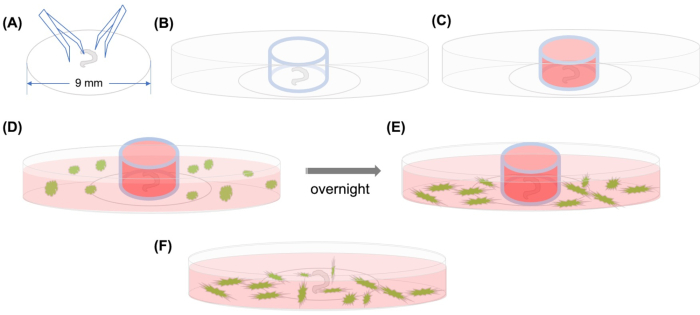
図1:図1:(A)コルティの解剖された器官が鉗子を用いてプラスチックカバースリップに付着した後、カバースリップは35mmガラス底の共焦点顕微鏡皿に置かれ、(B)ガラスシリンダーが配置される。(C)ガラスシリンダーの内部を媒体で充填した後、(D)GFPラベル付きMSCを媒体で慎重にシリンダーの外に追加する。(E)一晩のインキュベーション後、ガラスシリンダーを取り外し、画像を共焦点顕微鏡で撮影する。略語: GFP = 緑色蛍光タンパク質;MSC = 間葉系幹細胞。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
ICRマウスを含むすべての研究プロトコルは、元州医科大学延世大学の施設動物管理・使用委員会(IACUC)によって承認されました。実験は世界医師会倫理規定に従って行われた。このプロトコルでは、妊娠中のICRマウスを12/12時間の明暗サイクルに保ち、食物および水に自由にアクセスした。
1. コクリー解剖
- 紫外線を30分間オンにして層流組織培養フードを殺菌し、使用前に70%エタノールで全ての表面をスプレーします。表面を乾かします。
- 解剖器を70%エタノールに10分間入れ、使用する前に乾燥させます。
- 手術用ブレードを使用して、出生後3-4日齢のマウスの首を切り落とします(図2A)。
- 頭蓋骨を層流フードの実体顕微鏡の下に置き、組織を70%エタノールに浸します。
- 組織を組織解剖液(1xハンクスバランス塩溶液、1 mM HEPES)に素早く浸し、エタノールを除去する。
- 外科用ブレードで頭蓋骨の中心線を切る(図2B、C)。
- 皮膚を前から引き下げ、耳の外耳道を切断して頭蓋骨を露出させる(図2D)。
- 眼線を横切って頭蓋骨の前部から後部に切り取る(図2E)。
- 頭蓋骨を開き、前脳、小脳、脳幹を鈍い鉗子で取り除く(図2F、G)。
- マイクロ鉗子を用いて、側頭骨から内耳を分離する(図2H)。
- 組織解離液を含むペトリ皿にコクリーを移します。
- 内の人工内軟組織のみを残して、すべての人工内臓のオティックカプセルを慎重に解剖する(図2I、J)。
- 鉗子と別の鉗子のペアで人工内耳管の変化を保持し、ゆっくりと2つの組織を分離する(図2K)。
- ストリア血管症とテクトリアル膜を静かに剥がして取り除く(図2L、M)。
- 新しい組織解剖液に殺菌プラスチックカバースリップを入れ、コルティの器官を直径9mmのカバースリップに置き、バジラー膜が下向きであることを確認する(図2N-P)。
- Reissnerの膜と残りの変形組織を鉗子でカバースリップに押し込んで組織を固定化する(図2N-P)。
- 埋め込みティッシュのカバースリップを直径35mmの共焦点皿の中心に移す。
- 皿の中央に位置する人工内草を持つガラスクローニングシリンダーを皿の上に置き、100 μLの外植培養培地(DMEM/F12、10%胎児血清(FBS)、1%N2サプリメント、アンピシリン(10μg/mL))をシリンダー内に10を加える(図2Q)。
- プレート5×マウス骨髄由来緑色蛍光タンパク質(GFP)タグ付きMSPの10細胞を2mLの培養培地(45%DMEM+ 45%DMEM/F12、10%FBS、1%N2サプリメント、アンピシリン10μg/mL)の外ガラスシリンダー外(図2R)
- MSCが80〜90%コンフルエントである場合、トリプシンエチレンジアミンテトラ酢酸でそれらを取り外すことによってそれらを通過させる。
- コンフォーカルディッシュを加湿インキュベーターに慎重に移し、5%CO2雰囲気で37°Cで一晩インキュベートします。
- すべての媒体をシリンダーの内側と外側に吸い込み、ガラスシリンダーをコンフォーカル皿から取り外します。
- 共焦点皿に2mLの新鮮な培養培地を加え、分析の準備ができるまで加湿インキュベーターで組織培養皿をインキュベートする。

図 2.マウスの内臓の解剖とコルチとMSCの器官の共培養.(A)マウスの切断、 (B) および (C) 頭部の中線矢頭解剖、 (D) および (E) 脳の角膜解剖、 (F) および (G) 脳と側頭骨の除去、 (H) 人工内壁の除去、 ( H)骨内壁の除去、 (J)人工内骨の分離、 ( (L) コルチの器官からのストリア血管症 (SV) とスパイラル靭帯 (SL) の分離、 (M) プレート膜の除去、 (N-P) プラスチックカバースリップ上の内骨膜の固定、(Q) コンフォーカルディッシュにおけるカバースリップとガラスシリンダーの位置、 (R) 白スケールバー (A-Ecm = 1)オレンジ(F、G、P)と黄色のスケールバー(H、I)=1mm;緑色のスケールバー(J-O)=0.5 mm.この図の大きなバージョンを表示するには、ここをクリックしてください。
2. タイムラプスイメージング
- ここで示す実験では、ステージトップインキュベーターシステムを備えた共焦点顕微鏡システムを使用してください。
- 共焦点顕微鏡、蛍光灯、コンピュータの電源を入れます。
- 共焦点顕微鏡のステージ上に配置したステージトップインキュベーターの条件を37°C、5%CO2雰囲気に設定します。
- 皿の固定容器の上にサンプル皿を置き、皿の固定蓋で覆い、上ヒーターの蓋でチャンバーを閉じます。
- 視野のコルティとMSCの器官を局地化するためにズームとフォーカスを調整します。
- 画像処理ソフトウェアを開きます。 [位置指定 ]オプションで 、20x Plan-Apochromat の目的(0.8 の数値) と 0.5x トリミング領域を選択します。
- [ 取得] で スマート セットアップ をクリックし 、[EGFP]を選択します。
- [取得] の下のチャネルタブを開き、レーザーパワーを0.2% に、ピンホールを44 μmに、マスター ゲインを750 Vに、デジタルゲインを1.0に設定します。
- イメージング設定の下の[ESID]をクリックし、ESIDゲインを4に、デジタルゲインを7.5に設定します。
- 210タイルを生成するためにタイルとステークをクリックしてください。
- フォーカス戦略を開き、フォーカスモードを選択します。
- [ 時系列] で、 期間 を 24 時間 、 間隔 を 10 分に設定します。
- [取得] で、フレーム サイズを512 x 512 ピクセル、スキャン速度を8ピクセル、方向を双方向に設定し、平均を4倍に設定し、ピクセルあたりのビット数を16に設定します。
- 実験を 開始 するをクリックして実験を開始します。
3. 画像ファイルの変更
- [ 処理] で [ ステッチ] をクリックし、 最小オーバーレイ を 5% に設定し、 最大シフト を 10%に設定します。
- [ ムービーのエクスポート] をクリックし、 非圧縮に設定し、 速度 を 7.5に設定します。
4. 免疫染色
- 培地を慎重に吸引し、リン酸緩衝生理食塩分(PBS)でサンプルを5分間洗浄します。
- サンプルをPBSで4%ホルマリンで15分間固定し、サンプルをPBSで3回5分間洗浄します。
- PBSで0.1%トリトンX-100でサンプルを10分間透過し、PBSで3回5分間洗浄します。
- 250 μLのファロイジン-iFluor 647試薬(PBSで1:1000希釈)を加え、シェーカーの室温でサンプルを1時間インキュベートします。
- サンプルをPBSで3回5分間洗います。
- カバースリップをガラススライドに移し、2滴の取り付け溶液を追加します。
- スライドにカバースリップをそっと置きます。
- 透明なマニキュアでカバースリップを密封し、細胞が観察されるまで暗闇の中で4°Cで保管してください。
- 励起/放出(Ex/Em)=650/665 nmのファロイジンおよびEGFPのEx/Em=488/507 nmで、適切なフィルターを備えた共焦点顕微鏡を使用してスライドをイメージします。
結果
3次元モードにおけるMSCのインビトロ移行は、トランスウェルシステムまたは従来の創傷治癒法によって評価され、2次元(2D)モード11での移動を観察する。コルティの器官は、ボエッチャー細胞、クラウディウス細胞、Deiters細胞、ピラー細胞、ヘンセン細胞、外毛細胞、内毛細胞、神経線維、バジル膜、および網状層層などの様々な細胞から構成され?...
ディスカッション
損傷した細胞の再生を促進するために、損傷部位へのMSCの移植が広範囲に研究されており、治療効果が明らかである。移植とその後のMCの分化は、3-ニトロプロピオン酸13によって誘発される難聴を有するラットの聴力を回復させることが報告されている。Leeらはヒトに対してMSCをトランスベンで適用したが、彼らは聴覚14において有意な改善を達成しなか?...
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、韓国国立研究財団(NRF)とハリム大学研究基金の研究助成金(NRF-2018-R1D1A1B07050175、HURF-2017-66)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
参考文献
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved