このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
デジタル高速毛様体ビデオ顕微鏡を使用した鼻ブラッシングサンプリングと処理–COVID-19パンデミックへの適応
要約
PCD診断のための高品質毛様体機能解析を成功させるには、呼吸上皮のサンプリングと処理のための正確で慎重な方法が不可欠です。COVID-19パンデミックの間もPCD診断サービスを提供し続けるために、毛様体ビデオ顕微鏡プロトコルが更新され、適切な感染管理対策が追加されました。
要約
原発性毛様体ジスキネジア(PCD)は、遺伝的運動性繊毛症であり、重大な耳鼻咽喉科肺疾患を引き起こします。PCD診断は、さまざまな診断モダリティの課題のために見逃されたり遅れたりすることがよくあります。PCDの診断ツールの一つであるデジタル高速ビデオ顕微鏡(DHSV)を用いた毛様体ビデオ顕微鏡は、毛様体拍動周波数(CBF)と拍動パターン(CBP)解析からなる毛様体機能解析(CFA)を行うのに最適な方法と考えられています。ただし、DHSVには、サンプルを処理および分析するための標準化された公開された操作手順がありません。また、COVID-19パンデミック時の重大な感染管理の問題である生体呼吸器上皮を使用しています。この健康危機の間も診断サービスを提供し続けるために、毛様体ビデオ顕微鏡プロトコルは、適切な感染管理対策を含むように適応されています。
ここでは、繊毛呼吸器サンプルのサンプリングと実験室処理のための改訂されたプロトコルについて説明し、COVID-19感染管理対策に準拠するために行われた適応を強調します。このプロトコルに従って処理および分析された、16人の健康な被験者から得られた鼻ブラッシングサンプルからのCFAの代表的な結果が記載されている。また、品質選択基準を満たさないサンプルではCFAが可能になり、診断の信頼性とこの技術の効率が低下する可能性があるため、最適な品質の上皮繊毛ストリップを取得して処理することの重要性についても説明します。
概要
原発性毛様体ジスキネジア(PCD)は、遺伝性の不均一な運動性繊毛症であり、呼吸繊毛が静止している、遅い、または運動障害であり、粘液繊毛クリアランスの障害および慢性耳鼻肺疾患を引き起こします1,2,3,4。PCDの臨床症状は、乳児期初期から始まる慢性的な湿った咳と慢性的な鼻づまり、気管支拡張症につながる再発性または慢性の上気道および下気道感染症、および再発性または慢性の中耳炎と副鼻腔炎です5,6,7。PCD患者の約半数は、上皮内または曖昧な上皮などの臓器側性欠損を呈しています。一部の患者はまた、男性の不動の精子と女性の卵管の不動繊毛による不妊症の問題を呈します1,2,8。PCDはまれですが、有病率を定義するのは難しく、1:10,000から1:20,000の範囲です9,10。しかし、PCDの実際の有病率は、診断の難しさと臨床的疑いの欠如のためにより高いと考えられています。PCDの症状は、他の急性または慢性呼吸器疾患の一般的な呼吸器症状を模倣しており、診断を確認することの診断上の課題はよく知られており、不十分な治療とフォローアップにつながります2,5,9,11。
デジタル高速ビデオ顕微鏡(DHSV)を使用した毛様体ビデオ顕微鏡は、PCD4、8、12、13の診断ツールの1つです。DHSVは、毛様体拍動周波数(CBF)および拍動パターン(CBP)分析からなる毛様体機能分析(CFA)を実行するための最適な方法と考えられている2,14,15,16。DHSVは、通常、鼻ブラッシングから得られる生きている呼吸上皮を使用する13。
現在のCOVID-19の発生を考慮すると、基礎となる呼吸器疾患がCOVID-19感染後の転帰の悪化につながる可能性があることを証拠が示唆しているため、PCD診断の確認はさらに重要になっています17,18。現在のパンデミック時の安全で効率的なPCD診断サービスにより、確認されたPCD患者は、一般の人々と比較して、追加の保護措置の恩恵を受けることができます19。
COVID-19の感染は、主に飛沫拡散20を介して発生します。無症候性(または最小限の症候性)患者からの感染の高い可能性は、鼻サンプル20の高いウイルス量によって示唆される。さらに、ウイルス粒子がエアロゾル化されると、少なくとも3時間空気中にとどまります21。したがって、呼吸器医療従事者は、診断技術22のための臨床ケアおよびサンプル収集を行っている間、ウイルス量の高い貯蔵庫にさらされる。さらに、生きている呼吸器サンプルの操作は、技術者をCOVID-19汚染にさらします。COVID-19患者の世話をする呼吸器内科医と耳鼻咽喉科外科医のためのベストプラクティスの推奨事項が実施されていますが23、COVID-19パンデミック時にDHSVを実行するための推奨事項は不足しています。
PCD診断サービスを提供し続けるために、医療従事者(サンプル収集の実行)と技術者(サンプル処理の実行)の安全を確保しながら、毛様体ビデオ顕微鏡プロトコルをCOVID-19パンデミックに適応させる必要がありました。毛様体ビデオ顕微鏡の技術は、CFAが広範なトレーニングと経験を必要とするため、現在、研究サービスと専門の診断センターに限定されています。さらに、現在、DHSV 4,13を使用してサンプルを処理および分析するための標準化と正確な操作手順が不足しています。
この論文の目的は、DHSVの標準的な操作手順、特に生体鼻上皮をサンプリングおよび処理する際の感染対策と安全性を参照して説明することです。これにより、現在のCOVID-19の発生にもかかわらず、高品質のPCD診断とケアを継続することができます。
プロトコル
承認は、リエージュの病院と教員の倫理委員会と職場の衛生と健康保護のための大学部門から得られました。
1.呼吸繊毛上皮のサンプリング
- サンプリングする前に、被験者が少なくとも4〜6週間感染がなく、鼻薬や吸入薬がないことを確認してください。
- 補充されたM199製剤を調製する:細胞培養培地199(M199)(500 mL)に抗生物質溶液(5 mLのストレプトマイシン/ペニシリン(50 μg/mL))および抗真菌溶液(5 mLのアムホテリシンB(2.5μg/mL))を補充します。
- 蓋付きの2本(各鼻孔に1本ずつ)の15 mLコニカルチューブを準備し、それぞれに3 mLの補充M199を入れます。
- 気管支細胞診ブラシ(厚さ:2 mm、長さ:11 mm)を準備します。ワイヤーの端を切断して、ブラシの長さが約15 cmになるようにします(図1A、B)。鼻ブラッシングを行うときにブラシを保持するには、ワイルブレイクスリー鼻鉗子を使用します(図1B)。
- 新型コロナウイルス感染症(COVID-19)への適応:COVID-19の状態が不明な生きた鼻上皮サンプルの処理を避け、毛様体ビデオ顕微鏡検査のための鼻ブラッシングの48〜72時間前にCOVID-19について患者をテストします。このCOVID-19テストは、鼻咽頭スワブサンプル24,25からのポリメラーゼ連鎖反応で構成されています。現時点ではCOVID-19の患者の状態は不明であるため、FFP2マスク、手袋、フェイスシールドまたはゴーグル、長袖の耐水性ガウンなど、医師とスタッフは適切に保護する必要があります23,26。PCR検査が利用できない、不可能または疑わしい場合は、L2バイオセーフティラボで鼻ブラッシングのすべての処理を行いました。COVID-19が陽性の場合は、PCD診断検査を延期し、患者を管理するための代替アプローチを検討してください。
注意:COVID-19検査のためのこの鼻咽頭スワブサンプリングは、鼻呼吸器毛様体上皮に損傷を与えることにより、二次性毛様体ジスキネジアを誘発する可能性があります27,28。これを回避するには、鼻甲介や中隔を傷つけないように、硬い内視鏡制御下で鼻咽頭までの鼻腔に薄い綿棒を導入します。次に、サンプルを鼻咽頭から採取し、硬質内視鏡の制御下で綿棒を取り外します。適切な機器があれば、0°の硬質内視鏡検査は、外傷のない成人と子供に簡単に実行できます。
2. 呼吸繊毛上皮標本の採取
COVID-19の適応:患者のCOVID-19の状態が陰性であっても、偽陰性率のために、患者は手術中に口にサージカルマスクを着用するよう求められ、手袋、FFP2マスク、フェイスシールドが医師によって着用されます。
- 鼻ブラッシングの準備
- 患者に鼻をかむように依頼します。
- 鼻内視鏡検査または盲検下で鼻ブラッシングを行います。鼻内視鏡検査を使用する場合は、鼻ブラッシングの前に2つの鼻孔を調べます(COVID-19鼻腔スワブに対して以前に48〜72を行った場合は繰り返さないでください)。検査により、粘膜の状態(鼻ブラッシングを行うと炎症が激しいと出血を引き起こす可能性があるなど)、下鼻甲介の状態(毛細血管拡張症の存在を除外するなど)、中隔鼻腔がまっすぐであるかどうかを確認できます(図1C)。
- 患者に横になるか、快適に座るように依頼し、頭を椅子に後ろ向きに置きます(鼻ブラッシングによって反射が頭を後ろに動かすため)。2人目の介護者は、特に子供では、鼻磨き中に頭を保持します。
- 鼻ブラッシングの前に、付属のM199でブラシを振ってください(ブラシを湿らせると、ブラッシングによる刺激が軽減されます)。
注意: ブラシは、付属のM199内で湿っている可能性があります。患者が抗生物質にアレルギーがある場合(ペニシリンとストレプトマイシンが補充された細胞培養培地に含まれています)、生理食塩水でブラシを湿らせます。
- 鼻ブラッシング
- 局所麻酔または全身麻酔なしで鼻ブラッシングをそっと挿入します13。鼻腔内視鏡を使用する場合は、内視鏡を鼻の入り口に置いて下鼻甲介を視覚化してから、細胞診ブラシを鼻に挿入します。「盲検」の鼻ブラッシングを行う場合は、鼻底に続いてブラシを鼻に挿入します(図1D)。
注:一部の診断センターでは、ナファゾリンのタンポンを使用した局所麻酔を使用して鼻ブラッシングを行います。 - 下鼻甲介の後部上でブラシを前後に数回動かしてから引き抜きます。オペレーターは、ブラシが上皮をこすっていると感じるべきであり、患者はブラッシングの側面に片側の涙目を感じるかもしれません。
注:鼻ブラッシングが前方に行われすぎると、前鼻腔が移行期の非繊毛上皮で裏打ちされているため、繊毛細胞は得られません。 - サンプリング後、すぐに鼻ブラッシング標本を培養液に入れます。得られた呼吸上皮ストリップは、補充されたM199を含むチューブ内のブラシを攪拌することによって除去され、次いでチューブを閉じる(図1E)。
- 新型コロナウイルス感染症(COVID-19)への適応: サンプリング直後に、補充されたM199のブラシを攪拌して上皮ストリップを取り外さないでください。ブラシをチューブに入れ、チューブ内に完全に収まるようにワイヤーを切断し、すぐにチューブを閉じます。サンプルを気密ダブルバッグに入れます。
- 局所麻酔または全身麻酔なしで鼻ブラッシングをそっと挿入します13。鼻腔内視鏡を使用する場合は、内視鏡を鼻の入り口に置いて下鼻甲介を視覚化してから、細胞診ブラシを鼻に挿入します。「盲検」の鼻ブラッシングを行う場合は、鼻底に続いてブラシを鼻に挿入します(図1D)。
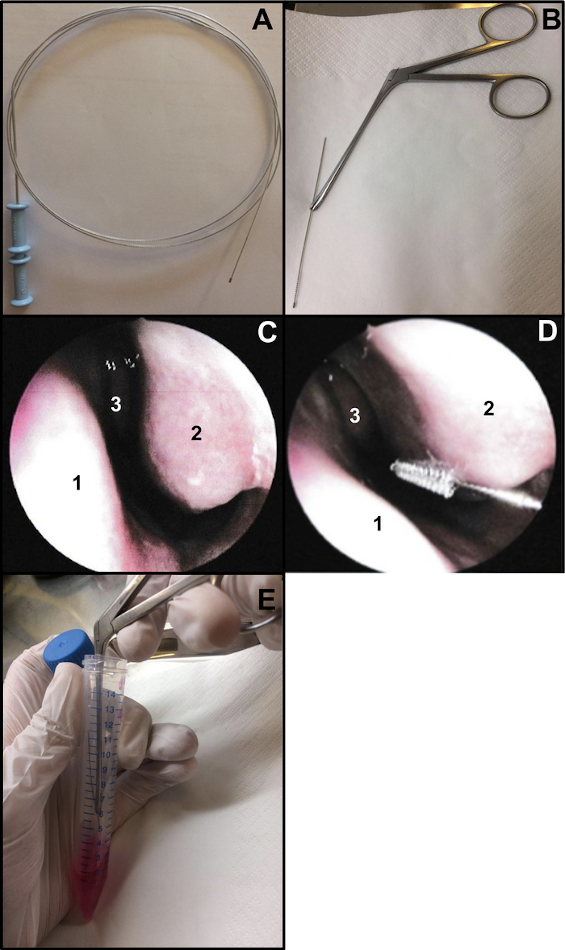
図1:鼻ブラッシング技術。 (A)気管支細胞診ブラシ全体(B)レディトゥブラシ:ワイヤーのブラッシング端を切断し(長さ約15 cm)、ワイルブレイクスリー鼻鉗子で保持します(C)鼻腔の内視鏡図:中隔(1)下鼻甲介(2)および中鼻甲介(3)(D)鼻ブラッシングは下鼻甲介(2)の後部で行われます。鼻中隔(1)中鼻甲介(3)。(E)呼吸器上皮ストリップは、補充されたM199細胞培養培地でブラシを振ることによって除去されます。 この図の拡大版を表示するには、ここをクリックしてください。
3. 呼吸繊毛上皮加工
- CBFとCBPの両方がこの時間枠内で安定しているため、サンプリング後9時間以内に顕微鏡で鼻ブラッシングサンプルを分析します(未発表データ)。
- 正立顕微鏡または倒立光学顕微鏡を使用し、x100油浸位相差レンズまたは干渉コントラストレンズを使用します。理想的には、繊毛の鼓動は外部振動(実験台など)によるアーティファクトの影響を受けるため、顕微鏡を防振テーブルに置きます13。
新型コロナウイルス感染症(COVID-19)への適応: オペレーターは、FFP2マスク、手袋、長袖の耐水性ガウンなどの個人用保護具を使用して鼻の処理を行います。
- 可視化チャンバーを準備します。
- 繊毛上皮ストリップをラボ製のオープン可視化チャンバーに吊り下げ、顕微鏡で分析しながら繊毛を自由に鼓動できるようにします。このチャンバーは、カバースリップ(22 mm x 40 mm)とスライドガラスを2つの隣接する正方形のカバースリップ(20 mm x 20 mm)で分離し、15 mmの距離で分離し、スライドガラス12 に接着することによって作成されます(図2、 図4A)。
新型コロナウイルス感染症(COVID-19)への適応: 上述のラボビルドチャンバは開放されており、試料と環境13との間のガスおよび湿度交換を可能にする。COVID-19パンデミックのコンテキストでは、深さ0.25 mmの両面スタックスペーサーを使用して、閉じた視覚化チャンバーを使用できます(図3、 図4B)。スペーサーをスライドガラスに貼り付けてから、カバースリップ(22 mm x 40 mm)をスペーサーの上に貼り付けます。

図2:ラボで構築されたオープンチャンバーの取り付け。 (A)2つの正方形のカバースリップ(20 mm x 20 mm)をスライドガラスの上に置きます。(B)正方形のカバースリップを約15mmの距離で分離し、スライドガラスに接着します。(C)チャンバーは、隣接する2つの正方形のカバースリップの間に、補充されたM199の繊毛上皮の小さなサンプル(約60μL)で満たされます。(D)隣接する2つの正方形のカバースリップに長い長方形のカバースリップ(22 mm x 40 mm)を置き、チャンバーを覆います。 この図の拡大版を表示するには、ここをクリックしてください。

図3:両面貼付スペーサーを使用した密閉チャンバーの取り付け。 (A)スライドガラスと両面貼りスペーサー。(B)スペーサーの片側で保護が取り外され、スペーサーがスライドガラスに貼り付けられます。(C)両面スタックスペーサーの反対側から保護を取り除き、次にスペーサーに少量のサンプル(約60μL)を補充したM199の繊毛上皮で満たします。(D)長い長方形のカバーガラス(22 mm x 40 mm)がスペーサーに貼り付けられ、チャンバーを閉じます。 この図の拡大版を表示するには、ここをクリックしてください。
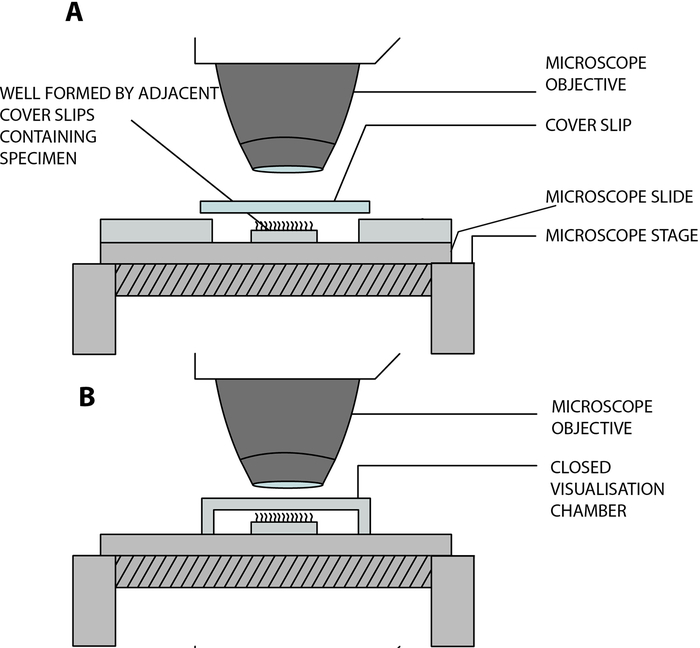
図4:デジタル高速ビデオ顕微鏡(DHSV)を使用した毛様体ビデオ顕微鏡検査を実行するために使用される主な視覚化チャンバーを示す概略図。 (A)オープンハンギングドロップ法:繊毛サンプルを、カバーガラスとスライドガラスを2つの隣接するカバーガラスで分離することによって作成されたオープンチャンバー内の細胞培養培地のドロップに懸濁します。(B)クローズドハンギングドロップ法:繊毛サンプルを、ガラス側とカバースリップの間に挟まれたスペーサーによって作成された密閉チャンバー内の細胞培養培地のドロップに懸濁します。スペーサーはスライドガラスとカバースリップの両方にしっかりと固定されています。ケンペニアスら13から複製および変更。この図の拡大版を表示するには、ここをクリックしてください。
- 温度制御
- 顕微鏡をプチプチで囲みます(図5A、B)。
- ベルクロストラップを使用してレンズヒーターを対物レンズの周りに取り付けます(図5C)。
- 制御温度チェックを行う1時間前にレンズヒーターコントローラーの電源を入れてください。
- 顕微鏡の電源を入れ、サンプルを通る光の量によってスライドの温度が変化する可能性があるため、顕微鏡のセットアップが完了していることを確認します。
- 加熱ボックスコントローラの電源を入れます(図5D)。
- 開始する前に、リファレンスプローブが正しく機能していることを確認してください。参照プローブの先端を指で挟みます。体温を測定する必要があります。
- スライドの中央、接着された2つの隣接する正方形のカバースリップ(20 mm x 20 mm)の間に空きメディアを置きます。
- リファレンスプローブチップを付属のM199に配置します。長方形のカバーガラス(22 mm x 40 mm)で覆います。プローブが媒体で完全に囲まれていることを確認してください(そうしないと温度が下がる可能性があります)。
- 新型コロナウイルス感染症(COVID-19)への適応: スペーサーを使用して密閉チャンバー内の温度制御を実行するには、スペーサーの片側を切り取ります(この穴は基準プローブと同じサイズである必要があります)。スペーサーをスライドガラスに貼り付け、スペーサーの中央に空きメディアを置きます。参照プローブの先端をスペーサーの穴を通して溶液に入れ、スペーサーに長方形のカバーガラス(22 mm x 40 mm)を貼り付けます。
- スライドを加熱ボックスのプレートに置きます。ふたで加熱ボックスを閉じます。
- 油浸対物レンズに油を追加します。
- 加熱ボックスを顕微鏡ステージに置きます。
- プレートと蓋の温度を調整し(結露を避けるために蓋の温度をプレートの温度より2°C高くする必要があります)、培地内の参照プローブで37°Cを測定します。
- 5分間待ちます(サンプルの温度を37°Cに上げるのに必要な時間)。
- 対物レンズを調整し、レンズの先端でカバーガラスに触れるまでスライドに近づけます。
- 顕微鏡でプローブの中央を見るために対物レンズを動かします。
注意: プローブがコンピューターの画面に表示されていることを確認してください(繊毛サンプルを見る前にカメラシステムが機能することを確認するため)。プローブの中央を見ると、画面は完全に真っ暗です。 - レンズヒーターの温度を調整します(油浸レンズがカバーガラスに接触したときの温度損失を補うため)。対物レンズがカバースリップに触れた場合は、必ず媒体内の参照プローブで37°Cを測定してください。
注意: 理想的には、これらの温度設定が変化しないように、温度が制御された部屋で作業してください。部屋の温度が管理されていない場合は、毛様体ビデオ顕微鏡検査を行う前に、この温度制御チェックを毎日実行する必要があります。 - 温度を確認した後、加熱ボックスからスライドを取り外します。
- スライドと参照プローブの先端をアルコールで洗浄し、片付けます。
- イソプロパノールでレンズを洗浄し、円運動で組織を洗浄します。

図5:DHSV実験室で使用される機器。 (A)100倍油浸位相差レンズを搭載した顕微鏡は、外部振動による毛様体機能解析のアーチファクトを避けるために防振台に置かれます(B)顕微鏡は、周囲空気からの熱損失を防ぐためにプチプチで囲まれています。(C)油浸対物レンズは熱損失を引き起こします。これは、レンズヒーター(矢印)を使用して防止できます。(d)試料を加熱ボックスを用いて加熱する。 この図の拡大版を表示するには、ここをクリックしてください。
4.呼吸器繊毛上皮サンプルの調製
- 繊毛がチューブ全体に広がるようにチューブを軽く振ってください(繊毛が他の繊毛細工のストリップ、粘液、または破片に付着して、自由に鼓動するのを防ぐため)。
注:このステップは、繊毛上皮の「最適なエッジ」を得るために不可欠です(図12)。 - 補充したM199中の繊毛上皮約50 μLをチューブの中央にピペットで抜き取ります。
- サンプルをラボ製のチャンバー(隣接する2つの正方形のカバースリップ(20 mm x 20 mm)の間)に置き、長方形のカバーガラス(22 mm x 40 mm)で覆います。泡を加えないように注意してください。
- 新型コロナウイルス感染症(COVID-19)への適応: 微生物学的安全キャビネットで手順4.1〜4.3を実行します。微生物学的安全キャビネット内の手順。
- サンプルを準備する10分前に微生物学的安全キャビネットの電源を入れます(環境が無菌であることを確認するため)。
- 取り扱う前に、微生物学的安全キャビネット全体を70%エタノールで消毒してください。
- 微生物学的安全キャビネットに入れる前に、必要なすべての材料を70%エタノールで消毒してください。
- 微生物学的安全キャビネットの下でサンプルを含む15 mLのコニカルチューブを一度だけ開き、補充されたM199でブラシ(Weil-Blakesley鼻鉗子を使用)を攪拌して上皮ストリップを取り除きます。
- スペーサーをスライドガラスに貼り付け、両面スタックスペーサーから保護を取り外します。
- チューブを軽く振って、繊毛がチューブ全体に広がるようにします。
- 補充したM199中の繊毛上皮の少量のサンプルをチューブの中央からピペット(約60 μL)で取り出し、スペーサーを満たします。
- 長方形のカバーガラス(22 mm x 40 mm)をスペーサーに貼り付けて、チャンバーを閉じます。
- 微生物学的安全キャビネットから出る前にスライドを消毒してください。
- 微生物学的安全キャビネットからスライドを取り外します。
- 微生物学的安全キャビネットを出るときは手袋を交換してください。
- 使用後は微生物学的安全キャビネットの電源を切る前に10分間待ちます(ドアを閉める前に微生物学的安全キャビネットの環境が無菌であることを確認するため)。
- スライドを加熱ボックスのプレートに置きます。ふたで加熱ボックスを閉じます。
- 油浸対物レンズに油を追加します。
- 加熱ボックスを顕微鏡のステージに置きます。
- 加熱ボックスとレンズヒーターの電源を入れます。
注意: レンズヒーターは、使用の1時間前にオンにする必要があります。 - 加熱ボックスとレンズヒーターコントローラーの温度設定を、手順3.4で取得した値に従って調整します。
- 5分間待ちます(加熱ボックスと対物ヒーターの両方に所定の設定を使用する場合、サンプルの温度を37°Cまで上昇させるのに必要な時間)。
- レンズの先端でカバーガラスに触れるまで、対物レンズをスライドに近づけます。
5. 呼吸繊毛エッジの可視化
- 高速度ビデオカメラを顕微鏡に固定し、カメラをコンピューターに接続し、カメラの電源を入れます。
- コンピュータの電源を入れます。
- ソフトウェアを介してデジタル高速ビデオ顕微鏡カメラをコンピューターに接続します(接眼レンズを通して見た画像がモニターに投影されるように)。
- ソフトウェアを開くと、 メインメニュー が自動的に開きます(図6A)。
注:ソフトウェアは、画像の取得と処理のために実験室で使用されるプログラムです。このシステムでは、ビデオシーケンスを記録し、低いフレームレートまたはフレームごとに再生できます。無料でダウンロードできます。 - カメラを開きます(図6A)。
- カメラ列挙フィルターが表示されたら、[OK]を選択します(図6B)。
- [リストの更新] を選択します。カメラの名前を選択します。インターフェイス:エキスパートを選択し、[開く]を選択します(図6C)。
- ドッキングされたダイアログメニューの上部にあるカメラのコントロールラインで、[ ライブ ]を選択します(図6D)。
- [ 再生 ] を選択してイメージを表示し、[ 停止 ] を選択して表示を終了します (図 6D)。
- ソフトウェアを開くと、 メインメニュー が自動的に開きます(図6A)。

図6:ソフトウェアの使用の説明:呼吸繊毛エッジのモニターへの視覚化。 (A)ソフトウェアを開くと 、メインメニュー が直接表示されます。(b) カメラ列挙フィルターを閉じます。(C)カメラを選択し、 インターフェース:エキスパートを選択します。(D)ライブモードでは、顕微鏡を通して見た画像をモニター上で視覚化することができます。 この図の拡大版を表示するには、ここをクリックしてください。
- カメラ取得設定(右上隅)を調整します(図7)。
- [ 取得設定 ]で [カメラ]を選択し、フレームレートを調整します: レート(Hz):500( 以下を参照)(図7A)。
- [ 取得設定 ]で [カメラ]を選択し、関心領域(ROI)を調整します(図7A)。
注:ROIは、x100油浸対物レンズで表示し、モニターに投影して、50μmに対応するピクセル数を定義するために、目盛り付きスケールを使用して計算されます(約50μmの繊毛エッジを記録するため(以下を参照))。 - [取り込み設定]で[録画]を選択し、ビデオの長さと記録された合計フレーム数を調整します(選択したフレームレートが1000OO Hzの場合、5秒の長さで5フレームに相当します)(図7B)。
注:私たちの経験では、CBFとCBPの両方を完全に分析するには、最低2秒のビデオの長さが必要です。 - [ ファイル ]、[ カメラCfgの保存 ]の順に選択して、新しい取得設定を保存します(名前を入力し、必要に応じてこの新しい構成のコメントを入力します)(図7C、D)。
- この新しいカメラ構成を開くには、 ファイル を開いて カメラCfgをロード します(図7C)。
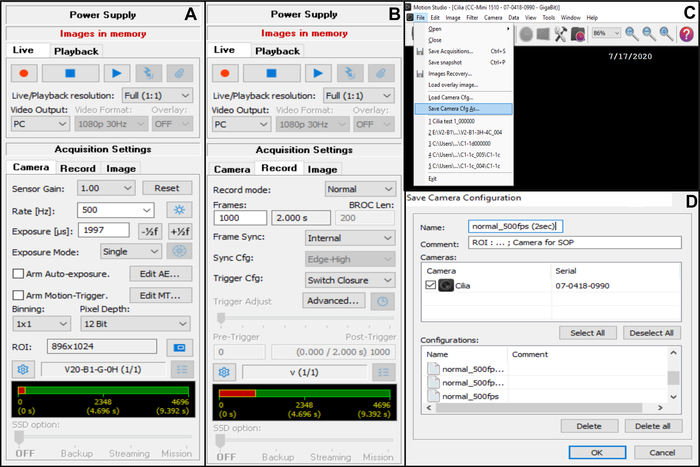
図7:ソフトウェアの使用の説明:鼓動繊毛エッジのビデオ録画のためのカメラ取得設定の調整。 (A)取得設定のカメラで、ビデオ録画 の関心領域(ROI)とフレームレート(レート)を調整します。(B)取得設定 の[録画]で、ビデオ録画の長さを調整します(以前に選択したフレームレートに応じて、選択した録画時間に必要なフレーム数)。(C) この新しいカメラ設定設定は、 カメラの保存Cfg 機能を使用して保存できます。 Load Camera Cfg を使用すると、保存した構成設定を再開して、さらに使用することができます。(D)新しいカメラ構成設定に名前を付けることができ、必要に応じてコメントを追加できます。 この図の拡大版を表示するには、ここをクリックしてください。
- 眼レンズを通して見て、サンプル内の細胞や破片を検索し、焦点を合わせます。
- モニターに画像が見えることを確認し、コンデンサー(干渉コントラストレンズを使用している場合はDICプリズム)を調整して画像の品質を向上させ、必要に応じてフォーカスを調整します。
- 繊毛上皮のストリップを検索します。
6.呼吸繊毛エッジの選択
注:実験システムでは、鼓動繊毛を3つの異なる平面で見ることができます:横向きのプロファイル、観察者に向かって直接鼓動する、および真上から(図8)。
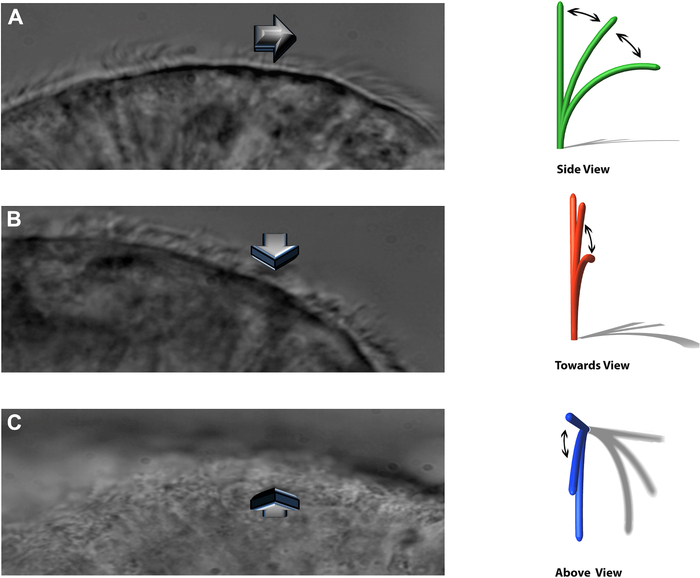
図8:DHSV技術により、鼓動繊毛を3つの異なる平面で見ることができます。 (A)横向きのプロファイル。(B)観察者に向かって直接叩き、(C)真上から打つ。ケンペニアスら16から複製。 この図の拡大版を表示するには、ここをクリックしてください。
- 長さが少なくとも50 μmの無傷の破壊されていない繊毛上皮エッジのみを記録します。
- 横方向のプロファイルで作成された記録については、Thomas et al.29 スコアリングシステムに従ってエッジの品質を決定します(図9)。毛様体機能解析には、通常のエッジ(図9A)または小さな突起のあるエッジ(図9B)のみを使用します。単離された細胞を除外する(図9E)。

図9:繊毛上皮縁の異なる品質に関するThomas et al29によるスコアリングシステムの代表的な画像。(A)正常エッジ:長さ50μm>無傷の均一な繊毛上皮ストリップとして定義されます(B)小さな突起を持つ繊毛エッジ:長さ>50μmのエッジとして定義され、細胞は上皮エッジラインから突き出ていますが、隣接する細胞の繊毛の先端の上に突き出ている頂端細胞膜のポイントはありません(C)主要な突起を有する繊毛縁:長さ>50μmの縁として定義され、細胞は上皮縁線から突き出ており、頂端細胞膜の少なくとも1つの点は隣接する細胞の繊毛の先端の上に突き出ている(D) 単離された繊毛細胞:長さ>50μmの上皮縁にある唯一の繊毛細胞として定義される(E)単一細胞:それ自体または他の細胞型との間に接触を持たない繊毛細胞として定義されます。スケールバー:5.5μm。Thomas et al.29から複製 この図の拡大版を表示するには、ここをクリックしてください。
- 粘液や破片のない繊毛のみを使用してCFAを実行し、記録されたエッジ用に選択したプロファイルを叩きます。エッジに沿って最低2つのCBFおよびCBP評価(以下を参照)が可能な繊毛エッジのみを選択します。
- CFAには、横方向のプロファイルで最低6つのエッジが打ち負かされ、上記の基準を満たすサンプルのみに使用します。横方向プロファイルで最大 20 個のエッジを解析します。
- CBPを特徴付けるために、観察者プロファイルの上から鼓動する繊毛の少なくとも1つの追加エッジを使用します。
7.繊毛エッジの記録
- 毎秒500フレームのカメラフレームレートを使用して鼓動繊毛エッジを記録し、高解像度モニターに投影します。CBF と CBP13 の両方の分析を可能にするには、400 Hz の最小フレームレートが必要です。1 つのエッジを毎秒 30 フレームのフレームレートで記録し、粒子クリアランスの効率を評価します。
- ドッキングされたダイアログメニューの上部にあるカメラのコントロールラインで[ ライブ]を選択します(図6D)
- [ 再生 ]を選択して画像を表示し、[ 停止 ]を選択して表示を終了します(図6D)。
- エッジを記録するには、 記録 を押します(図6D)。保存する前に録画を表示するには、ドッキングされたダイアログメニューの上部にあるカメラのコントロールラインに移動し、[ 再生]を選択します。録画されたビデオを表示するには [再生 ]を選択し、表示を終了するには [停止 ]を選択します(図10A)。
注意: 保存する前に、記録されたエッジの表示を停止してください。
図10:ソフトウェアの使用の説明。 (A)再生モード。繊毛エッジを打つ記録されたビデオシーケンスを確認するには、 再生モードを選択します。[ 再生 ] を選択してイメージを表示し、[ 停止 ] を選択して表示を終了します。名声率は、毛様体機能の分析を改善するために調整することができます(B、C)繊毛エッジを打つビデオ録画を保存する(B)ビデオを保存するには、[ ファイル ]、[ 取得の保存]の順に選択します。(C)録画したビデオの名前を入力し、ビデオを録画する定置を選択します。録音が .RAWファイル(D)分析する繊毛エッジのビートの記録の選択:ビデオ録画を開くには、[ ファイル]、[ 開く]、[ 画像]の順に選択します。 この図の拡大版を表示するには、ここをクリックしてください。
- ビデオをデータベースに保存します(図10B、C)。
- 左上隅の [ファイル ]を開き、 取得したものを保存します (図10B)。
- [ 取得の保存] に、録画したビデオの名前を入力し、録画が RAW ファイル形式で保存されていることを確認します (図 10C)。
- ビデオが保存されたら、ライブモードに戻ります(ドッキングされたダイアログメニューの上部にあるカメラのコントロールラインに戻り、[ ライブ]を選択します)(図6D)。
- この手順を繰り返して、CFA に必要な選択基準を満たすエッジの数を記録します。
注:スライドの準備後最大20分以内に、1つのスライドから選択基準を満たす複数の鼓動繊毛エッジを記録することができます(乾燥を避けるため)。20分後、選択基準を満たす十分なエッジが得られない場合は、新しいスライドを用意する。 - 加熱ボックスからスライドを取り外します。
- 長方形のカバーガラスを取り外し、特定の危険な医療廃棄物容器に入れます。
- スライド(2つの正方形のカバースリップを接着した状態)を70%エタノールと吸収紙で清掃します。スライドがきれいになったら、再び使用できます。
- 新型コロナウイルス感染症(COVID-19)への適応: カバーガラスとスペーサー付きのスライドを気密バッグに入れ、手袋とマスクを外して気密バッグに入れます。気密バッグを特定の危険な医療廃棄物容器に入れます。
8.毛様体機能解析
- 手動CBFおよびCBP評価を実行するための予備準備
- ソフトウェアを開きます。
- 左上隅にある[ファイル]を開き、[開く]、[画像]の順に開きます(図10D)。
- 分析するビデオを選択します。
- ドッキングされたダイアログメニューの上部にあるカメラのコントロールラインに移動し、[ 再生] を選択します(図10A)。録画したビデオを表示するには [再生 ] を選択し、表示を終了するには [停止 ] を選択します。
- 手動毛様体拍動周波数(CBF)分析
- 横方向のエッジのみを使用してCBFの評価を実行します。
- 繊毛のエッジを約5つの隣接する領域に分割し、それぞれが約10μmを測定します(図11)。
- 繊毛または繊毛のグループを低いフレームレートで識別して視覚化し、各領域で最大2回のCBF測定が行われ、各エッジに沿って最大10回のCBF測定が行われます(図11)。
- 繊毛のグループが5ビートサイクルを完了するのに必要なフレーム数を記録します。
- 簡単な計算でCBFに変換します:(CBF =記録フレームレート(Hz)/(5ビートのフレーム数)x 5)13,16,30。不動繊毛は、0Hz13のCBFを有すると報告されている。
メモ: 録画したビデオを再生するときは、フレームレートを調整します(図10A)。これは、繊毛が拍動を非常にゆっくりと分析する場合に特に役立ちます。フレームレートを上げると、繊毛の鼓動が非常に遅いか、動かないかを定義するのに役立ちます。 - 各サンプルについて、静的繊毛を含む横方向プロファイルに記録されたすべてのCBFの平均(SD)または(95%CI)として平均CBFを計算します。
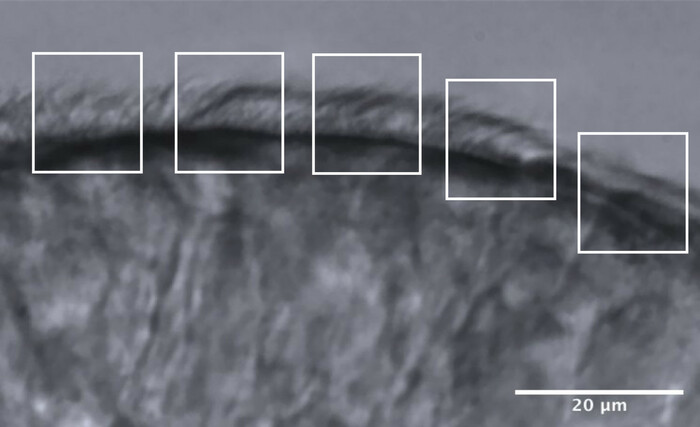
図11:最適な品質エッジの代表画像と、CFA分析を可能にするための5つの領域への分割。 最適な品質の繊毛上皮縁は、それぞれ10μmの5つの隣接する領域に断片化されています。各領域で最大2回のCBF測定(および2回のCBP評価)が行われ、各エッジに沿って最大10回のCBF測定(およびCBP評価)が行われます。スケールバー= 20μm。 この図の拡大版を表示するには、ここをクリックしてください。
- 手動毛様体拍動パターン(CBP)分析
- ジスキネジアのマーカーを評価するには、横方向プロファイルのみを使用します。CBP13のタイプを特徴付けるために、観察者に向かって上から平面を使用します。CBP評価にはさまざまな方法とスコアが存在します。以下は、ジスキネジアのマーカーの定義と共に実験室で使用される方法を説明する。
- サンプル内の各CBPの割合
- CBF測定に同定され使用された繊毛または繊毛のグループごとに(図11)、縮小フレームレートでCBP分析を実行します:フルビートサイクル中に繊毛がたどった正確な経路を、DHSV分析で観察された正常なCBPと比較します12,30。
- 分析された各繊毛または繊毛群に異なるCBP(正常、不動、硬直、円形、非同期(調整されていない毛様体拍動)または運動障害13)を帰属させる。
- サンプルごとに、サンプル内の個別のCBPの割合を計算します。サンプルに起因するCBPは、観察された優勢なCBPです。
- ジスキネジアの3つのマーカーを計算します。
- 不動指数(IMI):サンプル内の不動繊毛の割合(CBFの数= 0 /サンプル内のCBF測定値の総数X100)を計算します。IMIを平均値(SD)または(95%CI)1,16,31で表します。
- ジスキネジアスコア(DKS)を計算します。繊毛の各縁を象限に分割し、運動障害(または異常に拍動する)繊毛を持つ象限の数を決定します。これにより、0〜4のDKSを計算できます(0:エッジ全体の正常なCBP、1:繊毛の≤25%の異常なCBP、2:繊毛の≤50%の異常なCBP、3:繊毛の≤75%の異常な拍動パターン、および4:すべての繊毛の異常なCBP)。サンプル16,29について、中央値DKS(四分位範囲)が計算されます。
- 正常な拍動の割合を計算する:サンプル内の正常なCBPを持つ繊毛の割合として定義されます(正常なCBP測定値の数/サンプルのCBP測定値の総数x100)。
結果
この技術の効率を説明するために、16人の健康な成人ボランティア(男性5人、年齢層22〜54歳)のシリーズでCFAの結果を紹介します。
合計16人のボランティアのうち14人(男性4人、年齢範囲24〜54歳)の鼻ブラッシングサンプルは、CFAを実行するために必要な選択基準を満たすのに十分な適切な上皮エッジを提供しました。これらの14の鼻ブラッシングサンプルから、合計242の繊?...
ディスカッション
この論文は、鼻ブラッシングサンプルを使用したCFAの標準的な操作手順を提供することを目的としており、COVID-19パンデミック時の適切な感染管理の考慮事項に合わせて調整が行われます。PCD診断は困難であり、現在、鼻一酸化窒素測定、DHSVを使用したCFA、透過型電子顕微鏡(TEM)を使用した毛様体超微細構造分析、免疫蛍光を使用した毛様体タンパク質の標識、PCD原因遺伝子の遺伝子検査な?...
開示事項
これらの著者は開示するものは何もありません。
謝辞
ジャン・フランソワ・パポン、ブルーノ・ルイ、エステル・エスクディエ、そしてパリ東のPCD診断センターのすべてのチームメンバーが、PCD診断センターへの訪問中に彼らの可用性と心からの歓迎、および多数の交換に感謝します。また、ロバート・ハーストとレスターのPCDセンターのすべてのチームメンバーの歓迎と時間、アドバイス、専門知識に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
参考文献
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved