Method Article
NMRベースのフラグメントスクリーニングは、最小サンプルで最大限の自動化モードで
要約
NMRによるフラグメントベースのスクリーニングは、生体高分子(DNA、RNA、またはタンパク質)に対する低分子バインダーを迅速に同定するための堅牢な方法です。自動化ベースのサンプル調製、NMR実験と取得条件、および分析ワークフローを説明するプロトコルが提示されています。この技術により、 1H と 19F の両方の NMR 活性核を検出に最適に利用することができます。
要約
フラグメントベーススクリーニング(FBS)は、学術界と産業界の両方で創薬プロセスにおいて十分に検証され、受け入れられている概念です。NMRベースのフラグメントスクリーニングの最大の利点は、7〜8桁以上の親和性を持つバインダーを検出できるだけでなく、フラグメントの純度と化学的品質をモニタリングできるため、高品質のヒットと偽陽性または偽陰性を最小限に抑えることができます。FBSの前提条件は、フラグメントライブラリの初期および定期的な品質管理を実行し、関連するバッファー中のフラグメントの溶解度と化学的完全性を決定し、さまざまな高分子ターゲットクラス(タンパク質/RNA/DNA)に対応するために多様な足場をカバーする複数のライブラリを確立することです。さらに、サンプル量、生物学的構築物/フラグメント空間、条件空間(バッファー、添加剤、イオン、pH、温度)、およびリガンド空間(リガンド類似体、リガンド濃度)レベルでの取得と分析の速度に関する広範なNMRベースのスクリーニングプロトコルの最適化が必要です。少なくとも学界では、これらのスクリーニングの取り組みはこれまで非常に限られた方法で手作業で行われており、医薬品開発プロセスだけでなく、化学プローブ開発のコンテキストでもスクリーニングインフラストラクチャの利用可能性が限られています。経済的に要件を満たすために、高度なワークフローが提示されます。最新の高度なハードウェアを採用しており、温度制御された方法で液体サンプルの収集をNMRチューブに自動で充填することができます。 1次に、H/19F NMRリガンドベースのスペクトルを所定の温度で収集します。ハイスループットサンプルチェンジャー(HTサンプルチェンジャー)は、温度制御されたブロックで500を超えるサンプルを処理できます。これと高度なソフトウェアツールを組み合わせることで、データの取得と分析を高速化します。さらに、タンパク質およびRNAサンプルに対するスクリーニングルーチンの適用について、生体高分子研究における幅広いユーザーベースのための確立されたプロトコルを認識するために説明されています。
概要
フラグメントベースのスクリーニングは、タンパク質、DNA、RNAなどの高分子標的への結合が弱い、かなり単純で低分子量の分子(MW <250 Da)を同定するために一般的に使用されている方法です。一次スクリーニングからの最初のヒットは、ヒットの市販のより大きな類似体の二次スクリーニングを実施し、次に化学ベースのフラグメント成長またはリンク戦略を利用するための基礎として機能します。フラグメントベースの創薬(FBDD)プラットフォームを成功させるには、一般に、弱いヒットの検出と特性評価のための堅牢な生物物理学的方法、フラグメントライブラリ、生体分子ターゲット、およびフォローアップ化学の戦略が必要です。創薬キャンペーンで一般的に適用される4つの生物物理学的手法は、熱シフトアッセイ、表面プラズモン共鳴(SPR)、結晶学、核磁気共鳴分光法(NMR)です。
NMR分光法は、FBDDのさまざまな段階でさまざまな役割を果たしてきました。最適化されたバッファー系に溶解したフラグメントライブラリ中のフラグメントの化学的純度と溶解性を確保することとは別に、リガンド観察NMR実験は低親和性でターゲットへのフラグメント結合を検出でき、ターゲット観察NMR実験はフラグメントの結合エピトープを描写できるため、詳細な構造活性関係研究が可能になります。エピトープマッピングでは、NMRベースの化学シフト変化は、オルソステリック結合部位だけでなく、生体分子ターゲットのいわゆる励起立体配座状態でのみアクセス可能でアクセス可能なアロステリック部位も特定します。生体分子ターゲットがすでに内因性リガンドに結合している場合、同定されたフラグメントヒットは、NMRベースの競合実験を行うことにより、アロステリックまたはオルソステリックに容易に分類できます。リガンド-標的相互作用の解離定数(KD)を決定することは、FBDDプロセスにおける重要な側面です。NMRベースの化学シフト滴定は、観察されたリガンドまたはターゲットのいずれかを容易に実行してKDを決定することができる。NMRの主な利点は、相互作用研究が溶液中で生理学的条件に近い状態で実施されることです。したがって、ターゲットとのリガンド/フラグメント相互作用の分析のためのすべての立体配座状態を調べることができます。さらに、NMRベースのアプローチは、十分に折り畳まれた可溶性タンパク質のスクリーニングに限定されるだけでなく、DNA、RNA、膜結合タンパク質、天然変性タンパク質など、より大きなターゲット空間に対応するためにも適用されています1。
フラグメントライブラリは、FBDDプロセスの不可欠な部分です。一般に、フラグメントは最初の前駆体として作用し、最終的には生物学的標的用に開発された新しい阻害剤の一部(下部構造)になります。いくつかの薬剤(ベネトクラクス2、ベムラフェニブ3、エルダフィチニブ4、ペキシダルトニブ5)は断片として始まり、現在診療所で成功裏に使用されていると報告されています。典型的には、フラグメントは、高い水溶解性および安定性を有する低分子量(<250Da)有機分子である。通常数百のフラグメントを含む慎重に作成されたフラグメントライブラリは、すでに化学空間の効率的な探査を約束することができます。フラグメントライブラリの一般的な構成は時間とともに進化しており、ほとんどの場合、既知の薬物をより小さなフラグメントに分析するか、計算的に設計することによって導き出されました。これらの多様なフラグメントライブラリは、主に扁平な芳香族またはヘテロ原子を含み、Lipinski Rule of 5 6、または現在の商業トレンドRule 3 7に準拠していますが、反応性基は避けています。いくつかのフラグメントライブラリーはまた、高溶解性代謝産物、天然物および/またはそれらの誘導体に由来するかまたは構成されていた8。ほとんどのフラグメントライブラリがもたらす一般的な課題は、下流の化学的性質の容易さです。
ゲーテ大学フランクフルトの生体分子磁気共鳴センター(BMRZ)は、生化学および生物医学研究のすべての分野のすべてのヨーロッパの研究者のための構造研究インフラストラクチャのコンソーシアムであるiNEXT-Discovery(トランスレーショナルリサーチのためのNMR、EM、X線のインフラストラクチャ)のパートナーです。2019年に終了したiNEXTの以前のイニシアチブでは、768のフラグメントで構成されるフラグメントライブラリが作成され、大規模な化学空間をカバーする「最小フラグメントと最大多様性」を目指しました。さらに、iNEXTフラグメントライブラリも、他のフラグメントライブラリとは異なり、複雑で親和性の高いリガンドの下流合成を容易にすることを目的として「ポイズドフラグメント」の概念に基づいて設計されており、今後は社内ライブラリ(ダイヤモンド、構造ゲノムコンソーシアム、iNEXT)として知られています。
NMRによるFBDDの確立には、人的資源、知識、装置が必要です。BMRZでは、NMRによるフラグメントスクリーニングの技術支援をサポートするために最適化されたワークフローが開発されました。これらには、フラグメントライブラリー9の品質管理および溶解性評価、選択された標的に対する緩衝液の最適化、1Hまたは19F−観察された1Dリガンドベースのスクリーニング、オルソステリック結合とアロステリック結合を区別するための競合実験、エピトープマッピングのための2Dベースのターゲット観察NMR実験、および最初のフラグメントヒットの誘導体の二次セットとの相互作用を特徴付けるためのものが含まれる。BMRZは、文献10,11でも前述したように、低分子-タンパク質相互作用の分析のための自動化ルーチンを確立し、NMRベースのフラグメントスクリーニングに必要なすべての自動化インフラストラクチャを備えています。飽和移動差NMR(STD-NMR)、グラジエント分光法(waterLOGSY)で観察された水リガンド、およびCarr-Purcell-Meiboom-Gillベース(CPMGベース)の緩和実験を実装して、幅広いアフィニティーレジーム内のフラグメントを同定し、最先端の自動NMR装置と創薬用のソフトウェアを実装しています。NMRベースのフラグメントスクリーニングはタンパク質に対して十分に確立されていますが、このアプローチはRNAやDNAと相互作用する新しいリガンドを見つけるためにはあまり一般的ではありません。BMRZは、低分子-RNA/DNA相互作用の同定を可能にする新しいプロトコルの概念実証を確立しました。この貢献の次のセクションでは、タンパク質およびRNAサンプルへのスクリーニングルーチンの適用が報告され、生体高分子研究における幅広いユーザーベースのための確立されたプロトコルを認識します。
プロトコル
1. フラグメントライブラリ
- 社内フラグメントライブラリ
注:iNEXTの共同研究活動の1つの枠組みの中で、堅牢で下流の化学に優しい第1世代フラグメントライブラリが開発され12 、その後、エナミンと共同で第2世代のライブラリがまとめられ、DSI(Diamond-SGC-iNEXT)ポーズフラグメントライブラリ(以降、「社内ライブラリ」と呼びます)として知られています。このライブラリは、スクリーニング目的でBMRZで入手できます。- フラグメントライブラリの完全性と溶解性を、以前に報告されたNMRベースのプロトコル9を使用して評価します。
注:社内ライブラリは、非常に高い化学的多様性(>200シングルトン)を持つ768個のフラグメントで構成されています。フラグメント混合物でスクリーニングを実行すると、スクリーニングキャンペーンを大幅にスピードアップできます。ただし、ミックス中のフラグメントの数は、 1H-NMRスペクトルにおけるシグナルのオーバーラップのために制限されます。社内ライブラリが提供するより高い化学的多様性により、 1H観測NMRスペクトルに大きな化学シフトの重複なしに、12種類のフラグメントを含む混合物を調製できます。 - 768個のフラグメントのうち103個のフラグメントはフッ素原子を有する。19 Fスクリーニングの目的で、フッ素基を有する103個のフラグメントすべてを、最小19Fの化学シフトオーバーラップに基づいて5つのミックスに分割します。19Fスクリーニングでシグナルのオーバーラップを最小限に抑えるには、単一化合物測定からの化学シフト情報を使用して、フラグメント数が最大でシグナルのオーバーラップが最小の混合物を設計します。各混合物には20〜21個のフラグメントがあり、19Fの化学シフトが異なるため、フラグメントを明確に割り当てることができます。
- フラグメントライブラリの完全性と溶解性を、以前に報告されたNMRベースのプロトコル9を使用して評価します。
- ユーザー定義/提供のフラグメントライブラリ
- ユーザー定義または提供されたフラグメントライブラリを使用してスクリーニングキャンペーンを実行します。ただし、スクリーニングキャンペーンの前に次の手順を実行する必要があります。
- ユーザーが事前に指定しない場合は、フラグメントのNMRベースの品質管理を実行します(BMRZでは、高度なソフトウェアツールが使用されます。9、第6.1.1章)。
- 使用前に、生体分子ターゲット、構造の完全性、およびフラグメントの濃度について、選択したバッファーへのフラグメントの溶解度を確認してください。
- NMRスペクトルと測定時間の両方でシグナルのオーバーラップが減少するように混合物を設計します。
- ステップ4.2に従って混合物を設計します。
- ライブラリ全体ではなく、単一のフラグメントまたは混合物のサブセットをスクリーニングします。
2. サンプル調製
注:NMRによるハイスループットスクリーニングでは、サンプル調製にピペッティングロボットを使用します。NMRスペクトルだけでなく、タンパク質、RNA、DNAのシグナル取得の数日間にわたる安定性も温度変動に非常に敏感であるため、温度制御された自動システムは、ピペットで移されるサンプルの安定性を大幅に促進します。この目的のために、4〜40°Cで動作する追加のアドオンデバイスがピペッティングロボットに結合され、温度制御された環境でNMRサンプルを液体処理します。
- リガンド混合物の調製
- サンプル調製ロボットを用いてNMR測定用のスクリーニングサンプルを調製します。ロボットの柔軟な構成により、幅広いアプリケーション(NMRチューブから保存容器へのサンプルの回収や一般的な液体処理作業など)が可能になります。異なる直径(1.7、2.0、2.5、3.0、5.0 mm)のNMRチューブを使用できます。サンプルロボットシステムと高度な制御ソフトウェアは、各コンテナタイプに割り当てられたバーコードを読み取り、液体充填プロトコルを最適に実行します。
- 社内ライブラリリガンド混合物の調製には、バーコードバイアルを使用してください。バーコード化されたバイアルは、サンプルの最高レベルの信頼性と最適なトレーサビリティを保証します。
- 768 個の化合物を 96 ウェルフォーマットの 8 枚のプレートに分配します。個々の断片のストック濃度は、d 6-DMSO/D2O(9:1)中で50 mMです。合計で、それぞれ12個のフラグメントを含む64個のミックスを準備します。混合物中の各フラグメントの最終濃度は4.2 mMです。
注:ピペッティングロボットは、さまざまな形状のさまざまな容器タイプ(クライオまたはオートサンプラーバイアル、深さ96ウェルプレートの円形または正方形、バーコード化された標準バイアル、マイクロ遠心チューブ)に対応でき、さまざまなNMRチューブやラックへの液体移送の効率的な実行を支援します。

図1:(A)BMRZに設置されたハイスループットNMR試料調製とNMRチューブ充填ロボット。(B)BMRZ施設の600MHz分光計に設置された個別の温度制御ラックを備えたハイスループットサンプルチェンジャー。 この図の拡大版を表示するには、ここをクリックしてください。
- ブランク(参照リガンドスペクトル)およびターゲット(ターゲット存在下でのリガンド)によるスクリーニングサンプル調製
- NMRスクリーニングサンプルの調製には、標的生体分子(タンパク質/RNA/DNA)およびリガンド混合物の存在下で、標準NMRチューブのブルカーNMRポートフォリオから選択した3 mm NMR HTサンプルチェンジャーチューブを使用します。
- 定義されたスクリーニングバッファー中の生体分子ターゲット( 例:1H スクリーニング:10 μM RNAまたはタンパク質)を手動またはピペッティングロボットを使用して3 mm NMRチューブ(最終容量200 μL)に移します。
- ロボットシステムを使用して次のステップでリガンド混合物の10 μL( 例:1Hスクリーニング)を、制御ソフトウェアの内蔵プロトコルを使用して、ターゲット生体分子と混合物を含むバーコード化された3 mm NMRチューブに移します。
注:NMRチューブのバーコード番号は、取得したNMRデータセットに便利かつ自動的に組み込まれるため、取り違えのないID指向のワークフローが保証されます。ピペッティングロボット温度制御アクセサリを使用すると、NMRチューブ内の調製サンプルを一定の温度に保つことができます。
- 社内で定義した条件とパラメータ
- 社内フラグメントライブラリに対してRNAおよびタンパク質のスクリーニングを行うための最適なバッファー条件を確立します。BMRZでのRNAには、25 mM KPi、50 mM KCl、pH 6.2でコンディショニングされたサンプルが使用されます。Mg2+ は任意である。
- タンパク質は溶液条件に対して非常に敏感です。選択したターゲットに最適なバッファーを使用します。これらのバッファーのそれぞれについて、分析用のブランクとして機能するリガンドの追加参照スペクトルを取得します。
- ユーザー指定の条件
注:社内で確立された条件が潜在的なユーザーからスクリーニングされるターゲットに適していない場合は、次の手順を実行する必要があります。- リガンド観察スクリーニング実験を実施および分析する際にバッファーの成分からの干渉を最小限に抑えるために、バッファーのみの1H-NMRを実行します。干渉成分は、重水素化等価物で適切に置換することができる。
- サンプル生産(目標数量)/条件と入手可能性の制限
注:特定の生体高分子の単離または組換え生産は、場合によっては困難であることが判明し、薬物スクリーニングキャンペーンを成功させるための標的の利用可能性が限られる可能性があります。ターゲットの可用性が限られているか無制限である場合は、NMRベースのフラグメントスクリーニングを成功させるために、以下の代替手段を利用することができます。- 制限がある場合は、 19F-NMRベースのスクリーニングを使用してください。典型的なフッ素化配位子は単一の 19Fシグナルを有する。したがって、信号の重複がない25〜30個のフラグメントを含むカクテルを使用してください。解析する信号が少なく、バッファ成分からの信号干渉がなく、ヒット識別のために依存する信号も少なくなります。
- 無制限の場合は、 1H-NMRなどの大型スクリーンを使用してください。より大きなフラグメントライブラリをスクリーニングできます。通常、フラグメントは複数の陽子で構成されているため、分析に使用できるシグナルが多くなります。
3. NMR取得条件
- 社内で一般的に定義された条件
- HTサンプルチェンジャーを搭載した分光器(自動化)
- ハイスループットスクリーニングには、HTサンプルチェンジャーを使用してのみ測定できる96ウェルプレートを使用してください。HTサンプルチェンジャーは、各ラックを個別に焼き戻す可能性も提供します。
- 最適なS/N比を得るには、ヘリウムまたは窒素冷却された極低温プローブを備えた分光器を使用してください。自動化には、自動チューニングおよびマッチングモジュール(ATM)が必要です。
- パラメータセットとパルスシーケンス
注:多くのNMR実験では、結合イベントを特徴付けることができます。ヒットの識別は、実験のセットアップによって異なります。以下の実験は、BMRZスクリーニングキャンペーンで日常的に使用されています。ただし、ユーザー定義のスクリーニングキャンペーンやユーザー仕様に応じて変更を加えることができます。- TopSpinソフトウェアを使用する場合は、リガンドベースの実験用のパラメーターセット(SCREEN_STD、SCREEN_T1R、SCREEN_T2、SCREEN_WLOGSY)を含めます。パラメータセットには、必要なすべてのパラメータとパルスシーケンスが含まれています:STD:stddiffesgp.3;T1ρ: t1rho_esgp2d;T2: cpmg_esgp2d;と水LOGSY:ephogsygpno.2。
- 列挙されたすべての実験について、励起彫刻13 を水抑制として使用してください。参考までに、1D励起スカルプティング(zgesgp)を使用してください。スキャンの回数は、システムの感度(磁場強度とプローブヘッド)、サンプル濃度、および実験の選択によって異なります。NS=64 の 1D、NS=128 の T1ρ & T2 、NS=256 の STD、NS= 384 または 512 の waterLOGSY が推奨されます。
- 19 Fスクリーニングでは、1DとT2の両方の実験を使用します:1D:19 F{1 H}プローブヘッドにはF19CPD(pp=zgig)、19F/1HプローブヘッドにはF19(pp=zg)。SCREEN_19F_T2 (pp = cpmgigsp) です。
- スペクトル幅は 220 ppm、励起周波数は -140 ppm を使用してください。実験時間は、ハードウェアとサンプル濃度に応じて1〜5時間です(生体高分子の長期安定性を確保します)。T2の場合、CPMG時間は0ミリ秒から200ミリ秒の間で交互に行われるはずです。
- 加工
- STD、T1ρ およびT2 実験を擬似2Dとして記録する。2つの単一の1Dスペクトルを処理するために、IconNMRは、リラックスオプションの有無にかかわらず、auプログラムproc_stdを使用します。最初のオプションは、参照1Dと2つのスペクトルの差を提供します。2番目のオプションは、短い緩和時間と長い緩和時間を持つ2つの別々のスペクトルを生成します。waterLOGSYは単一の1Dであり、溶媒信号に対して負の位相でフェーズする必要があります。
- HTサンプルチェンジャーを搭載した分光器(自動化)
- ユーザー固有の条件
- 前述のパラメータのいずれかをユーザー定義の条件に適合させます。例えば、施設のユーザー提供タンパク質が一般的に使用される温度で安定していない場合、温度、濃度、緩衝条件などを変化させて最適化実験を行うことができます。
4.データ分析
- フラグメントライブラリQC(d6-DMSO/特異的バッファー)および定量
- シーエムシー-q
注:フラグメントライブラリの品質管理は、スクリーニングキャンペーンの開始前に不可欠です。さらに、フラグメントライブラリの長期安定性は、いくつかのスクリーニングキャンペーンの適用のために確保される必要があり、ライブラリの品質を定期的に評価する必要があります。この目的のために、TopSpinの統合ソフトウェアCMC-qとCMC-aが品質と数量の評価に使用されます。CMC-qおよびCMC-aは、トップスピン社のソフトウェアモジュールで、有機低分子から得られる1H-NMRスペクトル9を用いた構造検証を含むスムーズな取得・解析が可能です。- 完全性のために、d6-DMSO中のフラグメント濃度が1 mMの評価サンプルを調製します。ピペッティングロボットを使用して、液体サンプルコレクションを3 mm NMRチューブに充填することにより、自動化された方法でサンプルを調製します。
- 溶解度評価には、pH 7.4の50 mMリン酸ナトリウム緩衝液、150 mM塩化ナトリウム、90%H2O/10%D2O、および1 mMの3-(トリメチルシリル)プロピオン酸-2,2,3,3-D4酸ナトリウム塩(TMSP-Na)中の1 mM化合物からなるサンプルを使用します。
- 三重共鳴5 mm TCI極低温プローブと一度に579サンプルを処理できるHTサンプルチェンジャーを備えた600 MHz NMR分光計を使用して、298 Kまたは293 KのNMRスペクトルを収集します。
- CMC-qソフトウェアのセットアップについては、IconNMRユーザーの作成、FastLaneNMRのアクティブ化、およびHTサンプルチェンジャーの変更を実装するユーザーマニュアルの指示に従ってください。
- 90°パルスを校正し、TopSpinプロソルテーブルに保存します。
- 96サンプルウェルプレートをHTサンプルチェンジャーの5つのラック位置のいずれかに配置します。
- 提案された化学構造、一意の識別子、およびバッチ内の各サンプルのHTサンプルチェンジャー内の位置を含むSDFファイル(構造データファイル)をロードするには、CMC-qセットアップウィンドウの[参照]に移動し、.sdfで終わるファイルを選択してから[開く]をクリックします。
- CMC.qバッチ自動化設定で、測定する実験を定義する検証タイプ、IconNMRユーザーを設定し、溶媒を定義します。
- SDFファイルのパス、分子ID、サンプル位置のSDFファイルを定義します。
- [開始]をクリックして取得を開始します。もう一度[取得の開始]をクリックします。CMC-q セットアップは、[保存] をクリックして保存することもできます。
- CMC-qのセットアップ手順の詳細については、ブルカーのユーザーマニュアルの指示に従ってください。
- シーエムシー-a
- CMC-aについては、トップスピン社内のソフトウェアモジュールを使用して、有機低分子9から得られる1H-NMRスペクトルを用いた構造検証を含む解析が可能です。
- シーエムシー-q
- 混合設計
注:適切な混合設計は、NMRをプラットフォームとして使用するスクリーニングにおいて重要な役割を果たします。混合物あたりのフラグメント数が多いと、スクリーニングが速くなりますが、偽陽性および偽陰性のリスクが高まります。数値を小さくすると、そのリスクは減少しますが、スクリーニングの実施にかかる時間が長くなります。一般に、混合を作成するときは信号のオーバーラップを避ける必要があります。社内ライブラリを使用すると、ライブラリは多様性が高く、高い化学的多様性を維持しながらシグナルの重複がほとんどないように特別に設計されているため、 1Hスクリーニングではこれを無視できます。これは、64ミックスを作成するために特別な設計手順を実行する必要がないことを意味します。- 19Fスクリーニングは、フッ素を含む社内ライブラリのフラグメントに依存しており、ライブラリはこれらの特定のフラグメントのシグナルオーバーラップを減らすために作成されていないため、適切な混合物を設計してください。
- 19Fを含むすべてのフラグメントの単一化合物スペクトルを測定します。
- 各信号の化学シフト情報に注意してください。
- この情報に従って、混合物ごとに20〜21個のフラグメントを選択してください。これにより、シグナルの重複のない20〜21個のフラグメントを含む5つの混合物が得られ、データの半自動分析が可能になります。
- リガンド内で観察された生体高分子-リガンド相互作用のヒット同定を実行
注: 19Fと 1Hのスクリーニング手順では、ヒットの定義が異なります。以下のヒット識別は、当社が設定し、特定のルールに従っています。ヒット判定の対象は非常に主観的な方法であり、ユーザーごとに異なる場合があります。それにもかかわらず、検証と信頼性を維持するために、ヒット識別のルールが一度合意されると変更されないことが最も重要です。- 1Hスクリーン
- ヒットを確実に決定するには、1D 1Hスペクトル、waterLOGSYおよびT2 緩和実験をターゲットの存在下および非存在下の両方で取得し、結合剤を同定します。3つの実験はすべて、結合イベントを示す可能性があります。ブランクスペクトルと比較してサンプルスペクトルに6Hzを超えるCSPが見られる場合、これはヒットの兆候と見なされます。waterLOGSY中の強い正のシグナルと、サンプルスペクトルの30%以上のT2 減少が見られる場合も同様です。結合イベントは、スペクトルを含むサンプルをそれぞれのブランクスペクトルと比較すると、3つの実験すべてで示すことができます。ただし、結合イベントは、3つの実験すべてで表示されない場合があります。このため、フラグメントを結合ヒットとして分類するために、前述のイベントのうち少なくとも2つが発生する必要があることが合意されました。
- TopSpinのFBSツールを使用して、フラグメントの状態をバインディング、あいまい、不明、集約、非バインディングに定義します。
- ミックスが終了したら、FBSツール内で承認します。
- FBSプロジェクト内の[概要]タブで、[ スクリーニングレポートの作成]をクリックします。これにより、.xlsxファイルを作成するウィンドウが開きます。ユーザーは、スプレッドシートで報告されるすべてのリガンド、結合リガンドのみ、結合リガンドのみではない、あいまいなリガンドのいずれかを選択できます。
- 19名F 画面
- 非バインダー、週バインダー、および強バインダーを区別するには、200 msのターゲット測定値と200 msブランク測定値の積分商を0 msターゲット測定値の商で割り、0 msブランク測定値を使用します。
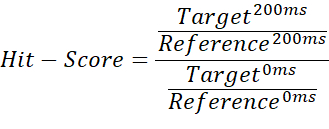
注: これにより、0 から ~1 (ヒット スコア) の範囲の値が得られ、バインド状態ごとにしきい値を割り当てることができます。 - 参照 200 ミリ秒の測定の平均をベースラインしきい値として使用して、ヒット スコアが 1 を超えるケースをマークします。これは、インポートされた積分に負の値が含まれている場合、または参照測定値がターゲット測定値よりも高い場合に発生する可能性があります。ヒットスコア ≤ 0.67 は弱ヒット、0.33 <は強打、0.67 >はノーヒットと見なされます。 図 2 に例を示します。
- 非バインダー、週バインダー、および強バインダーを区別するには、200 msのターゲット測定値と200 msブランク測定値の積分商を0 msターゲット測定値の商で割り、0 msブランク測定値を使用します。
- 1Hスクリーン
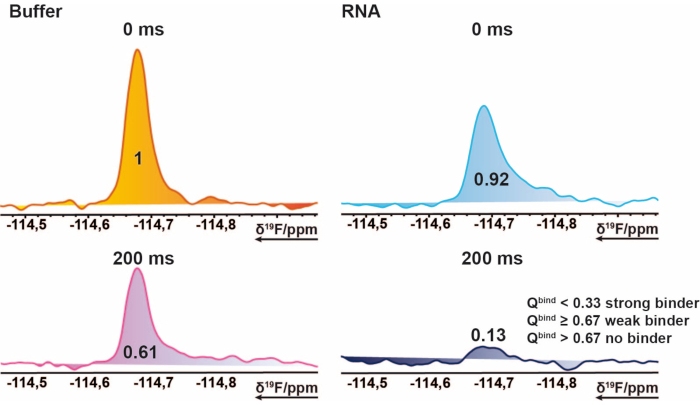
図2: 19Fスクリーニングのヒット識別。 例示化合物の 19FCPMG NMRスペクトルの断面図。この図は、バインダーの特性を説明しています。 19名RNAの存在下および非存在下での混合物サンプルから取得した化合物のF-CPMGスペクトル。値は、対応するピークのノルム積分値を表します。 この図の拡大版を表示するには、ここをクリックしてください。
- データ分析
- 分析用のデータの準備
メモ: 集録したデータに目に見える欠陥がないことが重要です。これは、シミングに問題がある、または水抑制が不十分なデータを分析のために考慮すべきではないことを意味します。むしろ、データを再度記録し、サンプル(気泡がないなど)、温度、シム、および水分抑制ですべてが正常であることを確認することをお勧めします。データの正確性は、DMSO信号を比較する際に常に評価できます。 - 1Hスクリーニング
- 1Hスクリーニングデータを解析するには、TopSpin 4.0.9のFBSツール(追加ライセンスが必要)を使用してください。
- FBSツールマニュアルの指示に従って、データ分析を開始します。次の手順は、マニュアルに記載されている手順をまとめたものです。
- スクリーニングキャンペーンからのBMRZ NMRデータを保存し、異なるスクリーニング混合物ごとに独自のディレクトリを持ち、サブディレクトリにサンプルで測定されたさまざまな実験を保持するようにします。
- FBSツールを使用するには、生体分子ターゲットを含まないサンプルから保存されたすべてのデータを含む参照スペクトルと、異なる/nmrディレクトリで測定された単一の化合物を保存します。FBSツールはそれぞれのディレクトリパスを個別に要求するため、これは重要です。
注:FBSツールは、次のデータセットがスクリーニングサンプルの混合物が保存されているのと同じディレクトリに保存されている場合、ディレクトリをスクリーニングプロジェクトとして認識します(csv、FragmentScreen XMLドキュメント、およびBAKファイル)。 - TopSpin 4.0.9を使用する場合は、取得したデータを含むディレクトリへの直接パス、いわゆるDIRを作成します。 すべての混合物が個別のディレクトリを持つ/nmrディレクトリを選択します。
- スクリーニングされたサンプルの FBS ツールを起動するには、シンボル FBS プロジェクトを TopSpin ウィンドウの中央にドラッグします。選択したディレクトリに、以前に指定されたデータセットがコピーされた場合、FBSプロジェクトシンボルが表示されます。
- フラグメント ベースのスクリーニングオプション ウィンドウは、新しいFBSプロジェクトを最初にロードするときに自動的に開きます。このウィンドウで、カクテルファイルを選択します。カクテルファイルは、ミックスの名前の割り当て、各フラグメントの名前、およびミックスへの分割を含むcsvファイルです。また、単一フラグメントのすべての測定スペクトルを含む参照リガンドスペクトルフォルダーを定義します。最後に、参照空の実験フォルダー (通常は、調査対象のターゲットを含まないミックスのデータセットを含むフォルダー) を定義します。
- フラグメントベースのスクリーニングオプションには、スペクトルタイプと呼ばれるタブがあり、調査されたスペクトルと スペクトル を表示するための色を定義できます。あらかじめ処理されたデータに応じてスペックタイプを設定します。 [表示レイアウト ]タブで、仕様タイプに従って互いに比較するスペクトルを定義します。
- [OK] をクリックして FBS プロジェクトを開始します。
- データを見ていると、別のウィンドウが開き、すべてのカクテルミックスと各ミックスのすべてのリガンドが表にまとめられます。セルをダブルクリックすると、それぞれのデータセットが開き、たとえば 1H 1D Blankスペクトルとターゲットを含むデータセットが比較されます。
- バインダーを割り当てる前に、基準ピーク(すべての測定値のDMSO、および単一の化合物)が互いに一致し、同じ化学シフトを持っていることを確認してください。違いが見られる場合は、TopSpinのシリアル処理オプションを使用して修正します。
- シリアル処理オプションは、[詳細設定] の [プロセス] タブにあります。データセットから選択したすべてのスペクトルに変更を適用します。このようにして、Spectypesを実験番号に簡単に割り当てることができ、すべてのスペクトルを一度にシフトしてリファレンスに合わせることができます。
- 19名F スクリーニング
- 19F 混合の最初の分析では、各混合の統合ファイルを作成します。統合領域を定義するには、[分析]タブの[統合]機能をクリックします。混合物中のすべてのフラグメントについて、対応する19F単体の明確な積分領域が定義されていることを確認してください。
- [統合リージョンの保存/エクスポート] ボタンを使用して、将来使用するために統合ファイルをエクスポートします。使用されている統合ファイルを C:\Bruker\TopSpin4.0.9\exp\stan\nmr\lists\intrng または TopSpin インストールディレクトリの対応するパスに保存します。
- 19F データの場合は、調査対象のターゲットの有無にかかわらずデータセットを開きます。
- 統合ファイルを現在のスペクトルにロードするには、分析タブを再度開き、統合に移動し、統合領域の読み取り/インポートボタンを使用して、対応する統合ファイルをロードします。これにより、そのファイルの定義された領域が現在のスペクトルに読み込まれます。
- 保存して戻り、 積分 タブですべての統合領域のリストを検索します。これをスプレッドシートまたはデータのさらなる分析に使用されるその他のツールにコピーします。
- ターゲットの有無にかかわらず、すべてのミックスに対してこの手順を繰り返します。
- データ管理
- 使いやすさと生産性のために、取得したデータをさらに分析および保存するために、統一されたワークフローを設定します。 1Hと 19Fの両方のスクリーニングでは、それぞれに特別に設計されたスプレッドシートを使用します。
注: 1Hスクリーニングでは、これは純粋にデータ管理と各ターゲットの要約に使用され、 19Fスクリーニングでは、第4.3章で説明した商を使用して、積分データがコピーされた後、各フラグメントをヒット/ヒットなしとして自動的にラベル付けしました。これにより、ファイルが適切に設定されていると仮定すると、分析中の人為的エラーのリスクが軽減され、すべての重要な情報がファイル内の1か所に収集され、データを最初に確認するための追加のプログラムを必要とせずに、事実上誰でも開くことができます。
- 使いやすさと生産性のために、取得したデータをさらに分析および保存するために、統一されたワークフローを設定します。 1Hと 19Fの両方のスクリーニングでは、それぞれに特別に設計されたスプレッドシートを使用します。
- 分析用のデータの準備
結果
フラグメントライブラリの品質管理
社内ライブラリーからのフラグメントは、90%d6-DMSOおよび10%D2O中の50mMストック溶液として提供されました(D2Oの10%は、凍結融解サイクルの繰り返しによる化合物分解の最小化を保証します14)。単一化合物サンプルは、50 mM リン酸緩衝液(25 mM KPi pH 6.2 + 50 mM KCl + 5 mM MgCl 2)中の1 mMリガンド、90% H 2 O/9% D2O/1% d6-DMSO中のpH 6.0で構成されていました。1iNEXTライブラリーのフラグメントのH-NMR実験を500/600MHz NMR分光計で測定しました。このデータはさらに、ユーザーが自動化された方法でスペクトルを完全に取得できるCMC-qソフトウェアを使用して、1Hスクリーニングキャンペーンで単一化合物を同定するために使用され、分析アドオンCMC-aフラグメントの品質(溶解度と完全性)が評価されました。CMC-aによる自動分析の結果は、図3に示すようなグラフ出力として示されています。グラフ出力は、96ウェルプレートの表現を示しています。赤色の円は、このフラグメントが構造または濃度の不一致を示していることを意味します。緑色のウェルは、フラグメントが一貫していることを示します。
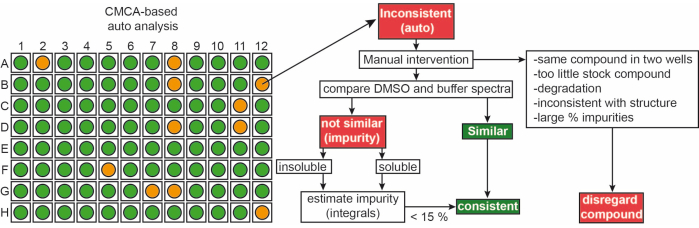
図3:フラグメントライブラリの品質管理。 CMC-aベースの自動出力の概略図。濃度や構造的完全性などのフラグメント特性が評価されます。緑は一貫性を表し、この場合のオレンジは一貫性がないことを表します。一貫性のないフラグメントは、示されているワークフローに従って手動で修正されます。 この図の拡大版を表示するには、ここをクリックしてください。
およそ、フラグメントの65%および35%が、DMSOおよびバッファーの両方でそれぞれコンシステントおよびインコンシステントとして分類された。さらに、一貫性のない分類されたリガンドの30%は、スペクトル9の慎重な手動検査の後に一貫性を生じた。
19F 混合計画
社内ライブラリーから1個または数個のフッ素基を含む103個のフラグメントを5つのミックス(A、B、C、D、E)に分けた。各ミックスには20〜21個のフラグメントがあります。この場合、信号のオーバーラップを避けるために、混合物を注意深く設計する必要がありました。 19名F横緩和実験は、CPMGパルス列を適用する各混合物について測定した。これらの実験は、緩和遅延を変化させることによって修正することができる。ミックスA-Eの 19F化学シフトを 図4に示します。
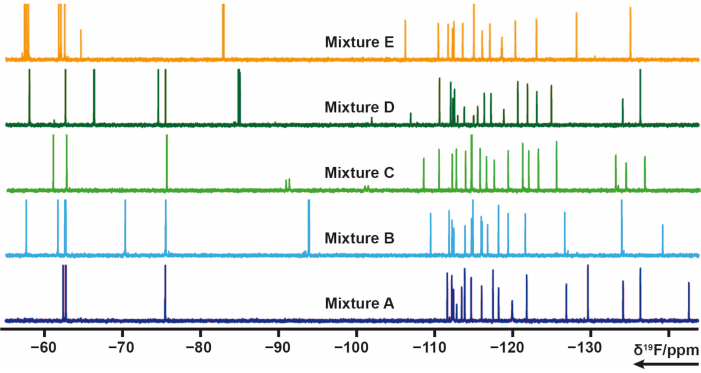
図4:社内ライブラリから得られた混合サンプルの 19F1D-NMRスペクトル。 この図の拡大版を表示するには、ここをクリックしてください。
サンプル調製
19Fスクリーニング手順のサンプル調製は、手動またはピペッティングロボットを使用した自動ピペッティングで行われました。各混合物中の断片は、90%d6-DMSOおよび10%D2O中に2.5mMの濃度を有していた。スクリーニングサンプルの最終容量は、ロック剤として5%D2Oを含む170μLであった。各混合物を2回ピペットで移し、1つは緩衝液含有溶液(標的なし)に、もう1つは標的含有緩衝溶液中に入れた。ターゲットとフラグメントの比率を1:1に設定し、最終的なターゲット/リガンド濃度を50 μMにしました。 さらに、コントロールサンプルは、ターゲットの完全性を確保するために混合物を含まないスクリーニングバッファー中のターゲット生体分子であり、バッファーの品質を確保するためにバッファーとD2Oのみを含むコントロールサンプルです。
19F−1Dおよび19F−CPMG−T2のNMRスクリーニングデータは、セクション3.1に記載のとおりに測定した。例えば、RNAの場合、バッファー中の単一標的サンプルに対してジャンプリターンエコー配列(pp = zggpjrse,15)が取得されました。
データ分析
19Fスクリーニング手順は、他のいくつかの標的の中でも、大腸菌由来のTPPリボスイッチthiMおよび結核菌由来のタンパク質チロシンキナーゼ(PtkA)に適用されました16。19Fスクリーニングライブラリには、Mix AからEまでのラベルが付いた5つのミックスに分割された103個のフラグメントがあり、スクリーニングサンプルの調製は、サンプルピペッティングロボットを使用せずに手動で行うことができます。40 μM thiM RNA含有溶液(緩衝条件)を混合物から3.2 μLと混合した。さらなる対照試料を、緩衝液のみ、5%のDMSOを含む緩衝液(所望のDMSO濃度の存在下で生体高分子の安定性を予め保証する)およびRNAを含む緩衝液からなる調製した。これらの13個のスクリーニングサンプルを調製し、3 mm NMRチューブに移しました。NMRチューブのバーコードをスキャンし、RNAの存在下および非存在下で各混合物、ならびに対照サンプルを、298Kで実施した前述の19FNMR実験に従って測定した。 社内ライブラリーに対するthiM RNAのスクリーニングは、異なるサンプルごとに0msおよび200msのCPMGでT2測定を行うことによって行った。測定終了後、すべてのサンプルについて追加測定された1H 1D実験の線幅拡大と強度損失の観点からすべてのDMSOピークを比較することにより、適切なシミングと水分抑制を監視しました。得られたCPMGT219F緩和スペクトルの処理を、TopSpinで予め調製および自動化したマクロをそれぞれ用いて行った。データ解析は、プロトコルの項の指示に従って行った。TopSpinから取得した積分データは、正しい条件としきい値を設定することにより、事前に作成されたスプレッドシートまたは同様のプログラムを使用して迅速かつ簡単に評価できます。前述のように、しきい値は、バインダー、弱バインダー、または非バインダーを定義するのに役立ちます。図5は、それぞれthiM RNAおよびPtkAのCPMGスペクトルの典型的な結果を示す。場合によっては、さらなる専門家による改訂が必要でした。
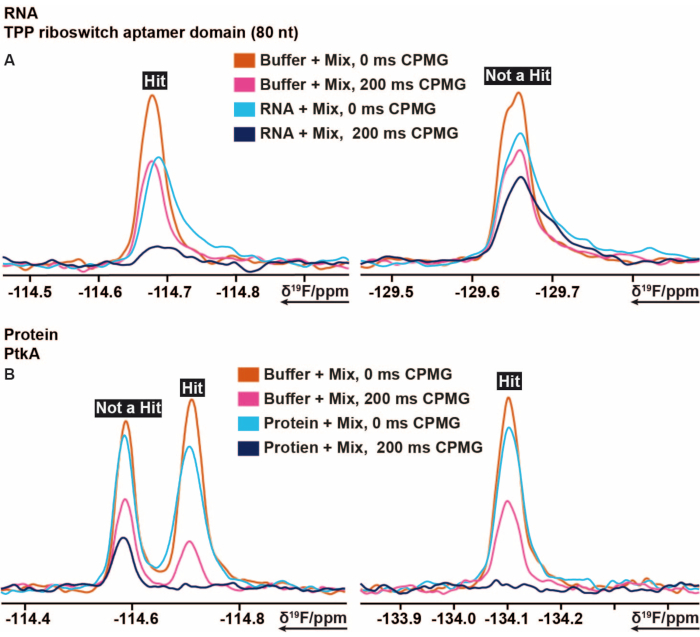
図5:CPMGベースの実験の異なる遅延時間から得られた強度変化を示す19FCPMG NMRスペクトルから切り出した。 (A)大腸菌由来のTPPリボスイッチthiM RNAに対して実施した19Fフラグメントベースのスクリーニングにおける結合剤(hit)および非結合剤の表現。(B)結核菌由来のPtkAに対して実施された19Fフラグメントベースのスクリーニングにおける結合剤および非結合剤の表現。この図の拡大版を表示するには、ここをクリックしてください。
1Hスクリーニング
混合設計
使用される社内ライブラリは非常に多様であるため、 1Hスクリーニングの目的で混合設計は実行されませんでした。これは、1つの混合物で混合する12をランダムに選択することによって64の混合が調製されたことを意味します。
サンプル調製
例示的なSARS-CoV-2 RNAの 1Hスクリーニングのために、ピペッティングロボットを用いた自動ピペッティングを実施してサンプルを調製した。各混合物中の断片は、90%d6-DMSOおよび10%D2O中に4.2mMの濃度を有していた。スクリーニングサンプルの最終容量は、ロック剤として5%D2Oを含む200μLであった。pH 6.2で25 mM KPi、50 mM KClの異なる混合物をそれぞれ含む64サンプルを、標的RNAなしでピペットで移した。それぞれ、64サンプルを標的RNAでピペッティングし、それぞれが異なる混合物を含んでいた。RNA:リガンド比を1:20に設定し、RNA濃度は10 μM、リガンド濃度は200 μMとなりました。
データ分析
1H解析には、TopSpinのFBSツールを使用しました。フラグメントがヒットしているかどうかを判断するために、1D化学シフト、waterLOGSY、およびT2緩和実験を実施しました。T2緩和については、30%を超える強度の減少をヒットとしてカウントし、一方、化学シフトについては、6Hzを超えるシフトをカットオフした。waterLOGSYは、有意なシグナル変化(この場合は負から正)を示す必要がありました。これら 3 つの条件のいずれか 2 つが陽性の場合、フラグメントはヒットとしてカウントされました。この 2 つの例を図 6 に示します。
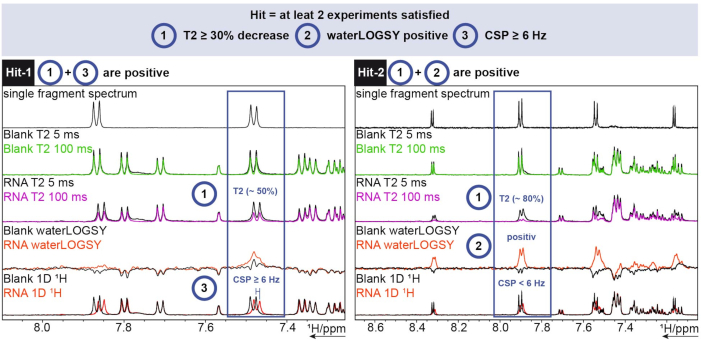
図6:ヒット判定基準を示す例示的なSARS-CoV-2 RNAに対して実施された 1Hスクリーニング。 3つの異なる実験(1H T2 CPMG(5 / 100 ms)、waterLOGSY、および1D 1H)の取得。この図の拡大版を表示するには、ここをクリックしてください。
Hit-1は、T2 が~50%減少し、CSPが6Hz≥ことを示しています。waterLOGSYは、陽性としてカウントされるほどのシグナルの有意な変化を示していません。3 つの実験のうち 2 つが肯定的であるため、このフラグメントはヒットとしてカウントされます。Hit-2の場合、T2 は~80%の信号強度の減少を示し、waterLOGSYでは明確な信号変化が見られます。この場合、CSPは十分ではありませんが、前の2つの基準が肯定的であるため、それでもヒットとしてカウントされます。
ディスカッション
NMRベースのフラグメント/薬物スクリーニングの汎用性。BMRZは、最先端の自動NMR装置、STD-NMR、waterLOGSYおよび緩和実験を成功裏に実装し、創薬のための幅広いアフィニティーレジーム内のフラグメントを同定しました。設置されたハードウェアには、ハイスループットサンプル調製ロボットと、600 MHz分光器に関連するハイスループットサンプルストレージ、チェンジャー、データ収集ユニットが含まれます。最近購入した1 H、19 F、13C、15 N用の極低温プローブは、提案された測定に必要な感度を保証し、19Fの検出中に1 H(1)デカップリングを可能にします。このプローブは、CMC-q、CMCアシスト、CMC-se、FBS(TopSpinに含まれる)など、ブルカーの高度なソフトウェアツールを使用する可能性を提供する最新世代のNMRコンソールに接続されています。フラグメントベーススクリーニング(FBS)ツールは、TopSpinの最新バージョンに含まれており、STD、waterLOGSY、T2/T1r緩和実験からなるハイスループットデータの分析に役立ちます。液体1D 1Hサンプルコレクションは、サンプル充填ロボットを使用して自動的にNMRチューブに充填できます。 通常、96本のチューブ(3 mm)のブロックが約2時間で充填されます。96ウェルプレートラックはHTサンプルチェンジャーに直接配置され、ブロックのバーコードを読み取り、自動化ソフトウェア(IconNMR)によって制御される実験にNMRチューブを割り当てます。5つの96ウェルプレートラックをHTサンプルチェンジャーに同時に保存およびプログラムできます。個々のラックの温度は、個別に制御および調整できます。さらに、個々のサンプルは、測定前に所望の温度に事前調整(凝縮した湿度を除去するための予熱およびチューブ乾燥)することができます。
幅広い用途に適しています。 この自動NMRベースのスクリーニングの幅広い用途の1つは、生体高分子ターゲット(DNA/RNA/タンパク質)に結合する新規リガンドの同定と開発です。これらのリガンドは、典型的には非共有結合的に結合するオルソステリックおよびアロステリック阻害剤を含み得る。また、NMRによるFBDDは、典型的には、有望な化合物を選択するための第1工程として使用され、満たすべき要件は、十分な量の生体分子標的の利用可能性である。この目標は、2つの主要なタスクに分かれています。
タスク1は、次の理由で社内フラグメントライブラリを開発および特性評価することです:初期および定期的な品質管理、特性評価、および1000を超えるフラグメントの定量化。各ターゲット、特にタンパク質ターゲット用に最適化されたバッファー中のフラグメントの溶解度の決定。多様な足場に対応し、他の高分子クラスに向けて拡張するためのいくつかのライブラリの確立。タスク2は、NMRによるフラグメントベースのドラッグデザイン(FBDD)のワークフローを統合することです:自動化された1Dリガンド観察スクリーニング(1Hおよび 19F観察)。オルソステリック結合とアロステリック結合を区別するための自動置換アッセイ((天然)リガンドとの競合実験)。複数のフラグメントを使用した自動二次スクリーニング。自動化された2Dタンパク質スクリーニング、およびEU-OPENSCREENライブラリまたはその他のライブラリを利用した最初のヒットに関する一連の誘導体の二次スクリーニング。選択したターゲットに対するFDAライブラリのスクリーニングを再プロファイリングします。
さらに、細胞周期の制御と代謝を結びつける制御機構を解明するために、様々な細胞株(疾患関連)の代謝型決定を行うことができます。また、構造/ドメインの最適化(構造調査(バッファー、pH、温度、塩のスクリーニング)のための安定性の最適化)のためのin vivo および in vitro でのRNA/DNA/タンパク質調節要素の機能特性評価、およびNMRベースのフラグメントスクリーニングの膜タンパク質および天然変性タンパク質への拡張もあります。
制限。 19Fおよび1Hフラグメントライブラリの使用には長所と短所があり、以下でそれらのいくつかについて説明します。19F対1H測定の最大の利点は、混合物に含まれるフラグメントの数がほぼ2倍になり、必要な実験が少なくて済むため、実際の測定時間とその後の分析の両方の速度です。また、バッファーからの干渉がなく、シグナルのオーバーラップがほとんどなく、より広い化学シフト範囲を提供し、最適に設計されたフラグメント混合物であるため、フォローアップ分析は19Fスクリーニングにも容易です。スペクトル自体は非常に単純化されており、通常、フッ素原子の数に応じて、フラグメントごとに1つまたは2つのシグナルしかありません。したがって、これらのスペクトルの分析は自動化でき、再び時間を短縮できます。これは、少なくともこの研究で使用されたライブラリでは、化学的多様性を犠牲にしてもたらされます。ライブラリの~13%しか19 Fを含まないため、当然のことながらすべてが1Hスクリーニングで使用可能であるため、19Fスクリーニングフラグメントの多様性は低くなります。これは、より多くのフラグメントとより大きな化学的多様性を備えた特別に設計された19Fライブラリを使用して回避できます。19Fスクリーニングのもう一つの欠点は、フラグメントあたりのシグナル数が少ないことです。フラグメントは、一般に、2個以上の水素原子から構成される。したがって、スクリーニング実験で観察された1Hは、結合を検出するために同じ断片に対する異なるシグナルに依存することができる。これにより、1 Hスクリーニングのヒットを特定する際の信頼度が高くなりますが、19Fスクリーニングでは、フラグメントごとに与えられた1つまたは2つのシグナルに依存する必要があります。
最新の自動NMRベースのフラグメントスクリーニング装置、ソフトウェア、分析方法、およびそれらのプロトコルに関する詳細な説明が提示されました。設置されたハードウェアには、ハイスループットサンプル調製ロボットと、600 MHz分光器に関連するハイスループットサンプルストレージ、チェンジャー、データ収集ユニットが含まれます。最近設置された1 H、19 F、13C、15 N用の極低温プローブヘッドは、提案された測定に必要な感度を保証し、19Fの検出中に1Hのデカップリングを可能にします。さらに、最新世代のNMRコンソールは、高度な分析ソフトウェアを使用して、取得とオンザフライ分析を支援する可能性を提供します。上記の技術、ワークフロー、および説明されているプロトコルは、NMRによるFBSを追求するユーザーにとって目覚ましい成功を促進するはずです。
開示事項
何一つ。
謝辞
この作業は、欧州委員会のホライズン2020プログラムによって資金提供されたプロジェクト番号871037のiNEXT-Discoveryによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Bruker Avance III HD | Bruker | 600 MHz NMR Spectrometer | |
| Matrix Clear Polypropylene 2D Barcoded Open-Top Storage Tubes | 3731-11 0.75ML V-BOTTOM TUBE/LATCH RACK | ThermoFisher Scientific | Barcoded Tubes |
| Matrix SepraSeal und DuraSeal& | 4463 Cap Mat, SeptraSeal 10/CS | ThermoFisher Scientific | |
| SampleJet | Bruker | HT Sample Changer | |
| SamplePro Tube | Bruker | Pipetting Robot |
参考文献
- Yanamala, N., et al. NMR-Based Screening of Membrane Protein Ligands. Chemical Biology & Drug Design. 75, 237-256 (2010).
- Souers, A. J., et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nature Medicine. 19, 202-208 (2013).
- Su, M. C., Te Chang, C., Chu, C. H., Tsai, C. H., Chang, K. Y. An atypical RNA pseudoknot stimulator and an upstream attenuation signal for -1 ribosomal frameshifting of SARS coronavirus. Nucleic Acids Research. 33, 4265-4275 (2005).
- Perera, T. P. S., et al. Discovery & pharmacological characterization of JNJ-42756493 (Erdafitinib), a functionally selective small-molecule FGFR family inhibitor. Molecular Cancer Therapeutics. 16, 1010-1020 (2017).
- Zhang, C., et al. Design and pharmacology of a highly specific dual FMS and KIT kinase inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 110, 5689-5694 (2013).
- Lipinski, C. A., Lombardo, F., Dominy, B. W., Feeney, P. J. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Advanced Drug Delivery Reviews. 23, 3-25 (1997).
- Congreve, M., Carr, R., Murray, C., Jhoti, H. A 'Rule of Three' for fragment-based lead discovery. Drug Discovery Today. 8, 876-877 (2003).
- Chávez-Hernández, A. L., Sánchez-Cruz, N., Medina-Franco, J. L. A Fragment Library of Natural Products and its Comparative Chemoinformatic Characterization. Molecular Informatics. 39, 2000050 (2020).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. , 00327-00329 (2020).
- Gao, J., et al. Automated NMR Fragment Based Screening Identified a Novel Interface Blocker to the LARG/RhoA Complex. PLoS One. 9, 88098 (2014).
- Peng, C., et al. Fast and Efficient Fragment-Based Lead Generation by Fully Automated Processing and Analysis of Ligand-Observed NMR Binding Data. Journal of Medicinal Chemistry. 59, 3303-3310 (2016).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Hwang, T. L., Shaka, A. J. Water Suppression That Works. Excitation Sculpting Using Arbitrary Wave-Forms and Pulsed-Field Gradients. Journal of Magnetic Resonance, Series A. 112, 275-279 (1995).
- Gossert, A. D., Jahnke, W. NMR in drug discovery: A practical guide to identification and validation of ligands interacting with biological macromolecules. Progress in Nuclear Magnetic Resonance Spectroscopy. 97, 82-125 (2016).
- Sklenar, V., Bax, A. A new water suppression technique for generating pure-phase spectra with equal excitation over a wide bandwidth. Journal of Magnetic Resonance. 75, 378-383 (1987).
- Binas, O., et al. 19F NMR-Based Fragment Screening for 14 Different Biologically Active RNAs and 10 DNA and Protein Counter-Screens. ChemBioChem. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved