Method Article
皮膚修復を正確に評価するヒトEx vivo創傷モデルと全山染色法
要約
ここでは、全マウント染色アプローチと組み合わせたex vivoヒト皮膚を用いた創傷修復を評価するための最適化された技術を実証する。この方法論は潜在的な創傷療法の評価のための前臨床プラットホームを提供する。
要約
主に高齢者や糖尿病に影響を与える慢性的な非治癒創傷は、臨床アンメットニーズの重要な領域である。残念ながら、現在の慢性創傷治療は不十分ですが、利用可能な前臨床モデルは新しい治療法の臨床的有効性を十分に予測しません。ここでは、ヒトの皮膚修復応答の複数の側面を評価するための高スループット、前臨床モデルについて説明する。部分的な厚さの創傷は、ヒトのex vivo皮膚で作成され、治癒時間コース全体で培養された。皮膚創傷生検は、全マウント染色手順のための固定剤で収集した。固定サンプルを一次抗体でブロックしてインキュベートし、蛍光結合二次抗体を介して検出を行った。創傷は、各生検における創傷閉鎖率(再上皮化)を計算する前に、共焦点顕微鏡を介して対数化され、画像化された。このプロトコルを適用すると、健康なドナー皮膚で作成された2mmの切除創傷が4-5日目の創傷後までに完全に再表皮化されることを明らかにした。逆に、糖尿病性皮膚創傷の閉鎖率は著しく低下し、障害性の改変を伴う。人間の皮膚創傷と新しい全マウント染色アプローチを組み合わせることで、迅速かつ再現可能な方法で元生体内創傷修復を定量化することができます。総称して、このプロトコルは、潜在的な創傷療法の有効性を評価するための貴重なヒトプラットフォームを提供し、前臨床検査と検証を変革する。
概要
高齢者や糖尿病患者に非常に蔓延している慢性的で治癒しない創傷は、臨床的な満たされていない必要性の大部分が評価されていない領域である。これらの傷は、患者に大きな身体的および心理的負担を提示し、1を治療するために毎年数十億ドルの医療提供者に費用がかかります。創傷生物学の理解が向上し、技術の進歩にもかかわらず、慢性創傷の最大40%はまだ最高の標準的なケア2に続いて治癒することができない。したがって、糖尿病性足潰瘍患者の14〜26%は、その後切断3を必要とし、5年間の切断後の死亡率は約70%4である。その結果、治癒の傷の低下によって引き起される実質的な医療負担を軽減しながら、患者の生活の質を向上させるための効果的な新しい治療法を開発することが緊急の要件です。予測が不十分な前臨床モデルは、効果的な新しい治療法の開発に依然として大きなハードルを持っています。
創傷修復は、多様な細胞タイプ、無数のレベルのコミュニケーション、および時間的に改造された組織環境を含む動的で多面的なプロセスです。皮膚の治癒は、止まり止め、炎症、増殖、およびマトリックスリモデリングの4つの主要な修復段階によって支えられています。これらの段階は最終的に失血や感染を防ぐために作用し、創傷表面を閉じ(再上皮化と呼ぶプロセス)、皮膚を傷つけていない状態に戻す5。慢性創傷は、治癒過程に対する多様な病因および広範な摂動と関連しており、治療標的の同定をさらに複雑にする。それにもかかわらず、創傷病理の分子および細胞の促進要因を解明し、新しい治療アプローチ7をテストするために、幅広いモデルが開発されてきた。
最も使用される創傷修復モデルは、マウスの急性創傷である。マウスは、機械学的研究のために非常に難解であり、老化と糖尿病の検証されたモデルを提供します 8.マウスと人間の治癒の間で示される一般的な類似点にもかかわらず、皮膚構造と治癒ダイナミクスの種間の違いは残っている。これは、ほとんどのマウス創傷研究が簡単にクリニック9に翻訳しないことを意味します。その結果、高い適用性と翻訳性10、11を持つヒトin vitroおよびex vivoシステムに向けてプッシュがありました。
ここでは、ヒトの皮膚の外来で部分的な厚さの切除傷を行うための詳細なプロトコルを提供する。また、エキビボヒトの皮膚治癒を評価する非常に再現性の高い方法として、全マウント染色アプローチの概要を説明します。表皮修復(再上皮化)とその後のバリア形成の軌跡を示し、健康なヒト皮膚と糖尿病患者の皮膚における創傷閉鎖率を評価する。最後に、さまざまな抗体を用いて全体実装染色を適応し、治癒反応の様々な側面を評価する方法を示します。
プロトコル
人間の皮膚は、完全な情報、書面による患者の同意、制度的ガイドライン、倫理的承認(LRECs:17/SC/0220および19/NE/0150)の下でキャッスルヒル病院とハル王立保健室(ハル、英国)で再建手術を受けている患者から得られました。非糖尿病の皮膚は、定期的な手術を受けている患者から収集された(平均年齢=68)。糖尿病皮膚は、II型糖尿病および潰瘍の既往歴を確立したドナーから選択された(平均年齢=81歳)。手術からのサンプルは、保持媒体で輸送され、実験室に到着するとすぐに処理された。未固定のヒト組織を用いた実験ステップはすべて、クラスII層流バイオセーフティキャビネットにおいてバイオセーフティレベル2(BSL-2)で実施した。
1. 皮膚培養培地の製造と染色試薬
注: すべての試薬と消耗品の詳細は 、材料表に記載されています。人間の組織の処理と培養に使用されるすべての試薬と装置が滅菌されていることを確認してください。使用前に器具を殺菌し、組織と接触した後に消毒剤で除染する。廃棄処理前に1%消毒剤で廃棄物を除染します。
- 保持媒体:2 mM L-グルタミンと4%(v/v)抗生物質抗ミキサン酸溶液を含む高グルコースダルベックコの改変イーグル培地(DMEM)を補う。
- 抗生物質を含むハンクのバランス塩溶液(HBSS):HBSSに4%(v/v)抗生物質抗抗薬溶液を加える。使用するまで4°Cで保管してください。
- Dulbeccoのリン酸緩衝生理食塩水(DPBS):蒸留水1リットル当たり9.6gのDPBS粉末を溶解してDPBSを調製(dH2O)。オートクレーブは滅菌し、使用するまで4°Cで保存します。
- ヒト皮膚成長培地:2mM L-グルタミン、1%(v/v)抗生物質抗抗薬溶液、10%(v/v)胎児ウシ血清で高グルコースDMEMを補う。使用するまで4°Cで保管してください。
- 皮膚固定剤:450mLのdH2Oに、ホルムアルデヒド溶液40mL、氷酢酸10mL、塩化ナトリウム4.5g、臭化アルキルトリメチルアンモニウム0.25gを加える。室温(RT)で保存し、数日以内に使用してください。
注意:固定性は危険です(刺激性および可燃性)。注意して取り扱い、適切なルートを介して処分します。 - リン酸緩衝生理食塩水(PBS):6gの塩化ナトリウムをリン酸緩衝液100mL、dH2Oの900mLに加えて、全マウント染色用のPBSを準備します。
- 洗浄バッファーの染色: 0.5% (v/v) トリトン X-100 を PBS で溶解します。
- ブロッキングバッファー:洗浄バッファーを染色するために0.2%(w/v)アジドナトリウムと2%(v/v)動物血清を加えます。4°Cで2週間まで保管してください。
注:二次抗体宿主種の血清中のブロック。アジ化ナトリウムは、インキュベーション中の細菌の増殖を防ぎます。 - DAPI作業溶液:ジメチルスルホキシドで4',6-ジミジノ-2-フェニリンドール(DAPI)の5mg/mLストックを準備します。汚れ洗浄バッファーでストック 1:1,000 を希釈して、5 μg/mL DAPI 動作溶液を提供します。
- ペルオキシダーゼブロック:洗浄バッファーを染色するために0.3%(v/v)過酸化水素を加えます。使用するまで4°Cで保管してください。分解を防ぐために暗闇の中に保管してください。
- ABC-HRPキット:
- HRP共役二次抗体:5 mLの染色緩衝液中のビオチン化ウサギ抗ヤギIgGの1滴。4°Cで2週間まで保管してください。
注:使用されるキット/セカンダリは、一次抗体の宿主種によって異なります。 - アビジンビオチン複合体(ABC)試薬:試薬A2滴及び5mLの洗浄緩衝液中の試薬B2滴。ABC試薬は、使用前に少なくとも30分を調製する必要があります。4°Cで2週間まで保管してください。
- HRP共役二次抗体:5 mLの染色緩衝液中のビオチン化ウサギ抗ヤギIgGの1滴。4°Cで2週間まで保管してください。
- ペルオキシダーゼ基板:試薬1滴3滴、試薬2滴2、試薬3滴2滴、過酸化水素2滴を5mLのdH2O.ペルオキシダーゼ基板は、使用直前に新たに調製し、保存することができない。
2. 創傷のための皮膚の準備
注:これらのステップはクラスIIの層流バイオセーフティキャビネットで行われるべきです。
- BSL-2キャビネットへのメディアと輸送を保持する皮膚を収集します。
- 90mmの滅菌ペトリ皿の中に皮膚真皮側を下に置き、滅菌はさみで脂肪組織を取り除きます。
- 25 mLのHBSSを含む50 mLチューブに、抗生物質を10分間RTで入れ、残った血液と脂肪組織を除去するために断続的に振ります。
- 新しい50 mLチューブを使用して、ステップ2.3を繰り返します。
- 25 mLのHBSSを含む新鮮な50 mLチューブに皮膚を入れ、今度はステップ2.3のようにRTで10分間抗生物質を使わずに皮膚を入れます。
- DPBS 25 mLの新しいチューブに皮膚を入れることで、最終的な皮膚リンスを行います。皮膚は今傷つける準備ができています。
3. エキビボヒト皮膚創傷の作成
注:これらのステップはクラスIIの層流バイオセーフティキャビネットで行われるべきです。
- 傷つく前に皮の文化料理を準備してください。60 mm のペトリ皿に、2 つの無菌吸収パッドを積み重ね、皿の側面を介して 4 mL の人間の皮膚培地を加えます。無菌ナイロンフィルター膜を吸収パッドスタックに配置します。
注:皮膚メディアは、必要な治療条件に応じて変更することができます。各スタック上で最大3つの創傷外植を培養することができる。 - 90mmペトリ皿で滅菌ガーゼの皮膚の真皮側を乾燥させて、残留DPBSを除去します。
注:これは、傷のときに皮膚が滑り回るのを防ぎます。 - きれいな90mmのペトリ皿の蓋の上に皮膚真皮側を下に置き、新鮮な滅菌ガーゼで乾燥した表皮を手に入れます。
注:ペトリ皿の蓋の皮膚は、ベースよりも簡単に傷つきます。その後の作業は、皮膚が乾燥するのを防ぐために迅速に行われるべきです。 - 皮膚を引き締め、2mmの生検パンチを皮膚に押し付け、そっとねじります。皮膚を完全にパンチしないでください。
注:部分的な厚さの傷は、表皮を通って部分的に真皮にパンチするように設計されています。部分的な厚さの創傷を作成するために必要な力にドナーからドナーへの変動および部位間の変動があるかもしれない。 - 湾曲した歯付き組織鉗子を使用して2mmの傷口の両側を拾い、2mmの傷口の下に湾曲した虹彩はさみを引き締め、均一に切り取ります。
- 中央2mmの創傷の周りの生検は、6mm生検パンチを使用して、中央に部分的な厚さ2mmの傷を有する6mmの外植を作り出す。
注:6 mm生検パンチは、各2mmの傷が必要な場所をマークするために皮膚をスコアリングするために使用することができます。組織全体に突き刺さらないで注意してください。脱毛を減らすためにハニカムパターンで創傷の外植を作成します。 - ナイロンフィルター膜スタック上に表皮を上に巻き出しを置く(ステップ3.1で作成)。
注意:創傷の外植を扱うときは、中央の傷を傷つけないように注意してください。小さな鉗子を使用し、反対側の各外植を拾う。 - 加湿雰囲気(90~95%)で32~37°C、CO25%で創傷を1~7日間インキュベートする。2~3日ごとにメディアを交換してください。
4. エキビボ創傷の全マウント染色
注:このセクションでは、免疫蛍光および免疫ペルオキシダーゼ染色法について説明します。使用前に試薬を十分に混合してください。
- 蛍光染色法
- 500 μLの皮膚固定液を含む1.5 mLマイクロ遠心分離チューブで創傷外植を回収し、一晩4°Cでインキュベートします。
注: このプロトコルで使用される固定剤は、記載されている抗体に対して適切に機能します。他の抗体には最適化が必要です。24時間を超える組織固定は、過剰固定につながる可能性があります。 - 翌日は固定液を取り除き、1 mLの洗浄バッファーを染色して交換します。生検は、染色前に2週間まで4°Cで洗浄緩衝液を染色して保存することができます。
注:すべての洗浄バッファーのステップのために、傷を傷つけないように注意して、血清ピペットまたはピペットチップを使用してください。 - 洗浄バッファーを吸引し、1 mLの洗浄バッファーでもう 1 回リンスを行います。
- ステップ 4.1.5~4.1.6(サンプル数 x 300 μL = μL のブロッキングバッファの量)に必要なブロッキングバッファの量を計算します。必要に応じて、追加のバッファを作成します。
- 各サンプルに150μLのブロッキングバッファーを加え、RTで1時間インキュベートします。すべての染色手順について、各サンプルが十分に覆われており、生検創傷表面を覆う気泡がないことを確認してください。
注:このステップは1.5 mLのマイクロ遠心分離管または48の井戸板で行うことができる。48ウェルプレートを使用する場合は、各ウェルで下に傷をインキュベートします。 - 残りのブロッキングバッファーで一次抗体を希釈します。
注:アンチマウスケラチン14(K14)は、ブロッキングバッファで1:1,000を希釈してうまく機能します。他の抗体または複数のプローブで使用するために、このステップを最適化します。 - ブロッキングバッファーを吸引し、ウェル/マイクロ遠心分離チューブあたり 150 μL の一次抗体を加えます。創傷外植を一晩4°Cで一次抗体にインキュベートする。
- 翌日、一次抗体を吸引し、RTで1時間0.2%アジ化ナトリウムを含む洗浄バッファーを洗浄液に吸い込む(1サンプルあたり500μL)。
- 洗浄バッファー(洗浄1回30分、サンプルあたり500 μL)を使用して、さらに3つの洗浄工程を実行します。
- 洗浄バッファーを染色する蛍光結合二次抗体を希釈する(例えば、1:400希釈時にヤギ抗マウス488)。
- 必要な二次抗体の量(サンプル数 x 150 μL = μLの量)を計算します。
- 各ウェル/マイクロ遠心分離チューブに150 μLの二次抗体を加えます。RTで1時間インキュベートする. 二次抗体が光感受性であるため、暗闇の中でインキュベーションステップ4.1.10~4.1.16を行います。
注:このステップは、必要に応じて一晩4°Cで実行することができます。十分なシグナルと限られたバックグラウンド染色に必要な二次抗体の濃度を最適化します。 - 二次抗体を取り出し、洗浄バッファー(サンプルあたり500 μL)で3 x 30分のリンスを行います。
- 残った洗浄バッファーを破棄し、必要な DAPI の作業ソリューションの量を計算します (ステップ 4.1.11 に従って)。
- RTで10分間のDAPI作業ソリューションの150 μLを備えた各外植物に対抗します。
注:DAPIは細胞核を青色に染色します。Hoechst染料は、DAPIの代替として使用することができます。 - 洗浄バッファー(サンプルあたり500 μL)で2回の最終30分洗浄を行います。生検は、画像化の2週間前まで暗闇の中で4°Cの洗浄緩衝液を染色して保存することができる。
- 500 μLの皮膚固定液を含む1.5 mLマイクロ遠心分離チューブで創傷外植を回収し、一晩4°Cでインキュベートします。
- ブライトフィールド染色法。
- ステップ 4.1.1 ~ 4.1.3 を実行します。
- ペルオキシダーゼブロックを一晩4°Cで焼入れ内因性ペルオキシダーゼ活性。
注:このステップは、組織からの非特異的なバックグラウンド染色を減らすためにHRP結合抗体を使用する場合に重要です。高度に血管化された組織は、より内因性ペルオキシダーゼ活性を含む。 - ペルオキシダーゼブロックを捨て、洗浄バッファーを染色して30分間2回洗い流します。
- ステップ 4.1.4 ~ 4.1.8 を実行します。
注:ステップ4.1.7の後のワッシュは、サンプルからアジ化ナトリウムを除去するために特に重要です。アジドナトリウムが十分に除去されない場合、HRPを不活性化し、染色検出を妨げる。 - 各ウェル/マイクロ遠心分離チューブに150 μLのHRP共役二次抗体を加え、RTで一晩4°Cまたは1時間でインキュベートします。
- 二次抗体を取り除き、洗浄バッファーを染色する際に3 x 30分洗浄を行います。
- 各ウェル/マイクロ遠心分離チューブに150 μLのABC試薬を加え、RTで4°Cまたは1時間で一晩インキュベートします。
- ABC試薬を吸引し、洗浄バッファーを染色して3 x 30分洗浄を行う。
- 1つの外植体に150 μLペルオキシダーゼ基板を加え、顕著な色の変化を検出するのに必要な時間を決定します。
注: 強い染色が予想されるサンプルを選択します。この場合、赤い環は、移行する表皮を示す(K14)。3,3'-ジアミノベンジジン-4、または任意の他の適切な発癌基質は、このペルオキシダーゼ基質の代替として使用され得る。 - 色の変化が観察されたら、ペルオキシダーゼ基板を取り除き、1 mLのdH2Oと交換します。
- 他の外植者に対するペルオキシダーゼ基板検出を繰り返し、ステップ4.2.11で決定した時間に対してインキュベートする。
- 1 mLのdH2Oで全ての外植物をすすいで、残留ペルオキシダーゼ基板を除去します。外植はイメージングの前に4°Cで1週間まで貯蔵することができるが、パーオキシダーゼ基板が時間の経過とともにdH2Oに浸出するのを防ぐためにできるだけ早くそれらをイメージする方が良い。
5. イメージングと定量
- 蛍光イメージング
注意:蛍光イメージングは、共焦点レーザー走査顕微鏡を使用して行われます。しかし、反転蛍光顕微鏡は、創傷閉鎖率を定量化するために2D画像を取得するのに十分な場合があります。二次抗体を選択する際には、選択した蛍光色素が、利用可能な顕微鏡装置の励起および発光スペクトルと互換性があることを確認してください。- 2.5倍、10倍、20倍の目的、x-y-z電動ステージ、デジタルカメラ、および取得ソフトウェアを搭載した共焦点レーザー走査顕微鏡を使用します。透過光検出器(TPMT)をオンにして、各生検を簡単に可視化し、全創傷閉鎖の測定を可能にします。あるいは、蛍光イメージングに続く明視野顕微鏡を介して各創傷を測定する。
- イメージングプラットフォームに60mmのペトリ皿ベースを置き、DPBSの薄い層(約1mL)を追加します。
注:DPBSが多すぎると、イメージング中に生検が動き回る。または、プレートホルダーが利用可能な場合は、48ウェルプレートを使用します。 - 小さな組織鉗子を使用して、傷ついた外植を井戸/マイクロ遠心チューブからDPBSを含むペトリ皿に移します。生検の傷口をペトリ皿に下に置きます。
- 接眼レンズと蛍光灯を使用して、傷口を見つけて焦点を当てます。気泡が視野のサンプルの下に閉じ込められている場合は、組織鉗子で創傷を拾い上げ、再配置します。
- イメージングソフトウェアをセットアップし、チャンネル間のピンホールサイズを均等にして最適な共焦点性を確保します。この場合、各チャンネルの 1 つの風通しの良い単位の値を確認し、最大値を選択します。スキャン速度、画質、平均を選択します。
注:共役二次抗体と選択されたカウンターステイン(例えば、DAPI)のフルオロクロムは、必要なチャネルを指示します。 - ライブ取得ソフトウェアのスイッチをオンにし、レーザーパワーと各チャンネルのゲインを、染色を視覚化するために必要なレベルに調整します。デジタルオフセットを増やすことで、バックグラウンドノイズを低減します。
- 創傷を撮像平面の中央に配置します。
注:傷が小さな目的を使用したり、より大きな創傷を作成したりするために画像全体を埋め尽くさない場合は、画像のパネルを取り、それらを一緒にステッチします(手動で、または関連するイメージングソフトウェアのタイリング機能を使用)。 - 創傷生検の画像を取得します。外植間で同じイメージング設定を使用します。
注:高いパワー画像は、組織構造と細胞マーカーの発現と位置の評価を可能にします。 - 特にペトリ皿に対して組織が完全に平坦でない場合は、創傷を通してシリアルZスタックを収集します。解析ソフトウェアを使用して、Z スタックを単一の最大強度投影イメージに集約します。
- ブライトフィールドイメージング
注:免疫ペルオキシダーゼ染色生検の明視野イメージングは、複数の方法で行うことができます。- 逆顕微鏡イメージング:ペトリ皿に入れ、手順5.1.2~5.1.3に記載の画像撮影用の創傷外植を準備します。デジタルカメラを搭載した反転顕微鏡で明視野照明下でデジタル画像を取得します。必要に応じて、複数の画像をつなぎ合わせます。
- ワイヤレスデジタル顕微鏡イメージング: 携帯電話やラップトップに接続されたワイヤレスデジタル顕微鏡を使用して、費用対効果の高い方法で高品質の画像を取得します。外植をいくつかの組織に巻き上げ、残りのdH2O(または洗浄緩衝液を染色)をサンプル貯蔵から取り除きます。創傷外植を顕微鏡の視野の中央に置きます。接続されたカメラを使用して画像を取得します。
- 定量化
注: フリーハンド形状を描画して測定できるソフトウェアでは、傷の閉鎖率を定量化できます。ImageJ は、次のように定量化に使用できます。- イメージ J ソフトウェアで、定量化するイメージを開きます。
- フリーハンドの形状ツールを使用して、通常の皮膚と出会う再上皮化創傷の外側を描きます。 M (または 分析|を押す「外側」領域測定を取得する測定。
注:再上皮化創傷組織の質感は正常な皮膚とは異なる。この種の解析の前に、画像を拡大縮小する必要はありません。 - フリーハンドのシェイプツールを使用して、開いた巻き領域の周囲に描画します。これは、開いた創傷が再上皮組織の内側の端と出会う場所です。 M (または 分析|を押す「内側」領域測定を取得する測定。
- 次の式を使用して、創傷の再表皮化/閉鎖率を推測します。
% クロージャー = (外巻面積 - 内創傷領域) / (外創面積) x 100
注:抗体の割合面積の範囲は、同じ方法(例えば、K14)または全創傷面積の割合として推測することができます。パーセンテージ強度はまた、関心のあるマーカーの組織レベル発現に関する半定量的情報を提供することができ、一方、高出力イメージングは細胞レベルで発現データを提示する。
結果
本報告では、ヒトの皮膚修復反応に影響を与える因子を評価するための新しいex vivo皮膚創傷および全マウント染色法を提示する。図1Aは、創傷インキュベーション時間に応じて3〜10日で行うことができる手続き型パイプラインの概略を示す。部分的な厚さの創傷は空気の膜積み重ねで培養される:膜界面および全マウント染色のために集めることができる、パラフィンまたはOCT培地に埋め込んで一般の神学のために、または生化学的分析のために液体窒素で凍結する(図1B)。我々は一般的に6ミリメートルの外植の中心内に2ミリメートルの部分的な厚さの傷を作成します。しかし、創傷および周囲の外植の大きさは、要件に応じて変更される可能性があります。全実装手順は、免疫性ペルオキシダーゼおよび免疫蛍光染色法の両方に対してうまく適応されている(図1C)。
免疫蛍光は、複数の抗体を用いた組織の調査を可能にする。このために、我々は、異なる種で育てられた一次抗体と、種間反応性を制限するために蛍光結合二次抗体を一致させた種を使用することをお勧めします。抗体濃度とインキュベーション時間を最適化する必要があります。バックグラウンド染色が観察された場合、抗体濃度を下げ、洗浄工程を増加させ、二次抗体にブロッキングバッファーを追加します。新鮮な組織の生存率は、商業用生存性染料で直接評価することができます(材料表を参照)。また、組織が生存後染色を固定し、それが実用的に適している場合に正常に画像化され得ることも示した(図1D)。
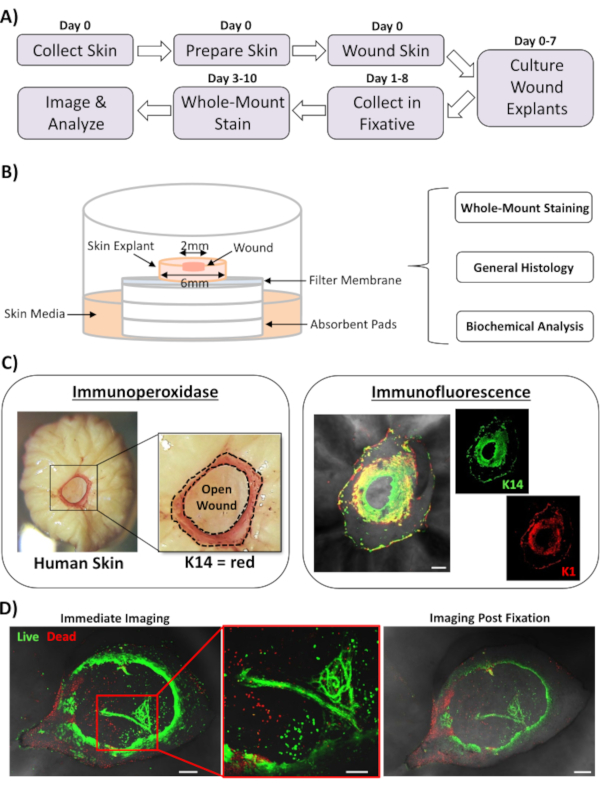
図1:ヒトのエキビボ創傷と全マウント染色アプローチ(A)皮膚の採取からエクスビボ創傷の実行から、組織の染色とデータの分析に関する手続きワークフローを描いたパイプライン。(B) ヒトのex vivo皮膚創傷培養システムを示す図を、組織上で日常的に行う分析を行う。(C)全実装染色法は、免疫ペルオキシダーゼおよび免疫蛍光技術の両方を用いて使用することができる。K14 = ケラチン 14.(D)生組織は、商業的生存性染料で染色され、正常に後固定後に画像化され得る。バー = 100 μm。この染色は、非糖尿病の皮膚で行った。この図の大きなバージョンを表示するには、ここをクリックしてください。
創傷の全体の取り付け染色に最も広く適用される用途は、組織学的切除を介して提供できるよりも再現可能な方法で創傷閉鎖率を決定することです。閉包率は、図2Aに示すように、創傷表面の再上皮化率として定量化された。特定のマーカーのパーセンテージ面積カバレッジは、全創傷領域から、または再上皮化創傷の割合として測定することができる。我々は、7日間の時間経過にわたって健康(非糖尿病)対糖尿病皮膚の治癒を特徴付け、創傷後の毎日で創傷を収集した(代表的な画像、図2B)。健康な皮膚創傷は予想通り時間の経過とともに閉じられ、4-5日目までにほとんどのサンプルで完全閉鎖が観察された。逆に、糖尿病の皮膚創傷は、7日間の分析期間内に完全に閉じることができませんでした(図2C)。各時点の傷害後の治癒率を比較すると、健康な皮膚創傷と糖尿病性皮膚創傷の間で創傷閉鎖の有意な遅延が観察された(P <0.001から6日目、P<6日目に0.05、P<0.05からP<0.001日目7日目)。
全体的な創傷閉鎖率の評価に続いて;K14陽性細胞を可視化できる創傷領域全体( 図2Aの外側領域)の割合を測定した( 図2Bの緑色染色)。興味深いことに、健康なex vivo皮膚創傷では、K14染色が2日目にピークを迎え、その後急速に減少したことを観察した(各時点での有意性と2日目のピーク、 図2D)。これは、分化された表皮層を介したK14抗体の浸透を除いた、初期の表皮バリアの再形成を反映している可能性が高い( 図2E 図表を参照)。再表皮化プロセス中、基底層(K14+ve)ケラチノサイトは、外側の創傷縁に近い表皮が内側の創傷縁に近い表皮よりも早く形成するように開いた創傷の上に内側に移動する(前部移動)。新たに形成された表皮の前縁が残りの開いた創傷を閉じるように移行し続ける一方で、外縁表皮は他の表皮層を改心するように区別し始める。早期治癒では、再表皮化領域のほとんどが基底(K14+ve)細胞で構成され、後の修復では表皮が外側の内側に分かれるにつれてK14染色が失われると予想されます( 図2Eの全マウント画像を参照)。したがって、 図2D に示すK14染色の減少(下向き矢印)は、表皮分化の増加と相関する。興味深いことに、目に見えるK14染色は、健康(2日目)対糖尿病(4日目)の創傷に対して早期にピークに達し、糖尿病性皮膚創傷において再上皮化とその後の表皮分化が遅れることをさらに実証した。
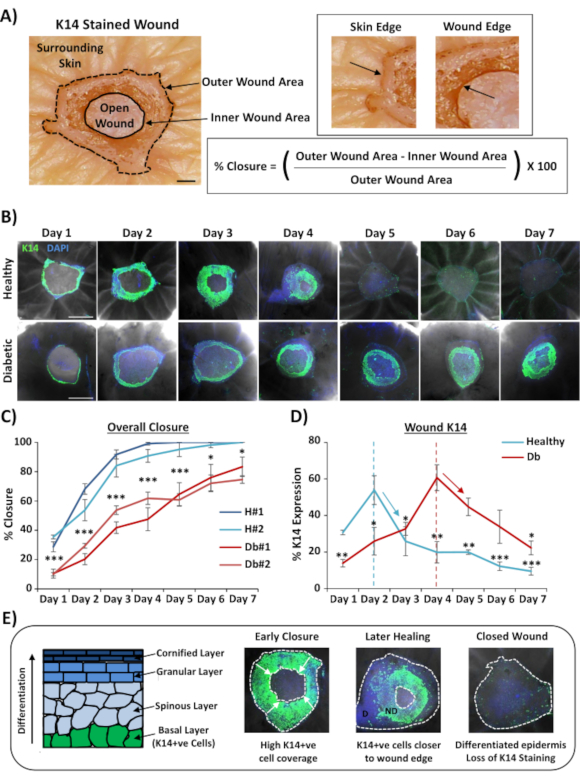
図2:全身取り付け染色は、糖尿病と健康な皮膚における摂動治癒率を明らかにする。 ブライトフィールド画像は、ケラチン14(K14)が赤で染色されている。Bar = 300 μm(B) 健康で糖尿病の皮膚における時間経過による治癒(日の創傷後)の代表的な画像。バー = 500 μm. K14 = 緑。DAPI = 青核。(C)創傷閉鎖率の定量化(再上皮化率)は、健康な皮膚からの元生体創傷が糖尿病皮膚からの元生体創傷よりも有意に速く近いことを示す。H = 正常です。Db = 糖尿病。(D) 健康な皮膚と糖尿病の皮膚で早くピークを染色し、表皮分化の増加(下向き矢印)に沿って減少する割合K14。(E)K14 (基底表皮細胞) 染色は、表皮が分化するにつれて失われる。D = 区別されます。ND = 区別されません。白い点線は、内側と外側の巻線を表します。白い矢印 = 移行方向。n = ドナーあたり6つの創傷、1ポイント当たり。平均 +/- SEM. * = P < 0.05、 ** = P < 0.01 および *** = P 0.001 <。Cの各治癒時点での健康および糖尿病性の比較(P値は最も有意でない比較のため)。Dの各ドナーのピークと比較してK14染色の時間変化.この図の大きなバージョンを表示するには、ここをクリックしてください。
次に、全マウント染色を用いて、非糖尿病皮膚における他の創傷関連マーカーの組織発現と局在化を調べる(図3)。使用されるすべての抗体とその作用濃度は、材料表に提供されています。開いた創傷の血管はα平滑筋アクチン(a-SMA)抗体で陽性に染色され、下力画像で表皮縁を線引するためにK14と組み合わせて使用される(図3A)。真皮マトリックスを、コラーゲンI型(COL1)およびフィブロネクチン(Fn)に対する抗体で染色した。ここでコラーゲンは、フィブロネクチン繊維がまばらで、波状で、薄い間に豊富な厚繊維として観察された(図3A)。当社の全マウント染色法は、K14陽性角化細胞に示されるように、染色の細胞レベルの分解能を提供することもできる(図3B)。
最後に、ヒトの元生体創傷は、3日目の創傷後に新たに形成された表皮の周りに検出されたランゲルハンス細胞を有する存在性免疫細胞を有することを示す(図3C)。実際、これらの結果は、全マウント染色が炎症、増殖、および細胞外マトリックスを含む治癒応答の主要な特徴を調査するために使用され得ることを示唆している(図4A)。まとめると、我々のデータは、組み合わされたex vivo皮膚創傷と全マウント染色手順が健康で糖尿病(病理学的)ヒト皮膚修復の様々な側面を評価するための有効な方法であることを明らかにした。
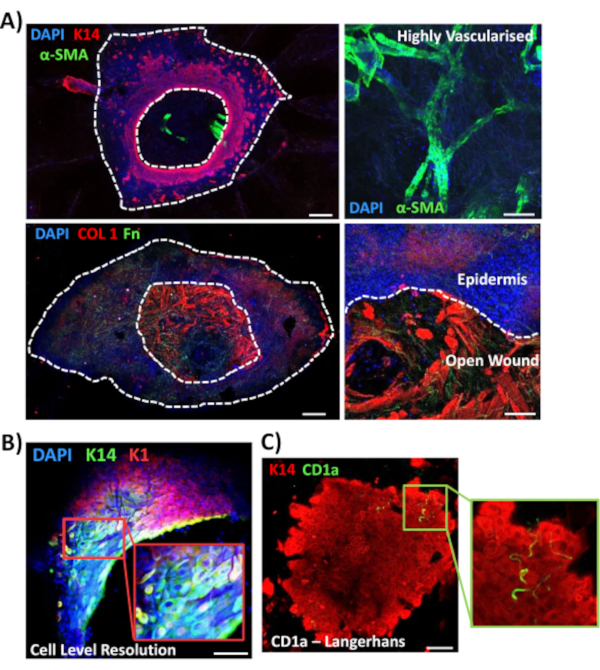
図3:他の抗体で使用するための全実装染色法の最適化(A)血管はアルファ平滑筋アクチン(α-SMA、緑色)とケラチン14(K14、赤)で染色され、マトリックス繊維はコラーゲンI(COL1、赤色)およびフィブロネクチン(Fn,緑色)で染色された。(B) 全マウント手順は、ローカリゼーションのセルレベルの分解能 (K14, 緑) まで提供します。K1、赤)。(C)CD1a+ve ランゲルハンス細胞(緑色)新たに形成された表皮で観察される。DAPI = 青核。バー = 100 μm。白い点線は、内側と外側の傷の縁と表皮から別々の創傷を示しています。この染色は、非糖尿病の皮膚で行った。この図の大きなバージョンを表示するには、ここをクリックしてください。
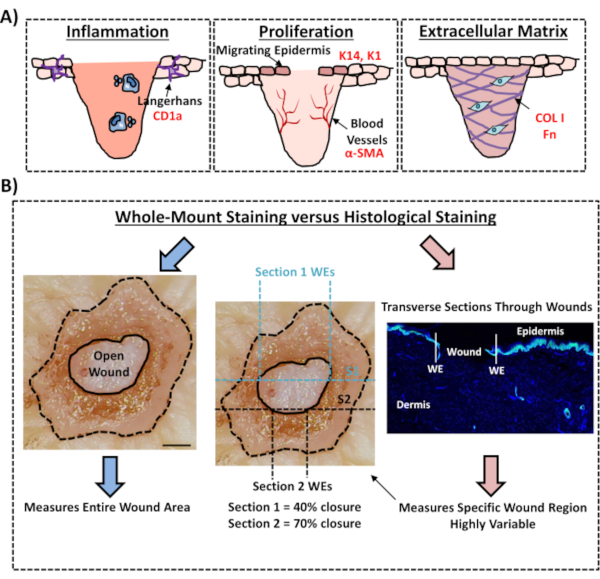
図4:創傷治癒を評価するための全マウント染色手順の妥当性(A)全体の取り付け染色技術が創傷関連のプロセスを評価する方法を示す図。使用される抗体 = 赤いテキスト。K14 = ケラチン 14.COL1=コラーゲン1。Fn = フィブロネクチン。(B)全マウント染色法(青矢印)は、標準的な組織学的分析(赤い矢印)よりも創傷閉鎖測定のばらつきが少ない。S1 = セクション 1。WE = 巻きエッジ。バー = 300 μm。この染色は、非糖尿病の皮膚で行った。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本実験プロトコルでは、全実装組織染色を用いてヒトex vivo皮膚における創傷閉鎖を評価するための最適化された方法について述べている。これは、潜在的な創傷治療の批判的評価を可能にし、ヒト創傷修復応答のより良い理解を提供するための重要な資源である。我々は、以前に12、13のex vivo皮膚創傷における治癒評価を発表しましたが、これらの報告書では、全マウント染色アプローチは創傷閉鎖を測定するために使用されませんでした。全体実装染色ははるかに簡単で、パラフィンやOCTのサンプルの埋め込みと切除を伴う標準的な占星術よりも技術的な経験が少なくて済みます。また、全体実装手順は実験のばらつきを低減し、組織内の定義された位置で単一の横断セクションだけでなく、創傷全体を定量化することができます(比較例については図4Bを参照)。我々は、マウス急性創傷14に対するRheaとDunnwaldによって明確に概説されているように、非対称創傷構造全体の治癒を定量化することの重要性を完全に支持する。これらの著者らは、創傷形態の再現性と正確な測定のために生体内切除創傷を連続的に切除することの重要性を示した。連続断面化は、ヒトのex vivo創傷にも同様に適用できます。しかし、創傷閉鎖と再上皮化を正確に定量するためには、高スループットの全マウント染色が好ましい方法であるべきである。我々は、この全マウント染色プロトコルは、従来の組織学的分析のための後続の処理(waxまたはOCT)とも互換性を持つべきであることに注意してください。
全体マウント染色は欠点がないわけではありません。創傷治癒実験でより高い再現性を与えるが、標準的な組織学的技術よりも分析のためのより多くの組織の使用を必要とする。これは、特に複数の抗体を評価する必要がある場合に、組織アクセスが制限される問題である可能性があります。別のアプローチは、創傷の幅が比較的均一で変動性が低下する切開創傷法を採用することであろう(マウスおよびヒト創傷15,16に示すように)。しかし、切除創傷は、ほとんどの病理学的創傷タイプ17に適用可能なままである。
本研究では、6mmの皮膚外植の中心内に2mmの部分的な厚さの創傷が作成された。この方法は、異なる皮膚深さ18で代替切除創傷および外植サイズに最適化され得る。さらに、創傷を発生させるために必要な力はドナーによって異なり、老化した皮膚は生検に対してより少ない力を必要とする。また、皮膚を使用して、目立つストレッチマークやその他の構造変更を表示しないようにします。我々は、ex vivo治癒応答の異なる側面を考慮するために、様々な抗体を検証した。このプロトコルは、抗体濃度およびインキュベーション時間を最適化する必要がある他の皮膚関連抗体と共に使用される場合もあります。それにもかかわらず、我々のプロトコルは、全創傷閉鎖の絶対的定量化に最も適していると考えており、その後、関心のある特定のタンパク質の空間的評価が行われる。全体実装は、組織切片の標準的な組織学的分析に対して免疫局在化の分解能を低減する一方で、標準の2D組織学に欠けている追加の3D情報を提供します。
ex vivo皮膚とin vivoモデルの治癒を評価する1つの注意点は、全身的な応答が欠けているということです。創傷修復の重要な側面は、炎症およびその後の組織造粒であり、血管系19からの炎症細胞および内皮細胞の流入によって引き起こされる。この制限にもかかわらず、ex vivo皮膚は、細胞ベースの創傷アッセイよりも臨床的治癒のより良い要約を提供する。一般に、インビトロ実験では、単一細胞型の単層または組織培養プラスチック上で増殖した共培養が含まれ、一方、ex vivo skinは細胞の挙動を探索するネイティブ環境を提供する。最近では、多くの皮膚等価系が出現し、人工マトリックスおよび単離された皮膚細胞20,21から実験室で皮膚が成長する。これらのモデルは、ほとんどのインビトロアプローチよりも人間の皮膚を模倣するが、彼らはまだ完全にネイティブ組織環境をシミュレートしていないし、一般的に再現性を傷つけるには壊れやすい。さらに、我々(および他)は、ex vivoヒト皮膚組織が存在する免疫細胞を保持することを実証しており、これは間違いなく22,23の修復に寄与するであろう。今後の作業は、後期治癒評価24のためのex vivoモデルの生存率と免疫能力の拡張に焦点を当てるべきである。1つの選択肢は、組織の生存率を延長し、培養25で最大2週間のネイティブ皮膚アーキテクチャを維持することができる有望な臓器オンチップ技術のさらなる進歩である。Ex vivoモデルはまた、好中球などの免疫細胞を宿主組織26に組み込むことや、宿主組織に免疫反応27を惹起する抗体を注入することで、皮膚炎症反応の重要性を考慮し始めている。これらの知見は、将来的にはより洗練された翻訳可能な方法の開発への道を開くことを期待しています。
創傷閉鎖を測定するためにex vivo皮膚を使用することの大きな利点は、健康(例えば、非糖尿病)と病理学的(例えば、糖尿病または老化)組織における治癒率を比較する能力である。ここでは、再表皮化とバリア形成が糖尿病と健康なex vivo創傷で実際に損なわれることを示した。実際、これは、老化および糖尿病が慢性創傷を発症するための主要な危険因子である病理学的修復の前臨床評価のための経路を提供する1.体外病理モデルは、老化および糖尿病組織から分離された細胞、または高血糖症28,29を模倣するために高グルコースで培養された細胞など存在するが、これらの細胞は生体内微小環境から除去されると、すぐにその表現型を失うことがある。外因性病理学的治癒環境の重要な構成要素は、老化および糖尿病30の両方で変化する真皮マトリックスである。実際、この摂動マトリックスは、居住者およびナイーブ線維芽細胞31、32の行動に影響を与える。したがって、宿主組織環境における細胞の研究の重要性を過小評価することはできません。
要約すると、我々のプロトコルは、ヒト創傷再上皮化を定量化し、調節因子を探索し、潜在的な治療の有効性および有効性を試験するための重要なプラットフォームを提供する12,13。前臨床試験はまだインビボアプローチを必要としますが、ex vivoヒト組織とインビボマウス創傷を使用した組み合わせ戦略は、動物の使用を改善しながら、種間の翻訳可能性を高めながら、前臨床経路を改善する必要があります。
開示事項
著者らは利益相反を宣言しない。
謝辞
パオロ・マッテウチ氏とジョージ・スミス氏が患者組織を提供してくれたことに感謝します。また、アンバー・ローズ・スタッフォードさんが組織収集を支援し、ラボ施設を提供してくれたデイジー・アピールにも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
参考文献
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved