このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
液滴界面二層の温度制御アセンブリと特性
要約
このプロトコルは、溶融温度の上昇を伴う脂質の脂質単層アセンブリおよび液滴界面二重層形成を促進するためのフィードバック温度制御加熱システムの使用、および膜の温度駆動変化を特徴付ける容量測定の詳細を示す。
要約
油中の脂質被覆水滴間で脂質二重層(すなわち、DIB)を組み立てる液滴界二重層(DIB)法は、他の方法に対して重要な利点を提供する:DIBは安定しており、しばしば長持ちし、二重層領域は可逆的に調整することができ、リーフレット非対称性は液滴組成物を介して容易に制御され、二重層の組織状ネットワークは、多くの滴を介して容易に制御され、二重層の組織状ネットワークは、多くの滴によって得ることができる。DIBを形成するには、液滴の表面で高密度脂質単層に脂質を自発的に集める必要があります。これは一般的な合成脂質の室温で容易に起こるが、十分な単層または安定な二重層は、いくつかの細胞脂質抽出物を含む室温以上の融点を有する脂質に対して同様の条件で形成できない。この動作は、モデル膜研究におけるDIBの組成(おそらく生物学的関連性)を制限している可能性があります。この問題に対処するために、DIB液滴をホストする油溜層を慎重に加熱し、脂質膜に対する温度の影響を特徴付ける実験プロトコルが提示される。具体的には、このプロトコルは、熱伝導性のアルミニウムフィクスチャと、フィードバックループによって制御される抵抗加熱要素を使用して、より広い脂質タイプの単層アセンブリおよび二層形成を改善する高温を規定する方法を示す。膜の構造的特性は、二重層を含む脂質の熱的な相転移と同様に、DIBの電気容量の変化を測定することによって定量される。この手順を組み合わせることで、多成分脂質混合物の有効な融解温度(TM)の決定を含む、様々な温度にわたってモデル膜の生物物理学的現象を評価するのに役立ちます。この機能は、モデル膜における自然相転移のより緊密な複製を可能にし、細胞の異質性をより良く捕捉するものも含め、より広い範囲の膜構成体からのモデル膜の形成と使用を促進する。
概要
細胞膜は、何千もの脂質タイプ1、タンパク質、炭水化物、ステロールから構成され、すべての生きた細胞をカプセル化して細分化する選択的透過性バリアです。その組成がそれらの機能にどのような影響を与えるかを理解し、自然分子と合成分子が細胞膜とどのように相互作用し、接着し、破壊し、トランスポジションするかを明らかにすることは、生物学、医学、化学、物理学、材料工学において広範囲に及ぶ影響を持つ重要な研究分野です。
これらの発見は、合成脂質または天然脂質から組み立てられた脂質二重層を含むモデル膜を組み立て、操作、および研究するための実証済みの技術から直接利益を得ることを目的としています。近年、油脂中の脂質被覆水滴間に平坦な脂質二重層を構築するための液滴界面二重層(DIB)法2、3、4は、5、6、7、8、9、11、1に大きな注目を集めている2,13,14,15,16,17,18,19,20,21,22,23,およびモデル膜形成のための他のアプローチよりも実用的な利点を示している:DIB法は、実行が簡単である、 洗練された製造や準備を必要としない(例えば、 膜を支える基質の「絵画」)は、一貫して優れた膜を生み出す長寿は、標準的な電気生理学的測定を可能にし、非対称リーフレット組成物3を有するモデル膜の形成を簡素化する。二重層は液滴と各液滴の間に自発的に形成されるため、位置と化粧で調整することができます。 DIB技術は、刺激応答性膜18、24、25、26、27、28、28、バランスのとれた区画化および輸送14、30、31、および組織状材料17、23、32、33、34、35、36を使用して構築する細胞に触発された材料システムの開発にも大きな関心を集めています。
モデル膜に関する公開実験の大半は、DIBを含め、室温(RT、〜20~25°C)および一握りの合成脂質(例えば、DOPC、DPhPCなど)で行われている。この実習では、モデル膜で研究できる生体物理学的な質問の範囲が制限され、観察に基づいて、DIBを組み立てるために使用できる脂質の種類も制限できます。例えば、42°Cの融解温度を有するDPPCのような合成脂質は、密に詰まった単層を組み立てないか、またはRT37でDDBを形成する。室温でのDIB形成は、哺乳類(例えば、脳総脂質抽出物、BTLE)38または細菌(例えば、大腸菌全脂質抽出物、ETLE)37などから生じる天然抽出物に対しても困難であることが証明されている。多様な組成物の研究を可能にすることで、生物学的に関連する条件で膜介在プロセスを理解する機会を提供します。
油の温度を上げることは2つの目的を果たすことができます:それは単層アセンブリの運動学を増加させ、脂質が液体乱れた相に達するために溶融遷移を受ける可能性があります。両方の結果は、単層アセンブリ39、DIBの前提条件を助ける。二重層形成のための加熱に加えて、形成後の膜を冷却して、カロリー測定を用いて検出が困難な天然脂質混合物(例えば、BTLE)内のものを含む単一脂質二重層38における熱的な遷移を同定するために使用することができる。脂質の熱的な遷移を評価する以外に、DIBの温度を正確に変化させることで、膜構造38 の温度誘発変化を研究し、脂質組成および流動性が膜活性種(例えば、気孔形成ペプチドおよび膜貫通タンパク質37)に与える影響を調べることができます。
本明細書において、改変されたDIB油貯留層を組み立て、RTよりも高い温度で単層アセンブリおよび二層形成を可能にするフィードバック温度コントローラを動作させる方法の説明が説明される。以前のプロトコル40とは区別して、オイル貯蔵所のDIBのアセンブリおよび特性評価に平行して温度を測定し、制御するために必要な器械使用の統合に関して明記された詳細が含まれている。したがって、この手順により、ユーザーはさまざまな科学的文脈で温度範囲にわたってDiIbを形成し、研究するためにこの方法を適用することができます。さらに、代表的な結果は、温度が変化するにつれて起こり得る膜構造およびイオン輸送の両方における測定可能な変化の種類についての具体的な例を提供する。これらの技術は、異なる膜組成における膜活性種の運動学の研究を含む、DIBで効果的に設計および実施することができる多くの生物物理学的研究に重要な追加である。
プロトコル
1. 加熱された器具の準備
- 幅と長さで25mm x 40mmにトリミングされた厚さ1mmの絶縁ゴム2個、25mm x 40mmの厚さ6mmのゴム2個、準備されたアルミニウムベースフィクスチャアセンブリ、アルミニウムベースフィクスチャの表示窓に収まるアクリルオイルリザーバー( 図S1、S2、およびS3 を収集して、製作と分解した組み立て図の詳細を参照)。最初に、UV硬化性接着剤でガラスカバースリップ表示窓をフィクスチャの底部に取り付け、フィクスチャの各25 mm x 25 mmサイドフランジの上部に1つの抵抗発熱体を付着させることで、アルミニウムフィクスチャを準備します。
- 細いゴム片を顕微鏡のステージに置き、各片の長いエッジがステージ開口部に接線になるように(図1)。
- アルミベースのフィクスチャを、対物レンズの上に中央に配置したフィクスチャの表示ウィンドウを使用して、絶縁パッドの上に配置します。接続された液滴を撮像するには、適切なアライメントが必要です。
- 各抵抗発熱体の上に厚いゴム片を置き、顕微鏡ステージクリップを使用して所定の位置に保持します。これらの部分は、ステージクリップによって引き起こされる損傷から発熱体を保護し、発熱体とアルミニウム器具と顕微鏡ステージの両方の間の偶発的な電気ショートに対して絶縁します。
- 熱電対の測定端を慎重に曲げて、終わりから~4mmで90°の角度を達成します。
- 熱電対の曲がった先端をアルミニウム製の器具の左下隅に挿入し、ロックねじで静かに固定します。
- アクリル貯留層をアルミニウム製の器具の井戸に入れる。これは、アルミニウム器具のウェル(ステップ1.8)に六方体油を添加する前に行われ、視聴窓とアクリル貯留層の底部との間の気泡をトラップするリスクを最小限に抑え、液滴の視界を妨げる可能性があります。
注:アルミニウム器具の表示室に添加されたオイルは、アクリルのリザーバ内に含まれる液滴のより鮮明な画像化のためにアクリルとガラスの屈折率を一致させるために使用されます。したがって、アルミニウム製のフィクスチャのウェル内の油はアクリル貯留層の内容物に接触せず、アルミニウム製の器具の厳密な洗浄は必要とされないことに注目する価値がある。 - アルミニウム製の器具(アクリル貯留層とアルミニウム製の固定具の壁の間)のウェルにヘキサデカンオイルの約1,000 μLを分配し、過剰充填しないように注意してください。アルミニウム器具のウェル内の油レベルは、熱伝達のための表面積を最大化するために許容される限り高くする必要があり、一方で、油は顕微鏡の段階または対物レンズに器具の端にこぼれないようにする。
- ヘキサデカンオイルの約1,000 μLをアクリル貯蔵所に分配し、オーバーフィルしないように注意してください。
注:アクリル貯留層は、実験の間に常に徹底的に清掃する必要があります。ユーザーは、エチルアルコールと脱イオン水を伴う連続したリンスからなる連隊を採用し、その後12時間以上乾燥器ボウルで乾燥する必要があります。

図1:加熱ステージアセンブリ 画像は、DIB形成のための熱伝導フィクスチャおよびオイルリザーバのアセンブリを示しています。各イメージの下の数字は、プロトコルの対応するステップを識別します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. DIBの同時フィードバック温度制御と電気特性評価のための計測
注:このプロトコルは、DIBのフィードバック温度制御と同時電気特性を可能にするための次の機器を統合します:2つの利用可能なユニバーサルシリアルバス(USB)接続を備えたパーソナルコンピュータ(PC)、専用データ集録(DAQ-1)システムにペアリングされたパッチクランプアンプ、波形発生器、電圧出力と温度入力モジュールを備えた2番目のプログラム可能なDAQ(DAQ-2)、電源/アンプ。以下の手順では、DIBの同時電気生理学から温度の測定と制御を分離するために必要なこれらの機器の必要な接続( 図2aに示すように)について説明します。同等の機器の置換は必要に応じて行われる場合があります。
- DAQ-2モジュールへの出力および入力接続を確立します。
- 差動電圧接続用の電圧出力モジュールのネジ端子を 2 組選択し、これらの位置にワイヤを接続します。奇数端子は共通のグラウンド接続であり、偶数端子は(図2c)に示すように、非丸め出力です。これらの2つのリード・ワイヤのペアをそれぞれ別のスクリュー・ターミナルBNCアダプターに接続し、電圧信号を他の機器にルーティングするために使用される別のBNCケーブルに各アダプターを接続します。
注: この設定では、端子 0 と 1 の差動接続が電力増幅器への温度制御出力に割り当てられ、端子 6 と 7 の別の接続ペアがパッチ クランプ アンプを介してドロップレットに送られる電圧出力用に指定されています。 - (図2c)を参照して、熱電対入力モジュール上の熱電対端子のセット(例えば、端子2と3はTC1対として指定されている)を選択し、その熱電対線を接続します。
- 差動電圧接続用の電圧出力モジュールのネジ端子を 2 組選択し、これらの位置にワイヤを接続します。奇数端子は共通のグラウンド接続であり、偶数端子は(図2c)に示すように、非丸め出力です。これらの2つのリード・ワイヤのペアをそれぞれ別のスクリュー・ターミナルBNCアダプターに接続し、電圧信号を他の機器にルーティングするために使用される別のBNCケーブルに各アダプターを接続します。
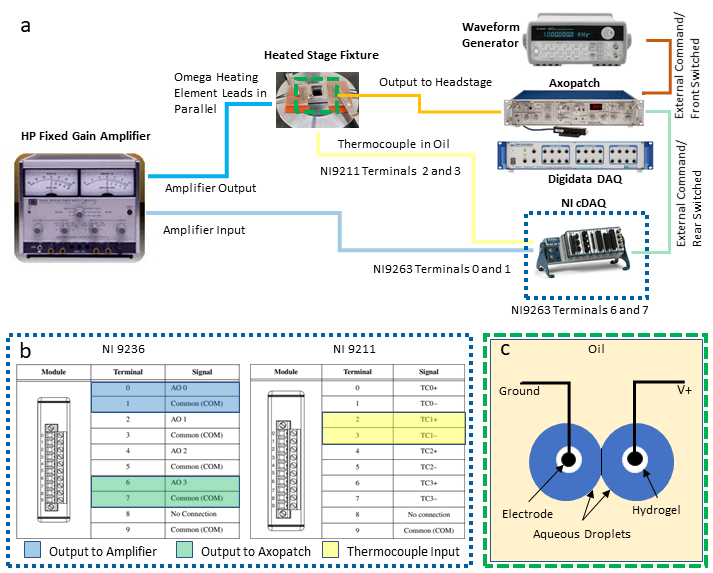
図2:システム配線接続 システムに必要なデバイスと配線の概略を(a)に示し、DAQ-2 接続の詳細は(b)で示されています。(c)の図は、DIB形成のために油に沈められたヒドロゲル被覆電極上の水性液滴を示している。2つの電極は、パッチクランプアンプのヘッドステージユニット上で、それぞれ接地された(V+)接続に接続されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- DAQ-2モジュールへの電気接続ができたら、USB接続でDAQ-2シャーシをPCに接続し、電源に接続します。次に、商用ソフトウェアで使用する前に、ドライバとソフトウェアのインストールが成功したことを確認します。
- DAQ-2と抵抗発熱体の間でパワーアンプを構成し、接続します。
- ゲインが10倍の固定ゲイン増幅モードで動作するようにアンプを設定します。
- バナナジャック-BNCアダプタを使用して、電圧出力モジュール(図2b)の端子0と1から発生するBNCケーブルをパワーアンプの入力接続に接続します。
- 追加のBNCアダプタとケーブルを使用して、パワーアンプの出力端子を、相互に平行に配線された両方の発熱体と、使用中に両方の要素が同じ電圧降下を維持するようにアンプに接続します。
- 電気生理機器に必要な接続を確立します。
- 電圧出力モジュール(図2b)の端子6と7から発生するBNCケーブルを、パッチクランプアンプ背面の背面交換外部コマンドBNCコネクタに接続します。
- パッチクランプアンプの背面にある、波形発生器の出力とフロントスイッチ外部コマンド接続の間に2本目のBNCケーブルを接続します。
注:これら2つの接続は、パッチクランプアンプを介して液滴電極に適用される電圧波形を生成するための代替方法を提供します。波形発生器は、膜容量を測定するために使用される三角波形電圧を生成するのに特に有用です。ユーザーは、どちらかの場合、自分のアプリケーションに必要などちらが必要かを決定できます。 - 3本目のBNCケーブルを使用して、パッチクランプアンプの前面パネルにある測定電流の出力を、DAQ-1前面の利用可能なアナログ入力BNCコネクタに接続します。
- 4本目のBNCケーブルを使用して、測定された膜電圧(パッチクランプアンプの背面)の出力をDAQ-1の別のアナログ入力コネクタに接続します。これにより、電極全体に印加される電圧のデジタル化が可能になります。
- ref.40のステップ7-9で説明されているように、2つの液滴電極を準備し、マイクロマニピュレータでサポートすると、電極をパッチクランプヘッドステージに接続します。
注:ヘッドステージの役割は、電極間の電圧を制御し、得られた電流を測定し、パッチクランプアンプによって出力される比例電圧をDAQ-1に変換することです。 - USB接続でDAQ-1をPCに接続し、対応する電源ケーブルをパッチクランプアンプとDAQ-1の両方に接続します。
- すべての測定機器の電源をオンにします。
注: このセットアップで最も重要な詳細は、パワーアンプ出力(mA-A)接続がパッチクランプアンプのヘッドステージユニットから電気的に絶縁されるようにすることです。
3. 液滴界面二重層のフィードバック温度制御
注: フィードバック温度制御システムを操作するための以下の手順は、比例積分 (PI) フィードバック温度制御40,41を実装するために作成されたカスタムグラフィカルユーザーインタフェース(GUI)に基づいています(補足コーディングファイルを参照)。その他のソフトウェアおよび制御アルゴリズムを代わりに使用することができます。このプログラムのコピーは、読者に紙の補足情報を提供しますが、ユーザーは自分の機器やニーズに合わせて設定する責任があります。
- PCでDAQ-2ソフトウェアを起動し、温度管理プログラムファイルを開きます。GUI が開いたら、GUI の左下隅にあるフォルダアイコンをクリックし、温度制御プログラムを選択してプログラムを再度開きます (図 3)。
- 比例制御ゲイン(KP)と積分制御ゲイン (KI) に適切な数値を入力します。
注: KP と KI の値は 0.598 と 0.00445 で、セットアップで適切に動作することが判明しました。これらの値は、測定されたオープンループ加熱応答から得られたパラメータを組み込んだシステムモデルを用いたシミュレーションを通じて反復的に決定された( 図4参照)。 オープンループ加熱時には、所定の加熱電力は測定温度とは無関係です。対照的に、 クローズドループ加熱 は、測定温度を所望の温度に近づけるようにヒーターに適用される電力を継続的に調整することで構成されています。これは、PI制御スキームを用いてここで達成される。 - 温度制御スキームをテストするには、希望の設定点温度(室温以上)を入力し、GUI内でフィードバック温度制御をオンにします。フィードバック(閉ループ)制御下の測定された温度信号を、GUIに数分間表示します。測定された油の温度が目的の温度を大きくオーバーシュートしたり、変化に反応しすぎる場合、または目的の設定点に収束しない場合、ユーザは制御ゲインを調整して、所望の閉ループ性能を達成する必要があります。
注:プログラムは、抵抗発熱体に供給される電力(したがって電圧)の飽和限界を定義します。例えば、ここに報告された2つの要素は、それぞれ最大5Wの電力を消費する。これらを並列に配線すると、総消費電力が10Wを超えないようにします。ユーザーは、デバイスに供給する必要がある電力の最大量を考慮し、この制限がクローズドループシステムが望ましい温度変化に応答する速度に影響を与える可能性があることを知ることをお勧めします。高い電力加熱要素は、より速い加熱と高い設定点温度を可能にしますが、加熱のために高い供給電流を必要とします。 - システムが許容可能な閉ループ性能に調整された状態で、DIB形成に必要な油温をGUIのセットポイントとして入力します。
注:例えば、60°Cの設定点温度は、水滴37中のBTLEリポソームを用いた実験で良好な結果をもたらした。このユーザは、ワイヤ型電極に掛かる液滴と、パッチクランプアンプ、DAQ-1、および電気生理学測定ソフトウェアを用いた電気生理学的機器の構成との間のDIBアセンブリを説明するプロトコルについて、他の2,40と呼ばれています。具体的には、Najem、ら40によるプロトコルは、ステップ13まで密接に従うことができる。そのステップを超えて、単層または二層形成を促進するために加熱を必要とする脂質を使用する場合、わずかに異なるアプローチが単層および二層形成を成功させるために採用される。 - アクリル貯留層の底に近くなるまで、銀/塩化銀(Ag/AgCl)電極の先端を油に下げます。この電極先端の位置決めは、油中の対流電流がヒドロゲル被覆電極から液滴を取り外すのが観察されている加熱された油中の電極上の液滴を保つために極めて重要である(図2c)。
- 2mg/mLのBTLE、100 mM塩化カリウム(KCl)、10mM 3-(Nモルフォリノ)プロパンスルホン酸(MOPS)を各電極先端に含む水性脂質溶液250nL液滴を各電極先端にインキュベートし、加熱された油中に最低10分間インキュベートさせ、単層形成を促進する。
- ヘッドステージと加熱されたステージフィクスチャを接地したファラデーケージで覆います。
- ゆっくりと液滴を穏やかな接触に持ち込む
電極の水平位置を操作して、ユーザーが接触から液滴が変形するのを見るか、または互いに変位し始め、二重層形成が始まるまで数分待つ。数分後に二重層が形成されない場合、液滴を二重層形成を容易にするためにより一緒に強制することができる。薄くなった界面二重層の形成は、目視検査(図5a)、または10mV、10Hz三角電圧22を出力する波形発生器によって誘導される方形波容量電流の振幅の増加を測定することによって確認することができる。二重層が、初期形成時および初期設定点での後続の特性評価の前に、安定した界面領域に到達するまで、最低10分間平衡化を可能にする。
注:油の種類は、二層間薄化、膜の厚さ、および液滴間接触角度に大きな影響を与える可能性があります。一般に、油分子が小さいほど、脂質アシル鎖によって占める二重層の疎水性コアに留まることが容易である。油保持は、単層と二層の緊張と厚さの両方を増加させ、液滴間の接触の領域と角度を減少させます。これらのメトリックは、接着の弱い状態を意味します。より大きく、よりかさばる分子は逆の効果を発揮する。例えば、スクアレンはヘキサデカンなどのアルカンよりもかさばる分子であり、二重層間の間から容易に排除することを可能にする。このように、スクアレンで形成されたDIBは薄く、接触領域および角度が高く表示され、形成22、42(液滴と滴下接着の尺度)のより高い自由エネルギーを示す。
4. DIBにおける温度依存の挙動の特性
注: DIB ベースのモデル膜では、温度の変化が膜の構造や輸送特性にどのような影響を与えるかなど、多くの物理プロセスを研究できます。以下のステップは、望ましい温度で二重層形成が成功した後に実行されるべきである。
- 膜38中の脂質の熱的な相転移を同定するために二層形成を可能にする設定点から油浴の温度を下げながら、膜の公称容量を測定する。
- GUI の 温度グラフ を右クリックし、表示されたデータをクリアします。これにより、バッファ内の十分な領域が後続の記録に使用できるようになります。
- パッチクランプアンプに接続された波形発生器を使用して、DIB電極に三角電圧波形(例えば、10mV、10Hz)を適用し、二重層を介して誘導電流応答を記録します。
- 設定点温度を5°C刻みで下げ、望ましい温度が達成されるまで温度変化の間の新しい定常状態温度で最低5分待って二重層を冷却します。あるいは、フィードバック制御システムをオフにして二重層を受動的に冷却してみてください。ただし、50~60°Cの受動冷却を実施する実験は、より高い合体率をもたらしたことに注意してください。
- オイルバスと二重層が希望する最低温度まで冷却した後、GUIの温度グラフをもう一度右クリックし、温度データ対時間をスプレッドシートソフトウェアにエクスポートします。現在の記録を停止します。
- 測定電流から、冷却期間中の時間に対する方形波電流応答の公称静電容量を計算します。
- 公称キャパシタンス(C)対温度(T)をプロットして、膜容量がどのように変化したかを観察します。 C と T の非単調な変化を見つけて、 TMを識別します。
注意:公称キャパシタンスは、矩形波電流43(|の振幅から計算することができます。I|)リレーションシップ |の使用私|= C dv/dt、ここで、dv/dt は電圧振幅の4倍の積(|V|)適用された三角電圧の周波数(f)を有する。これらの方程式から、C = |I|/(4|V|f)
- 同様に、オイルバスと二重層領域の温度を連続的に増加させることにより、二重層の準静的特定容量(Cm)を一定温度で評価する。
- GUIを使用して設定点温度を10°C単位で変更し、システムが新しい温度に平衡化できるようにします。
- ステップ 4.1.2 を実行して、容量電流と記録の測定を開始します。
- マイクロマニピュレータを用いて電極の位置を慎重に調整することで二重層面積を変化させる(すなわち、電極を分離すると、二重層面積が減少する)。正方形波電流が定常状態に達し、DIBの画像を収集して、顕微鏡に取り付けられたカメラを使用して顕微鏡ステージの開口から見た二重層を画像化することで、膜面積対時間の計算を可能にします。同時に、現在の記録ソフトウェアにデジタルタグを追加して、画像コレクションの対応するタイムポイントをマークします。
メモ:マイクロマニピュレータは電極の精密な制御を可能にし、液滴間の穏やかな接触を可能にする。液滴の粗い操作は、液滴の合体によって、または電極から滴が落ちるようにすることによって失敗した実験につながることができます。他の22で説明したように、二重層領域は、下側図画像で重なり合う円として現れる液滴間の接触長さから計算される。液滴の位置と寸法、および接触線の長さは、画像処理ソフトウェアまたは他の科学プログラミングツールを使用して計算することができる。 - ステップ 4.2.1.2 を最低 4 回繰り返して、合計 5 つの DIB 画像と二層電流の定常領域を取得します。
- 希望する各温度でステップ 4.2.1 を繰り返します。
- 取得した画像の定常二重層領域に対応するタグ付きタイムポイントで、現在の記録とDIB画像を分析して、各温度の C および A データを抽出します。
- 各温度のプロットC対Aデータを計算し、各温度22における二重層のCmを表す第1次回帰の傾きを計算する。
- ステップ 4.2.4 とTから得られた Cmのプロット値。
- C m対Tデータで非単調な変動を調べて、融解温度TMを特定します。
- GUIを使用して設定点温度を10°C単位で変更し、システムが新しい温度に平衡化できるようにします。
- 二重層全体でDC電圧ステップ入力を生成することにより、電圧依存性イオンチャネル形成のダイナミクスを評価します。
- 初期電圧を希望のステップ値(例:100 mV)に設定します。
- [最終電圧]と[ステップサイズ]を希望のステップより高い値(例えば、110 mVの最終電圧および110 mVステップサイズ)に設定します。
- ステップ入力の所望の持続時間を秒単位(例えば90秒)で設定します。
- ステップ入力に必要な極性(例えば、正数)を選択します。
- パッチクランプアンプをスイッチして、GUI/電圧出力モジュールから発生するコマンド電圧をヘッドステージに送ります。
- 現在の録画を開始します。
- 電圧をオンにして、誘導電流応答を記録し、臨界電圧に対するS字型応答を示す必要があります(例えば、2 mg/mL BTLEで1μg/mL Mzの場合は〜70mV)。
- これとは別に、膜の動的電流電圧関係を所望の温度で得て、イオンチャネルの挙動などの電圧依存関係を明らかにすることができます。
- パッチクランプアンプを切り替えて、波形発生器から発生するコマンド電圧をヘッドステージに送り、電流記録を開始します。
- 波形発生器で、希望の振幅、オフセット、周波数を持つ連続正弦波波形を出力します。
- 1つまたは複数のサイクルにわたって誘導電流応答を記録します。
- 異なる正波振幅、周波数、温度に対して、必要に応じて繰り返します。
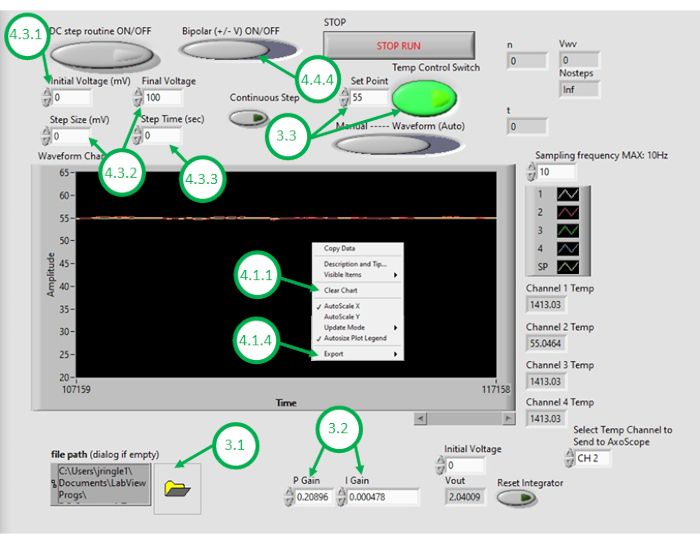
図3: 温度制御GUI この図は、オイルバスの温度を制御するためにプログラムのGUIを使用するために必要な重要なステップを強調し、ラベル付けします。 この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
図1は、DIB形成用の顕微鏡ステージ上でアルミニウム製の器具およびアクリルオイル貯留層がどのように調製されているかを示しています。組み立てステップ1.2-1.4は、より効率的な加熱のために、ステージからフィクスチャを熱絶縁するのに役立ちます。ステップ1.5-1.7は、熱電対をフィクスチャに適切に取り付け、オイル貯蔵所を配置する方法を示し、ステップ1.8 -1.9?...
ディスカッション
本明細書に記載されているプロトコルは、Dibを形成するために使用される油および液滴の温度を制御する実験システムを組み立て、操作するための指示を提供する。RT以上の融解温度を有する脂質を用いてDIB形成を可能にする上で特に有益である。さらに、油溜めの温度を正確に変化させることにより、二層温度を操作して、容量、面積、厚さ、熱伝導相変化、膜活性種の運動論、および二?...
開示事項
著者は利害の対立を持っていません。
謝辞
国立科学財団グラントCBET-1752197と空軍科学研究研究グラントFA9550-19-1-0213によって財政的支援が提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
参考文献
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved