このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ウッシングチャンバー技術による在来組織における腸タイトジャンクションバリアとイオン透過性の機能評価
要約
腸上皮は、栄養素の吸収だけでなく、有害物質に対する保護も与えます。頂端 - 最上皮細胞間接合部、すなわちタイトジャンクションは、傍細胞溶質およびイオン透過性を調節する。ここでは、粘膜シートの調製およびUssingチャンバー技術を用いたタイトジャンクションのイオン選択性の評価のためのプロトコルが記載されている。
要約
ウッシングチャンバー技術は、カエルの皮膚を横切るナトリウムの細胞間輸送を研究するために、1951年にデンマークの科学者Hans Ussingによって最初に発明されました。それ以来、この技術は、膜を横切る輸送の生理学的パラメータを研究するために、多くの異なる組織に適用されてきた。Ussingチャンバー法は、天然組織を使用できるため、他の方法よりも好ましく、 生体内で起こっていることにより適用可能である。しかし、天然組織が使用されるため、スループットが低く、時間が限られ、組織調製にはスキルとトレーニングが必要です。これらのチャンバーは、様々な組織における特定のトランスポータータンパク質の研究、嚢胞性線維症などの疾患病態生理学の理解、薬物輸送および取り込みの研究、および腸内の栄養輸送の理解に特に貢献するために使用されてきた。組織の上皮輸送プロセス全体を考えると、経上皮経路だけでなく、傍細胞経路も重要である。タイトジャンクションは、腸を横切る組織特異的な傍細胞透過性の重要な決定因子である。この記事では、Ussingチャンバー技術を使用して、経上皮コンダクタンスと希釈電位を測定することによってイオンの傍細胞透過性を評価します。
概要
ウッシングチャンバー法は、デンマークの科学者ハンス・ウッシングによって最初に開発されました。Ussingは、NaClが急峻な濃度勾配に対して皮膚を横切って輸送できることが観察された後、カエルの皮膚を横切るナトリウム輸送の短絡電流を測定するために最初にそれを使用した1。彼のシステムは、皮膚の両側にアクセスできる2つの部屋の間に取り付けられたカエルの皮膚で構成されていました。各チャンバーにはリンゲルの溶液が含まれており、それらは循環され、曝気された。皮膚の近くに位置し、飽和KCl-カロメル電極に接続された2つの狭い寒天リンガーブリッジは、ポテンショネータによって読み取られた電位差を測定した。第2の対の寒天リンガーブリッジは、AgClで飽和した飽和KClを有するビーカーに接続された各チャンバの反対側の端に位置し、電池によって提供される起電力を印加した。電位分配器を使用して電圧を調整し、皮膚両端の電位差がゼロのままになるようにし、短絡状態を作り出しました。マイクロアンペアメーターも接続され、皮膚を通過する電流を読み取ることができました(元のチャンバー設計については、参考文献1 の図を参照)。
過去70年以上にわたり、この技術は、栄養素およびイオン輸送を研究するために、多くの異なる組織、特に腸組織に適用されてきた。例えば、これらのチャンバーにウサギ回腸を装着することにより、コレラ誘発性下痢のメカニズムを調べたところ、コレラ毒素誘発性下痢がcAMP2によって媒介されることが分かりました。さらに、これらのチャンバーは、Na+グルコース共輸送体1(SGLT1)3を介したグルコース輸送の根底にあるメカニズムを研究するためにも使用された。私たちの研究室では、腸上皮細胞における細胞間および傍細胞輸送に焦点を当てています。Ussingチャンバー法を用いて、ペプチド輸送を、傍細胞ナトリウム輸送を障害したクローディン15ノックアウトマウスにおいて評価し、ウッシングチャンバーを用いて、非加水分解性ジペプチドグリシルサルコシンの吸収を測定した。管腔内Na+ 恒常性がプロトン結合ペプチド輸送に重要であることが判明した4。加えて、これらのチャンバーは、セリンプロテアーゼトリプシン5によるプロテイナーゼ活性化受容体1の粘膜下活性化に応答したマウス盲腸における陰イオン分泌を調べるためにも使用された。
ウッシングチャンバーは、最近、上皮組織における傍細胞経路を評価するためにも使用されている。傍細胞経路は、2つ以上の細胞が出会う時点で形成されるタンパク質の複合体であるタイトジャンクションによって調節される6。バリア機能およびイオン選択性(アニオンまたはカチオンがタイトジャンクションを選択的に通過できるかどうか)は、クローディンファミリータンパク質の存在によって決定される。そのうちのいくつかは、障壁(クローディン3および7)、アニオン細孔(クローディン10a)、またはカチオン細孔(クローディン2、10b、および15)7として作用する。血漿FITC濃度8、またはEDTA-Cr9を伴うFITCの経口経管栄養などの他の方法が、傍細胞経路を評価するために使用されている。しかしながら、これらの技術は分解能が低く、イオン選択性または腸管のセクションの特定のセクションを評価することができない。しかし、ウッシングチャンバーは、標的イオンの希釈電位を評価するために使用でき、したがって、タイトジャンクションのイオン選択性を決定することができる。例えば、NaClでは、Na+およびCl-に対するタイトジャンクションの選択性は、膜の片側(通常は粘膜側)を希釈し、経上皮電位差の変化を測定することによって計算することができる。Na+とCl-の相対透過性はゴールドマン・ホジキン・カッツの式10で推定でき、タイトジャンクションの選択性は君塚・コケツの式11で推定できます。したがって、これらのチャンバは、組織の電気生理学的パラメータを測定するという利点を有し、その結果、他の低分解能方法よりもタイトジャンクションを通るイオンの通過に関するより多くの情報を提供する。
ウッシングチャンバー法は腸管に限定されず、腸に関する研究で広く使用されていますが、他にも多くの用途があります。例えば、これらのチャンバーは、嚢胞性線維症、特に塩化チャネル嚢胞性線維症膜貫通コンダクタンスレギュレーター(CFTR)12を研究するために使用されている。嚢胞性線維症は、CFTR13の変異によって引き起こされ、呼吸器上皮細胞による塩化物分泌および流体輸送の障害をもたらし、その結果、より厚く乾燥した粘液層14が生じる。気道上皮CFTRの研究は、疾患を理解するだけでなく、疾患を治療する方法を発見するために、これらのチャンバーで行われてきた。例えば、嚢胞性線維症を引き起こす稀な変異を有する患者では、患者の呼吸器上皮細胞の分析が、Orkambiやアンプ共療法などの治療法をテストするために使用されてきた15。
ussingチャンバーは、薬物の取り込みや薬物動態を研究するためのヒト生検組織など、薬物送達経路の研究にも使用されています16。腸の取り込みは、薬物送達の唯一の経路ではない。これらのチャンバーは、鼻の薬物送達システムの研究にも使用されています17。Ussingチャンバーを用いた薬物送達研究も眼のために行われている。ウサギの角膜では、組織全体で薬物の吸収を増加させるように設計された薬物であるラブラゾールを用いて、透過性および取り込み試験が実施された18。別の研究では、ウサギ強膜における経強膜薬物送達に対する塩化ベンジルアルコニウムの効果を調べた19。
Ussingチャンバー法は、天然組織を使用できるため有用である。そのため、Caco-2細胞株などの インビトロ モデルに亘ることが好ましい。しかし、試料作製には熟練と時間が必要で、ハイスループットな用途には適していません。細胞単層の電気生理学的特性は、これらのチャンバー内の細胞培養インサートを用いて研究することができる。最近の発見により、上皮幹細胞または内皮幹細胞の採取から培養中に増殖したミニ臓器であるオルガノイドの培養が可能になりました20。オルガノイド培養物は、単層で増殖するように操作することができ、それによって、オルガノイドをUssingチャンバー21にマウントすることを可能にする。様々な上皮および内皮組織のオルガノイドを研究することができ、オルガノイド培養を長期間維持することができるので、必要な動物の数を減らすことができる。これはまた、時間がかかり、面倒な組織解剖および調製ステップが不要になるため、スループットを向上させます。将来的には、Ussingチャンバー研究は組織輸送の研究に非常に有用であり続け、個別化医療の分野で特に重要になるでしょう。
以下のプロトコルは、NaClの希釈電位を測定することによって、クローディン15ノックアウト(Cldn15-/-)マウスおよび野生型(WT)コントロールの小腸におけるタイトジャンクションの透過選択性およびバリア機能を評価するためのUssingチャンバー法の適用を実証する。タイトジャンクション(TJ)は、上皮および内皮組織において2つ以上の細胞が出会う点で形成される。二細胞タイトジャンクション(bTJ)、特にbTJ内に見られるクローディンファミリータンパク質は、TJ7のバリア機能および透過選択性を決定すると考えられている。Cldn15-/-マウスは、巨大小腸22を有し、クローディン154、23、24を介して起こる腸内Na+リサイクルの喪失による栄養素取り込み能力の低下を有する。Cldn15-/- マウスはNa+恒常性を損ねており、TJのパーマセレクティビティを研究するための興味深いモデルとなっています。以下のプロトコルは、中小腸におけるNaCl(PNa/PCl)の希釈電位を測定することにより、TJからNaClへの透過性を評価する。簡単に言えば、膜の片側(M側またはS側、どちらも以下のプロトコルで測定される)を希釈することによって生じる膜電位差の変化は、Na+(PNa)およびCl-(PCl)の透過性を計算するために使用することができ、希釈電位(PNa/PCl)は、タイトジャンクションがカチオン性またはアニオン性の選択性を有するかどうかを示す。
このプロトコールの実験は、腸管製剤が垂直に取り付けられた2つの半分からなるカスタマイズされたUssingチャンバ(図1A)、電圧クランプアンプ、電気レコーダー、電極、塩橋、リンゲル溶液、HEPES緩衝液(150mM NaCl)、希釈HEPES緩衝液(75mM NaCl)、腸製剤(機器の詳細については 材料表を参照)。
プロトコル
これらの実験に使用した動物はすべて静岡大学の動物飼育施設で飼育し、静岡大学の動物実験ガイドラインに従って実験を行った。すべての実験は、静岡県立大学動物愛護利用委員会の承認を得て実施した(許可書#205272、#656-2303)。
1. NaCl電極の作製
注:これらの実験で使用された電極は、濃縮NaClまたはKClからなる。KCl/カロメル電極は市販品として購入されます。実験を開始する前に、すべての電極が濃縮NaClまたはKCl溶液で上部に充填されていることを確認してください。
- プラスチック製の蓋(容量20mL)で小さなガラス瓶を準備します。
- プラスチック製の蓋に 2 つの穴を開け、1 つは NaCl 塩橋 (直径 2.5 mm)、もう 1 つは銀線 (直径 1 mm; 図1C、NaCl電極)。
- ガラス瓶に飽和NaCl溶液(約15mL、満杯になるまで)を充填する。
- 銀線(直径0.8mm、長さ7cm)を瓶に差し込みますが、瓶の外側の線部分がアリゲータークリップ(小型)を介してアンプシステムに接続できることを確認してください。
- 使用しないときは、電極を包み込み、乾燥を防ぐためにパラフィルムで穴が覆われていることを確認してください。
2. 塩橋の作製
注:実験の少なくとも1日前に塩橋を準備して、固化するための十分な時間を確保してください。ソルトブリッジは繰り返し使用できますが、2ヶ月後の使用はお勧めできません。
- NaCl塩橋
- #7ポリエチルチューブ(外径2.3mm、内径1.3mm)、19Gニードルおよびロック型シリンジ、200mLの1M NaCl溶液、2g寒天、塩橋貯蔵用の密閉可能なプラスチック容器を準備する。
- Ussingチャンバのセットアップに必要なサイズにチューブを切断して、適切な数のソルトブリッジを準備します(各チャンバには2つのソルトブリッジが必要です)。
- 寒天を注入する前に、チューブでU字型を作り、温水のビーカーに入れます(塩橋を設置するための簡単な形を作るため)。
- 11.688 gのNaClを200 mLの脱イオン水に溶解して、200 mLの1 M NaClを作る。
- 1 M NaClを100 mLの部分に分割する:1 M NaClに100 mLの2%寒天を作る(NaClに2 gの寒天を混ぜ、電子レンジで加熱して溶解させる)。
- 19 G 針とロック シリンジを使用して、シリンジに 1 M NaCl/寒天溶液を充填します。静かに溶液を一滴ずつ排出し始め、そうしている間に針をチューブの一方の端に挿入し、混合物が反対側から出てくるまで充填する。
- 溶液を表現したままゆっくりと針を抜き、必要な塩橋がすべて作られるまで繰り返します。(溶液がシリンジまたは針で固化した場合は、溶液が再び表現できるようになるまでお湯で短時間温めます。
- 塩橋をチェックして気泡がないことを確認し、残りの1 M NaCl溶液を密封可能な容器に保管します。
- KCl 塩橋
注:塩ブリッジチップが溶解し、K+がバッファに漏れる可能性があるため、KCl寒天ブリッジにはより薄いチューブが使用され、バッファ内のK+濃度の増加を回避します。- #3ポリエチルチューブ(外径1.0mm、内径0.5mm)、23Gニードルおよびロック型シリンジ、200mLの1M KCl溶液、2g寒天、塩橋貯蔵用の密閉可能なプラスチック容器を準備する。
- Ussingチャンバのセットアップに必要なサイズにチューブを切断して、適切な数のソルトブリッジを準備します(各チャンバには2つのソルトブリッジが必要です)。
- 14.91 gのKClを200 mLの脱イオン水に溶解して、200 mLの1 M KClを作る。
- 2つの100mL部分に分割する:1M KCl中に100mLの2%寒天を作る(KClに2g寒天を混ぜ、マイクロ波で加熱して溶解する)。
- 23 G 針とロックシリンジを使用して、NaCl ソルトブリッジと同じ方法で、2% 寒天 1 M KCl 混合物でチューブを注入します (チューブが完全に満たされ、気泡がないことを確認してください)。
- 塩橋をチェックして気泡がないことを確認し、残りの1 M KCl溶液を密封可能な容器に保管します。
3. リンゲル溶液およびHEPES緩衝液の調製
メモ:Ussingチャンバに取り付けられた組織に応じて、Ringerの溶液のコンポーネントが異なる場合があります。ここで提示されたレシピは、小腸と大腸に固有のものです。
- 表1に記載したように、実験当日にリンゲル溶液を新鮮にする。
- 溶液を95%O2/5%CO2でバブリングして、O2を組織に供給し、緩衝能を与える。
| リンゲル液(小腸) | リンゲル液(大腸) |
| NaHCO3 – 21.0 mM | NaHCO3 – 21.0 mM |
| K2HPO4 – 2.4 mM | K2HPO4 – 2.4 mM |
| KH2PO4 – 0.6 ミリアンペア時 | KH2PO4 – 0.6 ミリアンペア時 |
| NaCl – 119.0 mM | NaCl – 119.0 mM |
| MgCl2 – 1.2 mM | MgCl2 – 1.2 mM |
| CaCl2 – 1.2 mM | CaCl2 – 1.2 mM |
| インドメタシン – 10 μM (21 mM NaHCO3に1 mMストックを作り、1 Lのリンゲル溶液に10 mLのストックを加える) | インドメタシン – 10 μM (21 mM NaHCO3に1 mMストックを作り、1 Lのリンゲル溶液に10 mLのストックを加える) |
| 1 mM グルタミン (0.146 g/L) | 10 mM グルコース |
表1:リンガーのソリューションレシピ リンゲルの溶液を作るには、すべての成分を脱イオン水と一緒に混合します。Ringerのソリューションは、実験の前に新鮮にするのが最善です。使用時まで冷蔵庫または氷の上に保管してください。使用する前に、95%O2 / 5%CO2を含むガス。
- HEPES緩衝液を実験当日に表2に記載のように脱イオン水に成分を混合して新鮮にする。
- pH調整後まで、緩衝液の最終容量に調整しないでください。
- HEPES緩衝液を37°Cに温め、攪拌しながら1 Mトリス溶液をゆっくりと加えてpHを7.4に調整した。
- 適量の脱イオン水を加えて最終体積に調整する。
| HEPESバッファ | 希釈HEPESバッファー |
| ヘップス – 10 mM | ヘップス – 10 mM |
| グルコース – 10 ミリグラム (大腸) | グルコース – 10 ミリグラム (大腸) |
| 1 mM グルタミン (0.146 g/L) (小腸) | 1 mM グルタミン (0.146 g/L) (小腸) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM マンニトール (オスモル濃度の違いを調整するため) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| インドメタシン – 10 μM (21 mM NaHCO3 に 1 mM ストックを作り、1 L のリンゲル溶液に 10 mL のストックを加える) | インドメタシン – 10 μM (21 mM NaHCO3 に 1 mM ストックを作り、1 L のリンゲル溶液に 10 mL のストックを加える) |
| 1 M トリスを使用して pH 7.40 (37°C) に調整する | |
表 2: HEPESバッファレシピ HEPES緩衝液および希釈HEPES緩衝液を作るには、すべての成分を脱イオン水に溶解する。溶液は1 M Tris溶液でpH調整されなければならないので、全量の水を加えないでください(例えば、1 Lを作るときは、すべての成分を約800mLの水に溶かしてください)。次に、溶液を37°Cに加熱し、pHを7.4に調整してから、最終体積を調整します。
4. ussingチャンバーのセットアップ
注:このプロトコルで使用されるUssingチャンバは、カスタムメイドの連続灌流チャンバです。マウスの腸管バリア機能または栄養素の取り込みを評価するには、直径4mmまたは5mmの開口部を有するチャンバーを推奨し25(図1A-C)。
- エッジ効果26 を軽減し、チャンバーを密閉するには、セットアップ前に4mmまたは5mmの穴あけパラフィンフィルム(約4cm2)を取り付けます(図1B)。
- 希釈電位測定用の開回路条件で設定します。現在のクランプモードで設定します。出力を電流に設定し、電流パルスを±20μAに設定します。
- 短絡電流および経粘膜抵抗の測定のために短絡条件で設定する場合は、電圧クランプモードに設定する。出力を電圧に設定し、電圧パルスを±5mVに設定します。
- ウォータージャケット内で37°Cの水が循環していることを確認します。
- 各チャンバをリンゲル溶液またはHEPES緩衝液で満たし(量は使用するシステムによって異なりますが、ここで使用するチャンバは各側面に5mLが必要です)、漏れがないことを確認します。
- 塩の橋と電極を接続します。
- 電圧が0で安定したパルス電流であることを確認し、塩橋と電極が正しくセットアップされていることを確認します。
- システムとリンゲルの溶液温度が少なくとも 20 分間平衡化するのを待ちます。
- 平衡化後、KCl電極間の非対称電圧差を修正し、それをゼロに変更して流体抵抗を補償します(正しい方法を決定するために使用されるUssingチャンバシステムのマニュアルを確認してください)。
5. 腸組織の解剖
(注)すべての動物実験は、国および大学が定める規則の範囲内で実施しなければなりません。
- 腸組織を採取する前に、新鮮な氷冷リンガー溶液と95%O2 と5%CO2 を含むバブルを15分間準備します(ステップ3)。
- 研究における動物の使用を規定するガイドラインに従ってマウスを麻酔する。この実験のために、マウスを麻酔装置によって投与された2%〜3%イソフルランで麻酔した。つま先をつまみ、痛みの反応がないことを確認して、適切な麻酔を確認してください。
- 骨盤から横隔膜まではさみで腹部を切開する。胃を見つけて、胃の幽門端を切断する。
- 小腸に付着した胃部分を鉗子で掴み、腸間膜付着物を切り取りながら小腸を優しく引っ張ります。腸組織を切断したり損傷したりしないように注意してください。
- 腸を肛門まで解剖し続けます。大腸を完全に除去するには、骨盤骨を切って大腸の遠位部分を明らかにし、付着物を切り取って腸の残りの部分を慎重に取り除きます。
- 腸の長さを測定し、所望のセグメントに分割する。この実験では、小腸を3つのセグメントに分割し、中央のセグメントを使用します。
- 目的のセグメントを氷のように冷たく泡立てたリンガーの溶液に入れます。次に、腸間膜アタッチメントに沿って切断することによって、各セグメントを縦方向に開きます。脂肪と結合組織をトリミングします。
- セグメントを氷冷リンガーの溶液に戻し、徹底的に洗浄します(氷冷溶液であっても、上皮機能を維持するためには管腔上皮の酸素化が重要です)。
6.筋肉層を剥ぎ取り、腸管シートを調製する
注:セロサ(筋肉層)の除去は、腸を用いた輸送研究にとって重要である。セロサが残っている場合、腸組織は電気生理学的データを歪めるランダムな筋肉収縮を受け、輸送が阻害される可能性があります。剥ぎ取られていない組織は、セロサが基質および酸素の有意な拡散障壁であるため、Ussingチャンバに装着すると急速に悪化する。いくつかの特別なケースでは、筋肉層を保つ必要があるかもしれないので、決定は研究者と実験計画次第です。腸管シートは、どの層を除去するかに応じて2つの方法で調製することができる(図2)。この実験のためには、粘膜および粘膜下調製物が必要である(図2、第2パネル)。
- シリコーンゴムで覆われた解剖プレート(直径10cm)、ピン(小さな鍼灸針)、5mmパンチろ紙、パラフィルム正方形(2cm x 2cm、他のシステムでは必要ない場合がある)を準備します。
- 新鮮な、氷冷した、泡立てたリンゲル溶液を解剖プレートに注ぐ(組織を覆うのに十分、約2〜3mL)。
- 実体顕微鏡下で、腸組織の端部をピンで留める(粘膜側を下にする)。
- 細かい鉗子を使用して、下にある粘膜から筋肉層を鈍く解剖する。
- 組織に穴を開けたり、穴を開けたりしないように注意してください。
- 筋肉層が取り除かれたら、直径5mmの開口部に十分な大きさのピースを切断する。小腸を調製するときは、これらの条件下では管腔酸素化が困難であるため、血清 - 筋肉層の除去は10分以内に行うべきである。
- リンゲル溶液に正方形の5mmのろ紙を濡らし、粘膜下製剤が粘膜側を外側に自発的に包み込むので、粘膜側を下にしてその上に腸組織を置く。
- 開口部が腸組織によって完全に覆われており、しわがないことを確認してください。準備書の下に黒板を使って,開口部が完全に覆われているかどうかを確認します。
- 必要な数の粘膜製剤についてこの手順を繰り返す(この実験では、希釈電位の測定に1つの調製物を使用し、ベースライン電気パラメータを測定するためにもう1つの調製物を使用する)2つの調製物が必要である)。
7. ウッシングチャンバーへの腸管製剤の取り付け
メモ:セットアップは、使用するUssingチャンバーシステムと録音システムの種類によって異なります。
- リンゲルの溶液/HEPES緩衝液をウッシングチャンバーから吸引する。
- Ussingチャンバを分解し、腸管製剤の粘膜側を下にした濾紙を粘膜側チャンバの上に置き、チャンバの窓が濾紙の穴に揃うように調整する(図1A、チャンバ窓の周りの黒いマーキングは、製剤の位置合わせに有用である)。
- 粘膜側室にセロサール側室を慎重に置き、しっかりと閉じますが、接続中に腸管シートが動かないことを確認してください。
- 両方のチャンバーにリンゲル溶液またはHEPESバッファーをすばやく補充し、バブリングワンドを置きます(リンゲル溶液:95%O2 / 5%CO2;HEPES緩衝液:100%O2)をチャンバの反対側の端に、膜から離して(調製物に近すぎるバブリングは測定に影響を与える可能性がある)。
- ソルトブリッジを再接続し、電圧とパルス電流が安定しているかどうかを確認して、接続に問題がないことを確認します(図1C)。
- 各腸の準備について繰り返します。
- システムを約15分間平衡化させます。記録方式を使用する場合は、コンダクタンスとIsc/膜電位差を安定させてから実験を開始してください。
希釈電位実験(開放条件)
- HEPES緩衝液を吸引し、5mLの新鮮な予め加温したHEPES緩衝液を両側に添加することによってチャンバーの両側を洗浄する。
- 記録システムの電源を入れます。レンジを250mVに設定し(ここで使用するシステムは出力電圧を10倍に増幅します)、マーカ位置を設定し、記録システムを測定するように設定します。
- Ussingチャンバーシステムをクランプモードにして、測定を開始します。膜電位が安定すると(〜15〜20分)、評価を開始することができます。
- 粘膜側からHEPES緩衝液を吸引し、75mM NaClを含む5mLの加温希釈HEPES緩衝液で迅速に置換する。
- 膜電位がピークに達したら(5〜10分)、希釈緩衝液を「粘膜」側から除去し、HEPES緩衝液と交換する。
- 必要に応じて、セロサール側について工程3を繰り返し、セロサール側に希釈HEPESバッファーを加える。
- 組織が生存可能であることを確認するために、アデニル酸シクラーゼ活性化剤フォルスコリン(最終濃度10μM)をセロサール側に加える。
- 膜電位差がピークに達し、減少し始めたら、実験は終了します。
9. 経上皮電気コンダクタンスとベースラインIscの測定(短絡条件)
- リンゲル溶液を吸引し、5mLの新鮮な泡立ちリンゲル溶液を両側に加えて、チャンバーの両側を洗浄する。
- 記録システムの電源を入れます。レンジを2.5Vに設定し(ここで使用するシステムは出力電圧を10倍に増幅します)、マーカ位置を設定し、記録システムを測定するように設定します。
- Ussingチャンバーシステムをクランプモードにし、測定を開始します。Iscとコンダクタンスが安定すると(〜15〜20分)、ベースライン測定値が得られます。
- 組織が生存可能であることを確認するために、アデニル酸シクラーゼ活性化剤フォルスコリン(最終濃度10μM)をセロサール側に加える。
- 膜電位差がピークに達し、減少し始めたら、実験は完了です。
10. 結果の分析
- 開回路条件下では、オームの法則に従って、電流パルスに応答した電圧の変化から経粘膜コンダクタンスを計算します。オームの法則を適用した経粘膜電圧とコンダクタンスから等価短絡電流(Isc)を求めます。
- NaClの希釈ポテンシャルを使用して、ゴールドマン・ホジキン・カッツの式10で相対イオン選択性(PNa/PCl)を計算します。
- 各イオンのタイトジャンクションの絶対選択性を君塚・コケツ式11を用いて推定する。
- 希釈ポテンシャルからゴールドマン・ホジキン・カッツ方程式を用いてPNa/PClを計算し、Yuら10で次のように記述されているように、君塚・コケツ方程式から絶対透過性PNaとPClを求める。
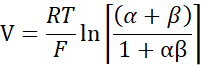

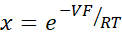

ここで、V:希釈電位(mV);α:活性比。HEPES緩衝液中のNaClの計算された活性を希釈HEPES緩衝液中のNaClの計算された活性で割った(この実験のために、1.8966として計算された);e: 数学定数, 2.71828;GM:経粘膜コンダクタンス(mS / cm2);F: ファラデー定数 (96,485.3329 C/mol);R: ガス定数 (8.314 J/mol K);T: 温度 (310.15 K)
結果
このホワイト ペーパーで示されている結果は、完了した大規模なプロジェクトの一部であった結果です (ref.4,23,24 を参照)。
小腸の経上皮電気コンダクタンスはCldn15-/-マウスにおいて減少する。
Cldn15-/-マウスの中央小腸セグメントの?...
ディスカッション
この実験では、Ussingチャンバーを使用して、Cldn15−/−およびWTマウスの小腸におけるNaClのベースライン電気パラメータおよび希釈電位を測定した。Ussingチャンバー実験を行う際には、実験で使用した膜調製物が実行可能であることを確認することが非常に重要です。これは通常、グルコースまたはアデニル酸シクラーゼ活性化剤フォルスコリンを添加し、Isc(マ?...
開示事項
著者らは、開示すべき潜在的な利益相反はない。
謝辞
この作業は、17K00860 (HH 宛) および 19K20152 (NI 宛) でサポートされています。WHは、2018年から2021年までの大塚俊美奨学財団の財政的支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
参考文献
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved