Method Article
ビーズは、接着性ヒト細胞にタンパク質と核酸をロード
要約
ビーズローディングは、タンパク質、プラスミド、および粒子を付着した哺乳類細胞に導入します。この細胞ローディング技術は、安価で迅速であり、細胞の健康に実質的に影響を与えません。ライブセルイメージングに最適です。
要約
多くの生細胞イメージング実験では、外因性粒子(例えば、ペプチド、抗体、ビーズ)を用いて細胞内に標識または機能する。しかし、膜を横切って細胞にタンパク質を導入することは困難です。現在の方法の限定的な選択は、低効率に苦労し、高価で技術的に要求の厳しい機器、または狭いパラメータ内の機能を必要とします。ここでは、DNA、RNA、タンパク質を生きたヒト細胞にロードするための比較的シンプルで費用対効果の高い手法について述べています。ビーズの負荷は細胞膜に一時的な機械的破壊を誘発し、高分子が付着した生きた哺乳類細胞に入ることを可能にする。実験あたり0.01米ドル未満では、ビードローディングは、利用可能な最も安価なセルローディング方法です。さらに、ビーズローディングは、細胞に実質的にストレスを与えたり、その生存率や増殖に影響を与えたりしません。この原稿は、ビーズのロード手順、適応、バリエーション、および技術的な制限事項のステップを説明しています。この方法論は、生細胞イメージングに特に適していますが、タンパク質、ビーズ、RNA、またはプラスミドを生きた、付着性哺乳類細胞に導入する必要がある他の用途に対する実用的なソリューションを提供します。
概要
高分子を哺乳動物細胞にロードするには、細胞の形質膜1を横切ることができる方法論が必要である。いくつかの方法は、トランスフェクションを介して哺乳動物細胞にプラスミドを導入することができる、リポソームトランスフェクション2 およびジエチルアミノエチルデキストラントランスフェクション3を含む。しかし、タンパク質や膜不透過性粒子を細胞にロードする方法は、より限定的である。
いくつかの技術は、様々な戦略を使用して、この困難なハードルをバイパスしています。まず、マイクロインジェクションは、マイクロピペットを介してマイクロピペットを介して、マイクロ顕微鏡4の下で生きた細胞に粒子を送達する。間違いなく最も制御され、最も侵襲性の低い方法ですが、細胞は1つずつロードされなければならないので、この技術は比較的低いスループットです。さらに、マイクロインジェクションには特殊な機器が必要であり、技術的に要求が厳しい。
第二に、エレクトロポレーションは、電圧誘発膜破壊5、6、7を介して細胞にタンパク質をエレクトロ注入する方法である。しかし、この方法は再び特殊で高価な機器を必要とし、ショックは細胞のストレスや死亡率を引き起こす可能性があります。さらに、細胞はエレクトロポレーションの前にトリプシン化され、その後再入植され、細胞がエレクトロポレーション後に調査できる時間枠を制限しなければならない。
第3に、細胞膜は、一時的に、可逆的な透過性8、9のために化学的に修飾されてもよい。ストレプトライジン-Oローディングは、一時的な細孔を形成する細胞膜に内毒素を挿入し、タンパク質およびDNAプラスミドを含む外因性膜不透過性粒子が細胞10に入ることを可能にする。2時間の回復後、細胞の約半分がこれらの毛穴を修復し、溶液からの内在化粒子を停止する。しかし、この技術は長い回復時間を必要とし、内毒素を許容できない細胞型と互換性がありません。
第4に、機械的破壊は、細胞膜11の物理的摂動を通じて粒子を細胞に負荷する。これは、セル12,13の上に引っ掻き、掻き取り、およびロールビーズを含む複数の方法で行うことができます。早くも 1987, ビーズは機械的に細胞にタンパク質をロードするために使用されています14.最近では、ここで説明するように、ビーズローディング技術は、プラスミドとRNAの負荷を含むようにタンパク質を超えて最適化され、適応されています。
ビーズローディングは、タンパク質とプラスミドを付着性ヒト細胞にロードするための簡単で安価で迅速な方法です。ガラスビーズは細胞の上に一時的に転がされ、細胞膜を一時的に破壊する。これにより、溶液中のパーティクルが入ります。ビーズの負荷は効率が低いため、単一分子または単一細胞顕微鏡実験に最適です。ビーズローディングは、断片化した抗体(Fab)、15、16個の精製タンパク質(scFvs、17イントラボディ、18、19、またはmRNAコートタンパク質、例えばMS2コートタンパク質)20、21を含む多種多様なタンパク質を導入することができる。プラスミド発現ベクターは、タンパク質溶液に添加することも可能であり、ビーズを同時に22、23、24、25にロードする。
タンパク質やプラスミドを超えて、250 nmのポリスチレンビーズの大きさの分子がビーズローディング(パーソナルコミュニケーション)を介して細胞に導入されています。ビードの負荷は非常に安価で、材料の実験ごとに0.01 USD未満の費用がかかり、追加の高価な機器を必要としません。イメージングチャンバーの中央14mm径マイクロウェル内の細胞のみがロードされるため、実験ごとに使用されるプローブの量を最小限に抑えることで、コストがさらに削減されます。制限されたローディング領域は、ビーズのローディングがバルクセルのロードに適していないことを意味します。
この原稿は、ビーズローディング装置の構築や実験の実施方法を含む、ビーズのロードプロセスを示す。タンパク質、RNA、DNAは様々な細胞タイプにロードすることができ、同時にビーズをロードした2つの異なるタンパク質は、高相関性の高い細胞濃度と比較的低い分散を有することを示しています。また、タンパク質、プラスミド、またはRNAの細胞の種類と負荷に基づくプロトコルのバリエーションも議論されています。ビーズは細胞膜を穿穿および破壊すると考えられているが、適切に行われると、ビーズローディングプロセスは、イメージングチャンバの底部から少数の細胞のみを外に出す。短い回復期間の後, 細胞が成長し、分裂し続けます.この方法論は、単一分子タンパク質およびRNA追跡、翻訳後修飾検出、動的細胞機構の観察、または細胞内局在化モニタリング15、16、22、26、27を含む生細胞顕微鏡実験に最適である。
プロトコル
1.ガラスビーズを洗浄、殺菌、乾燥させて、凝集を避け、細胞の上に広がることを保証します。
- 約5 mLのガラスビーズを水酸化ナトリウム(NaOH)で殺菌します。50 mL円錐管内のビーズを測定します。2M NaOHの25 mLを加え、2時間振る機またはローテーターを使用して穏やかに混ぜます。
- できるだけ多くのビーズを保持し、NaOHをデカント。ビーズが懸濁している場合は、遠心分離機でビーズのチューブを短時間回転させます(1分~1000×g、室温)。
- pHが中性になるまで細胞培養グレードの水でビーズを十分に洗います(溶出液上のpHテストストリップを使用して中性pHを確認します)。以前のように、毎回洗浄水をデスキャンします。
- 100%エタノール2~3倍で十分に洗浄してください。エタノールを毎回デカントし、前と同じように。
- ビーズを乾かします。ビーズを振りかけ、滅菌容器の中に薄い層を形成します(例えば10センチペトリ皿)。容器を開けたまま、ビーズをバイオセーフティキャビネットで一晩空気乾燥させます。容器をタップまたは軽く振って、ビーズが凝集や剥離のない砂の質感を持っていることを確認することによって、ビーズが完全に乾燥していることを確認してください。
- 乾燥ビーズを15分間紫外線殺菌します。
2. ビーズローダー装置を組み立てます。
- 金属再利用可能なイメージングチャンバーの男性と女性の端の間のメッシュをテープまたはクランプでビーズ保持室の開口部全体を覆うために、メッシュのパッチ(ポリプロピレンまたは同等の材料、ビーズが通過できるように105 μmの開口部)を固定します(図1A)。
- 装置を15分間紫外線殺菌する。ビーズを装置に加え、ワックス状のフィルムでしっかりと密封します。
注:このステップでは、ビーズが完全に清潔で乾燥していることが不可欠です。彼らは緩く、塊のない砂に見える必要があります。表示されない場合は、再洗浄し、ビーズを完全に乾燥させます。 - 装置を、シリカゲルまたは他の乾燥剤媒体によって乾燥した密閉された乾燥容器に保管する。ビーズが湿った場合は、ビーズの塊で明らかになりますが、ビーズローダーを十分に乾燥させて殺菌し、新鮮なビーズに置き換えます。
注:これらすべての予防措置は、ビードローダー内のビーズの上または周囲に成長する金型や細菌を防ぎます。ビーズローダー装置は、さまざまな方法で作ることができます。ディスカッションの詳細を参照してください。
3. 接着性細胞のガラス底チャンバーを準備します。
- 35 mm ガラス底チャンバーに哺乳類細胞を付着させます。ビードのロード時にセルが約 80% コンフルエントであることを確認します。(さまざまなセルタイプの詳細と、異なるセルタイプでのビードのロードの効果に関する注記については 、表 1 を参照してください。
注:細胞は、使用される細胞の数を節約するために、チャンバの中央にあるマイクロウェルにのみ播種することができます。 - ガラスに完全に付着するまで、通常の条件下で細胞をインキュベートします。
注: セル密度が十分に高く、セルがガラスにしっかりと接着することが不可欠です。これらの要件が満たされない場合、ビードのロード中に細胞が剥がれる可能性があります。細胞の播種とビーズの負荷の間のタイムラインは、適切な細胞の接着性と合流性を確保するために延長することができます。
4. ビーズローディングセル
注:必要に応じて、リン酸緩衝生理食塩分(PBS)で細胞を短時間洗浄し、最適な培地を2 mL加えます。30分以上インキュベートする。
- 目的のプラスミド、タンパク質、粒子を含む3~8 μLの溶液を作ります。各タイプのプラスミドの~1μg(0.1~1 pmol)と、実験要件に応じて0.5μg(0.01 nmol)のタンパク質を使用してください。タンパク質がチューブの壁に取り残されないように、保持度の低いチューブを使用してください。溶液をPBSで最低3μLまで持ち込み、溶液の体積を調整して、ロードする細胞の領域全体をコーティングします(すなわち、チャンバーのマイクロウェル、図1B)。
- 上下にピペットを入れたり、チューブをフリックしたりして、溶液を完全に混ぜます。簡単に卓上マイクロフュージでチューブの底まで溶液を回転させます。
- ビーズローディング溶液と細胞のチャンバーを組織培養フードに移します。滅菌技術を用いて組織培養フードの残りのステップを実行する。
- 細胞から培地を取り出し、滅菌チューブに一時的に保管します。チャンバーの端の周りからすべての媒体を穏やかに吸引し、およそ45°の角度でチャンバーを傾け、中央マイクロウェルの残りの媒体の滴を取り除きます。中程度の除去の間、ピペットの先端がガラスに触れないようにしてください。細胞が長く乾燥しないように、次のステップにすばやく移動します。
- チャンバーの中央にあるガラスマイクロウェルにビーズローディング液をそっとピペットします。オプション:チャンバーが完全に乾燥することを許可せずに〜30 sのための穏やかな揺れでインキュベート。
- ガラスビーズの単層を細胞の上に穏やかに分散させ、好ましくはビーズローディング装置を用いる(図1A)。ビーズがガラス底マイクロウェルの細胞を完全に覆っていることを確認してください。
- 2本の指でチャンバーをつまみ、それを〜2インチ持ち上げてしっかりと下げてフード表面にタップします。その高さから皿を落とすのとほぼ同等の力を使用してください。タップの合計が 10 回繰り返されます。
メモ:タップがセルを実質的に剥がさないようにしてください。タップは、セルの種類に合わせて最適化できます。セルの読み込みが悪い場合は、より強くタップします。ただし、多くのセルが剥がれる場合は、より軽くタップします。 - チャンバーのプラスチック側にゆっくりとピペットを入れ、ミディアムをチャンバーに静かに加えます。細胞を乱すことなく、浮遊ビーズを吸引してみてください。あまりにも多くが削除された場合は、この手順で、より多くの事前にウォームされたメディアを追加します。インキュベーターで0.5〜2時間培養します。
- 乾燥条件下で貯蔵に戻す前に15分間ビードローダーをUV殺菌します。
- メーカーの推奨プロトコルに従って、色素(例えば、DAPIまたはHaloTagリガンド染色、実験で要求される場合)を細胞に加えます。
- イメージングの前に細胞3倍を培地で洗浄し、溶液中のビーズおよび過剰な負荷成分を除去します。細胞に直接ピペットを入れて皮をむかないようにします。
5. ビーズをロードした細胞のイメージング
- すぐに、または実験で必要な場合にセルを画像化します。蛍光を捕捉できる顕微鏡(レーザーまたは単色光源)を使用してください。励起波長が選択された蛍光色素または色素(例えば、緑色蛍光タンパク質(GFP)の488nm波長光)に適していることを確認してください。
注:ビーズをロードしたタンパク質は、細胞が回復すると画像化されることがあります(ここで説明する細胞株のポストローディングは30分)。プラスミド式は、発現ベクター要素に応じて≥2hをとり、その後の説明を行う。ビーズを装填した細胞のイメージングは、ロードされたプローブに関連する適切な蛍光源を備えた顕微鏡、電子乗算電荷結合素子(EMCCD)や科学的相補金属酸化物半導体(sCMOS)カメラなどの蛍光画像を撮影できるカメラ、温度、湿度、炭酸ガスを制御するインキュベーターで行うことができます。蛍光顕微鏡のご案内については、27を参照してください。
結果
ビーズローディングの最も一般的な用途は、1種類以上のタンパク質を接着ヒト細胞に導入することです。これを例示するために、細胞はCy3-およびAlexa488-共役Fabタンパク質の溶液をビーズロードした。マイクロウェル内のすべての細胞がビーズをロードしたわけではありませんが、ほとんどの場合、ロードされた細胞にはCy3-とAlexa488の両方の標識タンパク質が一緒にありました(図2A)。以前の推定によると、4マイクロリットルで希釈されたFabの0.5マイクログラムがビーズロード29である場合、 図2Aのように、各細胞は約106 Fab分子をロードする。
GFPをコードするプラスミドDNA(プラスミドDNA1 μg、557 ng/μL溶液の1.8μL)および0.5μgのCy3標識Fabもビーズローディングを介して細胞に導入され、その後発現および可視化された(図2B)。GFP蛍光は、GFPコードプラスミドが細胞にロードされただけでなく、発現していることを示した。従って、同一細胞において、ビーズローディングは、タンパク質プローブ(例えば、Cy3標識Fab)及びレポータープラスミド(例えば、GFP)を導入することができ、この研究室で行われたように22、23、24。我々は、図2Bの代表的な視野に示すように、細胞の40%がFabタンパク質を有し、ビーズを装填した細胞の21%が共装プラスミドを発現していると判断した。典型的には、各チャンバは、リポフィクションとほぼ同じ量のプラスミドの1〜2μgを装填する。
ビーズを積んだ細胞は、様々なレベルのプラスミドを発現する(図2C,D)。具体的に測定するために、フィッシャー比検定を用いて、タンパク質の分布とプラスミド強度データを比較しました。結果は、タンパク質1と2は同様の強度分布を持っていたが(p=〜1)、各タンパク質はプラスミドよりも有意に小さい分布を持っていることを示した(p = 3.2e-6および1.8e-5)。これは、細胞ごとにロードされるプラスミドの数のばらつきが原因である可能性がありますが、細胞間で大きく異なる可能性が高いプラスミド発現に必要な多くのステップから変動の大きな原因が生じる可能性があります。対照的に、ビーズをロードしたタンパク質のレベルはわずかな細胞間分散を有し、同時にロードされた2つのタンパク質のレベルは互いに高い相関を有していた(図2D,E)。
プラスミド発現は、ビーズ後の負荷の2-4時間の早い時期に見ることができますが、最適なプラスミド発現が得られる時期によっては後で起こり得る。タイムコースを実行して、2~24時間のポストビーズのロードに及ぶ特定のプラスミドに最適な表現ウィンドウを決定することをお勧めします。これは長い時間枠のイメージを用いる1つの部屋で、またはビーズの負荷および多数の部屋をよろめくことによって行うことができる。ビーズを積んだ細胞は付着したままで、成長して分裂するのに十分健康です。ビーズをロードしたヒトU2OS細胞は、ビーズのロード後、直接、直後、および24時間前に画像化された。図 3A(左、中央)に示すように、適切なビーズのロードは、細胞の数またはその形態にほとんど顕著な影響を及ぼさなかった。
これに対し、ビードのローディングが多すぎると過度のタップ力が 図3Bに描かれています。これは、多くの細胞損失(細胞がなく、剥離、浮遊、焦点外の細胞のないカバーグラスの大きなパッチ)、貧しい細胞形態(切り上げられ、接着が不十分に見える細胞)、ビーズのロード後にカバーグラスに残っているビーズのクラスターを引き起こしました。細胞はビードローディング中に機械的損傷を受けると考えられているが、ビーズローディング後の細胞数の増加によって証明されるように、細胞は成長し、適切にビーズを積んだチャンバー内で増殖した(図3A、右)。細胞生存性に対する効果は、3-(4,5-ジメチルチアゾール-2-yl)-2,5-ジフェニルテトラゾリウムブロマイド(MTT)アッセイのような様々なアッセイを通じて評価され、ビーズをロードした細胞をモックロードされた細胞30に比較する。また、この研究とこれまでの研究では、ビーズを積んだ細胞が細胞分裂(図3C および 補足ビデオ1)を受け、かつ、ビーズローディング31によって有糸分裂のタイミングが影響を受けないことを示している。
ビーズローディングは、いくつかの付着細胞株および様々な高分子を収容する多目的な技術です。ここでは、この多様性が、Fab(図4A、B)を搭載したRPE1およびHeLaセルラインをロードすることによって実証されています。表 1は、この研究室およびそれ以降の異なる細胞株でのビードのロード例を示し、他のラボからのビードローディングプロトコル間の微妙な違いのいくつかを示しています。注:ローディングに使用されるガラスビーズの直径は実験室によって大きく異なりますが、最も効率的なローディングは、いくつかのセルライン14の小さな75 μmの直径ビーズに対して見つかりました。さらに、この研究室では、ビードローディングRNAも開始しています(データは示されていません)。図4Cは、Cy5-RNA 9merとCy3-DNA28merを一緒に搭載した代表的なU2OS細胞ビーズを示す。
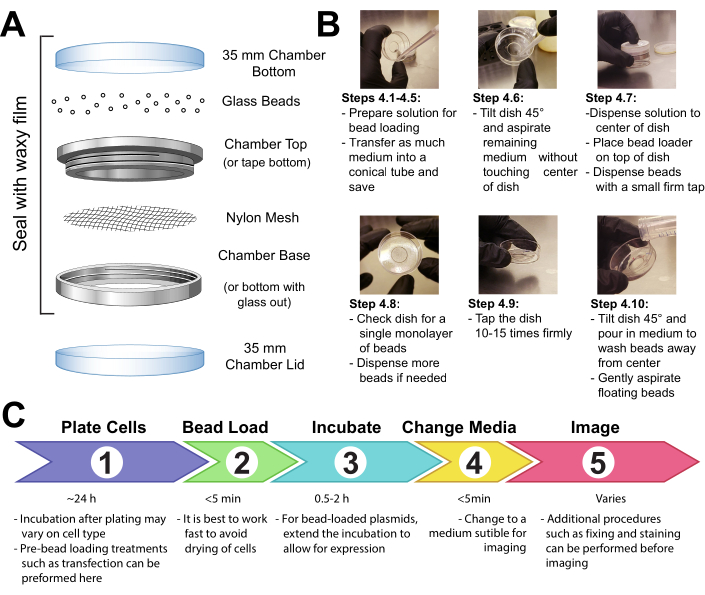
図1:ビードローディング装置、技術、タイムラインこの図の大きなバージョンを表示するには、ここをクリックしてください。
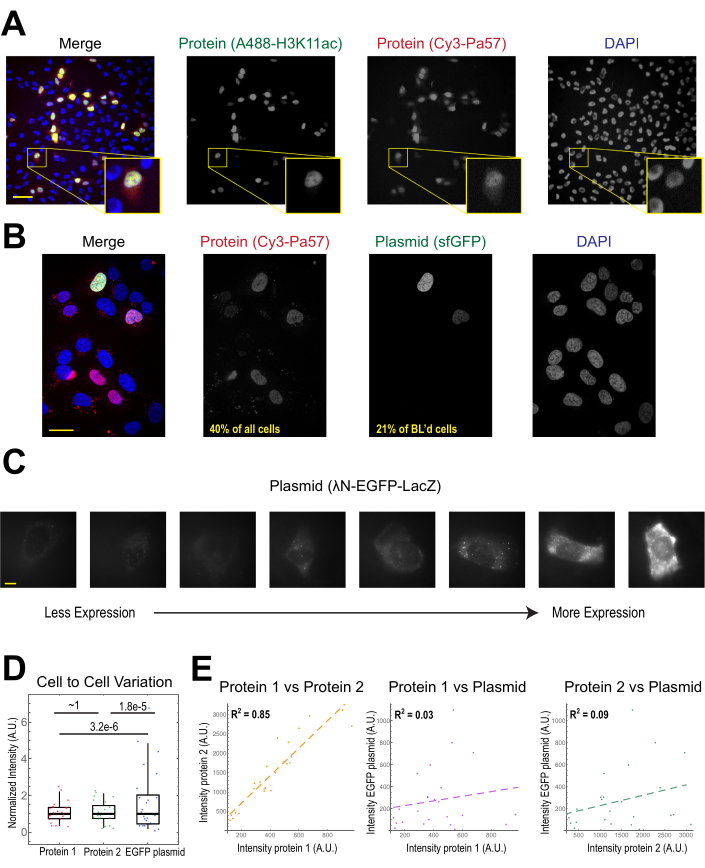
図 2.ビーズの負荷は、タンパク質濃度の低い変動を導入しますが、プラスミド発現では変動が高いです。(A)細胞は、4μLのビーズローディング溶液に、Alexa488-コンジュゲート抗H3K27アセチルファブ(緑色)およびCy3共役抗RNAPII-セリン5リン酸化ファブ(赤色)のそれぞれ0.5μgをビーズロードした。細胞をDAPI染色(青色)し、その後すぐに生画像化した。スケールバー=20μm(B)細胞は、0.5μgのFabタンパク質(Cy3-コンジュゲート抗RNAPII-Serine 5-リン酸化タンパク質、赤色)および4μLのベードローディング溶液中のスーパーフォルダGFP-H2B(緑色)をコードするプラスミド1μgをビーズにロードした。24時間後、細胞をDAPI染色(青色)し、生画像化した。スケールバー=30μm(C-E)タンパク質1(JF646-ハロリガンド標識ハロタグ-MCP)、タンパク質2(Cy3-共役抗FLAG Fab)、およびプラスミドコードEGFP(λN-EGFP-LacZ)を細胞に一緒にロードした。各蛍光チャネルの全強度を、各細胞の細胞質中の1.3 x 1.3 μmのパッチで測定した。N = 25 個のセル。(C)ビーズを含んだプラスミドを発現する代表的な細胞、λN-EGFP-LacZ。全ての細胞に同じ画像化条件と強度を使用した。スポットは、発現タンパク質の凝集体である。スケールバー= 10 μm(D) グラフは、各細胞のプラスミドから発現されるタンパク質1、タンパク質2、またはEGFPのいずれかの総強度を示しています。各チャンネルは中央値に正規化されました。ボンフェローニ補正P値は、フィッシャー比検定によって計算され、タンパク質またはプラスミド強度データの分布が同じ変動性を有するかどうかを判断した。各ポイントはセルを表します。(E)タンパク質1とプラスミド、またはタンパク質2とプラスミドの両方の全強度が互いにプロットされる。計算されたR2値が表示されます。各ポイントはセルを表します。略語: DAPI = 4',6-ジミディノ-2-フェニリンドール;EGFP = 強化された緑色蛍光タンパク質;A.U. = 任意の単位。MCP = MS2 コートタンパク質;RNAPII = RNAポリメラーゼ II.この図の大きなバージョンを表示するには、ここをクリックしてください。
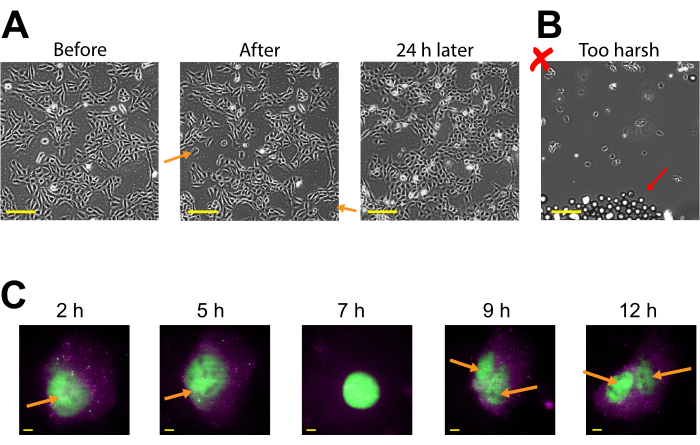
図3:ビーズを積んだ細胞は付着性を保ち、成長して分裂するのに十分健康である。(A)U2OS細胞は、ビーズローディング溶液の4 μLで0.5 μgのCy3結合抗FLAG Fabをビーズロードした。細胞は、ビーズのロード直後、ビーズローディング後に24時間画像化した。オレンジ色の矢印は、ビーズのロード中に細胞が剥がれた領域を識別します。スケールバー = 2 mm. (B) U2OS 細胞の代表的な画像は、(A) からのコンポーネントをロードしたが、厳しいタッピングとあまりにも多くのビーズを有する。赤い矢印は余分なガラスビーズを識別します。スケールバー=2mm(C)U2OS細胞は、14.4 kbpプラスミドsmFLAG-KDM5B-15xBoxB-24xMS2、Cy3-共役抗FLAGファブ(緑)の0.5 μg、8μLのベードローディング溶液中に130ngのハロタグ-MCP(magenta)の1.5 μgを搭載した。イメージングの直前に、ハロタグをJF646-ハロリガンドで染色しました。レポータープラスミドから転写されたmRNAのMS2ステムループはMCP(マゼンタスポット)によって標識され、FLAGタグ付けされた翻訳されたレポータータンパク質は抗FLAG Fab(mRNAへのグリーン共局在化)によって標識されます。成熟したFab標識タンパク質は核に局地化する。この細胞は、ビーズのロード後4〜15時間画像化した。黄色い矢印は、細胞分裂前の細胞核および細胞分裂後の核を識別する。スケールバー= 5 μm略語: MCP = MS2 コートタンパク質この図の大きなバージョンを表示するには、ここをクリックしてください。
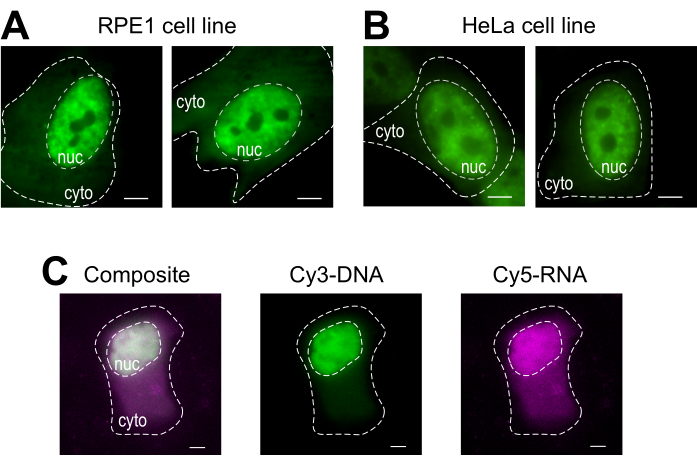
図4:ビーズローディングプロトコルのセルタイプローディング材のバリエーション(A-B)RPE1(A)およびHeLa(B)細胞は、4μLの負荷溶液中に1.5μgの核Fabタンパク質(抗RNAPII-セリン5リン酸化)をビーズロードした。各細胞の核(nuc)と細胞質(細胞)がマークされています。ビーズをロードした後、細胞を6時間画像化した。スケールバー=5μm(C)ヒトU2OS細胞は、Cy5-RNA 9mer(マゼンタ)およびCy3-DNA28mer(緑色)オリゴ、それぞれ10個のピコモール、4μLのビーズローディング溶液でビーズをロードした。ビーズをロードした後、細胞を4時間画像化した。すべての細胞核は破線で強調表示されます。スケールバー= 5 μm略語: RNAPII = RNAポリメラーゼ II.この図の大きなバージョンを表示するには、ここをクリックしてください。
| セルライン | セルタイプ | ビードローディングの有効性 | ノート/リファレンス |
| 幹細胞(ヒト) | 胚性幹細胞 | 難しい | *多くの細胞は、ゼラチンコーティングされたプレートにメッキされた場合、ビーズのロード中に剥がれます |
| ヘク 293 | ヒト胚性腎臓細胞 | 難しい | *ビーズのロード前にゲルマトリックスをイメージングチャンバー表面に置く必要があります。最初にビーズをロードするときに優しくタップします。 |
| ニューロン (ラット) | 初発性胚性ニューロン(e-18)、解約 | 非常に非効率的 | *ニューロンの効率的なビーズの負荷は、この標準のビーズ負荷プロトコルを使用して観察されませんでした。これは、ニューロンの非接着性の性質または結果的な神経プロセスへの損傷による可能性があります。 |
| MDCK (イヌ) | マディン-ダービーイヌ腎臓細胞 | マクニールとウォーダーを見る (1987)14 | *低効率ビードローディング14 |
| U2OS (人間) | 骨肉腫 | 標準ビードローディングプロトコル | |
| ヘラ (人間) | 子宮頸癌 | 標準ビードローディングプロトコル | |
| RPE1 (人間) | hTERTで不死化した上皮細胞 | 標準ビードローディングプロトコル | |
| HFF (人間) | 原発性包皮線維芽細胞 | フェセイロら(2009)31を参照してください。 | *31をタップする代わりに傾きのプロトコルを変更 |
| BALB/c 3T3、NIH 3T3、およびスイス3T3(マウス) | 胚性線維芽細胞 | ギルモアとローマー(1996)32、エマーソンら(2014)33とマクニールとウォーダー(1987)14を参照してください。 | *425~600 μmのガラスビーズ報告32 |
| ※200~300 μmのガラスビーズ33 | |||
| *75 μmガラスビーズは400 μm14より良い結果を与えた | |||
| DM (インドのムンジャク) | 皮膚線維芽細胞 | 「マダーズ、木村、クック」(1999年)34を参照してください。 | |
| チョ(ハムスター) | 上皮状の卵巣細胞 | メメドゥーラとベルモントを見る (2003)35 | *使用済み 425~600 μm ガラスビーズ35 |
| BAE (牛) | 牛大動脈内皮細胞(BAEC-11) | マクニールとウォーダーを見る (1987)14 | *75 μmガラスビーズは400 μm14より良い結果を与えた |
| PtK-2 (ポトムストリダカリリス) | 上皮性腎臓細胞 | マクニールとウォーダーを見る (1987)14 | *75 μmガラスビーズは400 μm14より良い結果を与えた |
| ハベック (人間) | 臍静脈内皮細胞 | ギルモアとローマーを見る (1996)32 | ※中古425~600μmのガラスビーズ32 |
| J774 および J774.2 (マウス) | 単球マクロファージ細胞 | ベッカーら(2005年)36とマクニールとウォーダー(1987)14を参照してください。 | *穏やかな攪拌(タッピングの代わりに)および425-600 μmのガラスビーズ36 |
| MS-5 (マウス) | 骨髄間質細胞 | モレナールら (2003)37 | |
| WPE1-NB11 (ヒト) | 前立腺上皮細胞 | ギルモアとローマー(1996)32と | ※中古425~600μmのガラスビーズ32 |
| エマーソンら (2014)33 | ※200~300 μmのガラスビーズ33 |
表1:異なるセルラインでのビードのロード。 この研究室でまだビーズがロードされていない細胞株については、プロトコルのバリエーションに関する参照と注意事項が提供されています。
補足ビデオ 1: ビーズをロードしたセルの細胞分裂の例。 U2OS細胞は、14.4 kbpプラスミド smFLAG-KDM5B-15xBoxB-24xMS2、0.5 μgのCy3-共役アンチフラッグファブ(緑)、130 ngのハロタタグ-MCP(マゼンタ)を8 μLのビーズローディング溶液に1.5 μg搭載しました。イメージングの直前に、ハロタグをJF646-ハロリガンドで染色しました。レポータープラスミドから転写されたmRNAのMS2ステムループはMCP(マゼンタスポット)によって標識され、FLAGタグ付けされた翻訳されたレポータータンパク質は抗FLAG Fab(mRNAへのグリーン共局在化)を介して標識されます。成熟したFab標識タンパク質は核に局地化する。この細胞は、ビーズのロード後4〜15時間画像化した。スケールバー= 10 μm略語: MCP = MS2 コートタンパク質 こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
ここで説明するビーズローディング技術は、高分子やその他の粒子を接着細胞に導入するための費用対効果と時間効率の高い方法です。この多目的なプロセスは、タンパク質(図2A)15、16、26、27、タンパク質とプラスミドの組み合わせ(図2B、C)22、25、RNA(図4C)、100および250 nmポリスチレンビーズ(パーソナル対応)、合成染料39または量子ドット34、40をロードすることができます。.ビーズローディングは、他のタイプの膜不浸透性粒子を同様にロードする能力を有し得る。その最も頻繁に使用されるアプリケーションは、抗体またはFabsをロードして、翻訳後修飾(PTM)などの内在性エピトープを生細胞にロードすることです。PTMなどの標的は、PTM特異的に、遺伝的にコードされたプローブ41、42を確立せずに生細胞で標識することがしばしば困難である。これに対し、ビーズローディングでは、複数のプローブ、レポーター、その他の分子ツールを同時に同じセルに導入し、複数の読み出しを同時に監視することができます。ビーズの装填は、様々な高分子や粒子を装填するのに役立つ技術になると予想しています。
ビードローディングの主な利点は、低コストです:各実験は0.01 USD未満の費用がかかります。ビーズローダー装置は、他の細胞ローディング法よりも大幅に安価な合計〜150ドルの安価な材料を使用して簡単に作ることができます。再利用可能な金属チャンバーをプラスチック製のチャンバーに置き換えることで、ビーズローダー装置のコストをさらに10ドル以下に抑えることができます。このためには、35 mmのチャンバーに穴を開けるか、35 mmのガラス底のチャンバーからガラスを取り外し、その後、しっかりとテープで所定の位置にメッシュを固定します。装置の代わりに、ビードローディングは、広孔1000μLピペットチップを使用して細胞にビーズをすくい、振りかけることさえできますが、この変動は細胞にビーズの単層を振りかけるのが困難です(ステップ4.6)。
ビーズローディングのもう一つの利点は、細胞が正常な全体的な形態を保持し、急速に回復し、少なくともここで研究されたU2OS、RPE1、およびHeLa細胞および他の場所で研究された他の細胞株のために成長し、分裂し続けることができるということです(図 3;図 4A,B;補足ビデオ 1;および表 1)31.ビーズのロード中、細胞は物理的ストレスを受け、時には剥離や剥離(最適な条件下では細胞の5%が剥離するが、ビードの負荷が強くなりすぎたり、ガラスビーズが多すぎると細胞の上にロードされると細胞が大きく失われる可能性がある)。しかし、カバースリップに取り付けられたままのビーズを積んだ細胞は、通常、正常に見え、ビーズのロード後に30分ですぐに画像を作成できます(図3A)。我々は一般的に細胞に30分の回復期間を許可するが、より早くポストビーズのロードが可能であることを予想する。
この技術の大きな欠点は、細胞がロード中に軽微な物理的ストレスに耐えることができ、カバースリップにしっかりと付着し続ける必要があるということです。コーティングされたプレート(HEKおよび幹細胞など)上で成長した不十分/非接着性細胞株(HEKおよび幹細胞)は、しばしばビーズのローディング中に穏やかなタッピング時に剥離する。さらに、経験からは、一次ニューロンがビードの負荷に敏感すぎることが分かっています。
ビーズの負荷は単一細胞または単一分子の実験に最も適している。我々の経験では、ビーズローディングは約20〜40%のタンパク質負荷効率を有し、ビーズを積んだ細胞の約20%も共装プラスミドを発現した(図2A、B)。したがって、ビーズローディングプラスミドは、ビーズローディング精製タンパク質よりもタンパク質発現の効率が悪い可能性があります(特に、核輸入、転写、翻訳など、それぞれが発現効率を低下させる可能性があるため)。ビーズをロードしたプラスミド発現の低効率は、リポフェクションなどの代替トランスフェクションプロトコルを用いて、ビーズローディングタンパク質またはプローブ16,27の前に回避することができる。さらに、ビーズローディング前に30分間最適培地中の細胞をインキュベートすることは、プラスミドの発現を助けるかもしれない。低プラスミド発現のため、この研究室では、ビーズローディングは、リポフェクションベースのトランスフェクションの代替として使用されることがあまりありません。唯一の例外は、Fabなどの精製タンパク質が共装される場合であり、その場合は同時にタンパク質とプラスミドをビーズロードするのが非常に便利です。さらに、リポフェクションに対して反応しない、または不耐性である細胞に対して、ビーズローディングは、一過性プラスミド発現のための代替的な、低効率ではあるが、方法を提供し得る。
開示事項
著者らは開示する利益相反はない。
謝辞
私たちは、このプロトコルを改善し、開発するのに役立った無数の会話のためにStasevichラボのメンバーに感謝しています。具体的には、リンダ・フォレロ博士とフィル・フォックス博士が、異なる細胞タイプのビーズのロードに関するアドバイスを求めています。ガラスビーズの積み込みプロトコルを共有してくださった林高中陽子先生、佐藤裕子先生、木村博先生に心より感謝申し上げます。アショク・プラサド博士とディエゴ・クラプ博士は、無機粒子を細胞に導入するためのビーズローディングプロトコルを寛大に共有してくれたことに非常に感謝しています。トラヴィス・サンダース博士、クレイグ・マーシャル博士、トーマス・サンタンジェロ博士がラベル付きRNA試薬を寛大に共有してくれたことに感謝しています。ALK、MNS、CAC、GG、TJSは、国立衛生研究所(NIH)助成金R35GM119728と国立科学財団(NSF)キャリア助成金MCB-1845761、両方のTJSに支援されました。CACは、NSF NRTアワードDGE-1450032によってもサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 10 cm cell culture dishes | VWR | 82050-916 | Use to culture cells |
| 35 mm cell culture dishes | Falcon | 353001 | Use to construct bead loader |
| Attofluor Cell Chamber | Thermo Fisher Scientific | A7816 | Use to construct the custom bead loader |
| DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960069 | Use in general cell culture |
| Drierite Indicating Absorbents | Thermo Fisher Scientific | 07-578-3B | Store the bead loader in a desiccator with these absorbent pellets |
| Fetal Bovine Serum | Atlas Biologics | F-0050-A | Use in general cell culture and as a supplement before bead loading |
| Glass beads, acid washed, ≤106 µm* | Millipore Sigma | G4649 | Sprinkle on cells to bead load plasmid DNA and proteins |
| Glass bottom dishes, 35 mm, #1.5, 14 mm glass | MatTek Corporation | P35G-1.5-14-C | Seed cells onto these chambers for imaging |
| L-Glutamine-200 mM | Thermo Fisher Scientific | 25030081 | Use to make DMEM + media |
| Opti-MEM, Reduced Serum Medium | Thermo Fisher Scientific | 31985070 | Optimal media for incubating cells before bead loading (optional step) |
| Parafilm | VWR | 52858-032 | waxy film used to construct bead loader |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140-122 | Use to make DMEM + media |
| Phenol-free DMEM | Thermo Fisher Scientific | 31053036 | Use on cells before imaging |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9625 | Working stock of sterile 1X PBS |
| Sodium Hydroxide (NaOH) | Thermo Fisher Scientific | S318-500 | Use 2 M solution to wash glass beads |
| Spectra Mesh Woven Filters, Polypropylene, 105 µm opening | Spectrum Labs | 148496 | Use to construct bead loader |
| Trypsin | Thermo Fisher Scientific | 25300062 | Use in general cell culture |
参考文献
- Stewart, M. P., et al. In vitro and ex vivo strategies for intracellular delivery. Nature. 538 (7624), 183-192 (2016).
- Felgner, P. L., et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proceedings of the National Academy of Sciences of the United States of America. 84 (21), 7413-7417 (1987).
- Schenborn, E. T., Goiffon, V. DEAE-dextran tansfection of mammalian cultured cells. Methods in Molecular Biology. 130, 147-153 (2000).
- Celis, J. E. Microinjection of somatic cells with micropipettes: comparison with other transfer techniques. Biochemical Journal. 223 (2), 281-291 (1984).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. Journal of Biological Chemistry. 264 (26), 15494-15500 (1989).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. American Journal of Physiology. 260 (2), 355-363 (1991).
- Potter, H. Transfection by electroporation. Current Protocols in Molecular Biology. 62 (1), 1-6 (2003).
- Fawell, S., et al. Tat-mediated delivery of heterologous proteins into cells. Proceedings of the National Academy of Sciences of the United States of America. 91 (2), 664-668 (1994).
- Prior, T. I., FitzGerald, D. J., Pastan, I. Translocation mediated by domain II of Pseudomonas exotoxin A: transport of barnase into the cytosol. Biochemistry. 31 (14), 3555-3559 (1992).
- Walev, I., et al. Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3185-3190 (2001).
- Pitchiaya, S., Androsavich, J. R., Walter, N. G. Intracellular single molecule microscopy reveals two kinetically distinct pathways for microRNA assembly. EMBO Reports. 13 (8), 709-715 (2012).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98 (4), 1556-1564 (1984).
- Ortiz, D., Baldwin, M. M., Lucas, J. J. Transient correction of genetic defects in cultured animal cells by introduction of functional proteins. Molecular and Cellular Biology. 7 (8), 3012-3017 (1987).
- McNeil, P. L., Warder, E. Glass beads load macromolecules into living cells. Journal of Cell Science. 88 (5), 669-678 (1987).
- Hayashi-Takanaka, Y., et al. Tracking epigenetic histone modifications in single cells using Fab-based live endogenous modification labeling. Nucleic Acids Research. 39 (15), 6475-6488 (2011).
- Morisaki, T., et al. Real-time quantification of single RNA translation dynamics in living cells. Science. 352 (6292), 1425-1429 (2016).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Zhao, N., et al. A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo. Nature Communications. 10 (1), 2947(2019).
- Jedlitzke, B., Mootz, H. D. Photocaged nanobodies delivered into cells for light activation of biological processes. ChemPhotoChem. 5 (1), 22-25 (2021).
- Coulon, A., et al. Kinetic competition during the transcription cycle results in stochastic RNA processing. eLife. 3, 03939(2014).
- Pichon, X., Robert, M. -C., Bertrand, E., Singer, R. H., Tutucci, E. New generations of MS2 variants and MCP fusions to detect single mRNAs in living eukaryotic cells. Methods in Molecular Biology. 2166, 121-144 (2020).
- Koch, A., et al. Quantifying the dynamics of IRES and cap translation with single-molecule resolution in live cells. Nature Structural & Molecular Biology. 27, 1095-1104 (2020).
- Moon, S. L., et al. Multicolor single-molecule tracking of mRNA interactions with RNP granules. Nature cell biology. 21 (2), 162-168 (2019).
- Moon, S. L. Coupling of translation quality control and mRNA targeting to stress granules. Journal of Cell Biology. 219 (8), 202004120(2020).
- Cialek, C. A., et al. Imaging translational control by Argonaute with single-molecule resolution in live cells. bioRxiv. , (2021).
- Forero-Quintero, L. S., et al. Live-cell imaging reveals the spatiotemporal organization of endogenous RNA polymerase II phosphorylation at a single gene. bioRxiv. , (2020).
- Lyon, K., Aguilera, L. U., Morisaki, T., Munsky, B., Stasevich, T. J. Live-cell single RNA imaging reveals bursts of translational frameshifting. Molecular Cell. 75 (1), 172-183 (2019).
- JoVE. Introduction to Fluorescence Microscopy. General Laboratory Techniques. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Hayashi-Takanaka, Y., Yamagata, K., Nozaki, N., Kimura, H. Visualizing histone modifications in living cells: spatiotemporal dynamics of H3 phosphorylation during interphase. Journal of Cell Biology. 187 (6), 781-790 (2009).
- Kumar, P., Nagarajan, A., Uchil, P. D. Analysis of cell viability by the MTT assay. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Stasevich, T. J., et al. Regulation of RNA polymerase II activation by histone acetylation in single living cells. Nature. 516 (7530), 272-275 (2014).
- Besteiro, S., Michelin, A., Poncet, J., Dubremetz, J. -F., Lebrun, M. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLOS Pathogens. 5 (2), 1000309(2009).
- Gilmore, A. P., Romer, L. H. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Molecular Biology of the Cell. 7 (8), 1209-1224 (1996).
- Emerson, N. T., Hsia, C. -H., Rafalska-Metcalf, I. U., Yang, H. Mechanodelivery of nanoparticles to the cytoplasm of living cells. Nanoscale. 6 (9), 4538-4543 (2014).
- Manders, E. M. M., Kimura, H., Cook, P. R. Direct imaging of DNA in living cells reveals the dynamics of chromosome formation. Journal of Cell Biology. 144 (5), 813-822 (1999).
- Memedula, S., Belmont, A. S. Sequential recruitment of HAT and SWI/SNF components to condensed chromatin by VP16. Current Biology. 13 (3), 241-246 (2003).
- Becker, T., Volchuk, A., Rothman, J. E. Differential use of endoplasmic reticulum membrane for phagocytosis in J774 macrophages. Proceedings of the National Academy of Sciences of the United States of America. 102 (11), 4022-4026 (2005).
- Molenaar, C., et al. Visualizing telomere dynamics in living mammalian cells using PNA probes. The EMBO Journal. 22 (24), 6631-6641 (2003).
- Jones, S. A., Shim, S. -H., He, J., Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nature Methods. 8 (6), 499-505 (2011).
- Sabri, A., Xu, X., Krapf, W. M. Elucidating the origin of heterogeneous anomalous diffusion in the cytoplasm of mammalian cells. Physical Review Letters. 125 (5), 053901(2020).
- Sato, Y., et al. Genetically encoded system to track histone modification in vivo. Scientific Reports. 3, 2436(2013).
- Sato, Y., Stasevich, T. J., Kimura, H. Visualizing the dynamics of inactive X chromosomes in living cells using antibody-based fluorescent probes. X-Chromosome Inactivation. Methods in Molecular Biology. 1861, Humana. New York, NY, USA. 91-102 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved