Method Article
真核細胞からのトランスレーショナル複合体の迅速な インビボ 固定と分離
* これらの著者は同等に貢献しました
要約
生きた酵母や哺乳動物細胞におけるホルムアルデヒド架橋を用いた翻訳(タンパク質生合成)複合体を迅速に安定化させる技術を紹介する。このアプローチにより、一過性の中間体と動的RNA:タンパク質相互作用の解剖が可能になります。架橋された複合体は、深いシーケンシングベースのプロファイリング方法、顕微鏡、質量分析など、複数のダウンストリームアプリケーションで使用できます。
要約
メッセンジャーRNAの迅速な再分配とmRNA翻訳の変化を伴う迅速な応答は、細胞の継続的なホメオスタティック調整に関連しています。これらの調整は、真核細胞の生存性と栄養素や塩分濃度、温度、および様々な化学的および放射線ストレスの変動中に「ダメージコントロール」に不可欠です。RNAレベル応答の非常に動的な性質と、RNA:RNAおよびRNA:タンパク質中間体の多くの不安定性のために、細胞質RNA状態の有意義なスナップショットを得ることは、限られた数の方法でのみ可能です。トランスクリプトーム全体のRNA-seqベースのリボソームプロファイリング型実験は、翻訳制御のための最も有益なデータ源の一つです。しかし、均一なRNAとRNA:タンパク質の中間安定化の欠如は、特にテンポの速い細胞応答経路において異なるバイアスを引き起こす可能性があります。本稿では、RNAとRNA:タンパク質の中間安定化を助けるために、異なる透過性の真核生物細胞に適用可能な迅速な固定の詳細なプロトコルを提供します。さらに、リボソームとポリ(リボ)ソマル画分との共沈下に基づく安定化RNA:タンパク質複合体の分離例を提供します。分離された安定化材料は、その後、翻訳複素プロファイルシーケンシング(TCP-seq)アプローチおよびその誘導体など、リボソームプロファイリング型実験の一部として使用することができます。TCP-seqスタイルの方法の汎用性は、様々な生物および細胞タイプのアプリケーションによって実証されています。安定化された複合体は、架橋反転の容易さのために、電子顕微鏡法を用いてさらに親和性精製および画像化を行い、異なるポリ(リボ)ソマル分画に分離し、RNAシーケンシングを行う。したがって、スナップ冷却およびホルムアルデヒド固定に基づく方法、続いて沈積物ベースまたは他のタイプのRNA:タンパク質複合体濃縮に基づく方法は、生細胞における急速なRNA:タンパク質複合体のダイナミクスのより細かい詳細を調査することに特に関心を持つことができます。
概要
生物は寿命を通じて動的な細胞内および細胞外の変化を受け、恒常性を維持し生存を確保するために迅速な応答を必要とする。環境適応を可能にするために、真核細胞は遺伝子発現制御を通じて代謝を調節する。遺伝子発現制御は、転写および/または翻訳中に行うことができます。一般に、1、2、3、4が急速に発生する翻訳応答を伴う。例えば、トランスレーショナル変化は通常、ストレス発症から1〜30分以内に起こり、転写レベルの変化はストレス暴露3、4、5の数時間後に続く。翻訳出力への変化は、細胞質におけるメッセンジャー(m)RNA分子の持続性の可用性により、より迅速に達成される。逆に、転写レベルでは、新しいmRNA分子を合成する必要があり、真核生物では、処理および核からの輸出、応答時間2、4、6、7、8に広範な遅延を生じさせる。
ストレスに対する急性翻訳応答は、一般的に、細胞生存に必要なタンパク質の選択的アップレギュレーションを伴う、翻訳出力の全体的な減少によって特徴付けられる1,3,4,9.タンパク質の生産量を減らすことは、プロセスの高いエネルギー費のために重要であると考えられています3,7.選択的阻害およびアップレギュレーションを促進するために、翻訳応答は複雑な調節メカニズムの範囲によって提供される。翻訳のすべての段階で規制を発揮することができます:開始、伸長、ポリペプチド生合成の終了およびリボソームリサイクル10,11,12,13が、開始段階で最も強く示されるが、5,7,9,10,13.開始中、真核開始因子(eIF)に助け子の小さなリボソームサブユニット(SSU)が結合し、開始コドンが認識されるまでmRNAの5'未翻訳領域(UTR)をスキャンする2,5,6,8,11,12,13.規制メカニズムは、アタッチメント、スキャン、コドン認識の開始に影響を及ぼす eIF をターゲットにすることが多い。例えば、開始因子eIF2は、開始者Met-tRNAの採用を支援する必須の翻訳因子であるiMet SSUに、しばしばストレス状態下で真核生物の標的にされる4,6,11.酵母では、この因子のリン酸化は、栄養欠乏と浸透ストレスの下で誘発され得る1,4,11,14,15、哺乳動物細胞では、アミノ酸飢餓、小胞体(ER)ストレス、UVストレス、ウイルス感染、および酸素レベルの変化がこの応答を引き起こす可能性がある8,9,11.特定のmRNA翻訳の急速なアップレギュレーションは、低酸素症に対する哺乳類細胞応答において明らかであり、これは低酸素誘導因子(IIF)生合成の世界的な急速な翻訳阻害および選択的アップレギュレーションを示す。IIFは転写因子であり、DNA転写レベルで長期的な細胞リプログラミングを引き出す8,9,16.熱ストレス下の酵母でも同様の反応が観察されており、熱ショックタンパク質(HSP)の迅速な翻訳発現に続いて転写レベルの応答が遅れている17,18.栄養不足や熱ショックに加えて、酵母の翻訳応答は様々な酸素の下で研究されています8,19塩分5、リン酸、硫黄20,21 と窒素22,23 レベル。この研究は、ベーキングや発酵などの酵母の産業用途に広く影響を及ぼします。24,25.翻訳応答は、酸化ストレスなどの細胞内ストレスを特徴とする神経変性疾患や心臓病などの疾患の理解を深めるのにも役立つ可能性があります。全体として、翻訳応答は遺伝子発現制御に不可欠であり、真核生物の幅広いストレス状態への迅速な適応を促進します。
翻訳応答を研究するためには、翻訳ランドスケープの歪みが最小限のスナップショットを提供する方法が必要です。ポリソームプロファイリングは、mRNA間の翻訳の研究で使用される古典的なアプローチであり、ショ糖勾配26、27を介した超遠心分離によるmRNAのポリ(リボ)ソマル分画の分離を含む。このアプローチは、個々のmRNA(逆転写およびポリメラーゼ連鎖反応、RT-PCR26などの検出方法を用いた)またはハイスループット技術(マイクロアレイまたはRNA-seq28,29)と組み合わせて、全体的に翻訳のレベルを探索するために使用することができる。より進化したアプローチはリボソームプロファイリングであり、ゲノムワイドスケールでmRNA分子に沿ってリボソームを細長くする位置の研究と、トランスクリプトーム全体の翻訳の効率の推論と、主要および代替開始部位30、31の利用を可能にする。リボソームプロファイリングは、それらの上にリボソーム存在によって保護されたmRNA断片の分離およびシーケンシングを伴う。リボソームプロファイリングは、低酸素ストレス、熱ショックおよび酸化ストレス31、32を含む多くの条件にわたる翻訳力学に関するかなりの洞察を提供してきた。この技術は、酵母および哺乳類細胞を含む複数のソース物質タイプに適応されている。
ポリソームおよびリボソームプロファイリングは翻訳研究の能力を拡張する上で基本的なものであり、翻訳のプロセスには、これらの方法11,13では捕捉が困難な様々な翻訳中間体および複合体が含まれる。その他の制限は、翻訳複合体が特定の翻訳阻害剤(抗生物質)の添加によって生体内で安定化されるか、特定のリボソーム分布アーティファクト、または細胞リシス(抗生物質)または非特異的(高塩またはマグネシウムイオン)に対するex vivoに至るまで、迅速な応答タイプを研究する能力の欠如に起因し、短命またはより安定でない中間体の剥奪につながる。 34、35。
ホルムアルデヒドは、クロマチン免疫沈降(ChIP)や架橋免疫沈降(CLIP)研究などで核酸やタンパク質を架橋するために広く使用されています。その小さなサイズと優れた細胞透過性は、迅速なin vivoアクション36を可能にします。急速ホルムアルデヒド架橋に基づいて、リボソームプロファイリングアプローチは、変換複合体プロファイルシーケンシング(TCP-seq)10、36、37、38、39、40で拡張されました。酵母で最初に開発されたTCP-seqは、走査または終了後のSSU複合体および複数のリボソーム構成37、38、41、42を含むすべての翻訳中間体の捕獲を可能にする。この方法は、翻訳阻害剤とホルムアルデヒド架橋の両方の組み合わせアプローチを使用して翻訳の逮捕を容易にするために、いくつかの研究10、38、39、41、42で利用されています。更なる修飾バージョンの技術である選択的TCP-seq39は、架橋複合体の免疫精製を含む、TCP-seqアプリケーションの範囲を広げるため最近採用されている。ホルムアルデヒド架橋の迅速で効率的で可逆的な性質により、これらのアプローチは、特に非常に動的な翻訳レベルの応答経路の文脈において、一過性のmRNA:翻訳複雑な相互作用を研究するのに適しています。
包括的な翻訳複合体安定化と分離を目的とした in vivo ホルムアルデヒド架橋のプロセスを詳述する。酵母細胞と哺乳類細胞に対して、別々のプロトコルを提供しています(図1)。我々はさらに、その後の架橋安定化材料(図1)の使用例を概説し、免疫ブロット法(ウェスタンブロッティング)を用いた共精製タンパク質因子検出、免疫支援精製(または「免疫沈降」)IP)と、対象とする特定の因子を含む翻訳複合体の濃縮、電子顕微鏡およびRNAシーケンシング。
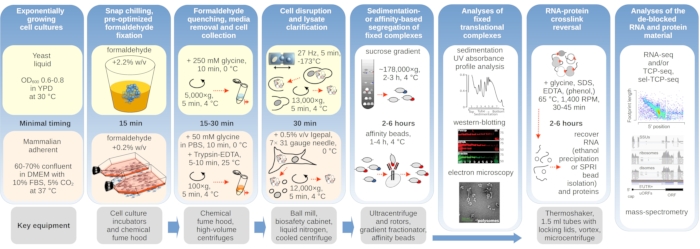
図1: 一般的な実験用セットアップの概要を示す回路図。in vivoのホルムアルデヒド安定化の主なステップは、主要な必要な機器に関する情報によって補足されたフローチャートとして描かれています。RNAのSPRIビーズ精製、RNAシーケンシング、質量分析など、このプロトコルでは採用に成功したが直接カバーされていない例を含む、架橋材料の潜在的な下流用途が概説されている。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
1. 酵母細胞プロトコル
- 酵母細胞培養と固定
注意:細胞の固定および収穫は修正と10、38から合わせられます。- 適切な培地(酵母エキスの1%w/v)で0.05 AU以下(OD600)の開始光学密度を有する軌道シェーカーに1 L酵母細胞培養(野生型(WT)BY4741が例として与えられる)を設定し、 ペプトンの2/v、デキストロース(グルコース)の2/v、例として使用されるアデニン硫酸(YPD)の40mg/L)を所望の条件下(30°C)で使用実験)。
- 酵母細胞の液体懸濁液培養液をペレット化するための、適合ローターおよび遠心分離ボトルを備えた先入遠心分離機を設置します。グルコース飢餓実験では、600 nmで0.6-0.8 AUの光学密度に達すると細胞をペレットにし、30°Cで短い遠心分離を使用し、1分間5,000 x gを使用する。
注: 成長する細胞の OD の記録を保持し、指数成長フェーズが関心がある場合は、OD600 が 0.6-0.8 AU に達するまで細胞を成長させます。 - ペレットを、無または低(0.25%w/v)を含むYP培地で直ちにグルコースを添加し、30°Cで30°Cでさらに10分間培養を軌道シェーカーインキュベーターに再懸濁させます。
注: メディア構成は、その後のクロスリンク効率に影響を与える可能性があります。このプロトコルは、YPD のみを使用してテストされました。飢餓実験を行う場合、タイミングを遵守し、手順間の遅延を最小限に抑えることは重要です。 - 細胞の準備ができたら、250gのきれいな砕いた水氷を含むビーカーでヒュームフードの中にアイスボックスを設置します。25 mLのストペットと購入したばかりのメタノール安定化37%w/vホルムアルデヒド溶液がフード内でアクセス可能であることを確認してください。砕いた水氷の25%w/vを含むビーカーに1 L培養物を注ぎます。
注: 特に指定がない限り、セルが凍結されるまで、その後のすべての操作を通して、細胞を氷の上に置いてください。 - ホルムアルデヒド溶液の77%w/vの75 mLを2.2%w/vの最終濃度に加え、氷が溶けるまで混合物を激しく攪拌します。
- 氷が溶けたら、タイマーを10分間設定します。
注:再現性のある固定結果を得るために推奨されるタイミングと温度のレジメンに従ってください。 - 10分間培養した後、培養液を予め冷却された遠心分離器ボトルに移し、4°Cで遠心分離して細胞をペレット化し、5,000 x gで 5分間培養します。このスピンがオンになっている間、50 mLチューブをプレクールし、準備したての緩衝液A(残りのホルムアルデヒドを中和するためにグリシンを含む)を氷の上に保管します。
注: 正確なバッファー構成については、提供されている表を参照してください。 - 遠心分離機の後、遠心管を氷に接触したペレット側の氷の上に置きます。チューブをヒュームフードに入れ、上清をホルムアルデヒド廃棄物容器に捨てます。
- 25 mLのストリッパーを使用して、50 mLのチューブに移すバッファー A の 20 mL ですべてのチューブから細胞ペレットを再懸濁します。
注:この洗浄は、再現不可能な架橋を避けるために重要であり、バッファの添加は、細胞の収穫から20分を超えてはなりません。 - バッファーAで最大40mLの体積を作り、4°Cで遠心分離して洗浄した細胞を5分間5,000xgで回収します。
- 上清を捨て、グリシンを含まない緩衝液A1の40mLの細胞ペレットを再懸濁し、グリシン汚染を除去する。
- ペレット細胞は4°Cで遠心分離することにより再び、5分間5,000xgとした。
- バッファー A1 でのこのス述をもう一度繰り返します。上清を捨て、細胞ペレットを氷の上に置きます。ペレットでチューブの重量を量る(湿った細胞塊は、細胞培養の1Lあたり〜1 gでなければならない)。
- 酵母細胞破壊と細胞ゾルの収集
- アルミニウムホイルを裏打ちしたポリスチレンフォームボックスに液体窒素を約3cmの深さまで充填します。箱の中に50mLのチューブを直立して置きます。
- ペレット(1g湿潤細胞質量)を550μLのバッファーA2に再懸濁し、10秒の渦を10秒にする。RNase阻害剤の40 U/μLの10 μLと10秒の渦を再び加えます。
注意: 液体窒素を取り扱う場合は、熱絶縁手袋などの適切な保護具を着用してください。液体窒素を保持するために使用される容器が漏れないようにし、内部のチューブラックが浮いたり、横に落ちたりしないようにしてください。酸素の枯渇を避けるために換気の良い領域で働く。 - 1 mL ピペットを使用して、液体窒素を含む 50 mL チューブに細胞懸濁液を滴下します。
注: 滴下は、液滴の凝集を避けるためにゆっくりと慎重に行う必要があります。新しい液滴を導入する前に、液滴が凍結することを確認してください。 - 凍結した細胞懸濁液を用いて50mLチューブを室温に移し、液体窒素が完全に蒸発するまで待ちます。チューブをキャップで密封し、セルペレットを-80°Cで保管するか、すぐにさらに進みます。
注意: チューブを密封する前に、液体窒素が完全に蒸発していることを確認してください。密閉チューブに残った液体窒素は、危険な圧力の蓄積を引き起こす可能性があります。 - 次のステップに備えて、ドライアイス上で1.5 mLヌクレアーゼフリーチューブと10 mLステンレススチール研削瓶をプレクールします。
- 凍結した細胞懸濁液を清潔で無菌のヘラを使用して瓶に移します。
注意: 研削瓶がしっかりと密閉されていることを確認してください。 - 粉砕瓶を液体窒素に1分間沈め、液相が接合部の下に残っていることを確認します。27 Hzのクライオミキサーミルを1分間攪拌します。
注: 加工に 1 つのキャニスターのみがサンプルで必要な場合でも、粉砕キャニスターと同じモデルの別のモデルのバランスを常に調整してください。 - ミキサーミルで1分間27 Hzで密閉された研削瓶を攪拌します。
- 粉砕瓶を液体窒素で以前のように再冷却し、ミキサーミルでさらに1分間27 Hzで振ります。
- 1.5 mLヌクレアーゼフリーチューブと一緒にドライアイスを含む氷箱に瓶を移します。小さなスチールヘラを使用して、得られた粉末サンプルを〜100mgのアリコートでチューブに移し、チューブを-80°Cで保存します。
注:実験ごとに、ポリソーム沈積プロファイル分析、翻訳された分画と非翻訳画分へのサイトゾルの分離、およびRNase消化時のSSU、リボソーム、および二数分分への翻訳された分画をさらに分離して構成するサンプルの約600mgを使用することをお勧めします。
- 固定(ポリ)リボソーム複合体と非翻訳分画の分離
注: 以前に確立された手順10,38一般的に、(ポリ)リボソームとの共沈下に基づいて翻訳されたRNAを濃縮するために続く。翻訳された細胞質と非翻訳された細胞質の分画を分離するためのより洗練されたアプローチがここに導入され、材料を沈殿させ、その後再溶解する必要性を排除する。- 薄い壁の超遠心チューブ(5 mL、13 x 51 mm)で凍結融解法43を使用して、バッファBで2.5 mLリニア10%〜20%のショ糖勾配を調製します。
注: フリーズ融解法は、互いの上に直線的に退行する濃度を持つバッファ付きスクロース層の順次付加と凍結によって行われます。詳細については 、補足表 1 を参照してください。 - 不連続な50%w/vスクロースクッションを作成するには、線形勾配の解凍と安定化時に、19 G x 1.5インチ針に取り付けられた1mLシリンジまたは同様の寸法/適切な寸法のガラス毛細血管を使用して、バッファBの50%スクロースの0.5mLをチューブの底に直接分配します。分配する前に、慎重かつゆっくりとそれがチューブ底に到達するまで、任意の妨害を避け、事前形成されたスクロース勾配の上から下に針または毛細血管の先端を駆動します。
メモ:バッファBの準備手順については 、補足表1 を参照してください。 - 慎重に上部を除去するか、バッファーBにスクロースの10 w/vを重ね、氷冷または4°Cに保つことによって、勾配のバランスを取ります。
注: 下の 50% スクロース層を持つ不連続勾配は、チューブ壁に沈殿することなく、より高い沈降率で材料を収集するために必要です。 - 凍結細胞粉末試料の解凍〜100mgを室温で、すぐに氷の上に置きます。150 μLのバッファーA2にピペットを加え、RNase阻害剤を1 U/μLに加え、ボルテックス(過度の発泡と気体相と混合を避ける)で10秒混合します。
注: 特に断らない限り、氷上に材料を保持しながら、すべての操作を続行します。 - 4°Cでチューブを遠心分離して細胞デブリをペレットにし、13,000 x g で5分間、新しい1.5 mLの低タンパク質結合チューブで清澄化上清(約150μL)を回収します。
- ステップ1.3.3から不連続なショ糖勾配チューブに得られた透明化混合物をロードし、慎重にそれらをバランスさせます。
- 4°Cの中容スイングバケットローターでチューブを超遠回しにし、平均gフォース287,980 x g(k ファクター49)で1時間30分間。
注:これらの条件は、底部(50)リボソーム分を濃縮しながら、勾配の上部(10%-20%スクロース)の上部(10%-20%スクロース)の部分に自由(非(ポリ)リボソームサブユニット)を保持するために(超遠心後の遠心勾配UV吸光度解析分析を使用して)事前に最適化されています。 - 翻訳された細胞質の分画を集めるために19 G x 1.5"の針が装備されている新しい生殖不能1 mLのスポイトを使用してください。安定したラックに 5 mL の勾配を配置し、チューブの底面が見えるようにします。
- チューブの上から、針を勾配の底にまっすぐに突き刺し(チューブを穿刺せずに)、気泡を作らずに穏やかに、翻訳されたRNAプールを含む底液の正確に0.5 mLを引き出します。
注:このステップは、冷たい部屋で行われ、チューブがしっかりと保持されていることを確認してください。グラデーションの乱れを避けるために、1 回のアップストロークモーションで 0.5 mL 全体を描画することをお勧めします。 - 超遠心分離の際にショ糖勾配の吸光度読み出しにより、得られた混合物中の(ポリ)リボソーム存在と、SSU、LSUおよび軽い分率の枯渇を確認する。
- 10 kDaカットオフ再生セルロース膜を備えたマイクロ濃度デバイスでの限外濾過を使用して、収集した翻訳されたRNAプールを前のステップから100 μLに濃縮します。
メモ:マイクロ濃度デバイスの膜を0.5mLのバッファ1( 図2a)で事前洗浄し、メーカーが推奨するスピン条件(g)を使用します。 - さらに、バッファー1で前のステップから材料を5回希釈し(400 μLを追加)、200 μLに濃縮して、スクロースの部分的な除去と同様に、より小さなボリュームを可能にします。
注: 得られた混合物を-80 °Cで6ヶ月まで保存し、'総翻訳RNA'RNA-seqライブラリ構造、またはTCP-seqライブラリ構造のRNase消化ステップの入力材料として使用することをお勧めします。「翻訳されていない」細胞質の分画は、同様の手順を使用して勾配の上端から回収し、-80°Cで保存することができます。
- 薄い壁の超遠心チューブ(5 mL、13 x 51 mm)で凍結融解法43を使用して、バッファBで2.5 mLリニア10%〜20%のショ糖勾配を調製します。
- 固定(ポリ)リボソーム複合体のRNase消化と、消化された物質を小さなリボソームサブユニット(SSU)、モノリボソーム(リボソーム、RS)、およびディリボソーム(ジソーム、DS)分数に分離する
注: 一般に、この手順は前述の方法に従います。10,38しかし、3つの全ての単離された分数にわたって最良の分解能を達成するために、変更された勾配タイプ、分離時間、加速度およびRNase消化条件が採用される。- 慎重にバランスのとれた12.5 mL線形10%-40%w/vショ糖勾配を調製し、13 mL薄壁ポリプロピレンチューブの緩衝1、14 x 89mm、ステップ1.3.1に記載されているフリーズ融解法43を使用して、その中に注意してください。
- 室温で解凍し、すぐに氷の上にサンプルを移すか、またはステップ1.3.12から濃縮され、スクロース枯渇翻訳サイトゾル分率を取ります。
注:特に明記されていない限り、氷上のすべての手順を続行します。 - 翻訳された細胞質の分率を、23°Cで30分間の分 画の 1OD260 単位当たり4.5 Uで混合して消化する。 RNase Iを不活性化できるRNase阻害剤を混合物に0.25 U/μLにして、RNase Iを不活性化させることですぐに加えて混合する。
注:AU 260=(μL中のライセートの1cmの光路x体積に相当する光学密度単位に標準化された260nmでの吸光度)/1,000を使用して、RNase I.誘導AU260を誘導するRNase阻害剤を使用してください。 - すぐにサンプルを氷に移します。
注意: 消化の推奨条件に従い、慎重に追加されたRNase Iの量を測定することが重要です。ここでいうRNase I単位は、37°Cで30分でマウス肝臓RNAから1μgの酸可溶性物質を生成するのに必要な酵素の量と定義され、RNase Iバッチは、活性に未定の変動を有し、最適な消化条件を達成するための実験を必要とすることがある。酵素ストックが濃縮しすぎる場合は、溶液の非常に少量のピペットを避けるためにバッファー1でそれを希釈することをお勧めします。 - ステップ 1.4.1 から 10%-40% w/v ショ糖勾配に反応混合物をロードします。
注:グラデーションごとに150〜300 μLの範囲の最終ボリュームを使用してください。各精製には、最小の2つの勾配が必要です。材料の異なる入力量(低いAU260、10-11AU 260、DS、SSUまたはRSの比較的高いAU260、13-14AU260)を使用して最適な分離を達成します。 - 4 °Cの中容スイングバケットローターのチューブを超遠回しに、平均g-force 178,305 x g(k ファクター143.9)で3時間30分間超遠回しにします。
注意: 予備のバランスチューブが必要な場合は、サンプル含有チューブで質量と質量分布を均等にします。スペアスクロース勾配は、サンプルオーバーレイと同等の量のバッファーと、均一なスクロース濃度のチューブと同等の量でオーバーレイして使用してください。 - 0.2 μmろ過重チェイス溶液(例えば、ここで使用される脱イオン水中の60%スクロース)を変位ポンプに充填するなど、超遠心分離スピン完了の少なくとも30分前に勾配分画装置を設定します。
注:脱イオン水を使用して分画器のラインとチューブを除染し、続いて脱イオン水、脱イオン水、および最後に80%エタノールを除イオン化水で1%-2%SDS溶液を除成することが推奨されます。 - 吸光度読み出しベースラインを調整するには、最初にシステムに脱イオン水を充填し、メーカーの推奨事項に従って光学系をゼロにし、サンプルチューブと同じバッファ(例えば、バッファ1)で作られた14 x 89 mmのスクロース勾配を使用してベースラインシフトを補正します。
注: 1.5 mL/min などのサンプルの読み出しと同じ変位速度を使用して調整を行います。 - 最初に検出器の光路に入り、最初に分数コレクタ出力に現れる溶液との間の時間を正確にカウントすることにより、変位システムのデッドボリュームを測定する。
メモ:推奨速度は1.5 mL/minで、分画は室温で行うことができます。採取した分数を氷上で直ちに移すことをお勧めします。 - 254 nmでの生光度読み出し、1.5 mL/min変位速度、サンプルの予想される沈み込み位置と吸光度プロファイルに基づくインライン画分検出を使用して分画を行います。前に測定したデッドボリュームに対応する時間遅延でコレクタチューブ切り替えを使用します。
- SSU、RS、DS複合体の位置と移動度に対応する分画を分離し、新しい低タンパク質結合1.5 mLマイクロ遠心チューブにそれらを収集します。すぐに氷上の単離された分画を移し、すぐにさらに処理されない場合は凍結する。
注:採取した分画をドライアイスまたは液体窒素で直ちにフラッシュフリーズし、-80°C以下で最大6ヶ月間保存することをお勧めします。
- リボソーム複合体の架橋解除とRNA-seqライブラリーの構築に用いられるRNAの単離
- クロスリンクを逆ブロック/逆にして、関連するタンパク質からRNAを分離するには、スクロースの勾配分の約半分を、蓋の安全/ロッキングデバイスを備えた新しい低核酸結合ヌクレアーゼフリーポリプロピレン1.5 mLマイクロ遠心チューブ(1チューブあたり350 μL)に移します。
- 40 μLの100%停止溶液(10%SDS w/vおよび100 mM EDTA)、25°C(10mM)で1 Mトリス-HCl pH 2の4μL、2.5Mグリシン(10mM)の1.6μL(10mM)および脱イオン化された核を得る40μLの体積に混合液を補う。
- 管の内容物をピペットで混ぜ、室温で管を移す。
- 酸性フェノールの等量を加える:クロロホルム:イソアミルアルコール125:24:1(pH 4.0-5.0)混合物を各チューブに加える。ボルテックスミキサーを使用して、最大速度に設定して2分間激しく混合物を振ります。
注意:フェノールとクロロホルムは腐食性および毒性がある。液体との物理的な接触を避け、換気の良い場所や煙のフードの下で働きます。フェノールやクロロホルムを使用する場合は、手袋、ラボコート、保護ゴーグル、またはフェイスシールドを使用してください。 - チューブをサーモシェーカーに入れ、65°C、1,400rpmで30分間連続的に振ります。
- 室温で10分間12,000 x g で混合物を遠心することにより、相凝集を促進します。
- 上の水相を収集し、新鮮な低核酸結合1.5 mLチューブに移します。
注: クロスコンタミネーションを避けるために、水相を完全に回収しないでください。適切なリカバリボリュームは300~350μLです。 - 収集した水相を、0.1容量の3 M酢酸ナトリウム(pH 5、25°C)、グリコーゲン20μg(5μg/μLストックを使用)、2.5体積の絶対エタノールで補います。慎重に1分間チューブをボルテックスして溶液を混合します。
- RNAを沈殿させるため、サンプルを-20°Cで2時間以上インキュベートします(一晩推奨)。
- チューブを室温まで温め、渦を混ぜて混ぜます。
注:チューブの事前の温暖化と室温でのその後の遠心分離(強制冷却なし)は、塩とフェノールの共沈殿と持ち越しを減らすのに役立ちます。これらの条件は、記載されているように、十分に純粋なエタノールを使用して行う場合、RNA採取の物質的損失または非効率をもたらさない。 - ペレットRNAは、チューブを12,000 x g で室温で30分間遠心して沈殿する。
- 上清を捨て、80%v/vエタノールでペレットを2回洗浄し、室温で10分間12,000 x g で遠心分離して毎回回収します。
- チューブ蓋を開け、開いたチューブを45°Cに設定して10分間乾燥ブロックに入れ、RNAペレットを乾燥させます。得られた乾燥ペレットを20 μLの1x HEバッファーに溶解します。
- UV吸光度スペクトル測定を用いて、得られたRNA濃度を推定する。
注:RNA断片の長さおよび全量は、自動蛍光ベースのキャピラリーゲル電気泳動装置などで変性ゲル電気泳動を使用してさらに評価することができます。
- SSU濃縮のタグ付きeIFおよびウェスタンブロット分析によるSSUの選択的共免疫精製
注:磁気IgGビーズを使用して親和性精製を行うために、ステップ1.4.11から消化および沈降分離SSU分率の〜15 AU(260 nm)を使用してください。SSU 分数の 5% を入力コントロールとして保存します (入力端数、I)。eIF4A タグ付け (TIF1-TAP;タンデムアフィニティー精製タグ)酵母株を用いた酵母株は、抗TAP抗体を用いてTAPタグをプローブすることによりeIF4Aを検出することも可能である。- 100 μL の磁気 IgG ビーズ懸濁液(1 mg のビーズを、各 15 AU (260 nm) のライセートまたは分数に使用した) を新しい低タンパク質結合1.5 mLチューブに移します。磁気ラックを使用してビーズを収集し、それらを吸引します。
- 磁気ラックを使用してピペット処理と回収により、1 mLのバッファー1で磁気ビーズを2回洗浄します。
- 洗浄後、マグネットラックに保管しながら、ビーズを回収してデカンにします。
- 洗浄ビーズにSSU分数を加え、〜20rpmに設定したシクロミキサーで4°Cで回転して4時間培養します。
- 4 °Cの磁気ラックを使用してビーズを収集し、上清(フロースルー画分、FT)を保存します。
- 4 mM DTTを加えたバッファー1でビーズを4°Cで2回洗浄し、各時間はシクロミキサーで10分間回転し、磁気ラック上のビーズを収集してデカントします。このスタイ(W1とW2の分数)を保存します。
- ウェスタンブロッティングなどの分析用途では、PH 8.5~1x、DTTを用いたLDS(ドデシル硫酸リチウム)ポリアクリルアミドゲル電気泳動(PAGE)サンプルバッファーを2mMに添加して、変性および還元条件下で結合材料を溶出します。
- 95°Cで熱ブロックで5分間加熱し溶出を確定します。
- 磁気ラックを使用してビーズを回収し、新鮮な低タンパク質結合1.5 mLマイクロ遠心分離管で変性溶出物(E分率)を回収します。
- 前のステップのE分を使用して、変性ドデシル硫酸ナトリウム(SDS)PAGEを直ちに実行するか、E分を-20°Cで保存します。
注:その後のアプリケーションに対するTAPタグ濃縮翻訳複合体の準備コレクションについては、タバコエッチウイルス(TEV)プロテアーゼを使用する代替溶出アプローチを使用してください。詳細については 、補足表 1 を参照してください。 - 希釈FT、W1およびW2画分を濃縮するために、3倍の量の氷冷アセトンを加えて材料を沈殿させる。サンプルアセトンミックスを-20°Cで3時間インキュベートします。
- ペレットは、4°Cで10分間13,000xgでチューブを遠心して沈殿する。
- 上清を捨て、開いたチューブのペレットを室温で30分間乾燥させます。
- ペレットを2 mM DTTで補った1x LDSローディングバッファの7 μLに溶解します。95°Cに設定した熱ブロックでサンプルを5分間加熱します。
- すべてのI、FT、W1、W2、およびEサンプルをアクリルアミド勾配の4%-12%w/v、ビストリスポリアクリルアミド変性ゲルにロードします。80 Vでバッファーを実行する1x MES SDS(2- [N-mopholino]エタンスルホン酸、ドデシル硫酸ナトリウム)を使用してゲルを実行し、タンパク質マーカー(10-250 kDa)がうまく解決し、鉛染料がゲルの底部に達するまでゲルを実行します。
注:コントロールとして、WCL(全細胞溶出)(2-10 μg)のシリアル希釈液をゲルにロードすることをお勧めします。分画材料全体にわたってゲルの同等の荷重を達成するために、いくつかの試みが必要な場合があります。 - ウェスタンブロッティング装置メーカーの推奨通り、冷たい部屋で100Vで1時間の湿式転写法によりゲルのタンパク質含有量をポリビニリデンジフルオリド(PVDF)膜に移します。
- 一定の揺れの下で室温で適切なブロッキングバッファー(リン酸緩衝生理食塩水ベース)を使用して膜をブロックします。
- 抗体希釈に関する製造業者の指示に従って、タグ付きeIF4Aタンパク質、抗Pab1p抗体または抗βアクチン抗体(または他の望ましい標的)を検出するための抗TAP抗体で膜をプローブし、ブロックバッファー(PBS)希釈抗体(1:1,000希釈)を用いた膜を一晩でインキュベーションします。
注:1:1,000抗体希釈は良い出発点です。 - 膜を1xリン酸緩衝生理食塩液で3回洗浄し、0.2%v/v Tween 20(PBST)をそれぞれ10分間洗浄します。
- 室温でシクロミキサーで1時間インキュベートすることにより、製造業者の指示に従って蛍光標識二次抗体で膜をプローブします。
注:1:20,000抗体希釈は良い出発点です。 - 1x PBSTで膜を3回洗浄し、それぞれ10分間洗浄します。膜を脱イオン水で簡単にすすいで、次に絶対メタノールですすいます。メーカーの指示に従って、蛍光イメージングシステムで膜を乾燥し、可視化します。
注:他のタンパク質の染色は、異なる蛍光チャネルに一致する色素を有する二次抗体(ここで使用されるeIF4A-TAP 対 β-アクチン対など)を使用して、同じ膜をシーケンシャル染色またはストリッピングして染色するか、または同じ分画のパターンを繰り返し含むゲルから膜を切断し、各部分をそれぞれの抗体で個別に検出することによって達成できます(ここで使用されるPab1p例のように)。
2. 哺乳類細胞プロトコル
- 哺乳動物細胞培養と固定
- 2 T-175フラスコでは、HEK293細胞をダルベッコの修飾イーグル培地で60%-70%合流し、37°Cで10%v/v胎児牛血清を37°C、5%v/v二酸化炭素で増殖させます。
注:完全な培地は、L-グルタミン、フェノールレッド、重炭酸ナトリウムを含む500mLの商業的に購入したDMEMに55mLの市販FBSを加えることによって作られていますが、HEPESまたはピルビン酸ナトリウムはありません。合流率70%でのT-175フラスコ当たりの細胞数は、1.7-2.0 x 107の範囲内にする必要があります。 - 所望の固定時間の少なくとも3時間前に、T-175フラスコの培地を完全な媒体の正確に30 mLに交換し、細胞インキュベーター内のフラスコを交換してください。
メモ:新鮮なメディアがフラスコの反対側にピペットでセルの単層にピペット化されていることを確認して、セルの剥離を避けてください。最小限のガスと温度バランスの乱れを導入し、できるだけ早くメディア交換を行うようにしてください。 - 細胞培地を交換したら、固定に必要なバッファーと化学物質を調製します。DPBSの500 mLボトルに2.5Mグリシンストックの10.2 mLを加えて混合することで、50 mMグリシンでダルベックコのリン酸緩衝塩(DPBS)を準備します。
- DMEMのボトルを、非滅菌条件で使用するステップ2.1.1と0.25%トリプシン-EDTAの100 mLアリコートとして10%FBSを補充して調製します。市販のDPBSの追加ボトルを塩化カルシウム(CaCl2)および塩化マグネシウム(MgCl2)であらかじめ配合した。
注:ソリューションは、最大2週間4°Cで保存することができます。 - T-175フラスコが上に均等に収まり、準備されたバッファと一緒にヒュームフードに入れておくことができるように、砕いた水氷で満たされた氷箱を準備します。
注:環境変化に対する翻訳の迅速な応答により、インキュベーターからの細胞フラスコの除去とホルムアルデヒド溶液の添加との間のすべてのタイミングを最小限に抑える必要があります。 - 細胞を冷却するために、インキュベーターからT-175フラスコを取り出し、氷にしっかりと押し付けて最大の表面接触を確保します。化学煙フードの内側で、フラスコを横に傾け、メディアが細胞の反対側に集まるようにします。ピペット168 μLの37%w/vホルムアルデヒドを直接プールされた培地に入れます(最終濃度は0.2%w/v)。フラスコを前後に軽く揺らすことですぐに混ぜ、フラスコを氷の上に閉じて再配置し、水平にして細胞が均等に覆われていることを確認します。
注意:ホルムアルデヒドは、長期的な悪影響を及ぼす可能性のある有害物質であり、呼吸器系と皮膚の両方に刺激を与えます。それは適切な化学発煙フードで扱われるべきである。ホルムアルデヒドの容器は、フームフードの外側で常に密封されなければなりません。
メモ:ホルムアルデヒドがフラスコの壁に直接添加され、フラスコの壁に追加されていないことを確認してください。ステップ 2.1.6 は 1 分未満かかります。 - さらに10分間氷の上にフラスコをインキュベートします。細胞とは反対側のフラスコ側を通して適切な廃棄物容器に媒体を注ぎ出す。
- ストレペットを使用して、カルシウムとマグネシウムイオンなしでダルベックコのリン酸緩衝生理食塩水の30 mLのピペットを使用し、さらに50 mMグリシンを含み、細胞と反対側の側に優しく含む。フラスコを揺らすことで混ぜます。フラスコを水平位置に戻し、氷の上でさらに10分間インキュベートします。
- 細胞とは反対側のフラスコ側から溶液を注ぎ、標準的な0.25%w/vトリプシン-EDTA溶液の7 mLを静かに加えて、細胞を取り外して再懸濁させます。フラスコを室温で5〜10分間インキュベートします。
注:トリプシンEDTAソリューションがすべてのセルを均等にカバーしていることを確認してください。細胞の剥離を促進するために、定期的な穏やかな傾きと揺りを使用してください。 - フラスコを垂直に移動し、ストリップレットを使用してフラスコの壁から残りの細胞を静かに洗浄することによって、切り離された細胞を収集します。懸濁液を氷上にセットした50mLチューブに移します。
メモ:固定セルはより脆弱になる可能性があります。フラスコ壁から細胞を取り外すために必要なもの以上に、強くまたはそれ以上のピペットをしないでください。 - 収集した細胞懸濁液を20 mLの完全な培地(10%FBSの非滅菌性の氷冷培地)ですぐに補い、チューブを軽くひっくり返して混ぜます。
注:完全な細胞培養培地(10%FBSを含む)を添加してトリプシンを中和し、細胞膜や細胞崩壊にさらなるダメージを与えないようにします。 - ペレットは、チューブを100xgで5分間及び4°Cで遠心して細胞をペレット化した。 細胞ペレットははっきりと見える必要があります。
- 培地を流し、細胞ペレットを10mLの氷冷DPBSでCa2+、Mg2+、グリシンなしで穏やかに再懸濁します。
- ステップ 2.1.12 を繰り返します。
- 洗浄バッファーを注ぎ、氷の上にグリシンなしでCa2+、Mg2+を使用して氷冷DPBSの800 μLで細胞ペレットを穏やかに再懸濁します。再懸濁した細胞を新しい低タンパク質結合1.5 mLマイクロ遠心分離チューブに移します。
- チューブを100xgで3分間、4°Cで遠心分離する。 1 mL ピペットを使用して上清を慎重に廃棄します。この段階では、細胞ペレットを-80°Cで凍結するか、細胞のリシスステップに進むことができる。
注:凍結細胞ペレットは、1年まで-80°Cで保存することができます。細胞ペレットの凍結は、その後のリシスを促進し、長期保存が計画されていない場合でも凍結を推奨することを発見した。
- 2 T-175フラスコでは、HEK293細胞をダルベッコの修飾イーグル培地で60%-70%合流し、37°Cで10%v/v胎児牛血清を37°C、5%v/v二酸化炭素で増殖させます。
- 哺乳類細胞破壊と細胞ゾルの収集
- バイオセーフティキャビネットに、非イオン性の非否定洗剤に基づく300μLのリシスバッファーと、40 U/μL RNase阻害剤の7 μLを加えます。1 mL チップを使用してピペット処理を行い、よく混ぜます。
- 慎重に1-3 mLの注射器に25G針を取り付け、少なくとも7つの遅い上向きの摂取量と速い下向きの排気ストロークを使用して、混合物を激しくピペットします。
- 注射器と針をシャープビンに捨て、31G針を装備した0.3 mLシリンジを使用して手順を繰り返します。
- 注射器と針をシャープビンに捨てます。4°Cでチューブを遠心分離し、12,000 x g で5分間細胞の破片をペレットします。
- 上清を新しい低タンパク質結合1.5 mLマイクロ遠心チューブに移します。両方を保管し、細胞デブリ(制御目的)と得られた透明化細胞のリセートを-80°Cで保管します。
注:2つのT-175フラスコを組み合わせ、推奨されるボリュームに続く場合、ライセートの光学密度は25-30 AU260 の範囲です。ライセートおよび細胞デブリは、1年まで-80°Cで保存することができます。
- 固定(ポリ)リボソーム複合体と非翻訳分画の分離
- 13 mL薄壁ポリプロピレンチューブで15%-45%w/vショ糖勾配を調製し、14 x 89mm、一般的に酵母プロトコルのステップ1.3.1に記載されているように凍結融解法を使用するが、緩衝液2を用いた(図2a)。
注:分画の前の夜4°Cの冷たい部屋で一晩勾配を解凍してください。 - 前のステップ2.2.5からバランスの取れた勾配に細胞のライセートの150-250(最大300)μLをロードします。残りのライセートを-80°Cで保存し、コントロール目的で使用してください。
注: ここでは、多染色体、リボソーム、および'自由'SSU画分への沈下ベースの分離の例が提供されています。代替の方法については、提供 されている補足表 1 を参照してください。 - 4°Cの中容振動バケットローターのチューブを超遠回しに、平均g-force 178,305 x g(k ファクター143.9)で1時間45分間。
- 30分のスピン完了の前に、酵母プロトコルステップ1.4.7-1.4.9で説明されているように、勾配分数を設定し、ベースライン化する。
- 一般的に、酵母プロトコルステップ1.4.10-1.4.11に記載されているように、勾配を分数する。
注:このステップは、多染色体、リボソーム、および'自由な'SSU分数を分離します。多染色体画分は、ポリソームプロファイリング実験で使用され得る。 - すぐに氷の上に収集された分数を移し、さらに処理されない場合は、-80°Cで6ヶ月まで保存します。
注:分数コレクタチューブの変更が、オンラインの端数識別および偏析と同期している場合は、最大800 μL分数(1.5 mL/min での分数当たり32秒の回収時間)を使用することをお勧めします。インライン吸光度読み出しを使用せずに分画を行う場合は、250~500 μLの画分(1.5 mL/minで10~20秒/分)を使用することをお勧めします。分離後、分画は、免疫精製、電子顕微鏡、変性PAGEおよびウェスタンブロッティングにすぐに使用するか、またはその後のRNAおよび/またはプロテオミクス分析のために架橋反転を行うことができます。
- 13 mL薄壁ポリプロピレンチューブで15%-45%w/vショ糖勾配を調製し、14 x 89mm、一般的に酵母プロトコルのステップ1.3.1に記載されているように凍結融解法を使用するが、緩衝液2を用いた(図2a)。
結果
翻訳複合体は、沈み込み特性が評価される超遠心化の間に特に重要であるバッファーのイオン組成に敏感である。したがって、我々は、並進複合体を解決し、リボソームサブユニット(SSU、LSU)、単群(RS)およびポリソームを勾配全体で解決するのに最も適した条件を選択するために、地中の非固定酵母材料から抽出された明確なライセートを使用して、いくつかの沈み込みバッファーをテストしました。すべてのバッファーは、25 mM HEPES-KOH pH 7.6 および 2 mM DTT を含むコア組成物に基づいていました。KCl、MgCl2、CaCl2、EDTAの濃度は、バッファー(図2a)にわたってさらに改変され、これらの成分は、勾配のロード前にライセートに加え、それに応じて、勾配鋳造前にスクロース勾配バッファーに添加された。
バッファー1および2では、適切に解決された翻訳複合体が得られた。バッファー1は、小さなリボソームサブユニット(SSUs)のやや良い分離をもたらした(図2a)。MgCl2の省略とEDTA(バッファ3,4)の添加は、ほとんどのポリソームの高い沈殿特性の損失を引き起こし、その部分分解の可能性が高い(図2a)。2.5 mMCaCl2を添加するとやや均質な多染色体ピークが生じる一方で、この場合の多染色体材料の全体的な量は緩衝液1および2と比較して減少した(図2a)。こうして、選択した作業バッファーとしてバッファー 1 を選択しました。
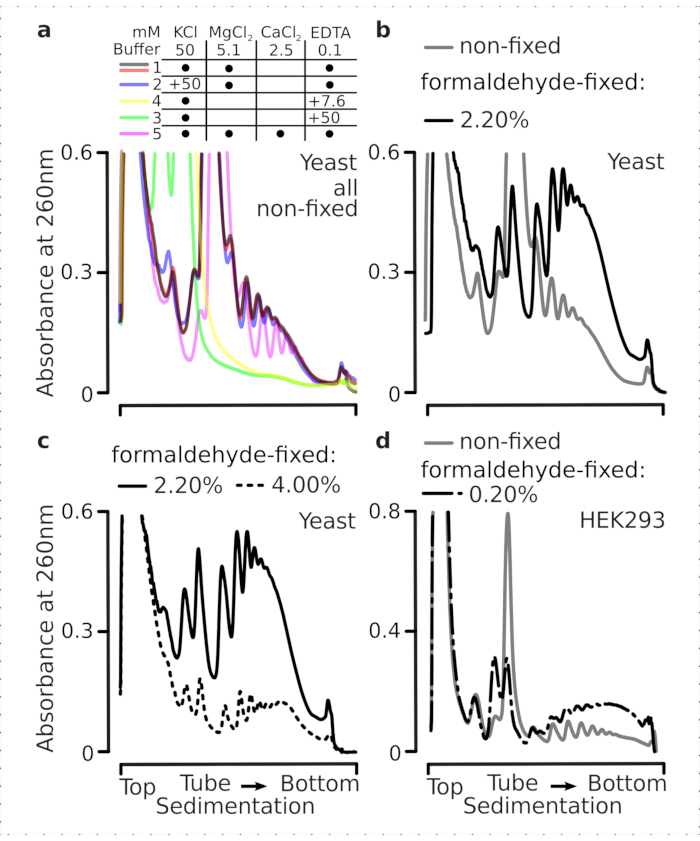
図2:並進複素抽出及び固定の安定化効果評価のためのバッファー条件 示されているUV吸光度プロファイルは、10%〜40%w/vショ糖勾配で分離された全酵母細胞リセートに対して260nmで収集された。(a)非固定酵母細胞から抽出された物質の沈下に及ぼす単価塩と二価塩とマグネシウムイオン隔離の影響赤と灰色の線は、典型的な反復を表します。(b,c)ホルムアルデヒド固定酵母細胞の非固定(灰色の線)、2.2%(黒い線)および4.4%(黒い点線)に由来するライセートの比較。(d) HEK 293T細胞のホルムアルデヒド固定(黒破線と点線)の0.2%w/vの最適化によるポリソーマの安定化(グレーライン)の材料と比較した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
次に、異なるホルムアルデヒド濃度の固定による多染色体安定化の効果を確認しました。それ以外の同じ細胞材料、バッファー、細胞処理およびタイミングアプローチを用いて、ホルムアルデヒドの2.2%および4%w/vで固定された非固定細胞と細胞から抽出された材料を比較した(図2b,c)。ホルムアルデヒドの2.2%w/vは、ポリソーム対単数比(図2b)で判断できるポリソームを優れた保存性を持つ一方で、ホルムアルデヒドの4%w/vに比べてリボソーム材料の全体的な収量を減少させなかったため、固定に適していることがわかりました(図2c)。
哺乳動物細胞由来の物質については、洗剤ベース抽出に必要な大きなリシスバッファー対細胞体積比に起因して、緩衝液2(図2a)を用いた。これは、ショ糖勾配における沈下時に十分に解決された翻訳複合体を生成した(図2d)。特に、0.2%w/vのホルムアルデヒド濃度がはるかに低く、高濃度が実質的な多染色体およびリボソーム物質損失をもたらした(データは示されていない)。酵母細胞で得られた結果と類似して、架橋安定化材料は、ポリソームの保存性とポリソーム対モノソーム比の向上を実証した(図2d)。
次に、選択したホルムアルデヒド固定条件が、架橋の結果として多染色画分内で積極的に翻訳されたmRNAを安定させるのに十分有効であるかどうかをテストし、多染色体収率の向上は酵素機能と翻訳伸び進行を阻害した結果だけではない。我々は、ポリソームとリボソームを不安定にするためにEDTAと高一価塩(KCl)を使用しました。これらの試薬は、透明化酵母細胞ライゼートに添加し、その後の全ての緩衝液およびショ糖勾配に、それぞれ緩衝液1組の上に含まれる。
実際、15mM EDTAは、固定細胞に由来する多染色体画分に対してより少ない不安定化効果を示し(図3a)、架橋された複合体がより強くであることを確認した。ホルムアルデヒド固定細胞の4%w/vの材料がより良く展開に抵抗したように、EDTAの不安定化効果は、ホルムアルデヒドの濃度を増加させることによっていくらか克服することができます(図3a)。しかし、EDTA濃度を50mMに増加させることで、材料の沈入が遅く、十分な形状のピークの欠如から推測できるように、固定条件と非固定条件の両方で大部分の翻訳複合体の不安定化をもたらした(図3b)。これは、mRNAからの多染色体成分の完全な解離ではなく、構造の部分的展開とコンパクトさの全体的な損失によって説明することができます。この場合でも、架橋材料はより速い沈み付きを実証している(図3b)。
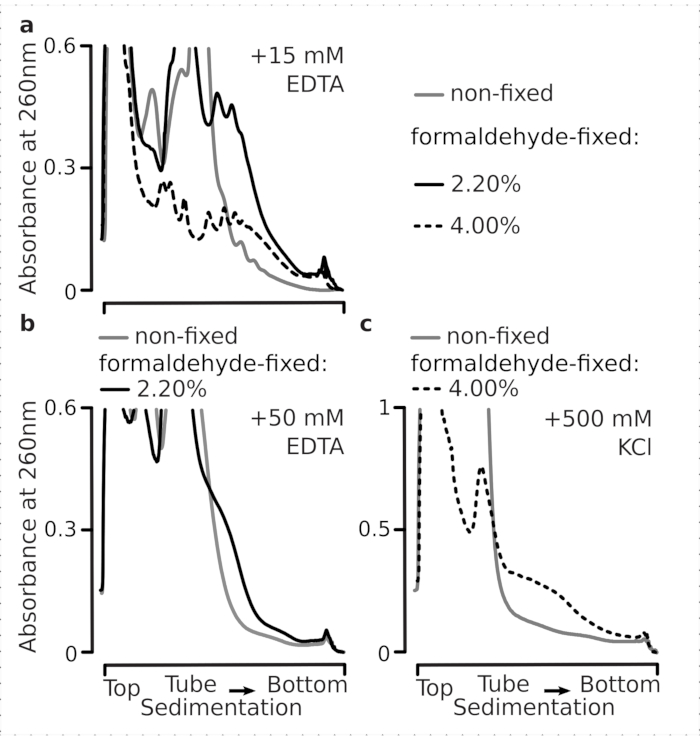
図3: インビボ 酵母ホルムアルデヒド固定がポリソームの安定性に及ぼす影響 バッファ1(テキストおよび 図2aを参照)は、すべての実験で使用された。 図 2 の凡例に示すように、データ型とプロット。(a)非固定(灰色線)に由来するポリソームの安定性に対する細胞ライセートおよびそれ以降の緩衝液への15 mM EDTAの添加の比較、2.2%(黒線)およびホルムアルデヒド固定細胞の4%(黒い点線)w/v。(b)は(a)と同じであるが、50 mM EDTAを添加し、ホルムアルデヒド固定細胞の4%w/vを除く。(c)は(a)と同じであるが、500 mM KClを添加し、ホルムアルデヒド固定細胞の2.2%w/vを除く。 この図の大きなバージョンを表示するには、ここをクリックしてください。
EDTA効果と同様に、500 mM KClで、ホルムアルデヒド固定の4%w/vで安定性の大幅な改善を見つけました(図3c)。この場合のコンパクト性の明らかな損失は、RNAからの完全な解離ではなく、リボソーム複合体の成分の部分的な剥離によっても説明することができる。全体として、ホルムアルデヒド固定細胞に由来するポリソームは、これらの複合体内に追加の共有結合を形成することと一致して、展開および構造的不安定化に対する耐性が高いことを示した。
成長条件を刺激する間、mRNAは、ポリリボソーム、またはポリソームとして知られている構造を形成する同じmRNA分子上に複数のリボソームの蓄積をもたらす迅速に開始することができます。ポリソームは、ショ糖勾配において超遠心分離によって分離することができ、そこで彼らの順序(mRNA上に同時に付着したリボソームの数)に基づいて沈下する。翻訳が抑制されると、リボソームはすぐに別の翻訳ラウンドに従事できず、ポリソームの(部分的な)「分解」をもたらし、これは、より低い順序のポリソームに向かってモーダルシフトとして示され、モノソーム4、26の蓄積となる。
多数形の分布レベルで視覚化できる翻訳応答のモデルは、グルコース飢餓によって提供することができる。グルコース枯渇は、酵母1、3、40に対する最も劇的で迅速な翻訳阻害効果の1つを引き出す。以前の研究では、グルコース枯渇の1分以内に、ポリソームの損失、単一体性の蓄積および翻訳開始の阻害が4に起こり得ることが証明された。グルコース再サプリメントの5分以内に、翻訳はポリソーム3、4の明らかな増加と迅速に回復する。また、細胞が0.5%以下のグルコースを含む培地に曝露した場合に翻訳が阻害され、0.6%(w/v)以上のグルコースレベルでは効果が見られなかったことも観察された。
したがって、我々は、多数対一数比で評価できるように、我々の固定条件がグルコースストレス応答のダイナミクス内の並進差の保存に適しているかどうかを判断することを望んだ。高グルコース(2.00%w/v添加)で中指数相で増殖した細胞の材料と、無添加または低い添加物(それぞれ0.00%または0.25%)のグルコースを含む培地に10分間移された細胞とを比較した。固定は、コントロールで並行してホルムアルデヒドの2.2%w/vを使用して行われ(非飢餓;グルコースを2%w/vを含む同じ標準培地との急速な培地交換、10分間のインキュベーションと固定)と10分の飢餓(同じ培地での急速な培地置換が低い0.25 w/vまたはグルコースなし、 その後、10分間のインキュベーションと固定)細胞が続きます。
以前の知見と一致して、酵母細胞はグルコース飢餓ストレス時の翻訳を大きく抑制することを観察した(図4a)。いずれも、ポリソーム分解を誘発する添加条件と低グルコース条件のいずれも、わずかにしかし明らかに多量のポリソームが低いグルコースを添加した場合に保持されている。したがって、酵母グルコース除去応答は、オールオンまたはオールオフタイプでないと、徐々に調整される。ホルムアルデヒド架橋の安定化作用に対する期待を肯定し、固定細胞からの多染色体物質は、飢餓細胞と非飢餓細胞の間でより高い区別を示しており、応答のより高いダイナミックレンジを確実に維持している(図4b)。興味深いことに、固定細胞からの材料の場合、低添加グルコース濃度は、非固定細胞と比較して、無添加のグルコース条件からはるかに優れた特異的多染色体豊富量をもたらした(図4a)。これは、並進応答中など、非常に動的なプロセスの平衡における比較的分差および一過性の違いを保存およびキャプチャする際のホルムアルデヒド固定法の適合性を強く示すものです。

図4:グルコース飢餓時の酵母翻訳の急激な変化を捉える。 バッファ1(テキストおよび 図2aを参照)は、すべての実験で使用された。 図 2 の凡例に示すように、データ型とプロット。(a)非飢餓(灰色線)、制限グルコース飢餓(0.25%w/vは10分間グルコースを加えた;茶色のライン)、グルコース枯渇(10分間グルコースを添加しない;赤線)非固定酵母細胞。(b) と同じ (a) が 2.2% w/v ホルムアルデヒド固定細胞の場合。 この図の大きなバージョンを表示するには、ここをクリックしてください。
sucrose勾配沈(「ポリソームプロファイリング」)を用いたmRNAの積極的な翻訳に関連するリボソームによる翻訳状態のモニタリングは、広く応用されている技術26、27、28である。定量的マイクロアレイ分析と組み合わせて、さらに最近では高スループットシーケンシング28、44を用いて、ポリソームプロファイリングはリボソーム関連mRNA転写体全体に関する情報を提供します。いくつかの仮定により、タンパク質生合成研究の分野では、多染色体存在がそれぞれのmRNAの翻訳に積極的に関与していることを示すものであると伝統的に主張されてきた。さらなる結論は、多くの場合(必ずしもではない)正当化され、特定の長さのmRNA(ポリソームの順序が高いほど高いほど)に存在するリボソームが、mRNAが翻訳に関与することがより積極的に正当化される。したがって、多ソーム分率を残りの物質から分離することは、活発に翻訳されたRNAを単離するという観点から有用であり得る。フットプリントプロファイリングアプローチ、特にTCP-seq10、38、39は、スキャン、開始および停止コドン複合体に由来する解放されたSUSの別々の集団を生成し、完全な単群またはポリソームと共沈着しないリボソームサブユニットを除去することがさらに洞察に富んでよい。
したがって、mRNAの「積極的な翻訳」プールから離れたフリーSSU(mRNAまたはmRNAを接続せずに単一のSSUまたはSSUに結合したmRNA)などの「非翻訳」mpRNPsを分離しました。これを達成するために、我々は、1つ(モノ−)または複数のリボソーム(ポリソーム)との相互作用に関与するmRNAを積極的に翻訳することができると仮定した。このような複合体は、その高い沈積係数によって他のものから分離することができます。また、mRNAの「積極的に翻訳された」プールを、チューブ壁の材料を直接ペレットするのではなく、スクロースクッション(スクロースの50%w/v)に分離することを提案しました。クッションへの速沈込複合体の遠心分離により、吸光度プロファイルの読み出しを使用して分離を監視し、ペレット化および再可溶化10,38と比較して、可溶化された非凝集および非変性材料のより高い出力を達成することができました。
全体として、個々のSUS、リボソーム、ジソーム、およびより高次のコンパクトに詰められたポリソームを精製するために、固定された透明化ライセートを2段階の超遠心分離プロセスを施した(図5)。最初のショ糖勾配では、超遠心分離は、勾配の上部(スクロースの10%〜20%w/v)部分に分離された自由なSSUおよびLsUをもたらしたのに対し、1つの完全なリボソームに関連するポリソームおよびmRNAを含む架橋された翻訳されたプールは、図の下端(50%w/vのスクロース)に集中した().翻訳されたmRNAプールを含むショ糖層の底部50%w/vを濃縮し、そのRNAをRNase Iで消化し、続いて2番目のショ糖勾配超遠心分離を行い、別々のSSU、LSU、RS、RNase耐性ジソーム(DS)および高次核抵抗性ポリソームのマイナーな分画を得る(図5b)。酢酸ウラニルによる陰性染色と透過型電子顕微鏡による撮像は、各沈積段階で単離された複合体の同一性を確認した(図5)。

図5:未翻訳RNA(a,c)回路図(左)およびそれぞれの代表的な結果(右;図2の凡例に記載されているデータタイプとプロット)の全翻訳RNA画分の単離(a)の非翻訳されたショ糖勾配分離(自由なSUSおよびリボソームと共沈入によって同定された翻訳mRNAプールを含む非翻訳されたショ糖の勾配分離) (c)制御されたRNase I消化および超遠心分離によって、SSU、LSU、リボソーム(RS)、およびヌクレアーゼ耐性ジソマル(DS)画分への第2の線形ショ糖勾配によって、翻訳されたmRNAプールから遊離した個々のリボソーム複合体の分離。非飢え消化材料の高(15 AU260)および低(8 AU260)量が含まれ、マイナーな分数が関心のある場合に超遠心負荷を増加させる可能性を示す。高次ヌクレアーゼ耐性ポリソームも同定することができる(例えば、トリソームは提供例で)。(b,d)ウラニル酢酸対照画の代表的なTEM画像(a,c)からそれぞれラベル付けされた。この図の大きなバージョンを表示するには、ここをクリックしてください。
一過性リボソーム関連タンパク質(特にeIF)の保持に対する固定レジメンの適合性を確認するために、リボソーム分画を横切ってリボソームに動的に結合する不安定性eIF4Aの共沈着について試験した。eIF4Aタンデム親和性精製(TAP)タグ付き酵母株(TIF1-TAP)を利用し、抗TAP抗体を用いて固定細胞と非固定細胞に由来する物質中のeIF4A存在を調査した。
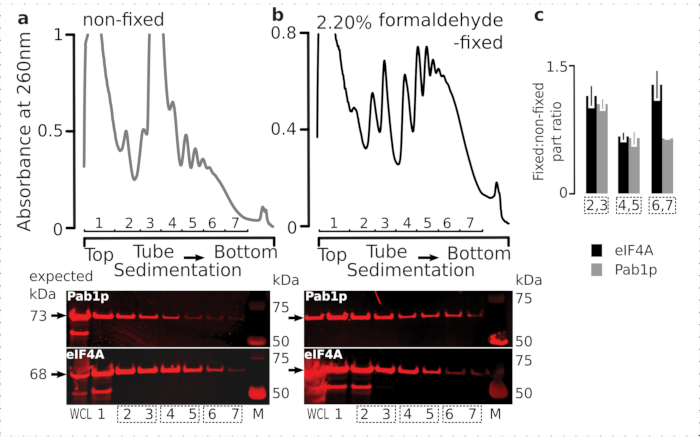
図6:インビボホルムアルデヒド固定化時の翻訳複合体中の一過性タンパク質の安定化(a,b)(上プロット)全細胞ライセート(WCL)の(a)非固定及び(b)2.2%ホルムアルデヒド固定eIF4A-TAP酵母細胞を超遠心分離によって分離し、図2の伝説に示すように可視化する。(下のプロット)対応する勾配で分析した材料の分離時のそれぞれのショ糖勾配画分のウェスタンブロットイメージング(上プロット)、およびコントロールとしてのWCL。(c)固定材料と非固定材料の分数における eIF4A または Pab1p の存在量の平均比率。eIF4A(黒いバー)とPab1p(灰色のバー)の相対比率(2〜7分の1のシグナルに正規化)は、2,3(SSU、LSU)、4,5(RS、軽いポリソーム)、および(下プロット)のデータから6,7(重いポリソーム)、および固定比から固定比を計算した。誤差範囲は、反復として処理されるプールされた分数(点線ボックス)を持つ平均からの比率の標準偏差を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
細胞中の高い存在量と一致して、細胞全体のリセート(WCL)中のタンパク質の両方からのシグナルの高強度と、非固定細胞由来の遅い沈み込み画分を観察した(図6a、下部パネル)。また、これらのタンパク質のかなりの量を固定細胞に由来するWCLで検出し、架橋材料抽出の効率と予期せぬ損失の欠如を安心させました(図6b、下部パネル)。しかし、非固定細胞とは対照的に、固定細胞からの物質は、Pab1p(図6c)と比較して、より速い沈み込みリボソーム画分におけるeIF4Aの相対的存在の上昇を示した(図6c)。この結果は、eIF4Aがホルムアルデヒド架橋材料中のポリソームとより強固に関連付けられていることを示唆している。
リボソーム画分中のeIF4A存在に対する架橋の正および特異的安定化効果を確認した結果、eIF4Aタグ付き(TIF1-TAP)酵母株の固定材料を用いて、磁気IgGビーズとの親和性精製によりeIF4A含有複合体を捕捉し、濃縮しました。アフィニティを豊富に持つWCLを持っています。 ショ糖勾配を介した最初の沈め物後のフリーSSUおよび多染色体(翻訳mRNAプール)画数(例えば、酵母プロトコルのセクション1.3)、ならびに翻訳されたプールをRNase I(e.g.セクション1.4)との個々の複合体に分解した2番目の沈からのSSU、LSUおよびRSの分数(e.g.セクション1.4)図7).LSU画分を除く全ての場合において、精製された分画(eluate,E)におけるeIF4Aの選択的濃縮を、ソース物質内のβ-actinの存在(入力、I)と比較して観察することができた(図7)。
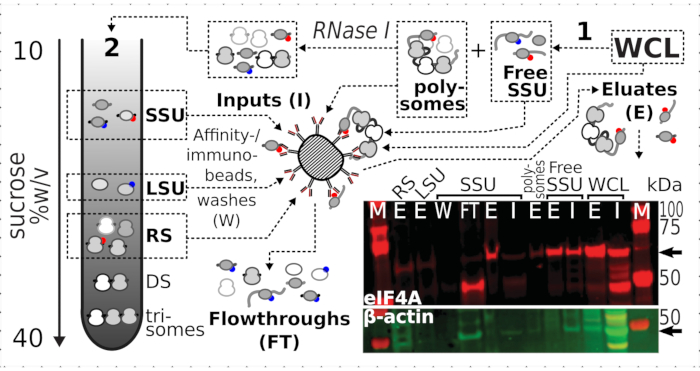
図7:一過性関連eIF4Aによる インビボ ホルムアルデヒド安定化翻訳複合体の選択的免疫精製この回路図は、eIF4A-TAP酵母細胞の非分画的明確化WCLを含む、異なる翻訳複合体およびeIF4Aエピトープのソースを示している。無料のSSUと翻訳されたRNAプール(ポリソーム)は、最初の超遠心分離で分離;RNase I消化によって翻訳されたRNAから解放され、第2の超遠心分離を用いて分離されたSSU、LSUおよびRS画分(テキストを参照)。ウェスタンブロット画像は、同時に染色されたβアクチン対照の豊富量と比較して、分数におけるeIF4Aの豊富さの可視化を提供する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ホルムアルデヒド固定は生体分子10、36、45、46、47、48の急速な生体架橋を達成する便利で一般的な方法である。他の潜在的な生体分子標的と比較して、翻訳複合体の捕獲に成功すると、細胞または他の物質のスナップ冷却中に即時固定が必要となる。遅延のない安定化がなければ、異なる翻訳関連プロセスが継続する可能性があり、複雑な分布をインビボ状態49の非摂動から遠ざける。翻訳的逮捕およびリボソーム複合体安定化の他の方法と比較して、細胞膜を横切るホルムアルデヒド作用の迅速性および架橋の無差別な性質は、それらのネイティブ分布状態50に近い翻訳複合体中間体の最大多様性の最大の多様性の保存を約束する。
ここで提示されるアプローチは、酵母細胞と哺乳類細胞の両方で確立され、最適化されており、脊椎動物全体(例えば、ゼブラフィッシュ胚)10、38、39、49、51、52など、より多様な生物学的材料にわたって使用するための他のグループによって得られた方法が現在あります.これらの作品は、アプローチの汎用性と幅広い適用性を一括して安心させるが、翻訳複合体の急速ホルムアルデヒド架橋は、最適化と調整の必要性のために新しいタイプの生物学的材料に転置することがやや困難であると考えることができる。
この方法の成功に対する最も重要な要件は、ホルムアルデヒドの濃度と細胞の収集と破壊技術の再最適化です。より少ない透過性、小および丸い酵母細胞は、固定細胞のホルムアルデヒド濃度および物理的破壊をはるかに高く(少なくとも10倍)必要とする。対照的に、培養中の大きく平坦化された付着性哺乳類細胞は、容易に過固定することができ、固定時に穏やかな取り扱いを必要とし、固定複合体の抽出は、洗剤を使用して膜破壊で化学的に行うことができる。架橋の下で、安定性が低い、または短命の中間体が解別したり、後の状態に漏れたりすることがあります。オーバー架橋は、リボソーム分画を分離して研究する能力に悪影響を及ぼし、重い複合体のより深い枯渇などの選択的バイアスを作成することができます。我々の観察では、使用される付着性ヒト細胞の種類のようなわずかな変化でさえ、回収された架橋複合体の収量に影響を与え、架橋レジメンの再最適化を必要とする可能性がある。また、植物細胞のような透過性特性が大きく異なる細胞は、固定条件52の追加の広範な最適化を必要とすることを予想することができます。しかし、このアプローチと完全に相容れない生物学的材料の一種を想像することは困難です。
哺乳類固定プロトコルに関連する1つの考慮事項は、入力として使用される細胞材料の密度および量である。細胞翻訳力学に対する外部の影響を避けるために、少なくとも2日間、再播種やその他の摂動を行うことなく、細胞を継続的に増殖させることが推奨されます。ほとんどの細胞タイプに適用されますが、接着細胞の大半は一貫して70%以下の合流レベルを達成することで、翻訳速度に悪影響を及ぼし、予測不可能な影響を及ぼす可能性のある主要な接触阻害効果がないことが保証されます。
無差別反応性に起因するホルムアルデヒド固定のもう一つの興味深く、潜在的にユニークな便利な特徴は、混合分類の系における翻訳複合体に対する安定化効果である。細菌、さらにミトコンドリア、葉芽細胞および異なる細胞内寄生虫の翻訳複合体は、特定の翻訳阻害剤で標的にすることは悪名高い困難であった。これに対し、TCP-seqデータでは、マイトトランスクリプトームへのフットプリントマッピングは、データ38、39、50で容易に観察可能である。興味深いその後の開発は、信頼性の高い迅速な翻訳逮捕と他の手段との複雑な安定化が問題となる土壌、水または腸のサンプルなど、マイクロコミュニティ全体の翻訳を調査するアプローチの使用である可能性があります。
また、最も複雑な材料(硬質組織やかさばる組織など)では、細胞破壊や材料の均質化時にすぐにホルムアルデヒド安定化の使用を妨げるものは何もないことも言及する必要があります。このアプローチは、特定の低分子阻害剤33、53、54、55で翻訳複合体を安定化させる場合の細胞の進入遅延を除去するために既に頻繁に採用されている。ホルムアルデヒド固定は、電子顕微鏡法45、56、57、58などの用途におけるex vivo/in vitroサンプル安定化に優れた結果を従来使用されてきたことを考えると、この場合、特に完全に固定された細胞からの翻訳複合体の抽出不良に関連するものは、さらに少ない負の影響が期待できます。
我々の知見は、eIF4Aを含むような非常に一過性の複合体を安定化させる急速ホルムアルデヒド固定のユーザビリティを確認する。哺乳類とは対照的に、酵母eIF4Aはキャップ結合複合体eIF4Fとはるかに弱く関連しており、その結果、一般的に翻訳複合体が関連していることは注目に値する。eIF4Aは、通常、酵母29、59、60、61、62、63のリボソーム材料の広範な精製中に失われます。しかし、生体内固定酵母材料では、その存在が予想される翻訳複合体のすべての画分においてeIF4Aの信頼性の高い濃縮を達成することが可能である。以前に公開されたSel-TCP-seqデータは、リボソームとより強く関連するeIF2およびeIF3の濃縮を実証した(しかし、一過性に発生する共翻訳タンパク質複合体集合体も明らかにした)39。したがって、この方法は、両方の、翻訳複合体の結合された成分の強く、弱いの両方の検出に適している。
要約すると、翻訳開始段階で起こる変化や、mRNA上でのリボソーム分布が最小限に摂動される場合に、主に洞察を得るのに役立つアプローチを提示しました。重要なことに、このアプローチは、eIF4Aのようなトランスレーショナル複合体の比較的不安定で動的な成分の安定化に適しており、必要な最適化に広く使用することができます。また、翻訳の急速な動的変化のシナリオにおけるホルムアルデヒド固定の有用性の証拠を提供し、環境変化やストレス状態に対するペースの速い細胞応答などの調査領域を開いた。
開示事項
著者らは利益相反を宣言しない。
謝辞
この研究は、オーストラリア研究評議会ディスカバリープロジェクト助成金(T.P.とN.E.S.へのDP180100111)、国立保健医療研究評議会調査官グラント(GNT1175388 to N.E.S.)、研究フェローシップ(APP1135928からT.P.)によって支援されました。著者らは、オーストラリア国立大学先端顕微鏡センター(大学と連邦政府が資金を提供する施設)の顕微鏡検査施設を認めている。
資料
| Name | Company | Catalog Number | Comments |
| Yeast extract | Merck, Sigma-Aldrich | 70161 | |
| Peptone | Merck, Sigma-Aldrich | 70178 | |
| D-Glucose (Dextrose) | Merck, Sigma-Aldrich | 49139 | |
| Adenine sulphate | Amresco | 0607-50G | |
| Formaldehyde solution | Merck Sigma-Aldrich | F11635-500ML | ACS reagent, 37 wt. % in H2O, contains 10-15% Methanol as stabiliser (to prevent polymerisation) |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | Invitrogen™ byThermo Fischer Scientific | 10777019 | |
| cOmplete™, EDTA-free Protease Inhibitor Cocktail | COEDTAF-RO Roche by Merck | 11873580001 | |
| Magnesium chloride solution | (Merck/Sigma-Aldrich) | M1028 | |
| Ethylenediaminetetraacetic acid solution | (Merck/Sigma-Aldrich) | E7889 | |
| Ambion™ RNase I, cloned, 100 U/µL | Ambion | AM2294 | |
| SUPERase•In™ RNase Inhibitor (20 U/μL) | Invitrogen™ by Thermo Fisher Scientific | AM2694 | |
| Acidic phenol:chlorophorm:isoamyl alcohol 125:24:1 (pH 4.0-5.0) | (Merck/Sigma-Aldrich) | P1944-100ML | |
| Dynabeads™ Goat Anti-Mouse IgG | Invitrogen™ by Thermo Fisher Scientific) | 11033 | |
| Sodium Acetate (3 M), pH 5.5 | Invitrogen™ by Thermo Fisher Scientific) | AM9740 | |
| Glycogen (5 mg/ml) | Invitrogen™ by Thermo Fisher Scientific) | AM9510 | |
| Ethyl alcohol, Pure | Merck; Sigma Aldrich | E7023 | |
| Amersham™ Hybond® P Western blotting membranes, PVDF | Merck | GE10600023 | PVDF membrane for western blotting |
| Bolt™ 4 to 12%, Bis-Tris, 1.0 mm, Mini Protein Gel | Invitrogen™ by ThermoFischer Sientific | NW04120BOX | Protein gel |
| 4X Bolt™ LDS Sample Buffer | Invitrogen™ by ThermoFischer Sientific | B0007 | LDS sample loading buffer |
| Precision Plus Protein™ Kaleidoscope™ Prestained Protein Standards | BioRad | 1610375 | Protein ladder |
| 20X Bolt™ MES SDS Running Buffer | ThermoFischer Scientific | B0002 | PAGE runninjg buffer |
| Intercept® (PBS) Blocking Buffer | LI-COR | 927-70001 | Odyssey Blcoking buffer (PBS) |
| IRDye® 800CW Goat anti-Mouse IgG Secondary Antibody | LI-COR | 92632210 | |
| IRDye® 800CW Goat anti-Rabbit IgG Secondary Antibody | LI-COR | 92632211 | |
| TAP Tag Polyclonal Antibody | Invitrogen™ by ThermoFischer Sientific | CAB1001 | |
| Anti-beta Actin antibody | Abcam | ab8227 | |
| Sucrose | (Merck/Sigma-Aldrich) | 84097 | BioUltra, for molecular biology, ≥99.5% (HPLC) |
| DL-Dithiothreitol solution | (Merck/Sigma-Aldrich) | 43816 | BioUltra, for molecular biology, ~1 M in H2O |
| Terumo Syringe 1CC/mL | Terumo Syringe | 878499 | |
| Potassium chloride | (Merck/Sigma-Aldrich) | 60128 | |
| HEPES | (Merck/Sigma-Aldrich) | H3375 | |
| Dulbecco's Modified Eagle's Medium - high glucose | Sigma Aldrich | D5796 | |
| Fetal Bovine Serum | Sigma Aldrich | 12003C | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Dulbecco's Phosphate Buffered Saline with Calcium and magnesium | Sigma-Aldrich | D8662 | |
| Glycine | Sigma-Aldrich | G7126 | |
| Tris hydrochloride | Merck/Sigma-Aldrich | 10812846001 | |
| Sodium dodecyl sulfate | Merck/Sigma-Aldrich | 436143 | |
| IGEPAL CA-630 | Merck/Sigma-Aldrich | I3021 | |
| Rnasin Ribonuclease Inhibitor | Promega | N2111 | |
| Stainless steel grinding jar | Retsch | 02.462.0059 | |
| MM400 mixer mill | Retsch | 20.745.0001 | |
| Gradient Fractionator | Brandel | BRN-BR-188 | |
| Thermomixer R | Eppendorf | Z605271 | |
| Nanodrop spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| 0.5-ml microcentrifuge tubes with locking devices | Eppendorf Safe-Lock | 30121023 | |
| Mini Gel Tank | (Thermo Fisher Scientific) | A25977 | PAGE running tank |
| 5 mL, Open-Top Thinwall Ultra-Clear Tube, 13 x 51mm | Beckman-Coulter | 344057 | |
| 13.2 mL, Certified Free Open-Top Thinwall Polypropylene, 14 x 89mm - 50Pk | Beckman-Coulter | 331372 | |
| Amicon Ultra-0.5 ultrafiltration devices | Merck | UFC5030 | Ultracel-30 regenerated cellulose membrane, 0.5 mL sample volume |
| Thermo Sorvall Evolution RC Floor Super Speed Centrifuge | Cambridge Scientific | 15566 | |
| Beckman Coulter Optima L-90K | GMI | 8043-30-1191 | |
| Nunc EasYFlask 175cm2 | Thermofisher Scientific | 159910 | |
| Falcon 50 mL Conical Centrifuge Tubes | Thermofisher Scientific | 14-432-22 | |
| 25 mL Serological Pipette | Sigma-Aldrich | SIAL1250 | |
| 10 mL Serological Pipette | Sigma-Aldrich | SIAL1100 | |
| DNA lobind tubes | Eppendorf | 30108051 | |
| Cold Centrifuge 5810 R | Eppendorf | EP022628188 | for 50 mL tubes |
| Orbital Shaking Incubator | Ratek | OM11 | |
| Frezco 17 Microcentrifuge | Thermofisher Scientific | 75002402 | |
| Eppendorf DNA lo-bind tubes | Merck/Sigma-Aldrich | EP0030108051 | |
| Eppendorf® Protein LoBind tubes | Merck/Sigma-Aldrich | EP0030108116 | |
| SW 41 Ti Swinging bucket rotor | Beckman-Coulter | 331362 | |
| Heracell™ 150i CO2 Incubator, 150 L | Thermofisher Scientific | 51026282 | |
| 0,3 mL ultra-fine II short insulin syringe | BD Medical | 328822 | |
| 3 mL syringe with Luer Lok tip | BD Medical | 302113 | |
| 25 G x 16 mm Hypodermic Needle | Terumo | TUAN2516R1 |
参考文献
- Janapala, Y., Preiss, T., Shirokikh, N. E. Control of translation at the initiation phase during glucose starvation in yeast. International Journal of Molecular Sciences. 20 (16), 4043 (2019).
- Masvidal, L., Hulea, L., Furic, L., Topisirovic, I., Larsson, O. mTOR-sensitive translation: Cleared fog reveals more trees. RNA Biology. 14 (10), 1299-1305 (2017).
- Ashe, M. P., De Long, S. K., Sachs, A. B. Glucose depletion rapidly inhibits translation initiation in yeast. Molecular Biology of the Cell. 11 (3), 833-848 (2000).
- Crawford, R. A., Pavitt, G. D. Translational regulation in response to stress in Saccharomyces cerevisiae. Yeast. 36 (1), 5-21 (2019).
- Melamed, D., Pnueli, L., Arava, Y. Yeast translational response to high salinity: global analysis reveals regulation at multiple levels. RNA. 14 (7), 1337-1351 (2008).
- Hershey, J. W., Sonenberg, N., Mathews, M. B. Principles of translational control: An overview. Cold Spring Harbor Perspectives in Biology. 4 (12), 011528 (2012).
- Mata, J., Marguerat, S., Bähler, J. Post-transcriptional control of gene expression: a genome-wide perspective. Trends in Biochemical Sciences. 30 (9), 506-514 (2005).
- Spriggs, K. A., Bushell, M., Willis, A. E. Translational regulation of gene expression during conditions of cell stress. Molecular Cell. 40 (2), 228-237 (2010).
- Liu, B., Qian, S. B. Translational reprogramming in cellular stress response. Wiley Interdisciplinary Reviews RNA. 5 (3), 301-315 (2014).
- Archer, S. K., Shirokikh, N. E., Beilharz, T. H., Preiss, T. Dynamics of ribosome scanning and recycling revealed by translation complex profiling. Nature. 535 (7613), 570-574 (2016).
- Hinnebusch, A. G., Ivanov, I. P., Sonenberg, N. Translational control by 5'-untranslated regions of eukaryotic mRNAs. Science. 352 (6292), 1413-1416 (2016).
- Dever, T. E., Green, R. The elongation, termination, and recycling phases of translation in eukaryotes. Cold Spring Harbor Perspectives in Biology. 4 (7), 013706 (2012).
- Shirokikh, N. E., Preiss, T. Translation initiation by cap-dependent ribosome recruitment: Recent insights and open questions. Wiley Interdisciplinary Reviews RNA. 9 (4), 1473 (2018).
- Jiménez-Díaz, A., Remacha, M., Ballesta, J. P., Berlanga, J. J. Phosphorylation of initiation factor eIF2 in response to stress conditions is mediated by acidic ribosomal P1/P2 proteins in Saccharomyces cerevisiae. PLoS One. 8 (12), 84219 (2013).
- Sonenberg, N., Hinnebusch, A. G. Regulation of translation initiation in eukaryotes: mechanisms and biological targets. Cell. 136 (4), 731-745 (2009).
- Majmundar, A. J., Wong, W. J., Simon, M. C. Hypoxia-inducible factors and the response to hypoxic stress. Molecular Cell. 40 (2), 294-309 (2010).
- Barraza, C. E., et al. The role of PKA in the translational response to heat stress in Saccharomyces cerevisiae. PLoS One. 12 (10), 0185416 (2017).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: Life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Jamar, N. H., Kritsiligkou, P., Grant, C. M. The non-stop decay mRNA surveillance pathway is required for oxidative stress tolerance. Nucleic Acids Research. 45 (11), 6881-6893 (2017).
- Chen, Z., et al. The complete pathway for thiosulfate utilization in Saccharomyces cerevisiae. Applied and Environmental Microbiology. 84 (22), (2018).
- Marzluf, G. A. Molecular genetics of sulfur assimilation in filamentous fungi and yeast. Annual Review of Microbiology. 51, 73-96 (1997).
- Miller, D., Brandt, N., Gresham, D. Systematic identification of factors mediating accelerated mRNA degradation in response to changes in environmental nitrogen. PLoS Genetics. 14 (5), 1007406 (2018).
- Zhang, W., Du, G., Zhou, J., Chen, J. Regulation of sensing, transportation, and catabolism of nitrogen sources in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 82 (1), (2018).
- Tokpohozin, S. E., Fischer, S., Becker, T. Selection of a new Saccharomyces yeast to enhance relevant sorghum beer aroma components, higher alcohols, and esters. Food Microbiology. 83, 181-186 (2019).
- Walker, G. M., Stewart, G. G. Saccharomyces cerevisiae in the production of fermented beverages. Beverages. 2 (4), 30 (2016).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Jin, H. Y., Xiao, C. An integrated polysome profiling and ribosome profiling method to investigate in vivo translatome. Methods in Molecular Biology. 1712, 1-18 (2018).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3889-3894 (2003).
- Lackner, D. H., et al. A network of multiple regulatory layers shapes gene expression in fission yeast. Molecular Cell. 26 (1), 145-155 (2007).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-Wide Analysis in Vivo of Translation with Nucleotide Resolution Using Ribosome Profiling. Science. 324 (5924), 218-223 (2009).
- Ingolia, N. T., Hussmann, J. A., Weissman, J. S. Ribosome Profiling: Global Views of Translation. Cold Spring Harbor Perspectives in Biology. 11 (5), (2019).
- Gerashchenko, M. V., Lobanov, A. V., Gladyshev, V. N. Genome-wide ribosome profiling reveals complex translational regulation in response to oxidative stress. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17394-17399 (2012).
- Hussmann, J. A., Patchett, S., Johnson, A., Sawyer, S., Press, W. H. Understanding biases in ribosome profiling experiments reveals signatures of translation dynamics in yeast. Proceedings of the National Academy of Sciences Genetics. 11 (12), 1005732 (2015).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Hoffman, E. A., Frey, B. L., Smith, L. M., Auble, D. T. Formaldehyde crosslinking: A tool for the study of chromatin complexes. Journal of Biological Chemistry. 290 (44), 26404-26411 (2015).
- Kage, U., Powell, J. J., Gardiner, D. M., Kazan, K. Ribosome profiling in plants: What is not lost in translation. Journal of Experimental Botany. 71 (18), 5323-5332 (2020).
- Shirokikh, N. E., Archer, S. K., Beilharz, T. H., Powell, D., Preiss, T. Translation complex profile sequencing to study the in vivo dynamics of mRNA-ribosome interactions during translation initiation, elongation and termination. Nature Protocols. 12 (4), 697-731 (2017).
- Wagner, S., et al. Selective translation complex profiling reveals staged initiation and co-translational assembly of initiation factor complexes. Molecular Cell. 79 (4), 546-560 (2020).
- Zlotorynski, E. Profiling ribosome dynamics. Nature Reviews Molecular Cell Biology. 17 (9), 535-535 (2016).
- Sen, N. D., Gupta, N., S, K. A., Preiss, T., Lorsch, J. R., Hinnebusch, A. G. Functional interplay between DEAD-box RNA helicases Ded1 and Dbp1 in preinitiation complex attachment and scanning on structured mRNAs in vivo. Nucleic Acids Research. 47 (16), 8785-8806 (2019).
- Zhao, J., Qin, B., Nikolay, R., Spahn, C. M. T., Zhang, G. Translatomics: The global view of translation. International Journal of Molecular Sciences. 20 (1), 20010212 (2019).
- Luthe, D. S. A simple technique for the preparation and storage of sucrose gradients. Analytical Biochemistry. 135 (1), 230-232 (1983).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Review Genetics. 10 (1), 57-63 (2009).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trends in Biochemical Sciences. 25 (3), 99-104 (2000).
- Schmiedeberg, L., Skene, P., Deaton, A., Bird, A. A Temporal Threshold for Formaldehyde Crosslinking and Fixation. PLoS One. 4 (2), 4636 (2009).
- Solomon, M. J., Varshavsky, A. Formaldehyde-mediated DNA-protein crosslinking: A probe for in vivo chromatin structures. Proceedings of the National Academy of Sciences. 82 (19), 6470-6474 (1985).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping proteinDNA interactions in vivo with formaldehyde: Evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Bohlen, J., Fenzl, K., Kramer, G., Bukau, B., Teleman, A. A. Selective 40S footprinting reveals cap-tethered ribosome scanning in human cells. Molecular Cell. 79 (4), 561-574 (2020).
- Shirokikh, N. E. Translation complex stabilization on messenger RNA and footprint profiling to study the RNA responses and dynamics of protein biosynthesis in the cells. Critical Reviews in Biochemistry and Molecular Biology. , (2021).
- Giess, A., et al. Profiling of small ribosomal subunits reveals modes and regulation of translation initiation. Cell Reports. 31 (3), 107534 (2020).
- Firmino, A. A. P., et al. Separation and paired proteome profiling of plant chloroplast and cytoplasmic ribosomes. Plants (Basel). 9 (7), (2020).
- Gerashchenko, M. V., Gladyshev, V. N. Translation inhibitors cause abnormalities in ribosome profiling experiments. Nucleic Acids Research. 42 (17), 134 (2014).
- Santos, D. A., Shi, L., Tu, B. P., Weissman, J. S. Cycloheximide can distort measurements of mRNA levels and translation efficiency. Nucleic Acids Research. 47 (10), 4974-4985 (2019).
- Schneider-Poetsch, T., et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin. Nature Chemical Biology. 6 (3), 209-217 (2010).
- Plénat, F., et al. Formaldehyde fixation in the third millennium. Annales De Pathologie. 21 (1), 29-47 (2001).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Wang, N. S., Minassian, H. The formaldehyde-fixed and paraffin-embedded tissues for diagnostic transmission electron microscopy: A retrospective and prospective study. Human Pathology. 18 (7), 715-727 (1987).
- Grifo, J. A., et al. Characterization of eukaryotic initiation factor 4A, a protein involved in ATP-dependent binding of globin mRNA. Journal of Biological Chemistry. 257 (9), 5246-5252 (1982).
- Li, Y. Commonly used tag combinations for tandem affinity purification. Biotechnology and Applied Biochemistry. 55 (2), 73-83 (2010).
- Blum, S., et al. ATP hydrolysis by initiation factor 4A is required for translation initiation in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 89 (16), 7664-7668 (1992).
- Merrick, W. C. eIF4F: A Retrospective. Journal of Biological Chemistry. 290 (40), 24091-24099 (2015).
- Rogers, G. W., Komar, A. A., Merrick, W. C. eIF4A: The godfather of the DEAD box helicases. Progress in Nucleic Acid Research and Molecular Biology. 72, 307-331 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved