このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
低層構造状態のタンパク質検出のための高圧NMR実験
要約
高圧セルの組み立て、高圧NMR実験の設定と記録に必要なステップの詳細な説明を提供し、最後に圧力下でのピーク強度と化学シフトの両方の変化を分析します。これらの実験は、タンパク質の折りたたみ経路と構造安定性に関する貴重な洞察を提供することができます。
要約
高圧は、球状タンパク質を不安定化させ、タンパク質複合体を可逆的に解化するために使用できる、よく知られた摂動法です。静水圧は、熱力学的平衡を、より低いモル体積の状態に向かって駆動します。圧力の上昇は、したがって、球状タンパク質の安定性とタンパク質複合体のオリゴマー化平衡を細かく調整する機会を提供します。高圧NMR実験は、NMR分光法の溶液によって提供される圧力摂動の微細な安定性調整能力と部位分解能を組み合わせることにより、球状タンパク質の安定性、その折りたたみ機構、およびオリゴマー化メカニズムを支配する因子の詳細な特徴付けが可能になります。ここでは、1バーから2.5kbarまで記録された2D 1H-15N実験のセットを介してタンパク質の局所的な折りたたみ安定性をプローブするプロトコルを提示する。このような実験の取得および分析に必要なステップは、hnRNPA1のRRM2ドメイン上で取得したデータと共に示されている。
概要
タンパク質およびタンパク質複合体の高エネルギー、まばらな立体構造状態が、多くの生物学的経路1、2、3において重要な役割を果たすことが長い間認識されてきた。Carr-パーセル-Meiboom-Gill (CPMG)4、化学交換飽和伝達(CEST)5、および暗い状態交換飽和伝達(DEST)6パルス配列(とりわけ)に基づく実験のおかげで、溶液NMR分光法は、一過性の立体状態を特徴付けるための選択肢として出現した7。これらの実験に加えて、温度、pH、または化学変性物質などの摂動を導入して、より高いエネルギー立体構造サブステイトの相対的集団を増加させることができる。同様に、タンパク質平衡は、高い静水圧を加えることによっても摂動することができる。対応する立体構造変化に伴う体積変化の大きさに応じて、数百から数千のバーの圧力の増加は、より高いエネルギー状態を有意に安定させ、またはタンパク質が8、9、10を完全に展開する原因となる。タンパク質NMRスペクトルは、通常、静水圧で2種類の変化を表示する:(i)化学シフト変化および(ii)ピーク強度変化。化学シフトの変化は、タンパク質表面水界面における変化および/またはタンパク質構造の局所圧縮を速い時間スケール(NMR時間スケールに対する)11に反映する。大きな非線形化学シフト圧力依存性を示すクロスピークは、より高いエネルギー立体構造状態12,13の存在を示すことができる。一方、ピーク強度の変化は、折り畳まれた状態/展開された状態の人口の変化など、遅い時間スケールでの主要な立体構造遷移を指します。フォールディング中間体または高いエネルギー状態の存在は、所与のタンパク質14、15、16、17の異なる残基について測定された展開時の体積変化の大きさの大きな変動から検出することができる。我々の経験に基づいて、通常2状態フォルダとして分類される小さなタンパク質でさえ、圧力に対する不均一な応答を示し、局所的な折りたたみの安定性に関する有用な情報を提供します。ここで説明するアミドピーク強度および1H化学シフト圧力依存の取得及び分析のためのプロトコルは、異種核リボヌクレオプロテインA1(hnRNPA1)の単離されたRNA認識モチーフ2(RRM2)をモデルタンパク質として用いる。
プロトコル
注:ここで説明するプロトコルは、(i)2.5 kbarと2.5 kbarの高圧ポンプとセルを定め、(ii)NMRスペクトルの分析用のソフトウェアSPARKY19、 および(iii)曲線フィッティングソフトウェアを必要とする。
1.サンプル調製、高圧セルの組み立て、および実験を設定する。
- バッファの選択: リン酸塩とトリス20,21などの陰イオンバッファーとカチオンバッファーの等しい混合を使用します。
注:リン酸やMESなどのアニオン性緩衝液のpKaは、実質的な反応量(すなわち、酸とイオン化産物の部分モル量の差)に関連付けられます。したがって、このようなバッファーの pH は圧力の変化 (〜0.25-0.5 pH 単位/kbar) によって大きな影響を受ける可能性があります。 - 必要なサンプル量が、標準の直径3mmのNMRチューブ(〜300μL)と同様であることを確認してください。
- ガラスピペットを含む 15個のN標識サンプルをジルコニアチューブに導入します。チューブの下部にあるサンプルシートを確認します。200 μLのミネラルオイルを完備し、透過液(例えば、水)と混合するのを防ぎます。チューブの残りの部分を液体を透過して充填します。
- ジルコニアチューブの上に使い捨てのOリングを置き、チューブをベースにスライドさせます(図1A、B)。次に、チューブを高圧テザーラインに接続し、最初に手でセルにベースを締めます。次に、14.7 Nmのトルクを適用して、低圧での漏れを防ぎます(図1C、D)。
- 圧力セルアセンブリの完全性を確認するには、細胞支持体と格納容器を使用して、分光計の外に最大300バーを加圧します。15分待ってから、圧力を1バーにリセットし、きれいな糸くずのないワイプで漏れをチェックします。
- テザーラインを慎重に導いて、無加圧チューブを分光器に挿入します。サンプルの座っている位置に到達するまで、分光計でチューブをスライドさせます(図1E)。
- 通常どおり 1 H と15N チャネルをロック、シム、マッチ、および調整します。
注:高圧評価ジルコニアチューブ用シムは、標準のNMRチューブとは大きく異なります。今後の使用のために最適化されたシムを保存することをお勧めします。 - 1H-15N-HSQC または TROSY-HSQC を設定し、大気条件での参照実験を記録します (1bar)。
2. 高圧NMR実験の記録
- タンパク質の全体的な安定性をテストするために、徐々に1バーから2.5 kbarに500バーインクリメントの圧力を増加させます。圧力ポンプの速度を、デフォルトで~18 bar/sに設定します。正確な折り畳み/展開速度が不明な場合は、サンプルが各500バーの増分の後に15〜20分を平衡にします。2.5 kbar でスペクトルを記録します。
- 圧力の摂動の可逆性をテストするために、500棒ステップで1バーに戻って圧力を徐々に減らします。大気条件で別のスペクトルを記録し、化学シフトとピーク強度を、以前に同じ条件で記録された基準スペクトルの基準スペクトルと比較します。
注: 圧力が発生した後にネイティブのクロスピークがより強い場合、大気圧で溶液中に存在する小さな凝集体が解別され、適切に折り直された可能性があります。一方、強度の損失または有意な化学シフト変化は、タンパク質が高圧条件で非可逆的なミスフォールディングを経験する可能性があることを示唆している。 - 1 つの棒から 2.5 kbar までの一連の 2D 実験を 500 bar ごとに記録します。フィットの精度を向上させるために、折り畳み/展開遷移の変曲点付近で追加の実験を記録することをお勧めします。
3. ピーク強度の変化を分析する
- すべてのスペクトルを処理し、1バーの基準スペクトルから500バーで記録されたスペクトルにバックボーンの割り当てを転送し、500バーから1kbarなどに割り当てを転送します。
注:圧力は1Hと15Nの化学シフトの不均一なシフトを誘発するので、単に1つのスペクトルから次のスペクトルにバックボーンの割り当てをコピーしないでください。手動で調整します。 - スパーキーメニューでピーク >ピークリスト (lt)をクリックします。ピーク リスト ウィンドウで 、オプション をクリックし、 周波数(ppm) と データ高さの両方を表示するオプションを選択します。各スペクトルに対して取得したリストを保存します。
- カーブフィッティングソフトウェアでは、クロスピークの同一性値とピーク強度の値をコピーして、圧力値(バー)をX軸変数に、強度をY軸変数として使用します。
- 完全またはほぼ完全な (>80%) 展開が観察された場合は、個々のピーク強度プロファイルをフィットして、単純な 2 状態モデルを使用して、展開時にそれぞれ自由エネルギーと体積変化を抽出します。
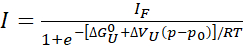 Eq. 1
Eq. 1
ここで、「I」は、与えられた圧力pでのクロスピークの観測強度であり、IFは完全に折り畳まれた状態で同じクロスピークの強度である。Rはガス定数、Tは絶対温度、ΔGU0は大気圧p0(1バー)で展開状態と折り畳まれた状態の間の標準的なギブス自由エネルギー差、展開時の体積変化をΔVuとする。圧力pをバーで、温度Tをケルビンに、R = 1.987 cal/K、ΔGU0はカル/モル、ΔVUはカル/モル/バーに入っています。適合から得られたΔVU値を41.84で乗算してmL/molに変換するΔVU値は、典型的には球状タンパク質22に対して-50〜-150 mL/molの範囲である。ここでは、展開反応に関して全てのパラメータが表現されますが、折りたたみ反応パラメータに簡単に変換することができます(ΔGU0 = -ΔGF0およびΔVU = -ΔVF)。
4. 化学シフト変化の解析
- 圧力点を可変値として、1H 化学シフトを Y軸としてスパーキーリストから抽出するために、ソフトウェアの列を整列します。
- 1H化学シフトの圧力依存性を単純な二次方程式に適合させます。
δ(p) = δ0(p0) + B1(p-p0) + B2 (p-p0)2 Eq.
ここで、δ(p)は、1バーで記録された基準スペクトルにおける同じクロスピークの1H化学シフトをδ 0(p0)でのクロスピークの測定1H化学シフトである。B1と B2は、それぞれ ppm/bar および ppm/bar2で表される 1 番目と 2 番目のパラメーターを表します。
結果
ここで説明するプロトコルは、2.5kbar範囲(>90%)内でほぼ完全に展開されたhnRNPA1(残基95〜106)の第2RNA認識モチーフであるRRM2の圧力依存性をプローブするために使用した。1H-15Nスペクトルは、1バー、500バー、750バー、1 kbar、1.5 kbar、2 kbar、および2.5kbarで収集した(図2)。2.5 kbarのノイズレベルより上に現れたクロスピークはどれも見えなかったので、対応する?...
ディスカッション
この研究では、圧力摂動に対するタンパク質構造および熱力学応答をプローブするために実装されたプロトコルを詳述する。ここでRRM2に記録された高圧実験は、非完全に協力的な展開を示すΔVU値の大きな変動が、比較的小さな単一ドメインタンパク質に見つけることができることを示しています。同様の画像は、圧力下での1H化学シフト変化の分析から浮かび上がる。なお?...
開示事項
すべての著者は原稿を読んで承認しました。彼らは利益相反を宣言しません。
謝辞
この作品は、ロイ・J・カーバー慈善信託からジュリアン・ロシュへの資金によって支えられました。RrM2サンプルを親切に提供してくれたJ・D・レヴェングッドとB.S.トルバートに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Bruker Nmr Cell 2.5 Kbar | Daedalus Innovations LLC | NMRCELL-B | |
| Sparky3 | University of California San Francisco, CA | N/A | |
| Xtreme-60 Syringe pump | Daedalus Innovations LLC | XTREME-60 |
参考文献
- Alderson, R. T., Kay, L. E. Unveiling invisible protein states with NMR spectroscopy. Current Opinion in Structural Biology. 60, 39-49 (2020).
- Korzhnev, D. M., Kay, L. E. probing invisible, low-populated states of protein molecules by relaxation dispersion NMR spectroscopy: An application to protein folding. Accounts of Chemical Research. 41, 442-451 (2008).
- Loria, P. J., Berlow, R. B., Watt, E. D. Characterization of enzyme motions by solution NMR relaxation dispersion. Accounts of Chemical Research. 41, 214-221 (2008).
- Ishima, R. CPMG relaxation dispersion. Methods in Molecular Biology. 1084, 29-49 (2014).
- Longo, D. L., et al. Chemical exchange saturation transfer (CEST): an efficient tool for detecting molecular information on proteins' behaviour. Analyst. 39, 2687-2690 (2014).
- Fawzi, N. L., Ying, J., Torchia, D. A., Clore, M. G. Probing exchange kinetics and atomic resolution dynamics in high-molecular-weight complexes using dark-state exchange saturation transfer NMR spectroscopy. Nature Protocols. 7, 1523-1533 (2012).
- Anthis, N. J., Clore, M. G. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48, 35-116 (2015).
- Roche, J., et al. Cavities determine the pressure unfolding of proteins. Proceedings of the National Academy of Sciences of the United States of America. 109, 6945-6950 (2012).
- Chen, C. R., Makhatadze, G. I. Molecular determinant of the effects of hydrostatic pressure on protein folding stability. Nature Communications. 8, 14561 (2017).
- Roche, J., Royer, C. A. Lessons from pressure denaturation of proteins. Journal of the Royal Society Interface. 15, 20180244 (2018).
- Xu, X., Gagné, D., Aramini, J. M., Gardner, K. H. Volume and compressibility differences between protein conformations revealed by high-pressure NMR. Biophysical Journal. 120, 924-935 (2021).
- Akasaka, K., Li, H. Low-lying excited states of proteins revealed from non-linear pressure shifts in 1H and 15N NMR. Biochemistry. 40, 8665-8671 (2001).
- Akasaka, K. Probing conformational fluctuation of proteins by pressure perturbation. Chemical Reviews. 106, 1814-1835 (2006).
- Kitahara, R., Yokoyama, S., Akasaka, K. NMR snapshots of a fluctuating protein structure: ubiquitin at 30 bar-3 kbar. Journal of Molecular Biology. 347, 277-285 (2005).
- Roche, J., et al. remodeling of the folding free energy landscape of Staphylococcal nuclease by cavity-creating mutations. Biochemistry. 51, 9535-9546 (2012).
- Nucci, N. V., Fuglestad, B., Athanasoula, E. A., Wand, J. A. Role of cavities and hydration in the pressure unfolding of T4 lysozyme. Proceedings of the National Academy of Sciences of the United States of America. 111, 13846-13851 (2014).
- Maeno, A., et al. Cavity as a source of conformational fluctuation and high-energy state: High-pressure NMR study of a cavity-enlarged mutant of T4 lysozyme. Biophysical Journal. 108, 133-145 (2015).
- Peterson, R. W., Wand, J. A. Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy. Review of Scientific Instruments. 76, 094101 (2005).
- Goddard, T. D., Kneller, D. G. . Sparky 3. , (2010).
- Caro, J. A., Wand, J. A. Practical aspects of high-pressure NMR spectroscopy and its applications in protein biophysics and structural biology. Methods. 148, 67-80 (2018).
- Kitamura, T., Itoh, J. Reaction volume of protonic ionization for buffering agents. Prediction of pressure dependence of pH and pOH. Journal of Solution Chemistry. 16, 715-725 (1987).
- Royer, C. A. Revisiting volume changes in pressure-induced protein unfolding. Biochimica et Biophysica Acta. 1595, 201-209 (2002).
- Erlach, M. B., et al. Relationship between nonliner pressure-induced chemical shift changes and thermodynamic parameters. Journal of Physical Chemistry B. 118, 5681-5690 (2014).
- de Oliveira, G. A. P., Silva, J. L. A hypothesis to reconcile the physical and chemical unfolding of proteins. Proceedings of the National Academy of Sciences of The United States of America. 112, 2775-2784 (2015).
- Nguyen, L. M., Roche, J. High-pressure NMR techniques for the study of protein dynamics, folding and aggregation. Journal of Magnetic Resonance. 277, 179-185 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved