Method Article
ヒト化メディケーターは、アレルゲン効力の読み取りとしてアッセイをリリース
要約
ここでは、メディエーター放出アッセイを提示し、ヒトIgE受容体にトランスフェクトしたラット好塩基性白血病細胞株を用いて、1型アレルギー反応において典型的に認められるエフェクター細胞の脱顆粒をシミュレートする。この方法は、高感度、再現性、およびカスタマイズ可能な方法でアレルゲンの生物学的活性を調査します。
要約
メディエーター放出アッセイは、推定アレルゲンの連続希釈による刺激を受けて、肥満細胞や好塩基球などのエフェクター細胞による インビトロ 免疫グロブリンE(IgE)媒介性の脱顆粒およびメディエーターの分泌を分析します。したがって、これらのアッセイは、感作患者または皮膚プリック検査でアレルゲン暴露時に起こる インビボ 脱顆粒プロセスを模倣する必須のツールを表す。さらに、これらのアッセイは、通常、タンパク質のアレルギー性の可能性と患者のセラの反応性の反応性を調べるのに使用されます。ここで、ヒト高親和性IgE血漿膜受容体(FcEεRI)を用いてヒト化した不死化ラット好塩球白血病細胞株を用いた単純な2日間のプロトコルについて説明する。メディケータ放出アッセイのこの変異体は、固体マトリックスに抗原を固定化する必要なしに、堅牢で敏感で再現性の高い インビトロ 細胞系です。このプロトコルは、(1)ヒトセラの補体不活性化、(2)細胞の収穫、播種、および受動的感作、(3)媒介物質放出を引き起こす抗原による刺激、および(4)ヒスタミンなどの放出された炎症性メディエーターの代理としてβ-ヘキソサミニダーゼ活性を測定する。このアッセイは、細胞脱顆粒を引き起こすアレルゲン-IgE架橋の容量を評価するのに有用なツールを表し、アレルゲン抽出物を標準化するために実施することができる、 患者の反応性をマイナーまたは主要なアレルゲンおよびアレルギー性抽出物(花粉、猫用ダーなど)と比較し、アレルゲンホモログ、アイソフォーム、フォールドバリアント(例えば、低アレルゲン性)の効力、ならびにリガンドがアレルギー活性に及ぼす影響を調べる。より最近の適用はアレルゲン免疫療法の過程で治療の有効性を監視するためにアッセイの使用を含んでいる。
概要
I型過敏反応は、それぞれの抗原に特異的な免疫グロブリンE(IgE)産生を特徴とする、世界人口のほぼ3分の1に影響を及ぼす。これらの反応は、喘息や鼻の結膜炎などのいくつかのアレルギー症状に関連しており、全身的な生命を脅かす反応を引き起こす可能性さえある1.インビボテストとは異なり、酵素結合免疫吸着法(ELISA)のような免疫化学的アプローチは、抗体の標的結合の調査にのみ適していますが、即座に過敏反応を引き起こす可能性のあるタンパク質の機能面には対処していません。固体支持体上のアレルゲンの固定化(例えば、ELISAプレート)は、それらの構造的完全性およびアレルギー関連エピトープの破壊に変化を引き起こす可能性がある2。皮膚プリック検査(SPT)でさえ、特定のアレルゲンに対する感作を確認する最も一般的なツールであり、症候性IgE媒介性食物アレルギーまたはアレルゲンの入手可能性3、4の検出に関する限界を有する。アレルゲンの生物学的効力を検査してI型過敏反応を引き起こす倫理的、非常に特異的、敏感、かつ費用対効果の高い方法を見つけるために、いわゆるメディター放出アッセイが確立されている。
これらのアッセイの原理は、感作期後の事象とそれに伴うIgEの能力が、マスト細胞や好塩基球などのエフェクター細胞の表面に発現する高親和性受容体のα鎖に結合することに依存している。IgEは、主に粘膜関連リンパ組織における形質細胞によって産生される。血液中の免疫グロブリン(非アトピー個体では約0.05%)が最も豊富であるが、アレルギー症状の主な原因である非常に高い生物学的活性を有する。IgEの半減期は、エフェクター細胞上の受容体に結合すると、2〜3日から数週間、さらには数ヶ月に増加する可能性があります。2つの受容体結合IgE分子の可変領域への抗原の結合は、その後、その架橋につながり、その後、脱顆粒に至るエフェクター細胞における下流シグナル伝達カスケードの誘導と、ヒスタミン、セリンプロテアーゼ(例えば、トリプターゼ)、およびプロタグランジン5.インターロイキン4(IL-4)やIL-13などのサイトカインの分泌は、炎症性Tヘルパー2(Th2)応答の維持及びB細胞のIgE産生血漿細胞へのクラス切り替え5、8、9を担う。一方、放出されたトロンボキサンは気管支収縮を引き起こし、かつ、滑らかな筋収縮や血管漏れを刺激し、喘息またはアレルギー性鼻炎10、11に至る気道炎症において重要な役割を果たす。
前述のメディエーターのほとんどを分析するための研究ツールが確立されましたが、いくつかの大きな欠点があります。トリプタスアッセイは、マスト細胞活性化による全身アナフィラキシーの測定に適した臨床アプローチであるが、アレルギー診断における感受性および特異性は、SPTのようなゴールドスタンダード法に比べて不正確である。一方、システイニルロイコトリエンアッセイは、βラクタムまたは非ステロイド性抗炎症薬12に対するアレルギーを診断することができない。アレルギー反応で放出される主要なメディターとしてのヒスタミンの測定のためのプロトコルは、1960年代に既に確立された。末梢血で放出されると、ヒスタミンはヒスタミンメチルトランスファー酵素によってすぐに分解され、血漿半減期はわずか数分となり、その分析は非常に困難な13になります。その不安定性とは別に、ヒスタミンのモニタリングは、薬物アレルギーに対する特異性および感受性が低く、また市販の食品タンパク質およびスズミチベノム12を有することが示された。
エフェクター細胞株を有するインビトロモデルは、離放出アッセイを行うアレルギー患者からの好塩基球の分離および培養の労働集約的な手順の代替として導入されている。従って、ラット好塩基性白血病-(RBL-)細胞株を用いたRBL-2H3ベースのアッセイが確立された3.この細胞株はヒトIgEを結合することができないため、まずヒトIgE原形膜受容体(FcεRI)のα、β、γ鎖を導入した。いくつかのクローンが生成され、ヒトα鎖の発現レベルと均質性についてテストされ、そのうちクローンRBL-30/25はインビトロ試験の最も有望な候補として浮上した。トランスフェクトクローンの受容体活性化時に誘導されるシグナル伝達カスケードを、カルシウム動員アッセイを介して試験した。ヒスタミン放出の脱顆粒および代理の指標として、リソソーム酵素β-ヘキソサミニダーゼを測定し、これはより高い安定性14の大きな利点を有する。RBL-30/25細胞を用いたメディター放出は最大100%に達し、したがって、アレルギー患者由来のセラを試験するために使用される。このアッセイは、市販のアレルゲン抽出物を用いた感作細胞に挑戦した後、メディター放出について試験した。これにより、異なる製造業者に由来するアレルゲン抽出物の組成(全タンパク質含有量に関して最大60倍)に大きなばらつきがあり、診断に使用される(例えば、SPT)または治療アプローチ3、15、16が得られた。
ここで、アレルギードナーからの血清を用いてメディター放出アッセイを行うRBLプロトコルの詳細な説明を提供する。受動的感作の間、血清中のIgEは好塩基性細胞の表面に発現される高親和性FcεR1受容体によって捕捉される。抗原刺激の際、抗原に特異的な結合IgEは架橋され、細胞脱顆粒化およびメディエーター β-ヘキソサミニダーゼの放出を引き起こす。β-ヘキソサミニダーゼの活性は、続いて、適切な基板を用いて測定される。アッセイのために、huRBL-2H3細胞を使用し、以下のプロトコルでhuRBLと呼んだ。プロトコルは、アレルゲンの1 μg/mLから0.1 pg/mLまでの範囲の1:10希釈8ステップを有する標準抗原希釈シリーズを記述する。
プロトコル
白樺花粉アレルギー患者由来のセラを使用する倫理的承認は、オランダの倫理委員会(承認番号:NL65758.018.18)から得られました。
1. 安全手順
- 実験の初日(バイオセーフティレベル2)の間に生物学的安全クラス2ワークベンチを使用して無菌条件下で作業する。ヒト血清の使用については、機関の安全ガイドラインに従ってください。
2. 人間のセラの不活性化を補完する
- P3X63Ag8.653細胞(今後Ag8細胞と呼ばれます)の密な培養物を細胞培養フラスコから収穫し、遠心分離管に移します。
- これらの細胞に対しては、次の培地を使用してください:血清濃度を低下させた変更イーグルスの最小必須培地、1%ペニシリンストレプトマイシン(100単位ペン、0.1 mg/mLストレップ)、5%加熱不活性化胎児/ウシ血清(FCSi)。
- 遠心分離機Ag8細胞を室温で250xgで5分間用いた。
- huRBL培地中の約1 x 106 細胞/mLの最終濃度に細胞ペレットを再懸濁する(アルファ修飾を有する最小必須培地イーグル、4 mM L-グルタミン、5%FCSi、1%G418(100%ストック:10g/125 mL dH2O)。
注:Ag8細胞は、将来の使用のために渡すことによって維持してください。 - Ag8細胞懸濁液でヒトセラ1:10を希釈する。アッセイの最終的な血清希釈は1:20になります。
注: 低い特定の IgE を持つセラの場合 1:5 (1:10 最終希釈) を使用することができます。 - 37°Cおよび5%-7%CO2で1時間インキュベートする。
3. huRBL細胞の収穫と播種
- HuRBL細胞に触れることなくT-75細胞培養フラスコから培地を吸引する(huRBL細胞は付着している)。細胞が約50%〜90%コンフルエントであることを確認してください。
注:細胞合流に応じて、密なT-75細胞培養フラスコの細胞含有量は、通常、1〜2つの96ウェルプレートで十分です。 - ダルベッコのリン酸緩衝生理食塩(DPBS)を10 mL加えて細胞を2回洗浄します。フラスコの反対側にDPBSを加え、細胞に直接加えるのではありません。
- 吸引DPBSを追加し、細胞剥離のためのプリウォーム1xトリプシンEDTA(0.05%/0.02%EDTA)の5 mLを加えます。
- 37°Cで5分間フラスコをインキュベートします。
- 慎重にフラスコをタップして細胞を取り外します。
- 細胞懸濁液を15 mL遠心チューブに移し、huRBL培地またはDPBSで満たしてトリプシン-EDTAを希釈します。
- 室温で5分間250xgで細胞を遠心分離する。
- 上清を吸引し、細胞計数用huRBL培地の5mLでペレットを再懸濁する。
- 細胞を数え、huRBL培地で希釈して、2 x 106 細胞/mLの最終濃度を得る。
- 滅菌96ウェルプレートを使用し、1ウェルあたりhuRBL細胞懸濁液の50 μLを追加します。
4. huRBL細胞の受動的感作
- 250 x gで 5 分間、あらかじめインキュベートされた Ag8/血清懸濁液を遠心分離します。
- 50 μLの遠心分離されたAg8/血清懸濁液を、Ag8細胞ペレットを邪魔することなくhuRBL細胞を含む各ウェルに移します。
- 感作されるが、刺激されない細胞(抗原を添加しない)である抗原制御を含まない、下のシグナル高原/背景の指標となる。バックグラウンドおよび最大のリシスコントロールウェルは、血清で感作する必要はありません。50 μL の huRBL 培地を加えて、代わりにウェルを制御します。
- 蓋でプレートを覆い、37°Cと5%-7%CO2で一晩インキュベートします。
5. 抗原刺激脱顆粒およびメディター放出
- 1xタイローデの緩衝液(9.5 g/Lタイローデの塩、0.1%のウシ血清アルブミン(BSA)、0.5 g/L炭酸水素ナトリウム(NaHCO3)を事前にdH2Oで希釈して調製してください。井戸あたり100 μLの最終量が必要です。
注:天然源から精製されたアレルゲンや組み換えで生産されたすべてのアレルゲンが、1x Tyrodeの緩衝液中で安定しているわけではありません。したがって、アッセイ手順の前に1x Tyrodeの緩衝液で安定性試験を行ってください。あるいは、1xタイローデのバッファーを重水素酸化物(D2O)で希釈し、アッセイのシグナル対雑音比を増加させる。 - 10または1 μg/mLのタンパク質から始まる反応管で、1:10希釈系列の目的とする抗原の8つの希釈を行います。
注: 希釈シリーズは事前に必ずテストしてください。あるいは、完全なリリース曲線をカバーするために、1:10希釈シリーズ(例えば、1:5、1:20、または1:30)を調整します。また、開始濃度は実験の設定によって異なる場合があります。 - 96ウェルプレートにメッキしたhuRBL細胞を洗浄するには、まず吸収性紙の上でプレートを慎重に吸引、反転、タップしてセラ含有細胞培地を取り除きます。
- 1xタイローデのバッファーの200 μLを持つ細胞をウェルあたり洗浄します。すべての井戸を同様に扱う。
注:それらを邪魔しないように、細胞にゆっくりと洗浄液を追加します。 - 約30sの間放置し、洗浄工程を合計で3回繰り返します。
- 最終時間に洗浄液を添加した後、溶液をウェルに残し、抗原希釈液を添加し続ける準備が整います。
注: 細胞を空気に露出させ過ぎると、空気が出ないようにしてください。 - 100 μLの抗原溶液を、予感化したhuRBL細胞を含む各ウェルに移す。
注:いくつかの異なるパラメータを分析する場合は、希釈系列の個々のサンプルを追加の非結合96ウェルプレートに転送し(huRBLプレートと同じレイアウトを使用)、後でhuRBLセルプレートにマルチチャンネルピペットを直接転送します。このようにして、細胞を空気に長時間さらすことは避けることができ、アッセイのパフォーマンスが低下する(低い/信号なし)可能性があります。 - 1x Tyrodeのバッファーの100 μLの制御ウェル(最大のリシスおよび非感作バックグラウンド細胞)をカバーします。抗原でこれらのコントロールウェルを刺激しないでください。
- さらに、1x Tyrodeのバッファーを100μLを希釈系列の感作非抗原ウェルに加え、データ解析中に感作細胞の抗原非自発的な放出を考慮に入れる必要があります。
- 37°Cおよび5%-7%CO2で1時間のhuRBL細胞をインキュベートする。
6. β-ヘキソサミニダーゼ活性の蛍光測定
- 最大リシスコントロールのウェルを10%トリトンX-100の10μLで処理し、細胞を完全にライスし、β-ヘキソサミニダーゼの100%放出を得るために適切に混合します。
- 50 μLの基材溶液を新しい非結合型96ウェルプレートに追加します。1つの96-ウェルプレートのための基質解決:0.1 Mのクエン酸アッセイバッファーの5 mL、pH 4.5;80 μLの10 mM 4-メチルウンベリフェリル N-アセチル-β-D-グルコサミニド。
- すべてのウェルの細胞上清の50 μLを、基質溶液を含む新しいプレートに移します。
注:上清はhuRBL細胞を破壊しないように、huRBLプレートから慎重に外清。 - 37°Cで1時間の基質溶液と細胞上清でプレートをインキュベートし、フルオロゲン基質の変換を可能にします。
注意:細胞生存アッセイのためにhuRBLプレートを保管してください。 - 停止液(15 g/Lグリシン、11.7 g/L NaClをdH2Oに溶解し、pH 10.7)を1ウェルあたり100 μL加えます。
- プレートリーダーを使用して、360 nmの励起と465 nmの発光で蛍光を測定します。
7. データ分析
- リリースの割合の基本的な計算については、任意のスプレッドシートソフトウェアを使用します。
- 背景の減算/ベースライン除去の場合は、他のすべてのウェルからバックグラウンドウェルの平均値を差し引きます。
- 最大溶解ウェルの平均を計算し、希釈系列のデータをパーセンテージで表現します。このようにして、細胞のリシスによって生じる最大酵素放出に正規化した細胞放出の割合としてデータを発現させることができる。
- 完全な用量応答メディター放出曲線は、X軸上のログ上の抗原濃度およびY軸上のメディター放出の割合を有するXYグラフとして最もよく表される。
- 非抗原制御の値を破線として加算し、背景または底面の高原を示します。
注: 同様に扱われるいくつかのセラは、この正規化戦略を使用して比較することができます。直接比較のために、カーブ当たりの最大かつ最小値の平均として定義される半分の最大放出に必要な抗原濃度(ng/mL)である半分の最大放出を計算することがさらに推奨されます。半分の最大放出を刺激する抗原濃度は、半最大放出値を対数回帰線に補間することによって計算される。
結果
このメディター放出アッセイは、huRBL細胞(図1A およびB)に基づいて、ベル状の線量応答曲線をもたらす(図1C)。データ表現を簡略化するために、半最大メディター放出に必要な抗原濃度は、線形回帰を用いて計算することができる(図1D)。細胞生存アッセイは、感作血清または刺激に使用される抗原のいずれかから得られる細胞傷害効果を排除するために行われる(図1E)。アッセイは、ある抗原に対する異なるセラの反応性を試験するために使用することができる。我々の場合、白樺花粉アレルギー患者に由来する5つのセラのうち4人がBet v 1刺激に反応した。血清#1は最高のメディターリリースを示した(図2)。血清#5はBet v 1刺激に反応せず、したがって、他の白樺花粉アレルゲン(例えば、ベットv 2、プロフィリン)に反応する可能性があります。これらのデータは、Bet v 1がIgE媒介性アレルギー症状の原因となる強力なアレルゲンであることを示しています。huRBLアッセイを用いることで、相同性アレルゲンに対するIgEの交差反応性を評価することができる(図3)。ここでは、両方の白樺花粉アレルギー患者がBet v 1によく反応したのに対し、患者#2だけがヘーゼルナッツに見られるBet v 1-相同の食物アレルゲンであるCor a 1にも応答した。これらのデータに基づいて、患者#2は、患者#1よりも高い1-クロス反応性IgEレベルの高いCorを有する可能性が最も高く、ヘーゼルナッツ消費時に経口アレルギー症状をもたらす。アレルゲンの変異変異型変異体の低刺激性の評価(効力の低下)も分析し、その野生型と比較することができる(図4)。提供された例では、フォールド変異体の放出曲線は、野生型アレルゲンに比べてより高い抗原濃度に向かってシフトし、その結果、半分の最大放出を引き起こすのに必要な抗原の濃度が有意に高くなる(図4B)。これらのデータは、生成された変異型/折り畳み変異体が野生型タンパク質と比較してアレルギー性が低いことを示唆している。IgE媒介脱顆粒を引き起こすこの還元された効力は、フォールド変異体の低刺激性特性を強調する。このアッセイに基づいて、フォールド変異体は治療中にIgE関連の副作用を減少させる可能性があるため、アレルゲン特異的免疫療法の興味深い候補である。
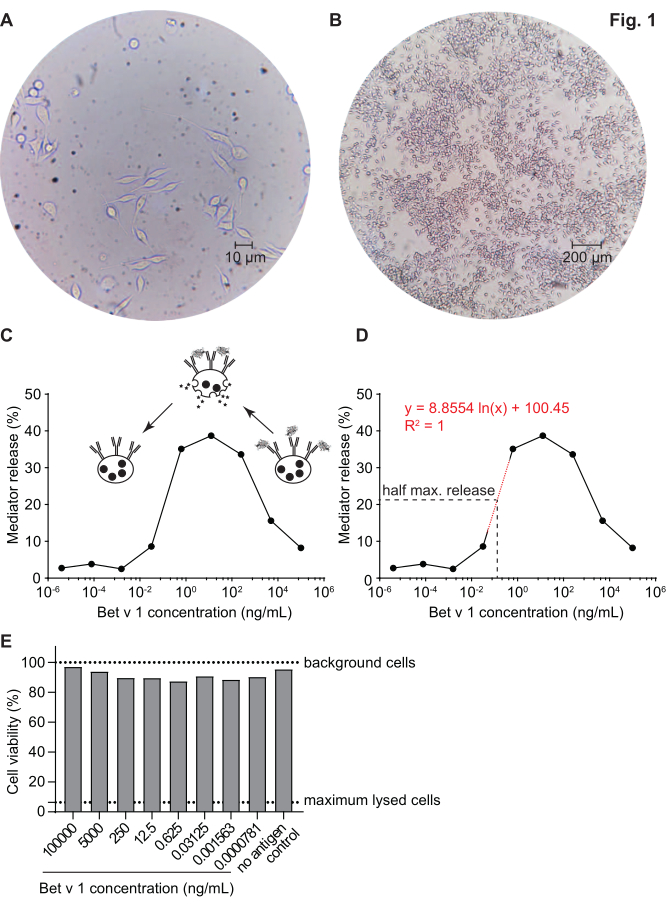
図1:ヒト化RBL細胞とIgE-アレルゲン架橋誘導β-ヘキソサミニダーゼ放出の代表的なベル状曲線 RBL細胞は培養フラスコに付着しており、自分自身を取り付けようとしている棒状の形を与える(A)。収穫される細胞のための合流の理想的なレベルは90%以下である(B)。細胞はそれぞれ40倍と10倍の倍率で示される。組換えベットv 1(rBet v 1)との挑戦に反応する白樺花粉アレルギー個体のヒト血清で感作した細胞は、主要なバーチ花粉アレルゲン(C)である。メディエーター放出の代理として、βヘキソサミニダーゼ活性は細胞上清で測定される。このベル状の曲線は、アレルゲンの過剰によるIgE上の抗原エピトープの一価の職業から生じ、高い抗原濃度でのアレルゲン-IgE架橋を競合的に阻害する。高アレルゲン濃度での低放出に関するもう一つの説明は、過剰な抗原の存在下での細胞内経路の阻害である。半最大放出を得るために必要なアレルゲン濃度の決定のために、メディター放出曲線の傾きの線形部分を表す実験値に基づく対数回帰線(D)を用いた。赤い点線は、計算に使用される対数回帰直線を表します。回帰直線の数式は赤で表示されます。半分の最大リリースは、半分の最大リリース = (最小リリース値 + 最大リリース値)/2 と定義されます。この例では、計算された半分の最大放出は20.6%でした。この実験で使用した代表的なヒト血清はhuRBL細胞とのインキュベーション用に1:20希釈し、刺激に使用される抗原濃度はベットv1の100μg/mLから0.004 pg/mLに及んだ。細胞生存アッセイ(この場合MTTアッセイ)を、抗原刺激後の残りの細胞と共に行い、細胞生存率および細胞数に対する抗原希釈の影響を評価する(E)。未処理の背景細胞およびリシス細胞(最大リシス)は、点線で示される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
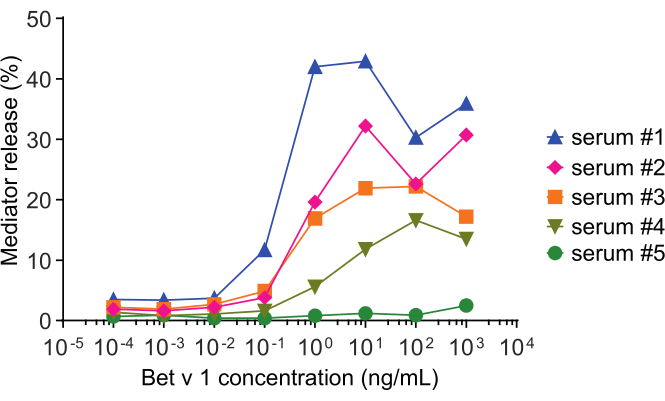
図2:5つの異なるヒトセラのβ-ヘキソサミニダーゼ%放出の代表的な曲線 rBet v1の同じ抗原濃度範囲を、異なる白樺花粉感作者のセラで感作したhuRBL細胞と共にインキュベートした。症状の重症度に対応する異なる患者間の放出率の明確な差がある。患者#5は主要な白樺花粉アレルゲンベットv 1に非反応性であることに注意してください。これらのメディター放出曲線を得るために使用される5種の全てのヒトセラは、huRBL細胞とのインキュベーションのために等しく1:20に希釈した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
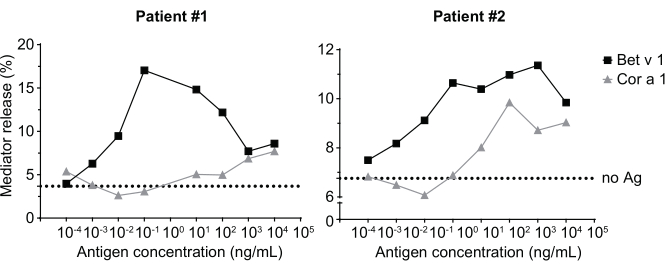
図3:バーチ花粉のセラに由来するIgEの交差反応性は、Bet v 1相同種ヘーゼルナッツアレルゲンCora1を有する患者を感作した患者である。 白樺花粉に感作された患者の2つの代表的なセラは、Bet v 1に強く反応するとともに、相同性アレルゲンCora1に対してより少ない程度に反応する。患者2は、コルA1に対して有意な反応を示し、したがって、メディター放出がほとんど無視できる患者1と比較して、ヘーゼルナッツ消費時に経口アレルギー症状を示す可能性が高い。点線は、ヒトセラで感作されたがアレルゲンで刺激されない細胞であるノー抗原コントロールを表し、したがって、底部のシグナル高原/背景の指標となる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
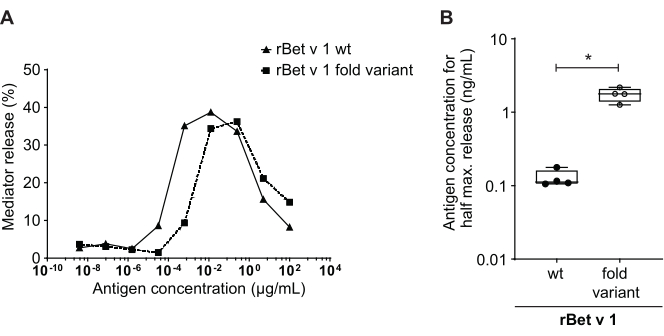
図4:rBet v 1野生型と低刺激性フォールドバリアントとの放出率の比較 白樺花粉感作者の同じ血清を、rBet v 1野生型(wt)と主要なバーチ花粉アレルゲンの低刺激性フォールド変種(A)でインキュベートした。メディター放出は両方の抗原に見られますが、同じパーセント放出に対してフォールドバリアントを野生型rBet v 1と比較すると、より高い抗原濃度に向かって明確なシフトがあります。異なる抗原の放出パーセントの差を比較する標準的な方法は、半分の最大放出を達成するために必要な抗原の濃度を計算することである(B)。これは通常、生物学的複製(異なるヒトセラにおけるアレルゲンごとに同じ抗原範囲の試験)で行われる。通常、重要な結論を導くために、メディエーター放出は、少なくとも8〜10の異なる患者からセラで行われる。ここでは、4つの異なるセラの結果を例にプロットします。ペアの t -testを使用して統計分析を行いました。*p ≤ 0.05;**p ≤ 0.01;p ≤ 0.001;p ≤ 0.0001. この図の大きなバージョンを表示するには、ここをクリックしてください。
| 潜在的な質問とトラブルシューティング | 解決 |
| 細胞応答性の変化によるアッセイ間の変動 | 細胞通過周期数が20~30の通過を超えないようにしてください。将来の実験のために早い段階で冷凍在庫を作る。 |
| むしろ技術的なものよりも生物学的複製(異なるセラの使用)に依存しています。 | |
| セラは、特定のIgEの低レベルが含まれています | 下段の最終血清希釈法は、1:20ではなく(すなわち1:10)使用することができる。逆に、特異的IgEの高レベルを含むセラをさらに希釈することができる(1:30または1:40)。 |
| アッセイを実行するのに十分な細胞がない | T-75フラスコの合流率が50~90%程度であることを確認してください。より多くのフラスコを通過します。 |
| セラの細胞傷害効果、すなわち不完全な補体不活性化によるもの | メディケータ放出アッセイに加えて、細胞生存アッセイを実行する。不完全な補体不活性化を避けるためにAg8濃度を増加させます。 |
| 低信号 | dH2Oの代わりに1xタイローデのバッファーを重水素酸化物(D2O)に希釈するか、または関心のあるアレルゲンに特異的IgEのレベルが高いセラを使用することにより、アッセイのシグナル対雑音比を改善します。 |
| アレルゲンはタイローデの緩衝液(例えば沈殿)で安定していない | アッセイ処理の前に、1x Tyrodeの緩衝液で安定性試験を行ってください。タイローデのバッファの置換は推奨されません。 |
| それぞれのアレルゲンの適切な開始濃度を見つける問題 | 完全なリリース曲線をカバーする希釈シリーズの適応(より多くの希釈ステップ、1:10の代わりに1:20希釈)。 |
| 低/ノーシグナルで示されるアッセイ性能の低下 | セラまたは抗原刺激(酵素アレルゲンなど)による細胞傷害作用を避けてください。細胞を洗い、慎重に浸します。空気への暴露を長く避け、細胞が乾燥するのを防ぎます。 |
| 下の信号台に到達したかどうかを知る方法は? | お皿に「抗原なし」コントロールを追加します。これらは感作細胞であり、1x Tyrodeの緩衝剤のみで刺激されたが、アレルゲンは含まない。 |
| 最大のリシスウェルに加えて、ポジティブコントロールが必要ですか? | さらなる陽性対照として、脱顆粒を引き起こす血清と抗原の組み合わせを、または抗FcεR1抗体を使用することができる。 |
| 井戸はいくつ必要ですか? | それはあなたの滴定シリーズ、あなたが分析したい抗原とセラの数に依存します。 テストするセラ/抗原の数に応じて、96 ウェルプレートのレイアウトを計画します。「無抗原コントロール」、バックグラウンド細胞(非感作、非刺激)、ならびに最大のリシスウェルを加えることを忘れないでください。 |
| 私は何セラをテストする必要がありますか?そして、私は複製が必要ですか? | アッセイは非常に堅牢ですが、細胞の応答性が変化するためアッセイ間の変動があります。したがって、技術的な複製よりも生物学的複製(異なるseraを使用)に頼ることを推奨します。アレルゲンを分析するには、最低8種類のセラで十分です。しかし、図4Bに示すように、有意な結果は、より少ないセラを用いて既に得ることができる。 |
表 1: トラブルシューティング
ディスカッション
本明細書記載のhuRBL細胞ベースのメディケーター放出アッセイは、任意の実験室で容易に実施し、実施することができる堅牢な方法である。唯一の要件は、細胞が無菌条件下で栽培される必要があるということです。このアッセイは、患者のIgE架橋および好塩基不顆粒化17を呼び起こすアレルゲンまたはアレルギー源の可能性を評価するために使用される。このアッセイは、患者の血清が高レベルの特異的IgEを有する限り、任意のアレルゲンまたはアレルギー源に容易に適応することができ、対象のアレルゲンを認識し、利用可能である。アッセイ性能の低下を招く可能性のある細胞傷害性効果を考慮するために、メディター放出アッセイに加えて細胞生存アッセイを実行することが推奨されます。これは、血清または他の血清由来細胞毒性効果の不完全な補体不活性化に起因する可能性があります。.例えば、抗原自体も、タンパク質分解/酵素活性のために、huRBL細胞に害を与える可能性があります。我々は通常、MTT(3-(4-4-ジメチルチアゾール-2-イイル)-2,5-ジフェニルテトラゾリウム臭化物)を用いて細胞生存アッセイを使用して、潜在的な細胞傷害効果を評価している。このアッセイは、細胞上清が収集され、移された後に残されたhuRBL細胞で容易に行うことができる(プロトコルのステップ6.3.を参照)。ELISAやウエスタンブロッティングなどの他の免疫化学的方法と比較して、アレルゲン-IgE結合に基づいて個々のアレルゲンまたは複雑な抽出物のアレルギー性ポテンシャルを決定するために、このアッセイは、アレルゲンへのIgEの結合を検出するだけでなく、ヒトIgEとアレルゲンの両方の機能性を測定し、IgE培地の梅動脱顆粒を引き起こす。したがって、患者のセラを用いて、アレルギー症状の重症度を研究するのに役立つ。アッセイはRBL-2H3細胞を利用しているため、従来の受動性の皮状アナフィラキシー検査よりも一貫性と効率が高いと報告されており、これは、マスト細胞やヒト好塩基球19、20などの初代細胞に比べて比較的扱いやすく、結果のばらつきが少ない。これに加えて、アッセイはアレルゲンの生物学的活性を良好に表現し、所定の複雑なサンプル3における総アレルゲン含有量を正確に推定することができる。プロトコルの特定の手順のトラブルシューティングについては、表 1を参照してください。
メディケータ放出アッセイのこのバージョンの適用性に関しては、主に研究目的だけでなく、それらの生物学的活性に基づくアレルギー性抽出物の標準化のために使用されています。これには、SPTソリューションの異なるバッチの分析、挑発テストソリューション、ならびにアレルゲン特異的免疫療法に使用される抽出物が含まれます。花粉、猫のダンダー、ハウスダニ、およびピーナッツエキス、ならびにビー毒3、17、21に示すように。この技術は、ピーナッツ、牛乳、小麦、卵22などの複雑な食品中のアレルギー成分の少量でも検出することができるので、特に食物アレルギーの診断に適用することができる。この点で、トトロミオシンなどの動物食物アレルゲンのアレルゲン性の評価に有用なツールとしても報告されており、非アレルゲン23と強力なアレルゲンを区別する際に役立つ可能性がある。研究ツールとして、このアッセイは、食品加工の影響を研究し、アレルゲンへのリガンド結合の影響およびアレルゲン性24,25に及ぼす影響を評価するために使用される。例えば、リガンドへのBet v 1の結合は、アレルゲン-IgE架橋に影響を及ぼさないと示されたが、その熱およびタンパク分解安定性25の増加を引き起こした。このアッセイは、患者の反応性を軽度および主要なアレルゲンと比較するとともに、Bet v 1および同種食物アレルゲンCora1を用いた例に示すように、アレルゲン同種およびアイソフォームの交差反応性を調べる場合にも使用できる(図3)。アレルゲンアイソフォームに関しては、メディエーター放出アッセイは、ブタクサ花粉(アンブロシアアルテミシフォリア)における最も強力なIgE反応性アイソフォームとしてAmb1.01の主要なアレルゲンを同定するために使用された。これに対し、ブタクサ花粉抽出物中の他の2つのアイソフォームは、Amb a 1.02およびAmb a 1.03であり、患者のIgE26に対する反応性の低下を示した。
近年、アッセイは、アレルゲンの潜在的な抗アレルギー性化合物および新しい低刺激性変異体を研究するために適用され、アレルゲン特異的免疫療法27、28に適した候補の同定を支援している。もう一つの新しいアプローチは、アレルゲン特異的免疫療法の過程で治療効果を監視するためにアッセイを使用することです。この点に関して、我々の研究グループは、アレルゲン特異的免疫療法29の間に患者の症状スコアの低下と良好に相関するhuRBLアッセイ阻害システムを開発した。アッセイは、アレルゲン誘導IgE媒介脱顆粒30に対するTGFβ1の免疫抑制効果を研究するためにも提案されている。
アッセイの限界は、huRBL細胞がマスト細胞または好塩基球のいくつかの特徴を有するにもかかわらず、これらのエフェクター細胞の自然な機能を完全に模倣しないことである。例えば、肥満細胞は、パターン認識受容体トール様受容体4(TLR4)を広く発現し、病原体認識に必要な、一方、RBL-2H3細胞31において完全に欠損している。機能性の違いにより、アッセイは実際の状況を完全に模倣するものではなく、データを解釈する際に留意する必要があります。また、huRBL細胞は癌性好塩基球細胞であるため、培養条件の変化や培養の長期化は、異なる実験室20の間で結果の変化につながる平滑性の違いをもたらす可能性がある。もう一つの態様は、高いアレルゲン濃度が高いので、この方法を適応させる際に考慮しなければならないアレルゲン濃度の選択は、大量のプロテアーゼまたはエンドトキシン18の存在に起因する非IgE媒介脱顆粒をもたらす可能性がある。他の制限は、比較的高い特異的IgEレベル(RASTクラス5-6)を有するヒトセラへの依存性と、毎日の臨床ルーチンで技術を実施するために克服する必要がある障害である細胞培養システムの必要性である。
これらの制限とは別に、huRBLアッセイはアレルギー疾患の診断と治療のための貴重な研究ツールを表し、幅広い用途で使用することができます。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ドイツのランゲンにあるポール・エールリッヒ・インスティトゥート分子アレルギー学科のステファン・ヴィース教授が、ヒト化/FcεRIに感染したRBL細胞を提供し、この研究方法論論文を書く同意を与えてくれたことに感謝したいと考えています。ファティマ・フェレイラ教授に、素晴らしいフィードバックを提供してくださったことに感謝します。さらに、アムステルダム大学医療センターのロナルド・ファン・リー博士と、実験免疫学科のヤープ・アッカーダス博士、ロケーションAMC、 アムステルダム、オランダ、プロジェクトBM4SITの過程で生成されたこの方法の論文で提供される代表的なデータを公開することに同意した - アレルギーのための革新(www.BM4SIT.eu)の仕事 著者らは、オーストリア科学基金(プロジェクトP32189)、ザルツブルク大学優先プログラムアレルギーがんバイオナノ研究センター、オーストリア科学基金(FWF W01213)が資金を提供するがんおよびアレルギー-ICAの博士プログラム免疫、および欧州連合(EU)の第7フレームワークプログラムFP7のBM4SITプロジェクト(助成金番号601763)によって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| 4-Methylumbelliferyl N-acetyl-β-D-glucosaminide | Sigma | M2133 | |
| 96-well plate for huRBL cells (Nunc MicroWell 96-Well, Nunclon Delta-treated, flat-bottom microplate) | ThermoFisher Scientific | 167008 | |
| 96-well plate for substrate solution and cell supernatant (Greiner Bio-One non-treated 96-well microplates) | Fisher Scientific | 655101 | |
| Bovine serum albumin (BSA) | Sigma | 10735078001 | |
| Citric acid | Applichem | 131018 | |
| Dulbecco's phosphate-buffered saline (DPBS without calcium and magnesium) | Sigma | D8537 | |
| G418 | Sigma | A1720 | |
| Glycine | Applichem | A3707 | |
| Heat-inactivated fetal calf/bovine serum (FCSi) | Sigma | F0804 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Minimum Essential Medium Eagle with Alpha Modification, with ribonucleosides, deoxyribonucleosides and sodium bicarbonate, without L-glutamine, liquid, sterile-filtered, suitable for cell culture | Sigma | M8042 | |
| Opti-MEM reduced serum medium, GlutaMAX supplement | Gibco/ThermoFisher Scientific | 51985034 | |
| Penicillin-Streptomycin (10K units Pen. 10 mg/mL Strep.) | Sigma | P4333 | |
| Sodium chloride (NaCl) | Applichem | A2942 | |
| Sodium hydrogen carbonate (NaHCO3) | Applichem | 131638 | |
| Triton X-100 | Sigma | X100 | |
| Trypsin-EDTA | Sigma | 59418C | |
| Tyrode’s salt | Sigma | T2145 |
参考文献
- Curin, M., et al. Next-generation of allergen-specific immunotherapies: molecular approaches. Current Allergy and Asthma Reports. 18 (7), 39(2018).
- Okamoto-Uchida, Y., et al. Different results of IgE binding- and crosslinking-Based allergy tests caused by allergen immobilization. Biological and Pharmaceutical Bulletin. 39 (10), 1662-1666 (2016).
- Vogel, L., Lüttkopf, D., Hatahet, L., Haustein, D., Vieths, S. Development of a functional in vitro assay as a novel tool for the standardization of allergen extracts in the human system. Allergy. 60 (8), 1021-1028 (2005).
- Ocmant, A., et al. Basophil activation tests for the diagnosis of food allergy in children. Clinical and Experimental Allergy. 39 (8), 1234-1245 (2009).
- Platts-Mills, T. A. The role of immunoglobulin E in allergy and asthma. American Journal of Respiratory and Critical Care Medicine. 164 (8), Pt 2 1-5 (2001).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693-704 (2012).
- Lawrence, M. G., et al. Half-life of IgE in serum and skin: Consequences for anti-IgE therapy in patients with allergic disease. The Journal of Allergy and Clinical Immunology. 139 (2), 422-428 (2017).
- Draber, P., Halova, I., Polakovicova, I., Kawakami, T. Signal transduction and chemotaxis in mast cells. European Journal of Pharmacology. 778, 11-23 (2016).
- Peebles, R. S. Prostaglandins in asthma and allergic diseases. Pharmacology & Therapeutics. 193, 1-19 (2019).
- Cyphert, J. M., et al. Allergic inflammation induces a persistent mechanistic switch in thromboxane-mediated airway constriction in the mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (1), 140-151 (2012).
- Méndez-Enríquez, E., Hallgren, J. Mast cells and their progenitors in allergic asthma. Frontiers Immunology. 10, 821(2019).
- Demoly, P., Lebel, B., Arnoux, B. Allergen-induced mediator release tests. Allergy. 58 (7), 553-558 (2003).
- Yamaga, S., et al. Decreased intracellular histamine concentration and basophil activation in anaphylaxis. Allergology International. 69 (1), 78-83 (2020).
- Huang, L., et al. A rapid and sensitive assay based on particle analysis for cell degranulation detection in basophils and mast cells. Pharmacological Research. 111, 374-383 (2016).
- González-Pérez, R., Poza-Guedes, P., Barrios Del Pino, Y., Matheu, V., Sánchez-Machín, I. Evaluation of major mite allergens from European standardized commercial extracts for in vivo diagnosis: addressing the need for precision medicine. Clinical and Translational Allergy. 9, 14(2019).
- Focke, M., Marth, K., Valenta, R. Molecular composition and biological activity of commercial birch pollen allergen extracts. European Journal of Clinical Investigation. 39 (5), 429-436 (2009).
- Hoffmann, A., Vieths, S., Haustein, D. Biologic allergen assay for in vivo test allergens with an in vitro model of the murine type I reaction. The Journal of Allergy and Clinical Immunology. 99 (2), 227-232 (1997).
- Sun, N., Zhou, C., Zhou, X., Sun, L., Che, H. Use of a rat basophil leukemia (RBL) cell-based immunological assay for allergen identification, clinical diagnosis of allergy, and identification of anti-allergy agents for use in immunotherapy. Journal of Immunotoxicology. 12 (2), 199-205 (2015).
- Kaul, S., Hoffmann, A. Mediator release assay of rat basophil leukemia cells as alternative for passive cutaneous anaphylaxis testing (PCA) in laboratory animals. Altex. 18 (1), 55-58 (2001).
- Passante, E., Frankish, N. The RBL-2H3 cell line: its provenance and suitability as a model for the mast cell. Inflammation Research. 58 (11), 737-745 (2009).
- Kaul, S., et al. Mediator release assays based on human or murine immunoglobulin E in allergen standardization. Clinical and Experimental Allergy. 37 (1), 141-150 (2007).
- Huang, J., et al. Application of in vitro and in vivo models in the study of food allergy. Food Science and Human Wellness. 7 (4), 235-243 (2018).
- Klueber, J., et al. Homologous tropomyosins from vertebrate and invertebrate: Recombinant calibrator proteins in functional biological assays for tropomyosin allergenicity assessment of novel animal foods. Clinical and Experimental Allergy. 50 (1), 105-116 (2020).
- Zhang, T., et al. Different thermal processing effects on peanut allergenicity. Journal of the Science of Food and Agriculture. 99 (5), 2321-2328 (2019).
- Soh, W. T., et al. Multiple roles of Bet v 1 ligands in allergen stabilization and modulation of endosomal protease activity. Allergy. 74 (12), 2382-2393 (2019).
- Wolf, M., et al. Amb a 1 isoforms: Unequal siblings with distinct immunological features. Allergy. 72 (12), 1874-1882 (2017).
- Eichhorn, S., et al. Rational design, structure-activity relationship, and immunogenicity of hypoallergenic Pru p 3 variants. Molecular Nutrition & Food Research. 63 (18), 1900336(2019).
- Abd Rani, N. Z., et al. Mechanistic studies of the antiallergic activity of phyllanthus amarus Schum. and Thonn. and its compounds. Molecules. 26 (3), (2021).
- Huber, S., et al. Does clinical outcome of birch pollen immunotherapy relate to induction of blocking antibodies preventing IgE from allergen binding? A pilot study monitoring responses during first year of AIT. Clinical and Translational Allergy. 8 (1), 39(2018).
- Araujo, G. R., et al. TGFβ1 mimetic peptide modulates immune response to grass pollen allergens in mice. Allergy. 75 (4), 882-891 (2020).
- Passante, E., Frankish, N. Deficiencies in elements involved in TLR4-receptor signalling in RBL-2H3 cells. Inflammation Research. 59, Suppl 2 185-186 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved