このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
植物細胞におけるフェルスター共鳴エネルギー移動測定
要約
インビボフェルスター共鳴エネルギー移動測定に対して標準の共焦点レーザー走査顕微鏡を設定し、その後データ評価を行うためのプロトコルが提供されています。
要約
感作発光ベースのフェルスター共鳴エネルギー伝達(FRET)実験は簡単に行われますが、顕微鏡の設定に依存します。共焦点レーザー顕微鏡は生物学者の役馬となっています。商用システムは、レーザーパワー調整と検出器感度に高い柔軟性を提供し、多くの場合、完璧な画像を得るために異なる検出器を組み合わせます。しかし、この柔軟性により、異なる実験やセットアップによる強度ベースのデータの比較は、しばしば不可能です。生物学者に優しい手順は利点があり、レーザーおよび検出器の設定の簡単で、信頼できる調節を可能にする。
さらに、生細胞におけるFRET実験は、タンパク質発現およびドナー・アクセクター比の変動の影響を受けるため、データ評価のためにタンパク質発現レベルを考慮する必要があります。ここで説明するのは、タンパク質発現の推定とレーザー強度と検出器の設定の調整のためのルーチンを含む、信頼性と再現性FRET測定のための簡単なプロトコルです。データ評価は、既知のFRET効率の蛍光色素融合を用いた較正により行われる。簡便性を向上させるために、細胞内で得られた補正因子と、組換え蛍光タンパク質の測定によって得られた補正因子が比較されてきた。
概要
フェルスター共鳴エネルギー移動((F)RETは、通常、蛍光分光法によって観察されるが、プロセス自体は、フルオロフォア間で発生するに限定されない。基礎となる双極子双極子結合は単に発光のドナー分子および光吸収の受け入れ器を必要とする。これは、正規化されたドナー発光とアクピケータ吸光度スペクトル1の必要なスペクトルオーバーラップ積分Jに由来する。しかし、RETは蛍光と競合するため、蛍光発光の変化によりエネルギー移動が測定可能になる:RETはドナーの焼入れおよび感作アクセプターの放出を誘導する。
蛍光系RETは、蛍光共鳴エネルギー移動(FRET)と呼び、これを生物発光共鳴エネルギー移動(BRET)から分離する。RETは、0.5〜10 nm2の範囲で広く、したがって、タンパク質とその複合体の寸法と同じ範囲にあるドナーとアクセクターの間の距離に強く依存します。第二に、RETは双極子双極子方向カッパ二乗に依存する。タンパク質結合フルオロフォアの回転自由度は分子量と回転緩和の遅さにより無視され得るという事実と相まって、RETは立体構造変化の解析を可能にする3。
いわゆるフェルスター半径は、スペクトル重複積分とオーバーラップの波長範囲に基づいているため、赤色光吸収性のクロモフォアは青色光吸収色素よりも長いフェルスター半径をもたらす。FRET測定のダイナミックレンジはR0×0と1.5×R0によって制限されているため、FRETペアECFP-EYFPは4.9 nm4のR0により2.5-7.3 nmのダイナミックレンジを有します。
蛍光色素の明るさは、そのモル絶滅係数とその量子収率の積で与えられます。FRET測定では、ほぼ同じ輝度の蛍光体を選択することが有利です。これにより、ドナーの焼入れおよび感作アクセプター放出の検出が強化される。また、顕微鏡システムのキャリブレーションを好みます。頻繁に使用されるFRET対のシアンおよび蛍光タンパク質を見ると、シアン蛍光タンパク質の輝度が低いほど明らかになる(図1A)。
しかし、アクシーザの寿命はドナーの寿命よりも低く、エネルギー移動のためのアクシークサの利用可能性を確保しなければならない。アクセクサの寿命がドナーの存続期間を超えた場合、ドナーが再び興奮したときに、アクセクサは興奮状態にある可能性があります。mTurquoiseのような高度なシアン蛍光タンパク質は、寿命が長く、FRETの増加確率に寄与します(図1B)。FRET の確率も、アクシペクタのモル絶滅係数に依存します。
プロトコル
注: 以下のプロトコルでは、前述のとおり、プロトプラストの一時的トランスフェクションが行われました。簡単な説明を以下に示します。
1. プロトプラストの一過性トランスフェクション
- シロイヌナズナエコタイプコロンビアの健康な葉の〜4 gを1mmスライスに切り、20 mLの酵素溶液(1.5%セルラーゼ;0.4% マセロザイム; 0.1% ウシ血清アルブミンフラクション V; 0.4 M マンニトール; 20 mM KCl; 20 mM 2-(N モルフォリノ)エタネスルホン酸 (MES), pH 5.7; 10 mM CaCl2.
- 葉のスライスに真空浸潤し、続いて室温で2時間攪拌してインキュベーションを行います。100×gで3分間遠心分離して細胞を収穫 する。
- プロトプラストをW5溶液(154 mM NaCl;125 mM CaCl2;5 mM KCl;2 mM MES、pH 5.7)で洗浄し、MMG溶液(0.4 Mマンニトール;15 mM MgCl2;4 mM MES、pH 5.7)で再中断します。
- ポリエチレングリコール(PEG)4000の存在下で浸透性ショックにより8ウェルスライドでトランスフェクションを行います。プロトプラスト懸濁液の20 μLをプラスミドDNA(5 μg/μL)5 μL、PEG溶液25 μL(0.2 M マンニトール、0.1 M CaCl2、40% PEG 4000)と混合します。
- 浸透性条件の穏やかな再調整によって浸透衝撃を逆にする。
注:目的のサンプルに加えて、ドナーとアクシペサのスペクトルブリードスルーをそれぞれ決定するために、ドナー単独とアクサクサの発現が必要です。ドナーとアクセクサの融合タンパク質は、較正目的でも発現する必要があります。蛍光タンパク質発現は、カリフラワーモザイクウイルス35Sプロモーター(pCaMV35S)の制御下にあった。すべての測定に対して、2つの共焦点レーザー走査顕微鏡(LSM1およびLSM2)が使用された。LSM1には2種類の検出器があります:FRET測定では、ドナー信号はGaAsP検出器によって検出され、FRETおよびアクセプターの放出はフォトマルチプライヤで記録されました。LSM2は、ドナー、FRET、およびアクセプタ放出の検出に使用された2つのフォトマルチプライヤを有する。
2. レーザー調整
注:ここでは、アルゴンイオンレーザーの458 nmおよび514 nmラインが、強化シアン蛍光タンパク質(ECFP)および強化黄色蛍光タンパク質(EYFP)標識タンパク質の間のFRET分析に適用されています。再現性のあるデータ取得のために、両行とも同様の強度に調整した。これは、伝送フォトマルチプライヤまたは反射モードのいずれかによって達成されました。
- 透過光増倍器によるレーザー調整
- 調整には空の井戸を使用します。
- ラインスキャンモードとヒストグラム表示を選択します。
- レーザー強度を最小限に抑え、検出可能なバックグラウンドノイズに検出器のゲインを調整します。
- 0.5%のステップでレーザー強度を増加させ、対応する信号を記録します。
- 両方のレーザーラインにルーチンを適用します。
- 反射モードによるレーザー調整
- 調整には空の井戸を使用します。
- 反射フィルタを適用し、反射 モードをオンにします(可能な場合)。
- 検出器の波長範囲がレーザーの波長をカバーしていることを確認します。
- ラインスキャンモードとヒストグラム表示を選択します。
- レーザー強度を最小限に抑え、検出可能なバックグラウンドノイズに検出器のゲインを調整します。
- 目標を最も低い位置に移動します。
- カバースリップの反射が見えるまで、目的を上に移動します。
- 0.5%のステップでレーザー強度を増加させ、対応する信号を記録します。
- 両方のレーザーラインにルーチンを適用します。
- データ評価
- データを集計し、信号強度でデータをソートします。
- 相対レーザーパワーに対して信号強度をプロットします。
- 同様の信号強度をもたらすレーザー強度を選択します。
3. フォトマルチプライヤの調整
注:レーザー調整後、フォトマルチプライヤーは、同様の感度を得るために個々のゲインに調整されました。このキャリブレーションは、対象波長範囲の中心にある514 nmレーザーラインで行われました。
- 調整には空の井戸を使用します。
- 反射フィルタを適用し、可能な場合は反射モードに切り替えます。
- 検出器の波長範囲がレーザーの波長(514 nm)をカバーしていることを確認してください。
- ラインスキャンモードとヒストグラム表示を選択します。
- 検出器のゲインを最大の半分に下げ、レーザー強度を検出可能なバックグラウンドノイズに調整します。
- 目標を最も低い位置に移動します。
- カバースリップの反射が見えるまで、目的を上に移動します。
- 50~100Vのステップで検出器ゲインを上げ、対応する信号を記録します。
- 両方の検出器にステップ 3.1 ~ 3.8 を適用します。
- データ評価
- 各検出器の検出器ゲインに対して強度をプロットします。
- 同様の感度を得るために、個々の検出器のゲインを選択します。
4. フレット画像の取得
注: 画像取得の設定に関するサンプルから始めます。
- 適切なフィルタ/二色性ミラー(例:FRETペアECFP/EYFP用のダブルダイクロICミラーMBS 458/514)を選択します。すべてのチャンネルで同じ二色ミラーを使用して、ラインバイラインスキャンを有効にします。生きている細胞のイメージングのための水浸漬目的を選択します。12 ビットまたは 16 ビットスキャンと中程度のスキャン速度を選択します。
- 検出範囲を定義し、好ましくはドナー検出用470-510 nm、ECFP/EYFPの場合はアクセクター/FRET検出用530-600 nmを定義する。445 nmまたは440 nmダイオードレーザーを使用する場合は、検出範囲として450〜510nmを使用してください。アヌースト光ビームスプリッター(AOBS)の場合、ドナー検出を450~500nmの範囲で定義し、不要なアクセプタ検出を防ぎます。
- 3.10.2に従って検出器設定を適用します。
- 2.3.2に従ってレーザー設定を適用します。必要に応じて、取得したレーザーパワーテーブルに基づいてレーザー強度を修正します。信号対雑音比が検出器のダイナミックレンジ全体(12ビットスキャンでは0~4095の範囲)をカバーしていることを確認します。
- レーザー強度を保ち、検出器のゲインを一定に保ちます。ピンホールの直径を微調整します。
注: ピンホール直径の変化は空間解像度に影響を与えます。 - 測定を行います(少なくとも20個の細胞の画像を撮ります)。
5. クロストーク補正の決定
注:ドナーまたはアクセクサのみを発現する細胞は、ドナースペクトルブリードスルー(DSBT)およびアクセクサスペクトルブリードスルー(ASBT)をそれぞれ決定する必要があります。セクション 4 で説明した設定と同じ設定を維持します。
- ドナー蛍光素を発現する細胞でFRET測定を行います。
- アクセクサフルオロフォアを発現する細胞でFRET測定を行います。
6. Beemillerら.13による測定値の較正
注:既知のFRET効率のドナー-アクセパシター融合を発現する細胞が必要です。ここでは、0.46のFRET効率を有するECFP-5 aa-EYFP-融合が使用されている。セクション 4 で説明した設定と同じ設定を維持します。
- ドナー-アクセクサ融合を発現する細胞でFRET測定を行う
7. データ評価
- 各プロファイルに複数のセルが含まれることを確認して、セルのライン プロファイルを取得します。プロファイルをテキスト ファイルとして保存します。
- [データ] セクションの [テキスト ファイルのインポート] オプションを使用して、テキスト ファイルをスプレッドシートにインポートします。
- Max 関数を適用して最大値を読み出します。
- 取得した値を表にリストし、ドナー排出ID、FRET排出IF、アクセクター排出IA、および少なくとも4つのデータセット(ドナーのみ、アクセクサのみ、ドナー・アクセクサ融合、および測定)のカラムを持つ。
注:ドナーの励起はまた、アクソクサの直接の励起をもたらし、α値によって記述されるASBTを引き起こす。 - 数式 (1) を使用して、アクサクタ専用データセットを使用して ASBT α値を計算します。
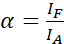 (1)
(1)
注: 次の方程式のすべてのα値の中央値を使用します。ドナーは、アクセプターの感作発光との発光クロストークをもたらす広域発光スペクトルを示す。この DSBT は、β値によって指定されます。 - 式 (2) を使用して、ドナーのみのデータセットを使用して、ドナースペクトルブリードスルーの値をβ計算します。
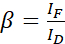 (2)
(2)
注: 次の式のすべてのβ値の中央値を使用します。キャリブレーションファクターマルケスは、FRET由来ドナーの焼入れと感作放出の線形関係を記述する。次の式では、7.5 と 7.6 の中央値を使用します。 - 式 (3) を使用して、ドナー-アクセクターフュージョン データセットとその FRET 効率効率 (0.46) を使用してキャリブレーション係数を計算します。
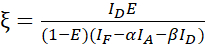 (3)
(3)
注: 次の式のすべての中央値を使用します。 - (4)と(5)の式を使用して、目的とするタンパク質ペアのFRET効率を計算します。
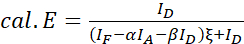 (4)
(4)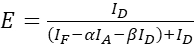 (5)
(5) - 表現強度およびドナーアクサコンダプタ比の効果を推定する: FRET 効率に対する ID、IF、および IA の合計をプロットします。線形回帰を実行します。グラフが急でR2 が高いほど、発現レベルの影響が高くなるか、ドナーとアクピケータの豊富さの差が大きくなることに注意してください。
結果
共焦点レーザー走査顕微鏡の調整
レーザー調整により、レーザー強度の増加に伴う放射の線形増加が明らかになった(図2 および 表1)。アルゴンイオンレーザーの予想通り、514 nm線の放出は、より急な斜面によって証明されるように、458 nmラインの放出よりはるかに高かった。その後の実験では、514 nm線と458nm線にそれぞれ4.5%と6.5%のレーザー?...
ディスカッション
ドナーの急流および感作アクセプター放出は、ドナーまたはアクセプターベースのFRETの計算を可能にする線形関係によって特徴付けられる。線形性の対応する要因は、G因子(受入者へのドナー)またはxi(ドナーへのアクシー)と呼ばれ、これは逆の値4である。蛍光顕微鏡による蛍光タンパク質間のフレット測定では、蛍光タンパク質の広い吸収および発光スペクトルにより、D...
開示事項
私たちは、すべての著者が利益相反を開示し、競合する財政的利益を持たないようにします。
謝辞
実験はビーレフェルト大学生物学部の光顕微鏡技術プラットフォーム(LiMiTec)で行われました。この作品はビーレフェルト大学が資金を提供しています。
資料
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
参考文献
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved