Method Article
ショウジョウバエの消費定量化のための高スループットマイクロプレートフィーダアッセイ
要約
マイクロプレートフィーダーアッセイは、 ショウジョウバエの液体食品消費を定量化するための経済的で高いスループットの方法を提供します。3Dプリントされたデバイスは、ハエが1536ウェルマイクロプレートに収容される96ウェルマイクロプレートを接続し、そこからハエがトレーサー染料で給餌溶液を消費します。溶液体積の減少は分光光度測定で測定される。
要約
ショウジョウバエの食物摂取を定量化することは、消費関連の形質の遺伝的および生理学的基盤、その環境要因、および多数の物質の毒性学的および薬理学的効果を研究するために使用される。現在実装されている方法の中には、高スループットの測定に適した方法はほとんどありません。マイクロプレートフィーダアッセイ(MFA)は、吸光度を用いて個々のハエの液体食品の消費量を定量化するために開発されました。このアッセイでは、ハエは1536ウェルマイクロプレートの選択された井戸から液体食品培地を消費します。希薄トレーサー染料を液体食品媒体に組み込み、既知の体積を各ウェルにロードすることにより、消費前後で得られたよく得られた吸光度測定は、その結果として生じる体積変化(すなわち、消費される体積)を反映する。この方法で高スループット解析を可能にするために、3Dプリントされたカプラーは、ハエを96ウェルマイクロプレートに個別にソートできるように設計されました。この装置は正確に96-および1536-wellマイクロプレートを向け、各フライに消費のための最大4つの井戸へのアクセスを与え、したがって、定期的な消費に加えて食品嗜好の定量化を可能にする。さらに、このデバイスには、一度に制御された封じ込めとサンプルの列の放出を可能にするために、開いた位置と閉じた位置を切り替えるバリアストリップがあります。この方法は、同時に多くのハエによる水溶液の消費の高スループット測定を可能にする。また、他の昆虫に適応し、栄養素、毒素、または医薬品の消費をスクリーニングする可能性を秘めています。
概要
ショウジョウバエメラノガスターは、食物摂取の生物学的基盤と消費に関連する形質を研究するための遺伝的モデル生物として広く使用されている。ヒト疾患を引き起こす遺伝子の65%がハエの機能的ホモログを有すると推定されており、ハエとヒトの間の機能的に同等な組織で発現されているもののかなりの割合を2に示している。さらに、D.メラノガスターのサイズ、短い世代間時間、簡単な維持、および遺伝的な難易度は、栄養素の消費に関する研究のための魅力的なモデルを作る3,4および様々な物質の毒性学的および薬理学的効果, 殺虫剤を含む様々な物質の, 含む, 汚染物質6, 医薬品7, 乱用薬8,9,10.
多くの場合、このような形質の研究は、消費の正確な定量化を必要とします。消費を定量化する方法は多様であり、CApillary FEeder(CAFE)アッセイ11、マヌアル・フィーディング(MAFE)アッセイ12、プロボシス拡張応答(PER)アッセイ13、トレーサー色素抽出14、15、オリゴヌクレオチドトレーサー抽出16、およびラジオアイソトープ抽出5、17を含む。最近の取り組みは、Expressoアッセイ18またはプレートベースの全動物給餌FLat(WAFFL)システム19のように、これらのアッセイのスループットを向上させることに焦点を当てている。その有用性にもかかわらず、これらのアッセイは複雑、コスト、または労働集約的であり、ハイスループット研究での使用を妨げる可能性があります。
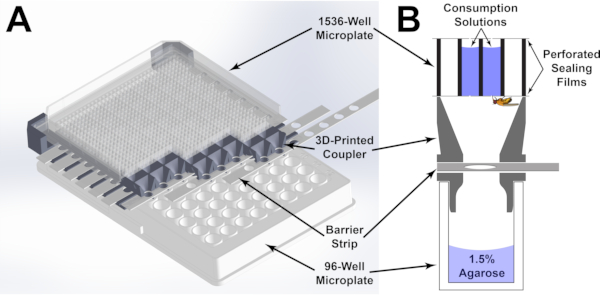
図1:マイクロプレートフィーダアッセイの成分(A)組み立てられたマイクロプレートフィーダアッセイの3Dレンダリング。1536ウェルマイクロプレートは、下の96ウェルマイクロプレートの各ウェルが上の1536ウェルマイクロプレートの4つの井戸にアクセスできるように、3Dプリントされたカプラーによって配向されています。ウェルへのアクセスは、カプラーを通してスロットされたバリアストリップの位置を調整することによって制御することができる。(B)マイクロプレートフィーダアッセイの各ウェルをグラフィカルに表現した。消費ソリューションは、フライによるアクセスを可能にするために穿穿られたシールフィルムを使用して、各井戸に保持されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
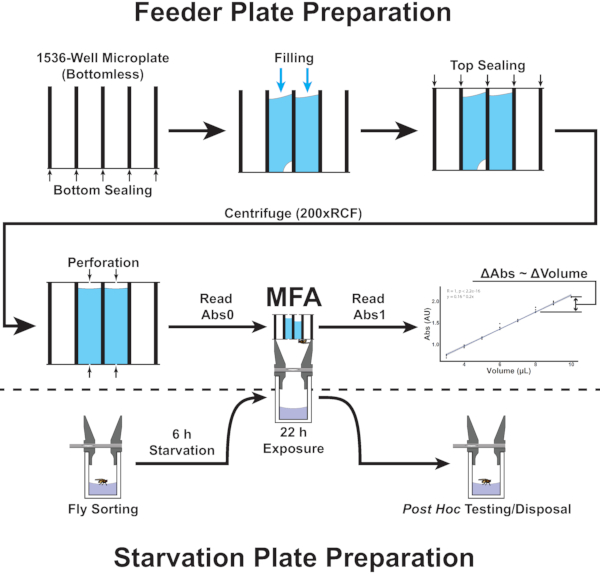
図2:マイクロプレートフィーダアッセイの手順の概要 図は、プロトコルのステップ 4.1 ~ 5.8 に対応するフロー図を示しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
これらのハードルを克服するために、マイクロプレートフィーダアッセイ(MFA; 図1)開発されました。このアッセイでは、ハエは96ウェルマイクロプレートに個別に収容されます。各マイクロプレートは、カスタムの3Dプリントデバイスを使用して1536ウェルマイクロプレートに結合されます。装置は正確に96ウェル版のそれぞれの井戸のそれぞれの井戸のフライが1536ウェルマイクロプレートの4つの井戸へのアクセスを持っていることを正確に2つの版を向ける。底なしの1536ウェルプレートとシールフィルムを使用することにより、ソリューションは選択した井戸に分配され、正確な0.25ミリメートルの直径の針で穿孔され、ハエへのアクセスを提供します。クリティカルに、マイクロプレートから直接消費を可能にするマイクロプレートリーダーを使用して即時吸光度ベースの測定を可能にする。希薄トレーサー色素を消費媒体に組み込み、露光後の吸光度の変化を使用して消費される体積を決定する(図2 および 図3)。各ウェルの液体は流体の列に近いので、体積差はカラムの高さの違いとして現れます。(図3A)ビール・ランバート法20によると:
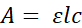
ここでAは吸光度、εは減衰分析物のモル吸収係数、lは光路長、cは減衰分析物の濃度です。したがって、一定のモル吸収係数および濃度を有する、吸光度の変化は、光路の変化、すなわち所定のウェル内の流体レベルに起因する。露光前後の吸光度を測定することで、吸光度の比例変化は体積の比例変化を反映する(図3B)。
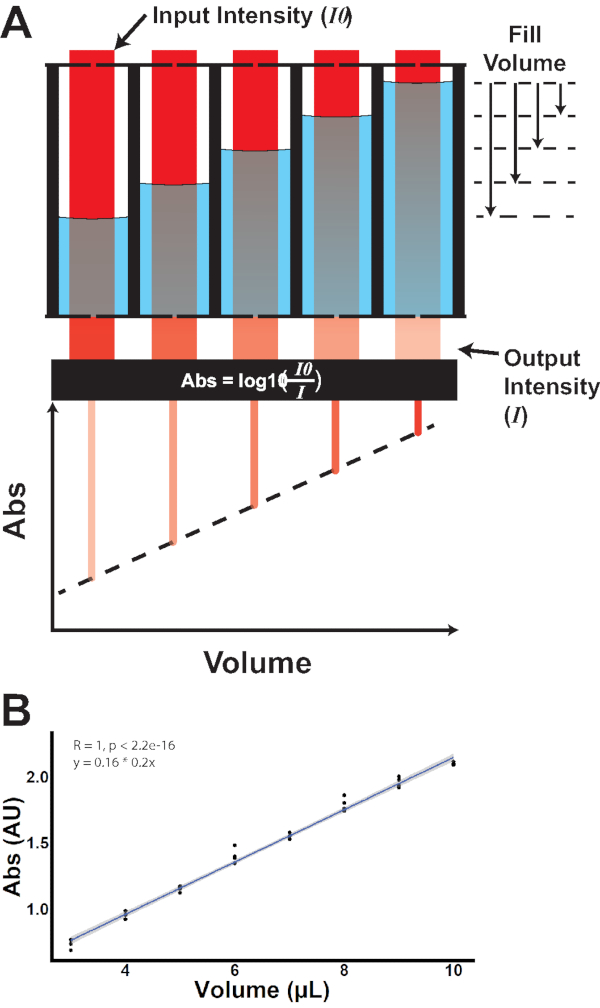
図3: 吸光ベースのウェルボリュームの定量化(A)既知の入力強度の入射光(I0)が各ウェルを通過する。異なる充填体積での光の減衰は、体積と吸光度の間に線形関係を示す異なる出力強度(I)をもたらす。(B)吸光度対体積の経験的測定。この図の大きなバージョンを表示するには、ここをクリックしてください。
体積の変化に基づいて、任意の摂取された化合物の量は、摂食溶液中の既知の濃度から計算することができる。アッセイに必要な部品はコストが低く、再利用性が高いため、アッセイの繰り返しコストが大幅に削減されます。したがって、この手順は、正確に消費を定量化する手頃な価格、高スループットの方法を提供します。
プロトコル
1. 飢餓プレートの準備
- アガロース1.5gを250mLガラスビーカーに計量します。
- 100 mLの蒸留H2Oをビーカーに加えます。
- アガロースが完全に溶融するまで断続的にマイクロ波。
注:アガロースは沸騰しやすいので、ビーカーを観察してください。 - 溶融アガロースを試薬トラフに注ぎ、多チャネルピペットを使用して96ウェルマイクロプレートの各ウェルに80 μLの溶融アガロースを分配します。室温で覆われながらプレートを治します。残ったアガロースを密閉した袋に入れ、再溶融してプレートを追加します。
2. フライソートと飢餓
- バリアストリップチャンネルにバリアストリップを挿入してカプラーを準備します。バリアストリップが緩み過ぎる場合は、指の周りにそれらを巻き付けて、チャネルでそれらを保持するために曲率を与えます。
- カプラーを飢餓プレートに貼り付けます。カプラーが滑り落ちる可能性があるため、カプラーを使用してプレートを操作しないでください。カプラーが正しく向きであることを確認します(つまり、カプラの角度付きコーナーがマイクロプレートの斜めのコーナーと一致していることを確認します)。
- CO2麻酔(材料表)では、3-5日齢のハエを選別します。個々のハエを柱で飢餓プレートにロードします。
注: ハエは列によってロードされますが、下段ではなくプレートの下の行にサンプルのグループを分散することをお勧めします(プレートレイアウトの例については 図 4 を参照)。 - 各列を閉じ、そのバリア ストリップを閉じた位置に調整して、塗りつぶしに合わせて閉じます。
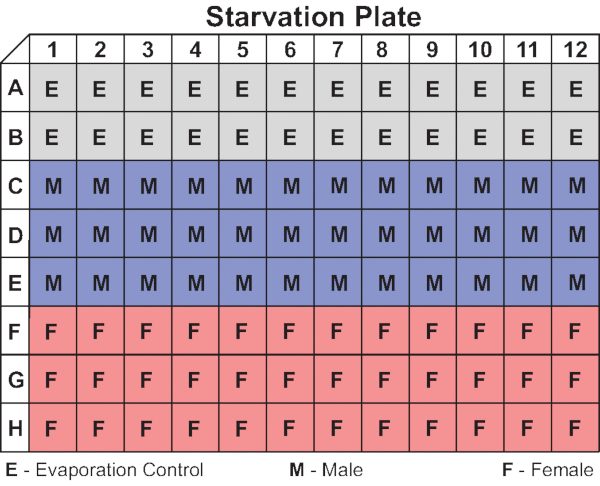
図4:代表的な飢餓プレートレイアウト この図は、この研究で使用される96ウェルプレートの蒸発制御と男性と女性のハエの組織を示しています。また、行AとHに蒸発制御を有する男女の交互の列を含む代替構成も使用できます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- マイクロプレート内のサンプルレイアウトを注意深く記録します。飢餓プレートが満たされたら、ハエがCO2 を取り除いた後に自発的に回復し、最初の麻酔時間から6時間飢えさせます。
3. 液体食品の準備
注:毎日新鮮な液体食品を作ります。
- 蒸留したH2OでFD&Cブルー#1の染料ストック溶液10mg/mLを調製します。
注:これは、6ヶ月まで室温で保存することができます。 - 10 mLの液体食品(4%スクロース、1%酵母エキス、FD&Cブルー#1の40 μg/mL)を15 mL円錐形チューブに15 mL円錐管に調製し、10mLのスクロースと0.1gの酵母エキスを10mLの蒸留H2O.Vortexで完全に溶解するまでチューブを溶解します。40 μLの染料ストック溶液を加え、チューブを繰り返し反転して溶液を均質化します。
- 液体食品を0.45 μmフィルターでチップした10 mLのシリンジに移します。1.7 mLマイクロ遠心分離チューブに一度に溶液の1.5 mLをフィルターします。溶液を含むシリンジを脇に置き、フィーダープレートの調製中に必要に応じて追加の溶液をフィルターします。
4.フィーダープレートの準備
注:充填後にフィーダープレートを優しく取り扱い、吸光度の測定値に影響を与える可能性のあるウェル内の泡や液滴の形成を防ぎます。
- 1536ウェルマイクロプレートの底部をシールフィルムで密封してフィーダープレートを準備します。シールパドルを使用してフィルムに完全に付着します。カミソリの刃で、左右の端から余分なフィルムをトリミングします。
- 濾過された液体食品の10 μLをカラム方向に分配し(図 5 を参照)、1536ウェルマイクロプレートの適切なウェルに塗布します。4 つのウェルの各クラスターの左上ウェルに分配します (図は 図 5 を参照)。
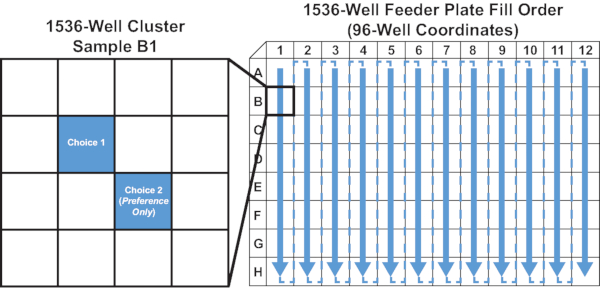
図5:1536ウェルフィーダープレートの充填順序と良好な位置 この図は、プロトコルのステップ 4.2 を示しています。矢印は、フィーダプレートに1列ずつ、1列から12列目までの送り液が導入される順序を示す。サンプルB1は、1選択および2選択アッセイのための供給溶液の位置の例を示すために拡大される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- すべての井戸が充填されたら、プレートの上部にシールフィルムを塗布します。シールパドルを使用してフィルムに完全に付着します。カミソリの刃で、左右の端から余分なフィルムをトリミングします。希望するプレート数に対して繰り返します。
- プレートを200 x g で10 sで遠心して液体を沈着させます。これは、吸収度の測定値を隠し、凝縮を引き起こす可能性があるため、プレートを冷やすようにしないでください。
5. 露出
- ハエが消費アッセイの準備ができたら、直径0.25mmの針を装備した針プローブツールでプレートの上面の井戸を穿孔します。溶液を分配する際に使用したのと同じ順序で穿フォーを行います。プレートをめくり、底の井戸を穿穿けます。クロスコンタミネーションを防ぐために、溶液間の針を拭き取ります。これは井戸からの解決策をウィックとして穿けに触れないように注意してください。
- 蓋なしで630 nmでプレートの吸光度を読み取ります。
- 上部のシールフィルムに内部蓋を置き、凝縮リングが穿光井戸を囲むよう確認します。外蓋をプレートに置きます。
- ガイドがフィーダープレートと飢餓プレートの適切な穴を揃えるよう、ボンプラーの上にフィーダープレートを向けて配置します。カプラーとプレートが正しく向きであることを確認します(つまり、カプラーの角とプレートが一致していることを確認します)。上部と下部のプレートの周りに弾性バンドをラップし、カプラーを一緒に保持します。フィーダープレートとカプラの間の位置合わせとギャップを確認します。
- すべてのフィーダープレートがカプラーにロードされたら、カプラーのバリアストリップを調整してプレートの井戸を開きます。カプラー/プレートアセンブリを 2 次コンテナに配置します。各セカンダリ コンテナは最大 6 つのアセンブリを収容できます。
- 浸したペーパータオルを入れたピペットボックスの下半分を各二次容器に入れて湿度を提供します。二次容器の蓋を閉じ、制御された環境(25°C、湿度制御、12時間光:暗いサイクル)に移します。ハエが22時間消費することを許可します。
- 22時間の露出後、各プレートに死んだハエがないか確認し、それに応じてプレートのレイアウトを更新します。すべてのプレートをチェックした後、二次容器の中にCO2をポンピングすることによって、ハエを一斉に麻酔します。~60s後、すべてのハエが固定されていることを確認してください。ハエを飢餓プレートにそっと踏み込み、プラスチック製のバリアストリップを交換します。読み取り用のフィーダープレートを取り外します。
- プレートの吸光度を630 nmで再読み込みしてください。すべてのプレートが読み取られるまで繰り返します。
6. データ分析
注: 調査員の推奨ソフトウェア パッケージで分析を実行できます。
- 22時間の暴露の間に死んだハエを省略する。
- 各井戸について、消費されるボリュームを次のように計算します。
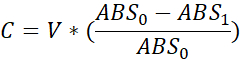
C - 消費されるボリューム (μL)
V - 初期ウェルボリューム(すなわち、10 μL)
ABS0 - 曝露前吸光度
ABS1 - ポストエクスポージャー吸光度
注: 消費は計算で正のボリュームとして示されます。 - 蒸発を考慮するには、それぞれのプレート内のフライ消費量値から平均蒸発量を減算します。2選択/好みのテストの場合は、それぞれの溶液(例えば)によってすべての井戸を調整し、蒸発制御の「選択1」によって「選択1」ウェルを調整します。
- 蒸発を調整した後、消費値がゼロ未満のサンプルをドロップします。
- 2 選択テストの場合は、各々の設定を計算します。
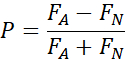
P - 好み指数(正の方向は好みを示す)
FA - 添加物を含む液体食品の消費量(選択肢2)
FN - 通常の液体食品の消費量 (選択肢 1)
7.マイクロプレートとカプラー洗浄プロトコル。
メモ:マイクロプレートの底部の損傷がシーリングに影響を与える可能性がありますので、注意してください。
- 1536ウェルマイクロプレートからフィルムとラベルを取り除きます。カプラとバリアストリップを分離します。ボトルなどの密閉可能な容器にバリアストリップを入れます。一連の温かい水道水、中性洗剤溶液、温かい水道水で激しく揺れ、次いでH2Oを蒸留してバリアストリップを洗います。
- 暖かい水道水の下で1536ウェルマイクロプレートとカプラーをすすいでください。マイクロプレートの場合は、各マイクロプレートの井戸を通して水道水を流し、できるだけ多くの溶液と破片を取り除きます。必要に応じて、ピペットチップを使用してデブリを取り除きます。プレートに金属やガラスの道具を使用しないでください。
- 各プレートとカプラーを中性洗剤溶液(例えば、1%対/v Aquet)で覆います。プレートの場合は、手袋をはめた手で表面をこすります。カプラーの場合は、ブラシを使用します。
- 各プレートを水道水で十分に洗い流し、蒸留したH2O.で井戸が水の流れの下で具体的に洗い流されていることを確認します。
- プレートとカプラを室温で乾燥させておきます。使用するまで清潔な保管庫に保管します。
メモ:手袋なしで1536ウェルマイクロプレートを扱うことはありません。皮膚からの残留油は密封を妨げ、漏れや蒸発を引き起こす可能性があります。
結果
個々のプレートのウェル間に相関関係があるかどうかを判断するために、蒸発をすべてのウェル(n = 3プレートの96ウェル/プレート)について定量化しました。蒸発は-0.036 μL±0.003 μL(全体を通してSEM±平均)であることが判明した。(図6A)ピアソン相関を計算して、蒸発と井戸の位置の間の傾向を評価した。蒸発対行の相関係数(図6B,C)は-0.04(p = 0.4949)であり、蒸着対カラムの相関係数は-0.23(p = 0.0001)であった。グループは、その後、列間で穏やかだが統計的に有意な相関関係を緩和するために、列間で分散された。
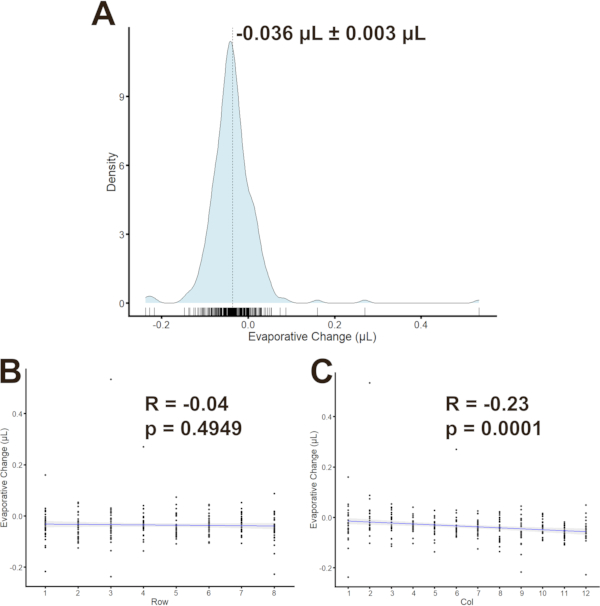
図6:MFAにおける蒸発 分布(A)破線で示される平均±SDによる蒸発変化の密度分布。蒸発と行(B)または列(C)とピアソン相関係数およびp値との相関を示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコルの有効性を確立するために、消費は3-5日齢の 広東-Sハ エ(n = 36/性別/プレートおよびn = 3プレートの蒸発制御/プレート24)について定量化された(図7)。制御ウェル間の蒸発は、ゼロ(-0.030 μL ± 0.006 μL、p = 4.81 x 10-6;1サンプル t-testvs zero)とは大きく異なっていました。データセットから2つのサンプル(両方の男性)を省略し、1つは夜間暴露中の死亡によるもので、もう1つは蒸発の調整後の負の消費値によるものです。これにより、99%のサンプル保持率>が得られた。
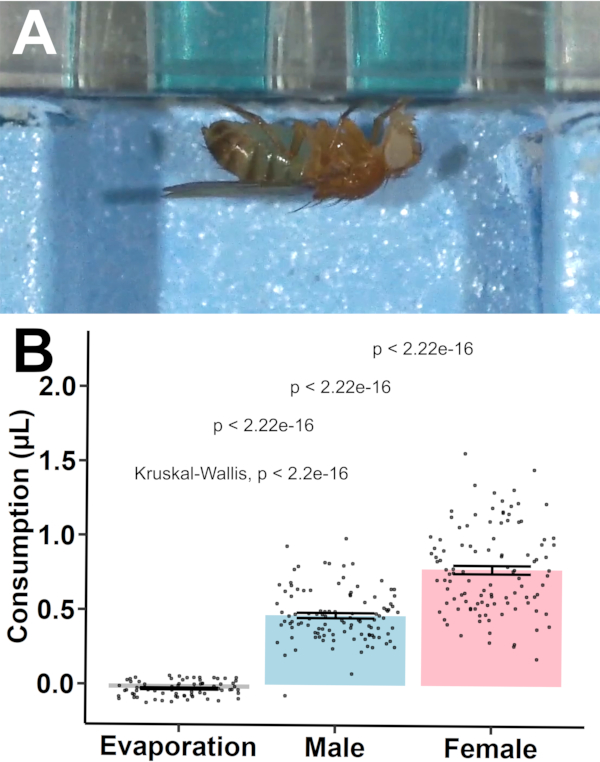
図7:MFAを用いた消費定量 化(A)は、カスタム製造ガラス室を用いて可視化した。ハエは穿穴の井戸からの飲酒を観察し、染色された溶液の摂取に続いて青い腹部染色を示した。蒸発制御、雄ハエ、および雌のハエの間の 補足ビデオS.1. (B) 消費値 (平均± SEM) も参照してください。不均一分散を伴う対方向 ポストホック t-testを、統計的比較のために実行し、有意性はバーで示した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
続いて、分散分析(ANOVA)モデルをY=μ+S+P+SxP+eで記述したとおりに構築し、Yをグループ平均として、全体的な平均としてはS μ、セムの固定効果としてはS、Pはプレートの固定効果、SxPは性とプレートの相互作用、eは残存変動として構成した。ANOVAは消費のために有意なプレート間変動性(p = 0.671)またはプレートとの性特異的相互作用(p = 0.104)を示さなかったが、セックス単独では消費の観察された変動に有意に寄与した(p = 4.17 x10-18)。ポストホックt-testは、オスが女性よりも有意に少ない消費を示した(0.500 μL±0.017 μL対0.811 μL ± 0.028 μL、p = 1.13 x 10-17、不均一分散を有する2つのサンプルt-検定)。
2選択の好みの定量化にアッセイを使用できることを実証するために、ハエは、1%酵母抽出物を含む4%スクロース溶液と、15%エタノールおよび1%酵母抽出物を添加した4%スクロース溶液の中から選択を与えられた。男性と女性の両方がエタノールと酵母エキスを含む溶液に対して圧倒的な好みを示し、好み指数は0.974±、メスは0.026、メスは0.876±0.06(平均±SEM)を示した(図8)。
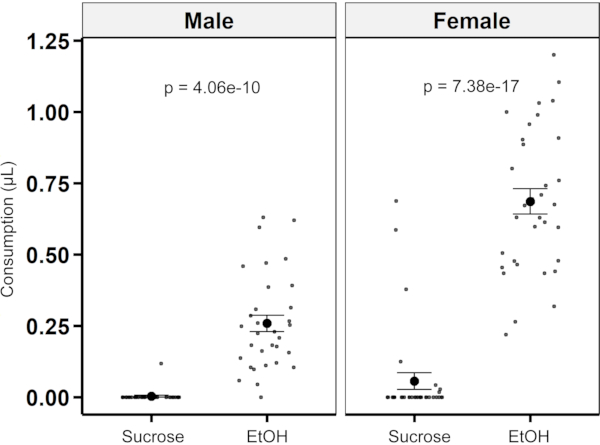
図8: MFAを用いた選好定量化4%スクロース対4%のスクロースの消費は、男性と女性のハエのための15%エタノールと酵母エキスを補った(n = 各性別に対して33)。オスのハエは、コントロールショ糖溶液よりも多くのエタノール溶液を消費しました(0.511 μL ± 0.029 μL対0.00 μL ± 0.017 μL;p = 4.06e-10;2サンプルt-test)。雌ハエはまた、コントロールショ糖溶液よりも多くのエタノール溶液を消費した(0.939 μL ± 0.044 μL 対 0.132 μL ± 0.044 μL;p = 7.38e-17;2サンプルt-test)。この図の大きなバージョンを表示するには、ここをクリックしてください。
補助ビデオS.1:ビデオは、穿穴ウェルから餌を与え、染めた溶液を摂取しながら青い腹部染色を蓄積するハエを示しています。図 7Aに静止画を示します。こちらをクリックして、このビデオをダウンロードしてください。
補助ファイル S.2: マイクロプレートフィーダーアッセイカプラー.これは MFA で使用されるカプラーの 3D プリント可能な構造です。印刷材ナイロンPA12はMFAに使用されました。 このファイルをダウンロードするには、ここをクリックしてください。
補助ファイル S.3: マイクロプレートフィーダーアッセイバリアストリップ. これは、フィーダープレートへのハエの露出を切り替えるために使用されるプラスチックバリアストリップの設計が含まれています。単一のカプラーは12までの障壁ストリップを利用できる。 このファイルをダウンロードするには、ここをクリックしてください。
補助ファイル S.4: マイクロプレートフィーダアッセイの開梱と製造手順 カプラーとバリアストリップを開梱するための手順が含まれています。内部蓋、外蓋、および露光時の蒸発を制限するために使用される二次容器の製造指示が含まれています。 このファイルをダウンロードするには、ここをクリックしてください。
補助ファイル S.5:マイクロプレートフィーダアッセイ (MFA) と 1 選択シングルフライ CApillary FEeder (CAFE) アッセイのコスト比較.1行で72のハエ/性別をテストするには、2セットのMFA機器(カプラー+プレート+バリアストリップ)が必要ですが、CAFEは各培養バイアルに1つの毛細管のみを必要とします。MFA の初期投資の大きな違いにもかかわらず、経常コストの大きな差 (それぞれ $14.80 と $46.08) をテストした後に前払い費用を回復することができます(損益分岐点)。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、ショウジョウバエの消費を定量化するための新しいプロトコルであるマイクロプレートフィーダーアッセイ(MFA)について説明しています。このアッセイでは、ハエは制御されたサイズの穿径を通して1536ウェルマイクロプレートの密閉された井戸から消費する(図1、図2;補足ビデオ S.1).液体食品はマイクロプレートを介して染色・提供されるため、マイクロプレート分光光度計を用いて食品の光学吸光度の測定が得られる(図3)。この方法で、消費は、消費の前後の吸光度を比較し、その後、消費前に分配される既知の体積にこの割合を適用することによって決定される。これは、染色された媒体の異なる体積の吸光度を測定することによって経験的に検証された(図3B)。
このアッセイを開発するには、消費の吸光度ベースの定量化を活用できる装置が必要でした。マイクロプレート形式のハエのテストは、食品を分配するために使用されるマイクロプレートを補完し、カプラの形状を調整することによって複数のプレートフォーマット(例えば、6-、12-、48-、または96-ウェル形式)から選択する柔軟性を可能にするため、魅力的です。個々のフライ培養を可能にするために96ウェルマイクロプレート形式が選ばれました。
3Dプリントデバイス(図1)は、96ウェル培養プレートを持つ1536ウェルフィーダープレートを正確に向け、各フライが最大4つのフィーダープレートにアクセスして消費します。さらに、ハエをハウジングプレートに分配するための十分な時間を提供し、アッセイ開始を制御するために、デバイスには、それぞれの井戸にハエを含むバリアストリップを切り替え、違反を防ぐことが含まれます。これらの部品の調達または修正に必要なファイル (補足ファイル S.2-S.3) と、関連する部分に必要な製作手順 (補足ファイル S.4)が提供されています。
MFA は、ショウジョウバエの摂食行動18、21、22を監視するためのより精巧な方法を補完する単純な高スループット方式を提供します。MFAは、食物摂取量を定量化するために使用される他の方法よりも複数の利点を提供します。プレートリーダーを使用して消費を定量化することで、スループットが向上します。これにより、手動測定が不要になり、手動でのデータ入力が不要になります。データは、プログラムによる抽出や処理にも適しています。さらに、スループットが高いほど、特に共同フィーダー設計と比較して、生物学的複製の実現可能な数が増加し、消費の小さな違いを検出する力が大幅に増加します。MFAを使用して、単一の実験者は、アッセイの1泊1回の実行あたり500以上のハエの消費量または好みを定量化することができます。アッセイの実行を重ねることによって、2,000以上のハエを5日間でテストすることができます。最後に、マイクロプレートとカプラ(補助ファイルS.5)の再利用性による長期的なコスト削減があります。MFAを使用すると、アッセイあたりの推定コストは$ 14.80まで低く、機器の前払いコストは$ 127.60です。高価な精密マイクロキャピラリを必要とする古典的なキャピラリーFEeder(CAFE)アッセイを使用して、同等の数の複製に対するアッセイあたりの推定コストは$ 46.08です。したがって、必要な機器の取得に先行投資がある一方で、定期的なコストの削減は、特に繰り返しテストが行われる場合に、大幅な節約につながる可能性があります。
すべてのアッセイと同様に、MFAには一定の制限があります。主に、1536ウェルマイクロプレートを読み取ることができるマイクロプレート分光光度計へのアクセスが必要です。さらに、定量化のための吸光度測定への依存は、この方法を光学的干渉の影響を受けやすい方法にします。これは、テストされたサンプルの小さなサブセットに対して負の消費値として現れます。栄養素、医薬品、医薬品、または毒素が、アッセイと互換性を持つために水溶性でなければならない。
制限にもかかわらず、この方法は、 ショウジョウバエの消費行動を定量化する高スループット方法を提供しています。さらに、カップリングデバイスは、多くのプレートフォーマットを受け入れるように簡単に変更することができ、様々な昆虫種に対応することができます。
開示事項
著者らは開示する利益相反はない。
謝辞
この研究は、国立薬物乱用研究所(U01 DA041613)からTFCMおよびRRHAへの助成金によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| 0.25 mm Diameter Needles | Rave Scientific | RS-MN-52-001012 | |
| 0.45 µm Syringe Filters | Olympus Plastics | 25-245 | |
| 10 mL Disposable Syringe | EXELINT | 26200 | |
| Agarose | Fisher Scientific | BP1600 | |
| Barrier Strips (Laser Cut) | Ponoko | - | Material: clear PETG, 0.5mm thickness; Supplementary File: |
| Centrifuge 5810 R | Eppendorf | 22625501 | |
| Centrifuge Rotor A-4-62 with micro-titer plate buckets | Eppendorf | 22638041 | |
| FD&C Blue #1 | Spectrum Chemical Mfg Corp | FD110 | |
| Film Sealing Paddle | Fisher Scientific | 50-563-280 | |
| Flystuff Flypad | Genesee Scientific | #59-114 and #59-119 | CO2 Anesthesia: The Flypads come in two sizes, either of which is appropriate |
| Microplate Coupler (3D Printed) | Shapeways | - | Material: Multi Jet Fusion nylon (MJF PA12); Supplementary File: |
| Microplate Lids | Greiner Bio-One | 656170 | |
| Molecular Devices SpectraMax iD5 | Molecular Devices | - | Any microplate reader with 1536-well resolution will do. |
| Needle Probe Holder | Rave Scientific | RS-MN-52-001000 | |
| Polyester Sealing Film | Excel Scientific, Inc. | 100-SEAL-PLT | |
| Polystyrene 96-well microplates | Greiner Bio-One | 655101 | |
| Polystyrene, Bottomless, 1536-well microplates | Greiner Bio-One | 783000 | Made to Order; allow for adequate lead time when purchasing. |
| Rubber Bands | |||
| Sucrose | Sigma | S7903 | |
| Weather Stripping | 1/2" x 1/8" High Density Self Adhesive Neoprene Rubber | ||
| Yeast Extract | Fisher Scientific | BP1422 |
参考文献
- Wong, R., Piper, M. D. W., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS ONE. 4 (6), (2009).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Spitaler, U., et al. Yeast species affects feeding and fitness of Drosophila suzukii adults. Journal of Pest Science. 93 (4), 1295-1309 (2020).
- Wang, Q. P., et al. PGC1α controls sucrose taste sensitization in Drosophila. Cell Reports. 31 (1), 107480 (2020).
- Valtierra-de-Luis, D., et al. Quantification of dose-mortality responses in adult Diptera: Validation using Ceratitis capitata and Drosophila suzukii responses to spinosad. PLoS ONE. 14 (2), 1-11 (2019).
- Williams, M. J., et al. Exposure to bisphenol A affects lipid metabolism in Drosophila melanogaster. Basic & Clinical Pharmacology & Toxicology. 114 (5), 414-420 (2014).
- Jajoo, A., Donlon, C., Shnayder, S., Levin, M., McVey, M. Sertraline induces DNA damage and cellular toxicity in Drosophila that can be ameliorated by antioxidants. Scientific Reports. 10 (1), 1-12 (2020).
- Fochler, S., et al. Genetics of alcohol consumption in Drosophila melanogaster. Genes, Brain and Behavior. 16 (7), 675-685 (2017).
- Highfill, C. A., Baker, B. M., Stevens, S. D., Anholt, R. R. H., Mackay, T. F. C. Genetics of cocaine and methamphetamine consumption and preference in Drosophila melanogaster. PLOS Genetics. 15 (5), 1007834 (2019).
- Keebaugh, E. S., Park, J. H., Su, C., Yamada, R., Ja, W. W. Nutrition Influences caffeine-mediated sleep loss in Drosophila. Sleep. 40 (11), (2017).
- Ja, W. W., et al. Prandiology of Drosophila and the CAFE assay. Proceedings of the National Academy of Sciences. 104 (20), 8253-8256 (2007).
- Qi, W., et al. A quantitative feeding assay in adult Drosophila reveals rapid modulation of food ingestion by its nutritional value. Molecular Brain. 8 (1), 87 (2015).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (PER) assay in Drosophila. Journal of Visualized Experiments: JoVE. (3), e193 (2007).
- Shell, B. C., et al. Measurement of solid food intake in Drosophila via consumption-excretion of a dye tracer. Scientific Reports. 8 (1), 1-13 (2018).
- Wu, Q., et al. Excreta quantification (EX-Q) for longitudinal measurements of food intake in Drosophila. iScience. 23 (1), 100776 (2020).
- Park, A., Tran, T., Atkinson, N. S. Monitoring food preference in Drosophila by oligonucleotide tagging. Proceedings of the National Academy of Sciences of the United States of America. 115 (36), 9020-9025 (2018).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: Comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Yapici, N., Cohn, R., Schusterreiter, C., Ruta, V., Vosshall, L. B. A Taste circuit that regulates ingestion by integrating food and hunger signals. Cell. 165 (3), 715-729 (2016).
- Jaime, M. D. L. A., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- IUPAC. . Compendium of Chemical Terminology (The "Gold Book"). , (1997).
- Itskov, P. M., et al. Automated monitoring and quantitative analysis of feeding behaviour in Drosophila. Nature Communications. 5, 4560 (2014).
- Ro, J., Harvanek, Z. M., Pletcher, S. D. FLIC: high-throughput, continuous analysis of feeding behaviors in Drosophila. PLoS One. 9 (6), 101107 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved