このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Tiインプラントの血小板由来細胞外小胞機能化
要約
ここでは、血小板リセート(PL)に由来する細胞外小胞(EV)の分離方法と、チタン(Ti)の被覆用表面の使用について説明する。落下鋳造コーティング法、表面からのEV放出プロファイル、およびTi表面にコーティングされたEVの インビトロ 生体適合性について述べています。
要約
細胞外小胞(EV)は、細胞通信において重要な役割を果たす生物学的ナノ胞である。その含有量には、タンパク質や核酸などの活性生体分子が含まれており、再生医療に大きな可能性を秘めています。最近では、血小板リセート(PL)に由来するEVは、PLに匹敵する骨形成能力を示している。また、生体材料は整形外科や歯科修復に頻繁に使用されます。ここでは、Ti表面をPL由来のEVで機能化し、骨形成特性を改善する方法を提供します。
EVはサイズ排除クロマトグラフィーによりPLから分離され、その後Tiサーフェスはドロップ鋳造によってPL-EVで機能化されます。機能性は、乳酸デヒドロゲナーゼ(LDH)放出アッセイによるEV放出およびその生体適合性によって証明される。
概要
EVは、あらゆる細胞によって分泌される膜小胞(30-200nm)であり、貨物を運んで細胞間通信において重要な役割を果たします。それらは核酸、成長因子、または生理活性脂質1を含み得るさまざまな活性生体分子を含んでいる。これらの理由から、EVは治療における潜在的な使用について評価されています。整形外科と骨再生の面では、異なるソースからのEVがテストされています。その中でも、血小板由来のEVは、低細胞傷害性プロファイル2,3を維持しながら幹細胞に分化効果を誘導することが示されている。そこで、EVとバイオマテリアルを組み合わせて日常的に臨床現場で使用する可能性を探る研究が必要です。
チタン系生体材料は、機械的特性、高い生体適合性、および長期耐久性に起因する骨治癒の臨床介入のための足場として広く使用されています。それにもかかわらず、Tiインプラントはバイオイナート材料であり、したがって、周囲の骨組織5との結合のための能力が乏しい存在である。このため、チタンの改質は、その表面上のより機能的な微小環境を達成することによって性能を向上させるために研究されている。この意味で、EVは、化学的な8または物理的な相互作用9,10によってチタンに固定することができます。幹細胞またはマクロファージに由来する固定化されたEVは、細胞接着および増殖を促進することにより、Tiの生物活性を高め、それによって骨形成効果8,9,10を誘導する。
本稿では、TI表面にPL由来のEVを塗布するためのドロップ鋳造戦略を詳しく説明します。また、経時に被覆表面からのEV放出プロファイルを評価し、その細胞の生体適合性を インビトロで確認します。
プロトコル
血小板リセート(PL)は、IdISBaバイオバンクが提供する新鮮なバフィーコートを出発材料として使用する制度ガイドライン3 に準拠して前述したとおりに得られます。現在のプロジェクトでの使用は、倫理委員会(IB 1995/12 BIO)によって承認されました。
1. PL からの EV の分離
- より大きなボディ除去
- 室温でPLを解凍します。
- 遠心分離機PL 1,500 x g で4°Cで15分 ペレットは細胞の破片が含まれているので捨てます。
- 上清を集め、4°Cで30分間10,000 x g で2回連続の遠心を行います。
注: ペレットはマイクロベシクルなどの大きな EV に対応し、この場合は廃棄されます。 - 上清を0.8 μm多孔膜で最初に濾過し、次に0.2 μmの多孔膜を通してフィルターを行います。
注: これらの手順では、必要でないすべての EV を削除します。 - フィルターPLをプールし、使用するまで-20 °Cで保管してください。
- サイズ除外クロマトグラフィー
- フィルター処理されたPBSで所望の流量でクロマトグラフィー装置に結合されたカラムを平衡化する。
注: 使用される流量は列の特性によって異なります。この場合、0.5 mL/min に設定されます。 - 処理された PL (5 mL) を、装置にシリンジを付けてロードします。
- PLをカラムに注入し、15 mLチューブで5 mL分を集め始めます。
- EVの濃縮された分数を収集し、使用するまで-80°Cで保存します。
注:初めて実験を行う場合は、タンパク質定量と免疫検出によってすべての分画を特徴付け、EVs3,11で濃縮されたものを決定します。この実験では、9分の一部が収集されます。 - クロマトグラフィーカラムを30 mLの0.2%NaOH溶液で洗浄し、平衡に達したら20%エタノール溶液に保存します。
- フィルター処理されたPBSで所望の流量でクロマトグラフィー装置に結合されたカラムを平衡化する。
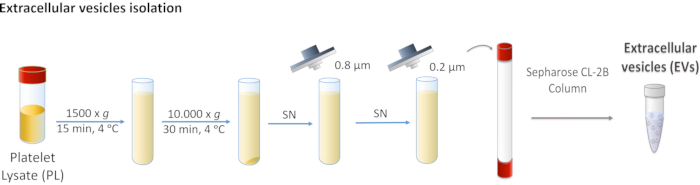
図1:血小板リセート(PL)細胞外小胞(EV)分離の模式図。 PLは最初に1,500 x gで遠心され、次に10,000 x g で大きなボディを除去する。上清は0.8および0.2 μmフィルターによって濾過される。処理された PL はカラムにロードされ、EV はサイズ除外クロマトグラフィーで区切られます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. EVの特徴付け
メモ:機能研究を行うためには、EVの特性評価が必要です12。電子顕微鏡法またはウェスタンブロット特性は、以前に報告されている13。本レポートでは、Ti表面機能化に不可欠な特性評価手法に焦点を当てます。
- ナノ粒子追跡解析(NTA)
- 0.2 μmのろ過PBSでEV(1:1000)を希釈します。
メモ:濃縮されたサンプルや希釈しすぎたサンプルは、NTAの判定に範囲外になり、調整が必要になります。 - 希釈したEVの1mLをNTA機器に注射器で積み込み、NTA機器に注入します。
- 粒子濃度およびサイズ分布の決定のための製造業者の議定書に従ってください。
- 0.2 μmのろ過PBSでEV(1:1000)を希釈します。
- タンパク質濃度
- 1 μLのEV溶液を使用して濃度を決定します。分光光度計で280nmの波長で吸光度を測定します。
注: EV は、パーティクルの数に比べてタンパク質のレベルが低いはずです。 - 分光光度計を使用して吸光度の読み取りを取得するには、製造元の指示に従ってください。
- 1 μLのEV溶液を使用して濃度を決定します。分光光度計で280nmの波長で吸光度を測定します。
3. チタン表面機能化
注:この方法では、機械加工チタンディスク、c.p.グレードIV、直径6.2ミリメートル、および2ミリメートルの高さを使用しています。ディスクはTiピンセットで操作できますが、表面を傷つけないようにすることが重要です。さらに、加工された側は、プロセス全体の間に上向きでなければなりません。
- Tiディスクウォッシュ
注:Ti洗浄に使用されるソリューションの量は、Tiディスクをカバーするのに十分なはずです。Tiディスクをガラスビーカーに入れ、溶液を注ぎます。次に、デカンティングにより溶液を除去する。- Tiインプラントを脱イオン(DI)水で洗浄し、水を捨てます。
- Tiインプラントをエタノール70%で洗浄し、次いでデカントして溶液を除去する。
- インプラントをDI水に入れ、50°Cで5分間超音波処理します。水を捨てる。
- Tiを50°Cで40%NaOH溶液にインキュベートTiインプラントで、10分間攪拌します。ソリューションを破棄します。
注意: NaOH溶液は準備中に暖かくなります。この溶液は腐食性であり、ヒュームフードの内部で使用する必要があります。 - 50°Cで5分間DI水中のインプラントを超音波処理し、その後、水を除去します。
- 中性pHになるまで、DI水(少なくとも5)で数回の水を流します。pH インジケータで pH を確認します。
- 50°Cで5分間DI水中のインプラントを超音波処理し、水を取り除きます。
- 50°Cで50%HNO3 溶液中のインキュベートTiインプラントを、攪拌で10分間行います。ソリューションを削除します。
注意:HNO3 は腐食性および酸化剤物質であり、ヒュームフードの内部で使用する必要があります。 - 50°Cで5分間、DI水中のインプラントを超音波処理します。水を取り除きます。
- 中性pHが得られるまで、DI水(少なくとも5)で数回の水を流します。pH インジケータを使用して pH を確認します。
- 50°Cで5分間、DI水中のインプラントを超音波処理します。水を取り除きます。
注:この時点で、Tiインプラントを70%エタノール溶液に貯蔵することによって実験を停止することができます。
- ティパッシベーション
注: Ti パッシベーションの手順は、以下に示す順序で異なるソリューションで Ti ディスクを完全にカバーすることによって実行されます。Tiディスクはガラスビーカーに入れられ、溶液はそっと注がれます。すべての洗浄ステップで使用される容積はインプラントを完全にカバーしなければならず、デカンティングによって取除かれる。- Tiインプラントを30%HNO3 溶液で、穏やかな攪拌下で室温で30分間インキュベートします。ソリューションを削除します。
- 中性pHになるまで、DI水(少なくとも5)で数回の水を流します。pH インジケータを使用して pH を確認します。
- インキュベートTiは、DI水中の室温で一晩移植する。
- 40°Cの真空条件下で10分間、インプラントを乾燥させます。
- EV ドロップキャスト
注意:細胞機能研究では、細胞培養キャビネットで作業することが重要です。- Tiインプラントを96ウェルプレートに入れ、機械で加工された側面を上に向けます。
メモ:インプラントが逆さまにされた場合、針を使用して戻すことができます。 - EV溶液を解凍し、攪拌と混合します。3 sのパルスには渦を使用します。
- EVをTiサーフェスに堆積させます。この研究では、40 μLのEV溶液をTiに配置し、NTAによって決定された濃度に従ってインプラント当たり最大4 x 1011 EVを固定化します。
- Tiを含むプレートを真空条件下で37°Cで完全に乾燥するまで(〜2時間)置きます。
注:インプラントの数と真空チャンバーに存在する水に応じて時間を調整します。
- Tiインプラントを96ウェルプレートに入れ、機械で加工された側面を上に向けます。
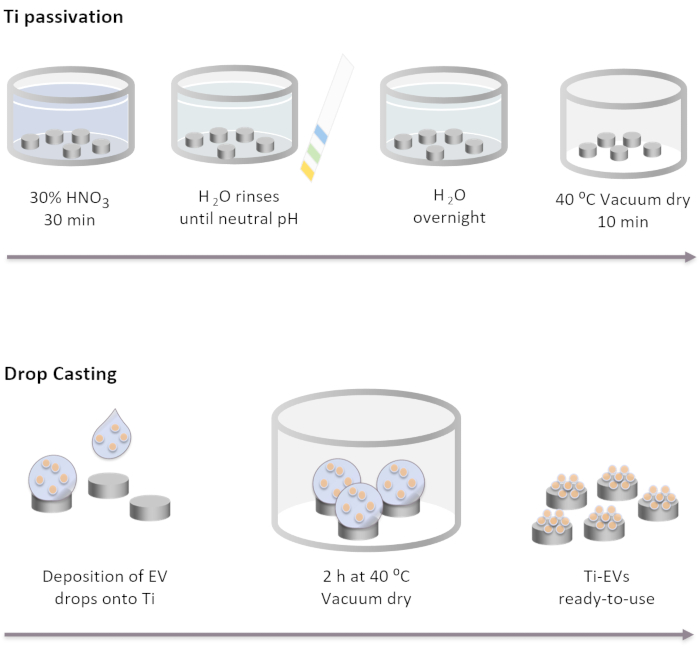
図2:ドロップ鋳造によるTiパッシベーションとEVの機能化の概略図 Tiインプラントは、室温で30%HNO3 溶液中で30分間インキュベーションすることによって最初にパッシベーションされる。DI水で数回の水を流した後、pHは中性に達する。次いで、TiインプラントをDI水中の室温で一晩インキュベートする。その後、インプラントは40°Cの真空条件下で乾燥する。 EV固定化の場合、40 μL の EV 溶液を Ti インプラントに堆積します。次に、インプラントは、EVが表面に物理的に結合されるまで2時間真空中でインキュベートされる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
4. Ti表面特性
- リリーススタディ
- 37°Cで200μLの濾過PBSをインキュベートするTi表面。
メモ:PBSは、NTA測定との干渉を避けるためにフィルタリングされます。 - 異なる時点でPBSを交換し、-80°Cで保管してください。
注:この研究では、2日間、6日、10日、14日間の時間ポイントを分析しました。 - メーカーの指示に従って、NTAによる粒子研究のために保存されたPBSを分析します。
注: 異なる時間における PBS におけるパーティクル濃度は、時間の経過に従って EV リリース プロファイルを表します。
- 37°Cで200μLの濾過PBSをインキュベートするTi表面。
- 生体適合性研究
注:ヒト臍帯由来間葉系幹細胞(hUC-MSC)は、機関ガイドラインに従ってIdISBaバイオバンクから取得されます。- 使用まで20%FBSで補うDMEM低ブドウ糖でhUC-MSCを維持します。週に 2 回メディアを変更します。
- 細胞播種の場合は、5 mLのPBSでフラスコで細胞を2回洗浄します。
- トリプシン溶液の1 mLを加えることによってhUC-MSCをトリプシン化する。細胞の単層を完全に覆っていることを確認してください。トリプシン溶液を取り出し、細胞培養フラスコを37°Cで約2分間置きます。顕微鏡下での細胞剥離を見る。切り離されたセルは、形状が丸く表示され、サスペンションになります。
- 1%のEVがFBSを枯渇させたDMEM低グルコースの細胞を再懸濁する。
注:1%FBSを補ったメディアを準備し、FBS-EVを取り除くために120,000 x g で超遠心分離を18時間準備してください。小板の EV との干渉を避けるために、EV を取り外す必要があります。 - ノイバウアー室14を有する細胞数を数えて細胞濃度を決定する。
- hUC-MSCを50,000個の細胞/mLの濃度にします。
- Tiインプラント上の細胞溶液のシード200 μL。
- 48時間後、50μLの培地を回収し、製造者のプロトコルに従って乳酸脱水素酵素(LDH)活性キットを使用して細胞傷害性測定を行います。
結果
この記事で紹介する方法では、EVの機能性チタンディスクを入手できます。EVは表面に物理的に結合されるため、時間の経過とともに持続的な放出が可能になります。リリースされるEVの量は、2日目、6日目、10日目、14日目のNTAで測定できます。最初の測定は2日目に、約109 台のEVがリリースされ、6日目に持続的なリリースが行われていることを示しています(約108 台のEV)。10日...
ディスカッション
このプロトコルは、TiサーフェスにEVの機能化のための明確な指示を提供することを目的としています。提示される方法は、機能化の物理タイプであるドロップ鋳造戦略に基づいています。Ti表面上のEV機能化に関する貧弱な文献目録は存在するが、Ti10上にEVを固定化することによって異なる利点を示す研究はほとんどない。とにかく、探求される戦略のいくつかは、生化学?...
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、ESF欧州社会基金とERDF欧州地域開発基金(MS16/00124)が共同出資する、インスティトゥート・デ・サルド・カルロス3世、エコノミア・イ・コンペティビビダード大臣(MS16/00124;CP16/00124;PI17/01605)、ディレッキオ将軍デインベスティガシオ、コンセラーシア・デインベスティガシオ、ガバナー・バレア(FPI/2046/2017)、プログラムAジュニア・デル・プロジェクター・タレントプラス、コンストライェルド・サルード、ジェネランド・ヴァロル(ジュニア01/18)、ベイルレス諸島の持続可能な観光税によって資金提供。
資料
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
参考文献
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved