Method Article
成人マウス口蓋からの一次口腔角化細胞の分離と培養
要約
本プロトコルは、成人マウス口蓋に由来する経口角化細胞の分離および培養について説明する。免疫染色を用いた評価方法も報告されている。
要約
何年もの間、ケラチノサイトを含むほとんどの研究は、ヒトおよびマウスの皮膚表皮ケラチノサイトを使用して行われてきた。近年、独特の機能や特徴から、口腔角化細胞が注目を集めている。彼らは口腔上皮の恒常性を維持し、再生療法の応用のためのリソースとして役立つ。しかし、成人マウス由来の経口一次ケラチノサイトを使用する インビトロ 研究は、効率的で確立された培養プロトコルの欠如のために制限されている。ここで、経口の一次角化細胞を、成体マウスの口蓋組織から単離し、キレキセド血清を添加した市販の低カルシウム培地で培養した。これらの条件下では、ケラチノサイトは増殖性または幹細胞様状態で維持され、その分化は、通過量が増加した後でも抑制された。マーカー発現解析は、培養した経口角化細胞が基底細胞マーカーp63、K14、およびα6-インテグリンを発現し、分化マーカーK13と線維芽細胞マーカーPDGFRαに対して陰性であったことを示した。この方法は、 インビトロでの経口上皮幹細胞機能の研究における下流用途に適した生存および培養可能な細胞を産生した。
概要
口腔上皮は、化学的または物理的な損傷および細菌およびウイルス感染を含む環境ストレスから身体を保護する第一の障壁として機能する1,2。口腔粘膜は、角化した扁平上皮の外層を含み、主に線維芽細胞と細胞外マトリックスからなる層と呼ばれる層状の血縁組織と呼ばれる根間管組織からなる。マウス口腔粘膜は、咀嚼(硬口蓋および歯肉)、専門(側舌)、および粘膜(頬粘膜、腹側舌、軟口蓋、唇)粘膜2、3(図1A)の3つのサブタイプに大別することができる。口腔上皮は、咀嚼および特殊な粘膜で角化され、内層粘膜において非角化される。その解剖学的位置にもかかわらず、経口上皮は、分化の様々な程度を持つ緊密に詰まった上皮細胞から成り立っているという点で皮膚表皮に似ています: 未分化細胞を含む基底層;角化上皮、または非角化上皮4を形成する中間および表面層を形成する、生極、粒状、および角質化層。トランスジェニックマウスモデルは口蓋、頬粘膜、舌、歯肉の口腔上皮幹細胞の細胞および分子特徴の研究を促進した5,6,7,8,9,10,11.しかし、これらの研究のほとんどは、主に生体内マウス実験で使用される。細胞培養システムは、確立された効率的なプロトコルの欠如のために、典型的には採用されなかった。
インビトロ培養システムは、幹細胞レギュレータの分子および生化学的分析、細胞ベースのアッセイ、および薬物スクリーニングに使用できます。現在、皮膚表皮の原発性ケラチノサイトの培養に関するプロトコルが開発されており、基礎ケラチノサイトを臨床および研究目的で正常に単離し、培養することができる12,13,14,15。1980年、ヘニングスらは、培養培地中の低カルシウム濃度(<0.09 mM Ca2+)が未分化状態で細胞の増殖および維持を促進することを示した。より高いレベルのカルシウムが細胞分化を促進し、増殖を減少させた16。その後、新生児および成人マウス表皮角化細胞の培養方法が確立され、インビトロ研究のための異なる遺伝的背景を有する多数のマウスモデルに広く適用されている17,18,19。皮膚と口腔上皮は共通の特徴を共有するが、それらはまた、例えば、それらのケラチニンゼーション状態、回転率、遺伝子発現、および創傷治癒能力における本質的な違いを示す3,11,20,21,22,23,24,25,25,26。
ヒト経口ケラチノサイト培養は27,28,29回の正常な実施が行われているが、マウス経口ケラチノサイト培養30,31,32に関する出版物は、皮膚表皮ケラチノサイトと比較して標的組織のサイズが小さく、細胞の特徴が明確に異なるために制限されている。本プロトコルは、マウスの一次経口ケラチノサイトの分離および長期培養技術について説明する。
プロトコル
熊本大学と筑波大学の動物実験委員会のガイドラインに従って、すべての動物実験を行いました。
試薬・培養媒体の製造
- 60μMのカルシウムと600μLの抗抗薬溶液を含むケラチノサイト培地40mLを調製します。0.025%トリプシン20mL、抗生物質抗ミコティック溶液400μLを調製します。
- トリプシン阻害溶液を室温で解凍し、ステップ4.1で使用するまで4°Cに保ちます。
注:分離試薬は、5匹のマウスの組織分離のために調製されます。
- トリプシン阻害溶液を室温で解凍し、ステップ4.1で使用するまで4°Cに保ちます。
- 培養培地を調製するには、培地500mLを取り、5mLの成長サプリメント溶液(以下、完全 培地と呼ぶ)と20%カルシウム枯渇したキエキセドウシ胎児血清(FBS)33 (以下、キレキセド-FBSと呼ぶ)を加える。
2. 成人マウスからの口蓋組織の解剖
- 動物福祉に関する施設の規制に従って、頸部脱臼によって成人C57BL/6Jマウス(男性または女性)を犠牲にする。
- 口の周りの髪を剃りで取り除きます。はさみを使用して、頬から顎に向かって両側に切ります。
注:マウスは犠牲になる前に麻酔をする必要があります。メデトミジン、ミダゾラム、ブトルファンノールの麻酔混合物が使用されています( 材料表を参照)。
- 口の周りの髪を剃りで取り除きます。はさみを使用して、頬から顎に向かって両側に切ります。
- 鉗子を使って口を大きく開け、綿棒を使って血液を吸収します。口蓋を消毒するには、10%ポビドネヨウ素を含む綿棒で口の中を拭きます。
- マウスの口蓋を収穫するには、まず、外科的メスの刃を使用して、上顎歯の口蓋側に沿って完全な厚さの限界切開を行います。その後、ラパトリアムを使用して口蓋全体を慎重に解剖する。
注意:ラパラトリアムは、ムコプリオスチールフラップを上昇させるために使用されるツールです(材料表を参照)。 - 4 mLの完全培地+抗生物質抗ミコティック溶液を含む15 mLチューブに、口蓋組織を素早く移す。インキュベーションの準備ができるまで、組織を氷の上に置いてください。
注:複数のマウスから採取する場合、口蓋組織は氷上に最大4時間保持される場合があります。
3. 口蓋組織の前処理
- 層流フードで、完全な培地+抗生物質抗ミコティック溶液の4 mLを含む60 mm皿に組織を移す。
- 短く鈍い鉗子とメスの刃を使用して、組織から血液をそっと取り除きます。完全な媒体でティッシュを10回洗う。
- 0.025%トリプシン+抗生物質抗ミクティック溶液の4 mLを含む35mm皿に組織を移し、上皮表面を下に向けます。
注: 内側にカーブする上皮表面は、トリプシン溶液に浸す必要があります。層のプロポリアは上向きにする必要があります。組織は、トリプシン溶液に完全にインキュベートされるように可能な限り平坦化する必要があります。 - 培養フード内の室温で0.025%トリプシンで約16時間培養します。
4. 一次細胞の採取と培養
- 1組の鈍い鉗子を使用して、トリプシン溶液(35mm皿)から組織を取り除き、上皮表面を上向きにした60mm皿(1皿あたり4mL)でトリプシン阻害剤溶液に移す。
- 鉗子を使用して口蓋の端に保持し、メスの刃を使用して下層層の上皮層をそっと削り取ります。
注:結合組織はトリプシンによって消化されないので、擦り傷の間は剥がれず。 - 組織から上皮細胞の最大量を収集するには、4 mL完全な培地で別の60 mm皿に組織を移し、掻取りステップを繰り返します。
注:ブレードの先端で組織を削らないようにしてください。代わりにブレードのエッジを使用してください。掻き取りは、組織あたり5〜10分間行われます。 - 50 mL円錐形チューブの上に滅菌100 μmのセルストレーナーを置きます。
- 滅菌ピペットを使用して、2 mLのトリプシン溶液(ステップ4.1から)をストレーナーに移して表面を濡らします。
- ピペットを使用して、60 mm皿(ステップ4.2-4.3から)に細胞懸濁液を数回混合し、ステップ4.4-4.5で調製した100 μmセルストレーナーを通して細胞をフィルターします。
- ヘモサイトメーターを使用して細胞の数を数えます。15 μLのトリパンブルー溶液を準備し、15 μLのセル懸濁液を加えます(ステップ4.6)。細胞トリパンブルーミックスの10 μLをヘモサイトメーターに移し、細胞数を数えます。
注:マウスの口蓋の1つの部分は、最大100万個の細胞を生成することができます。 - カウント中、チューブを100 x g で室温で5分間(ステップ4.6から)遠心分離します。
- ピペットで上清を吸引する。チューブに完全な培地+ キレキセドFBSの2 mLを加えます。5 mL ピペットを使用して数回トリチュールすることにより、細胞ペレットを再懸濁します。
- 1つのマウスから、コラーゲンタイプIであらかじめコーティングされた24ウェルプレートのウェルにプレート2-5 x 105 細胞をプレートします( 材料表を参照)。
- 培地を変えずに37°Cで2日間培養します。
- 播種の2日後、培地の半分を完全培地+キレキセドFBSに置き換える。顕微鏡下で細胞の形態を確認してください。完全な培地+キレキセドFBSを2日ごとにフィードセル。
注:シードの後、異なるサイズのセルが観察されます。播種後約3~5日後、石畳の形態を有するケラチノサイト(図2)が観察できる。最初の通路が行われるまでに1〜2週間の培養が必要であり、その後の1〜2週間は、細胞が2番目と3番目の通路の準備が整う前に必要です。その後、細胞はより速く成長し、凍結保存のために準備することができます。細胞は、1つ目と2番目の通路でそれぞれ1つのウェル(24ウェルプレートの)と6ウェルプレートに再めっきすることができます。その後の通過は、細胞の成長と密度に依存します。3番目の通路の後に1:2または1:3の細胞分割比を使用することができます。
5. ケラチノサイトの通路
- 培養皿から上清の2 mLを収集し、15 mL円錐形のチューブ(氷の上)に分配します。滅菌1x PBSで細胞を2回洗います。
注:細胞が約70%-80%の合流に達すると、それらは通過の準備ができています。 - 6ウェルプレートの1ウェルに0.05%トリプシンEDTAの1 mLを皿に加えます。
- 37°Cで5〜15分間インキュベート。5分後に細胞が皿から切り離されるかどうかを確認してください。
- 1 mLのトリプシン阻害液と2 mLの完全培養培地+キエキセドFBSを穏やかなピペットで反応を中和する。次に、ステップ5.1と同じ15 mL円錐管に細胞懸濁液を移す。
- 細胞懸濁液を100xgで4 °Cで5分間遠心分離する。 上清をピペットで吸引し、細胞ペレットを1mLの完全培養培地で再懸濁させた。
- ヘモサイトメーターを使用して細胞を数えます。次に、細胞懸濁液のプレート1mLを新しい24-または6ウェル培養プレートに入す。
注:初期の通路からの細胞の一部は、70%完全な培養培地+20%キレキセドFBS+10%DMSOの混合物で凍結することができる。1-2細胞のクライオビシャルは、1つのコンフルエント培養プレートから収集することができる。
6. ケラチノサイトの凍結保存と回収
- 細胞凍結
- 角化細胞を80%~90%の合流まで成長させます。
注: 細胞の増殖状態と生存率が低下する可能性がありますので、細胞が過剰増殖しないようにしてください。 - ステップ 5.1-5.5 で説明したように、0.05% トリプシン-EDTA で皿のケラチノサイトを扱います。
- 血球計を使用してケラチノサイトを数えます。計算されたセル番号に基づいて、各バイアルに1 x 106 セル/mLの転送を可能にするクライボシャルを準備します。
- 細胞懸濁液を100xgで4°Cで5分間遠心分離する。 上清を捨て、10%DMSO + 20% キレキセドFBS + 70%完全培養培地(9 mLの完全培地+キレキセドFBSおよび1 mL DMSO)の10 mL溶液で細胞ペレットを再懸濁します。
- バイアルあたり1mLの懸濁液で細胞を凍結剤に分配する。バイアルを-80°Cで一晩極低温貯蔵容器に入れます。 翌日、バイアルを液体窒素タンクに移します。
- 角化細胞を80%~90%の合流まで成長させます。
- 細胞回復
- 液体窒素タンクから凍結液を取り出し、室温で部分的に解凍します。15 mL チューブに、完全な培養培地 + キレキセド FBS の 3 mL とセル懸濁液の 1 mL を混合します。
- 100xgおよび4°Cで5分間混合物を遠心分離する。 上清を捨て、完全培養培地+キエキセドFBSの1mLでペレットを再懸濁する。
- 細胞懸濁液を新しい60mmコラーゲンIコーティングされた培養皿に盛り付けます。培養培地を2〜3日ごとに交換し、一度コンフルエントに細胞を通過させる。
7. 免疫蛍光染色
- 6ウェルプレート(5 x 105 細胞/ウェル)の正方形のカバーリップ(22mm x 22mm)上の経口ケラチノサイトを2日間培養する。
- ケラチノサイトを4%パラホルムアルデヒド(PFA)とPBSの溶液に20分間室温で固定してから、1x PBSで3回洗浄します。
- PBSで0.1%トリトンの溶液中の細胞を透過させる。細胞をブロッキング試薬(2.5%ヤギ血清、ロバ血清2.5%)で室温で1時間培養し、続いて一次抗体( 材料表を参照)を4°Cでインキュベートする。
注:一次抗体は、ウサギの抗K14(1:1000)、ラットα6-インテグリン(1:100)、ウサギの抗p63(1:500)、ウサギの抗K13(1:100)、ヤギ抗PDGFRα(1:100)の希釈剤で使用されました。 - PBSで0.1%トリトンの溶液中のサンプルを洗浄し、続いて室温で1時間二次抗体をインキュベートする。
注:2次抗体(Alexa 488または555)を1:300希釈で使用しました。 - 10分間のHoechst溶液を用いたすべてのサンプルに対抗し、ガラススライドにセルをマウントします。
注:Hoechst溶液は、細胞の核を染色するために使用されます。 - 共焦点顕微鏡を用いてサンプルイメージングを行います。
メモ:画像編集ソフトウェアを使用して、明るさとコントラストは等しい強度に調整されます。
結果
成人マウス口蓋からの解剖過程と経口角化細胞の分離の概要
解離した経口角化細胞を、成体マウス口蓋から採取し、カスタマイズした20%キレキセドFBSで培養した。マウスの口蓋は、硬口蓋と軟口蓋で構成されています(図1C)。マウス経口角化細胞の単離の手順を 図1Dに要約する。口蓋組織を解剖し、抗生物質抗抗組織溶液を含む培地に移され、一晩4°Cで0.025%トリプシン溶液でインキュベートされる。翌日、口蓋組織は、トリプシン阻害剤溶液と完全な培養培地を等量で処理する。その後、組織は外科用メスブレードを使用して掻き取られ、経口角化細胞を収集する。細胞懸濁液は100 μmの細胞のストレーナーを通して濾過され、遠心分離される。次に、細胞を完全な培養培地+キエキセドFBSの2 mLを含むコラーゲンIコーティング24ウェルプレートに播種する。
マウス経口角化細胞の分離に成功した代表的な結果
原発性経口ケラチノサイトは単層として成長し、石畳の形態を示した(図2)。小さなケラチノサイトコロニーは3〜5日で見えました(図2A、B)。これらは、インキュベーションの1週間で大きく、かつ密着なコロニーを形成した(図2C)。ケラチノサイトコロニーは、基底ケラチノサイトの典型的な形態学的特徴を示し、その健康な状態を示した。ヒト経口ケラチノサイトは、0.06 mM Ca2+16,28を含む完全な培養培地内のいくつかの通路について未分化のままであった。最初の通路は、最初のめっきから約2週間行った(図2D)。後の通路では、ケラチノサイトは培養期間が短く安定成長を示した(図2E-G)。分離過程で有意な線維芽細胞汚染が発生した場合、ケラチノサイトは増殖を停止した(図2H)。
分離マウス経口角化細胞は基底細胞マーカーを発現する
一次経口ケラチノサイトの状態を確認するために、ケラチン14(K14)およびα6-インテグリン34の基底細胞マーカーを用いて免疫染色を行った。K14及びα6-インテグリンを培養後のケラチノサイトで発現させた(図3A、B)。細胞はまた、幹細胞マーカーp63で染色し、そのステムを確認した。早期通過(パッセージ4)および後期通過(通過7)細胞は、p63の均一な発現を示した(図3C、D)。これに対し、高カルシウムで処理したケラチノサイト(1.2mM2日間誘導)は、p63発現の低下を示し(図3E)、高カルシウム処理が前述の原発ケラチノサイトにおける幹細胞関連遺伝子を抑制することを示す16。分化マーカーケラチン13(K13)は、高カルシウム処理の下で早期および後期の両方の通路および有意な発現において稀または全発現を示した(図3F-H)。ケラチノサイト培養における線維芽細胞汚染の可能性を試験するために、PDGFRαを用いた線維芽細胞マーカーを用いた染色を、マウス胚性線維芽細胞(MEF)と比較して同じケラチノサイトのセットで行った。ケラチノサイト培養ではPDGFRαの発現はなく、MEF細胞において認められた高発現と比較した(図3I-3L)。これらの結果は、このプロトコルが基底ケラチノサイトを正常に分離し、未分化状態でこれらの細胞を維持できることを示した。
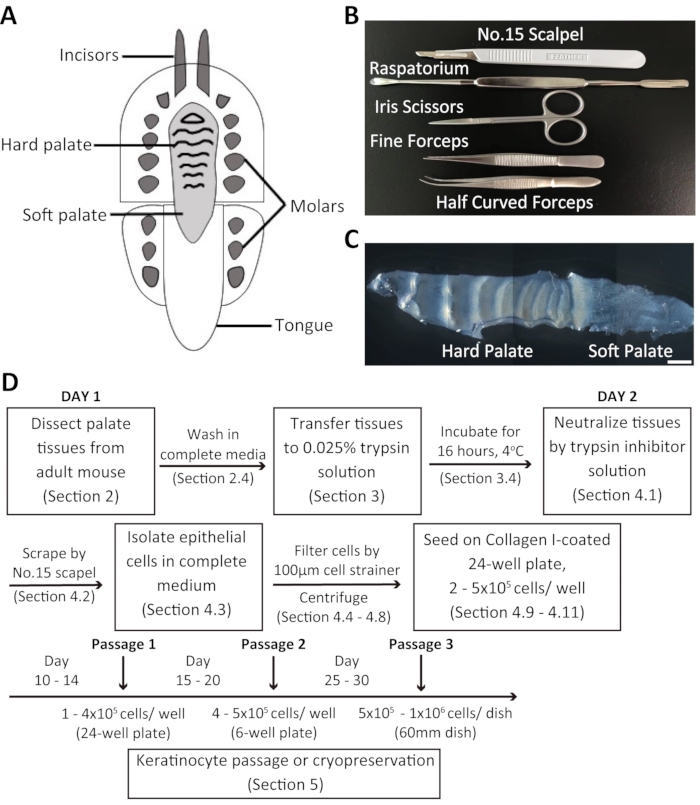
図1:マウス経口角化細胞の解剖手順および単離の概要。 (A)マウス口腔の模式的表現。(B) 口蓋を解剖し、マウス経口角化細胞を分離するために使用される器具。(C) マウスの口蓋のブライトフィールド画像。スケールバー:100 μm(D)プロトコルの概要。 この図の大きなバージョンを表示するには、ここをクリックしてください。
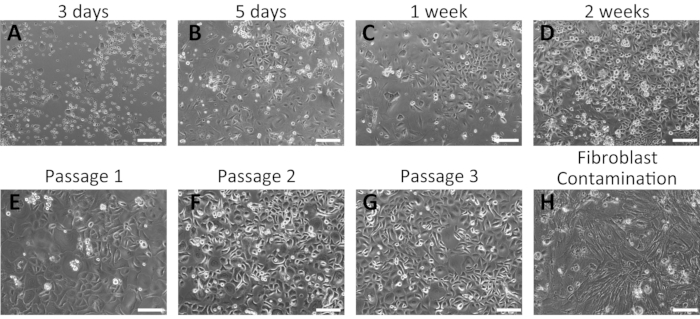
図2:マウス経口角化細胞の分離に成功した代表的な結果。 (A-G)培養された一次口腔角化細胞の経時画像を、3日(A)、5日間(B)、1週間(C)、および2週間(D)で培養した後の培養物を分離した。マウス口腔角化細胞の形態は、第1(E)、第2(F)、および第3(G)の通路後に示されている。(H)マウス口腔角化細胞培養における線維芽細胞汚染の例。スケールバー:400 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
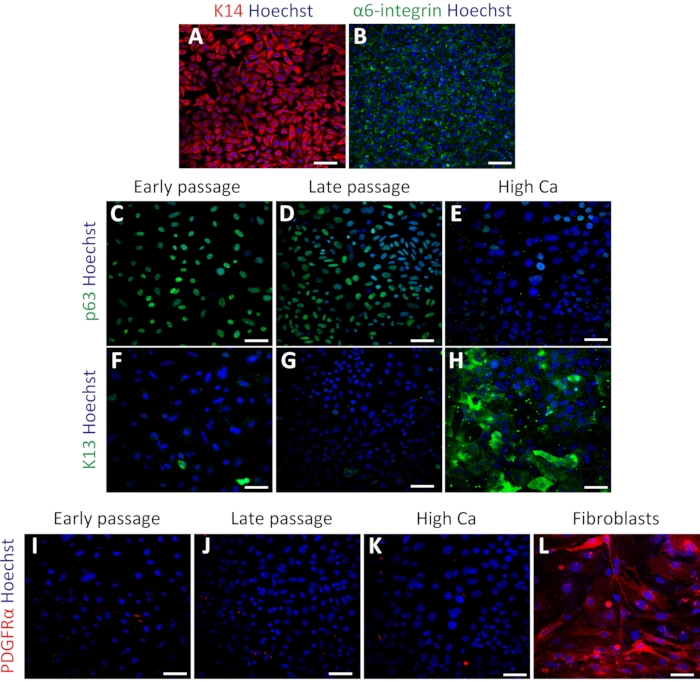
図3:単離マウス経口角化細胞は基底細胞マーカーを発現する。 (A-B)通過4におけるK14(A;赤色)およびα6-インテグリン(B;緑色)の免疫蛍光染色の代表的な画像。(C-E)p63(緑色)のp63(緑色)の免疫蛍光染色の代表的な画像は、通路4(C)、通過7(D)、高カルシウム処理(E)である。(F-H)通過4におけるK13(緑色)の免疫染色像、通過7(G)、高カルシウム処理(H)。。(I-L)PDGFRα(赤色)の免疫染色画像は、通路4(I)、通過7(J)、高カルシウム処理(K)、およびMEF(L)である。核は、Hoechst(青)で染色されます。スケールバー:100 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ヒトまたはマウス皮膚表皮から分離された原発性角化細胞は、研究および臨床応用において長年にわたって利用されてきた12,13,15,18,27,28,29。対照的に、一次経口ケラチノサイトを成人mice30,31,32から分離および培養するためのプロトコルはほとんど確立されていない。本研究では、増殖性または幹細胞様の状態でケラチノサイトを維持するために、市販の完全培養培地およびキレートドFBSを用いた。この培養システムは、経口上皮幹細胞およびそれらの関連疾患の特徴をさらに理解するために、分子および生化学的アッセイに採用することができる。
このプロトコルには、いくつかの重要なステップが含まれています。まず、トリプシン濃度とインキュベーション時間は、その後の培養のために生細胞を産生する上で不可欠である。室温でチャンバーフードに0.025%のトリプシン溶液と16時間のインキュベーション期間を一貫して使用しました。十分な時間インキュベートしないと、ケラチノサイトは組織から適切に解離せず、最終的な細胞収率を低下させる。第二に、2日目の細胞懸濁液の穏やかなピペット化は、細胞の生存率に顕著に影響を及ぼす。擦り傷は上皮側から穏やかに開始し、組織サンプルあたり10分を超えないようにする必要があります。最後に、最初の単離細胞懸濁液は線維芽細胞および他の細胞タイプを含む;これらの不要な細胞は、通常、その後の培養で消え始めます.
潜在的な制限は、細胞の分離および培養中に同定された。まれに、線維芽細胞は、分離プロセス中に汚染され、そして、線維芽細胞は、その後の通路でケラチノサイトの成長を阻害する可能性がある(図2H)。このような培養物の汚染を排除するためには、線維芽細胞増殖抑制剤を含有する市販培地を選択する必要がある。マウス口蓋および他の口腔粘膜は比較的小さいサイズを有するため、1つのマウスからの初期細胞収量が低い場合がある。したがって、このプロトコルの培養期間全体が、凍結保存段階までは、原発性皮膚ケラチノサイトに対してのそれよりも長い。分離された経口角化細胞は、より長い培養期間が細胞の特性を変化させ、幹細胞の数を減らすことができるので、10の通過以内に最もよく使用される。
現在の方法は、マウス経口ケラチノサイトが増殖条件下で密に詰まった石畳の形態および形成された単層コロニーを示したことを示した。また、基底マーカーα6-インテグリン、K14、および幹細胞マーカーp63の高発現も示した。今後の研究では、免疫蛍光染色、RNA-シーケンシング、RT-PCR、およびウェスタンブロット解析を用いて、細胞の不均一性と経口ケラチノサイトの純度を検証し、細胞の性質についての理解をさらに深めます。
2〜3節後、経口ケラチノサイトは、さらなる機能実験で使用できるほど安定していた。重要なことに、この培養プロトコルは、遺伝子ノックアウト、Cre-loxP、およびテト誘導性システムを含むトランスジェニックマウスラインと組み合わせることができ、細胞および分子アッセイにも使用することができます。このように、本プロトコルは、研究者に、さらに、口腔角化細胞幹細胞生物学を理解するために使用できる基本的かつ効率的な方法を提供する。
開示事項
著者らは競合する利益を宣言しない。
謝辞
この研究は、科学研究のための助成援助(B)(20H03266)(A.S.)、早期キャリア科学者のための助成援助(18K14709)(Aへ) )、助成金番号JP21gm6110016および21bm0704067(A.S.へ)の下でAMED、および武田科学財団(A.S.へ)からの研究助成金。熊本大学動物資源開発センター、筑波大学動物資源センターの優れたマウスケアに感謝します。熊本大学のIRCMSコア施設に対し、共焦点イメージングの支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin/EDTA | Gibco | R001100 | |
| 0.05% Trypsin/EDTA, phenol red | Gibco | 25300062 | |
| 0.4w/v% Trypan Blue solution | Wako | 207-17081 | |
| 10 mL Serological pipet | Falcon | 357551 | |
| 100 µm Nylon cell strainer | Falcon | 352360 | |
| 15 mL sterile conical tube | Falcon | 352096 | |
| 2 mL Aspirating pipet | Falcon | 357558 | |
| 35 mm Cell culture dish | Corning | 353801 | |
| 50 mL sterile conical tube | Falcon | 352070 | |
| 60 mm Cell culture dish | Corning | 353802 | |
| 6-well Tissue Culture plate | Falcon | 353046 | |
| 96 Well Culture plate (U bottom) | Falcon | 353077 | |
| Antibiotic-Antimycotic 100x | Gibco | 15240062 | |
| Biocoat Collagen I cellware 60mm dish | Corning | 356401 | |
| Blunt Forceps | AS ONE | 1-8187-03 | |
| Butorphanol | Meiji Seika Pharma | Vetorphale | |
| CoolCell LX | Corning | 432002 | Cryogenic storage |
| Cotton | AS ONE | 63-1452-97 | |
| Cover slips 22 x 22 μm square | Matsunami Glass Ind. | C022221 | |
| Cryogenic Vial 1.2 mL | Thermo Scientific | 5000-0012 | |
| Defined Trypsin Inhibitor (DTI) | Gibco | R007100 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 276855-100ML | |
| Donkey anti-Rabbit IgG (H+L), Alexa Fluor 555 | Invitrogen | A31572 | |
| Donkey anti-Rat IgG (H+L), Alexa Fluor 488 | Invitrogen | A21208 | |
| Donkey serum | Sigma-Aldrich | D9663-10ML | |
| EpiLife Defined Growth Supplement (EDGS) | Gibco | S0120 | |
| EpiLife, with 60 µM calcium | Gibco | MEPI500CA | |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Fine forceps | BRC Bio Research Center | PRI13-3374 | |
| Goat anti-PDGF Receptor α | R&D Systems | AF1062 | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Half-curved forceps | BRC Bio Research Center | PRI13-3376 | |
| Hemocytometer | Hirschmann Laborgeräte | 8100204 | |
| Hoechst | Sigma-Aldrich | B2261 | |
| Iris Scissors | Muromachi Kikai | 14090-09 | |
| Medetomidine | Nippon Zenyaku Kogyo | Domitor | |
| Midazolam | Astellas Pharma | Dormicum | |
| No.15 Disposable scalpel | Feather | 219AABZX00136000 | |
| Paraformaldehyde | Wako | 162-16065 | |
| Phosphate Buffered Saline 1x, pH 7.4 | Gibco | 10010049 | |
| Povidone-iodine | Y's Square | 872612 | |
| Rabbit anti-Cytokeratin 13 antibody | Abcam | ab92551 | |
| Rabbit anti-K14 | BioLegend | 905301 | |
| Rabbit anti-p63 antibody | Abcam | ab124762 | |
| Raspatorium #14 | AS ONE | 8-4599-01 | |
| Rat α6-integrin | BD Biosciences | 553745 | |
| Triton X-100 | Wako | 581-81705 | |
| Type I Collagen coated 24-well plate | Corning | 354408 | |
| Type I Collagen coated 60mm dish | Corning | 356401 | |
| Type I Collagen coated 6-well plate | Corning | 355400 |
参考文献
- Presland, R. B., Jurevic, R. J. Making sense of the epithelial barrier: what molecular biology and genetics tell us about the functions of oral mucosal and epidermal tissues. Journal of Dental Education. 66 (4), 564-574 (2002).
- Squier, C. A., Kremer, M. J. Biology of oral mucosa and esophagus. Journal of the National Cancer Institute Monographs. (29), 7-15 (2001).
- Jones, K. B., Klein, O. D. Oral epithelial stem cells in tissue maintenance and disease: the first steps in a long journey. International Journal of Oral Science. 5 (3), 121-129 (2013).
- Winning, T. A., Townsend, G. C. Oral mucosal embryology and histology. Clinics in Dermatology. 18 (5), 499-511 (2000).
- Asaka, T., Akiyama, M., Kitagawa, Y., Shimizu, H. Higher density of label-retaining cells in gingival epithelium. Journal of Dermatological Science. 55 (2), 132-134 (2009).
- Bickenbach, J. R. Identification and behavior of label-retaining cells in oral mucosa and skin. Journal of Dental Research. 60, Spec No C 1611-1620 (1981).
- Bickenbach, J. R., Mackenzie, I. C. Identification and localization of label-retaining cells in hamster epithelia. Journal of Investigative Dermatology. 82 (6), 618-622 (1984).
- Byrd, K. M., et al. Heterogeneity within stratified epithelial stem cell populations maintains the oral mucosa in response to physiological stress. Cell Stem Cell. 25 (6), 814-829 (2019).
- Jones, K. B., et al. Quantitative clonal analysis and single-cell transcriptomics reveal division kinetics, hierarchy, and fate of oral epithelial progenitor cells. Cell Stem Cell. 24 (1), 183-192 (2019).
- Willberg, J., Syrjanen, S., Hormia, M. Junctional epithelium in rats is characterized by slow cell proliferation. Journal of Periodontology. 77 (5), 840-846 (2006).
- Tanaka, T., et al. Identification of stem cells that maintain and regenerate lingual keratinized epithelial cells. Nature Cell Biology. 15 (5), 511-518 (2013).
- Compton, C. C., et al. Skin regenerated from cultured epithelial autografts on full-thickness burn wounds from 6 days to 5 years after grafting. A light, electron microscopic and immunohistochemical study. Laboratory Investigation. 60 (5), 600-612 (1989).
- Gallico, G. G., O'Connor, N. E., Compton, C. C., Kehinde, O., Green, H. Permanent coverage of large burn wounds with autologous cultured human epithelium. New England Journal of Medicine. 311 (7), 448-451 (1984).
- Guo, Z., et al. Building a microphysiological skin model from induced pluripotent stem cells. Stem Cell Research & Therapy. 4, Suppl 1 2(2013).
- O'connor, N. E., Mulliken, J. B., Banksschlegel, S., Kehinde, O., Green, H. Grafting of burns with cultured epithelium prepared from autologous epidermal-cells. Lancet. 1 (8211), 75-78 (1981).
- Hennings, H., et al. Calcium regulation of growth and differentiation of mouse epidermal cells in culture. Cell. 19 (1), 245-254 (1980).
- Caldelari, R., Suter, M. M., Baumann, D., De Bruin, A., Muller, E. Long-term culture of murine epidermal keratinocytes. Journal of Investigative Dermatology. 114 (5), 1064-1065 (2000).
- Lichti, U., Anders, J., Yuspa, S. H. Isolation and short-term culture of primary keratinocytes, hair follicle populations and dermal cells from newborn mice and keratinocytes from adult mice for in vitro analysis and for grafting to immunodeficient mice. Nature Protocols. 3 (5), 799-810 (2008).
- Yano, S., Okochi, H. Long-term culture of adult murine epidermal keratinocytes. British Journal of Dermatology. 153 (6), 1101-1104 (2005).
- Iglesias-Bartolome, R., et al. Transcriptional signature primes human oral mucosa for rapid wound healing. Science Translational Medicine. 10 (451), (2018).
- Papagerakis, S., et al. Oral epithelial stem cells - implications in normal development and cancer metastasis. Experimental Cell Research. 325 (2), 111-129 (2014).
- Szpaderska, A. M., Zuckerman, J. D., DiPietro, L. A. Differential injury responses in oral mucosal and cutaneous wounds. Journal of Dental Research. 82 (8), 621-626 (2003).
- Chen, L., et al. Positional differences in the wound transcriptome of skin and oral mucosa. BMC Genomics. 11, 471(2010).
- Chen, L., Gajendrareddy, P. K., DiPietro, L. A. Differential expression of HIF-1alpha in skin and mucosal wounds. Journal of Dental Research. 91 (9), 871-876 (2012).
- Simoes, A., et al. Differential microRNA profile underlies the divergent healing responses in skin and oral mucosal wounds. Scientific Reports. 9 (1), 7160(2019).
- Turabelidze, A., et al. Intrinsic differences between oral and skin keratinocytes. PLoS One. 9 (9), 101480(2014).
- Aasen, T., Izpisua Belmonte, J. C. Isolation and cultivation of human keratinocytes from skin or plucked hair for the generation of induced pluripotent stem cells. Nature Protocols. 5 (2), 371-382 (2010).
- Izumi, K., Tobita, T., Feinberg, S. E. Isolation of human oral keratinocyte progenitor/stem cells. Journal of Dental Research. 86 (4), 341-346 (2007).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. Journal of Visualized Experiments: JoVE. (138), (2018).
- Hatakeyama, S., et al. Establishment of gingival epithelial cell lines from transgenic mice harboring temperature sensitive simian virus 40 large T-antigen gene. Journal of Oral Pathology & Medicine. 30 (5), 296-304 (2001).
- Ookura, T., et al. Fibroblast and epidermal growth factors modulate proliferation and neural cell adhesion molecule expression in epithelial cells derived from the adult mouse tongue. In Vitro Cellular & Developmental Biology - Animal. 38 (6), 365-372 (2002).
- Parikh, N., Nagarajan, P., Sei-ichi, M., Sinha, S., Garrett-Sinha, L. A. Isolation and characterization of an immortalized oral keratinocyte cell line of mouse origin. Archives of Oral Biology. 53 (11), 1091-1100 (2008).
- Brennan, J. K., Mansky, J., Roberts, G., Lichtman, M. A. Improved methods for reducing calcium and magnesium concentrations in tissue culture medium: application to studies of lymphoblast proliferation in vitro. In Vitro. 11 (6), 354-360 (1975).
- Cerqueira, M. T., Frias, A. M., Reis, R. L., Marques, A. P. Interfollicular epidermal stem cells: boosting and rescuing from adult skin. Methods in Molecular Biology. 989, 1-9 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved