Method Article
感染後ブドウ膜炎のモデルとしてのプライミングマイコバクテリアブドウ膜炎(PMU)
要約
このプロトコルは、マウスにプライミングマイコバクテリアブドウ膜炎(PMU)を誘発するための手順を概説しています。この方法は、マウスモデルシステムで信頼性が高く堅牢な眼の炎症を引き起こすのに役立つ手順を概説します。このプロトコルを使用して、免疫学的、トランスクリプトミクス、およびプロテオミクスアッセイでさらに評価するために、単一の動物からブドウ眼と炎症を起こしていない仲間の目を生成しました。
要約
「ブドウ膜炎」という用語は、すべてが眼内炎症を特徴とする不均一な一連の状態を表します。大まかに言えば、ブドウ膜炎は病因によって定義されます:感染症または自己免疫。感染性ブドウ膜炎は適切な抗菌剤による治療を必要としますが、自己免疫性ブドウ膜炎はコルチコステロイドまたは他の免疫抑制剤による治療を必要とします。感染後ブドウ膜炎は慢性ブドウ膜炎の一種であり、最初の感染後に免疫後遺症を制御するためにコルチコステロイドが必要です。 結核菌 (Mtb)感染に伴うブドウ膜炎は、感染後ブドウ膜炎のよく知られた形態ですが、病気のメカニズムは完全には理解されていません。mTB感染後の慢性眼の炎症を刺激する上でマイコバクテリア抗原と自然リガンドが果たす役割を理解するために、マウスで使用するためにモデルPrimed Mycobacteria ブドウ膜炎(PMU)が開発されました。この原稿では、カラー眼底および光干渉断層撮影(OCT)イメージングを使用して、PMUを生成し、炎症の臨床経過を監視する方法を概説しています。PMUは、加熱死菌抽出物による免疫とそれに続く7日後に片方の眼への同じ抽出物の硝子体内注射によって誘発されます。眼の炎症は、in vivoイメージングを使用して縦断的にモニタリングされ、その後、組織学、フローサイトメトリー、サイトカイン分析、qPCR、またはmRNAシーケンシングを含む幅広いアッセイのためのサンプル収集が行われます。PMUのマウスモデルは、慢性ブドウ膜炎のメカニズムであるmTBに対する眼の反応の研究、および新しい抗炎症療法の前臨床有効性試験に有用な新しいツールです。
概要
「ブドウ膜炎」という用語は、すべてが眼内炎症を特徴とする不均一な一連の状態を表します1。ブドウ膜炎の動物モデルは、疾患メカニズムの理解や新しい治療法の前臨床試験に重要です。ブドウ膜炎の動物モデルが多数確立されている2。最も広く研究されている2つは、実験的自己免疫性ブドウ膜炎(またはブドウ膜炎;EAU)およびエンドトキシン誘発性ブドウ膜炎(EIU)。EAUは、典型的には、眼抗原による免疫によって生成されるか、またはAIRE遺伝子の非存在下で中枢寛容が破壊されたときに自然発生的に起こり得る3,4。その後、モデルの他の変異体は、異なるブドウ膜生成ペプチドを含むように5,6,7開発されている。これらは広範囲にレビューされています8、9、10。EAUは、Vogt-小柳-原田病やバードショット絨毛網膜炎などのT細胞依存性自己免疫性ブドウ膜炎の形態の主要なモデルです。EIUは、細菌性リポ多糖(LPS)の全身または局所注射によって生成されます10,11。EIUは、自然免疫シグナル伝達経路12の活性化によって生じる急性ブドウ膜炎のモデルとして使用されている。どちらのモデルも、眼免疫学の現在の理解に役立っていますが、どちらも感染後の慢性ブドウ膜炎の効果的なモデルではありません。マウスで最近確立されたプライミングマイコバクテリアブドウ膜炎(PMU)モデルは、この形態のブドウ膜炎の臨床的および細胞的側面を調査および評価するためのアプローチを提供するようになりました13。
世界中でマイコバクテリア感染症の有病率が高く、2019年に世界保健機関によって1,000万人以上の新規症例と140万人以上の死亡が報告されています14。活動性結核(TB)感染の肺外症状にはブドウ膜炎が含まれ、感染性ブドウ膜炎のよく認識されている原因です15,16。結核関連ブドウ膜炎の症状はプロテアンであり、これは、直接眼感染やあまり理解されていない免疫介在性炎症を含む複数の異なる疾患メカニズムを反映している可能性があります17,18,19。これらの感染後後遺症の提案されたメカニズムには、網膜色素上皮(RPE)におけるパウチ菌感染の持続によって刺激される慢性炎症反応、正常に除去された眼感染からの残留病原体関連分子パターン(PAMP)の存在によって刺激される慢性炎症反応、および分子模倣または抗原のプロセスを介した眼抗原に対する適応免疫応答の不適切な活性化が含まれます。 全身性結核感染によって引き起こされる広がり20,21,22,23。
慢性感染後ブドウ膜炎の機構的理解をよりよく得、疾患の開始におけるマイコバクテリア抗原の役割を研究するために、マウスで使用するためにPMUモデルが開発された13,24。したがって、炎症を誘発するために、マウスはまず全身感染を模倣するために熱死した結核菌H37Ra株からの抗原の皮下注射を受け、続いて7日後に同じ抗原の硝子体内注射を受けて局所眼感染を模倣するために左または右眼に投与する。その後のブドウ膜炎の強度および持続時間は、縦方向のin vivo光干渉断層撮影(OCT)および眼底画像化25によってモニターされる。PMUは、硝子体炎、血管周囲網膜炎症、および網膜外損傷の病巣領域を伴う慢性T細胞優性後部ブドウ膜炎に発展する急性骨髄優性汎ブドウ膜炎を特徴としています26。眼の後部に肉芽腫性炎症が存在することは、PMUモデルを使用して、過去のMtb感染の免疫学的証拠を持つ患者に見られる、ある種の前部(肉芽腫性および非肉芽腫性)および中間ブドウ膜炎の研究に使用できることを示唆しています27。さらに、PMUモデルで使用された加熱死Mtbの成分は、抗結核療法(ATT)に反応する眼結核患者の再発性ブドウ膜炎の側面の根底にある免疫応答を引き起こすことが示唆されています28。PMUは、EAUやEIUと比較して疾患の開始と炎症経過が異なるため、眼抗原による免疫に依存しないブドウ膜炎の新しい動物モデルであり、慢性ブドウ膜炎患者の疾患メカニズムの解明に役立つ可能性があります。このプロトコルでは、PMUの生成、炎症の臨床経過のモニタリング、フローサイトメトリーによる死後分析のための眼サンプルの収集の方法を概説しています。
プロトコル
実行されたすべての手順は、ワシントン大学の動物管理および使用委員会(動物研究プロトコル#4481-02)によって、または英国内務省ライセンス(PPL 30/3281)およびブリストル大学倫理レビューグループに準拠して、ローカルで承認されました。両機関で実施された実験は、眼科および視覚研究における動物の使用に関する視覚眼科学研究協会(ARVO)の声明と一致していました。PMUは6〜10週齢のC57BL / 6Jマウスで生成されました。ブドウ膜炎誘発時のマウスの体重は全て18g以上であり、Crb1遺伝子29のrd8変異については陰性が確認された。マウスは、特定の病原体のない条件下で、標準的な飼料と薬用水(アセトアミノフェン200〜300 mg / kg /日)を 自由に 維持しました。.動物の安楽死は、標準的な二酸化炭素吸入方法30を用いて行った。
1.皮下注射用抗原製剤
- Mtb H37Raパウダーとの吸入または皮膚接触を防ぐために、化学ヒュームフード内でこのセクションのすべての手順を実行してください。完全なフロイントアジュバント(通常はBSL-1)の制度的方針に従って処理してください。これには、耐薬品性手袋、安全メガネ、防護作業服(白衣)の使用が含まれます。
- 実験動物に導入される試薬の汚染を防ぐために、優れた滅菌技術を使用してください。
- 5 mLの微量遠心チューブで5 mgの凍結乾燥され、熱死した 結核菌 H37Ra粉末と2.5 mLの冷たいPBSを混合することにより、PBS中のMtb懸濁液を作ります。30秒間一度渦を流してから、氷の上に置きます。
- PBS中のH37Raの微細懸濁液を生成するには、氷上で懸濁液を5分間超音波処理する。
- アンプを外しますampコンバーターユニットの本体と、70%(v / v)アルコール綿棒でプローブを清掃します。
- 超音波処理器の電源を入れ、電源制御ノブを回して電力設定を4に調整し、プローブの先端をPBS含有マイコバクテリア粉末に浸します。プローブの先端がサンプルの少なくとも半分の深さまで浸されていること、およびプローブの先端がマイクロ遠心チューブの壁に触れていないことを確認してください。
- 氷上で混合物を30秒間超音波処理し、30秒間一時停止し、合計5分間繰り返して、液体を加熱せずに粉末を均一な懸濁液に完全に分散させる。
- フロイントの不完全なアジュバントの2.5mLを混合物に加え、エマルジョンが練り歯磨きのような粘稠度を形成するまで氷上で超音波処理プロセスを繰り返します。
- コントロールノブを使用して電源を0に設定し、ユニットの電源を切って超音波処理を終了します。懸濁液からチップを取り外し、アルコール綿棒でプローブを拭きます。
- 抗原エマルジョンは4°Cで保存する。 エマルジョンのバッチを作成することは、実験間の一貫性を確保するのに役立ちます。エマルジョンは4°Cで最大3ヶ月間保存できます。
2.皮下注射
- 硝子体内注射の1週間前に皮下注射を行います(-7日目として指定)。.
- 1 mLシリンジ(針は付いていません)にマイコバクテリアエマルジョンをロードします。.エマルジョンの粘度と不透明度のために、見えにくい気泡がシリンジを満たす可能性があります。
- シリンジ内の気泡を防ぐために、0.2〜0.3 mLのエマルジョンをロードした後、シリンジを反転させ(先端を上に向けて)、カウンターの端でシリンジを繰り返し軽くたたき、気泡を表面に持ってきます。
- シリンジから空気を排出し、シリンジの充填を続けます。反転し、いっぱいになるまで断続的にタップします。
- シリンジに25 Gの針を置き、エマルジョンを進めて針を満たします。使用するまでシリンジを氷上に保管してください。
- 皮下注射を安全に行うには、マウスを麻酔するか、または動物の後肢31に容易にアクセスできるようにする人道的拘束方法を利用する。
- 皮下注射のために麻酔をかけるには、動物をイソフルラン誘導チャンバー(誘導用に3%〜4%、維持用に1%〜3%)に入れる。麻酔をかけたら、マウスの呼吸数が遅く、呼吸困難の兆候がないことを確認します。.
- 皮下注射を腰の背側表面、または鼠径リンパ節の領域に近い脚の腹側表面のいずれかに配置します。
- 筋肉への注入を防ぐために慎重に針を挿入します。0.05 mLのMtbエマルジョンを皮下腔に注入します。濃厚なエマルジョンを完全に注入するために、すぐに針を取り外さないでください。
- 左側と右側の両方で注射を繰り返し、動物あたり合計0.1 mLにします。.
- 麻酔をかけた場合は、完全に回復するまでマウスを温かい加熱パッドに置きます。胸骨横臥を維持するのに十分な意識を取り戻すまで、マウスを放置しないでください。.
- 完全に回復したらマウスをケージに戻し、ケージカードに皮下注射の日付をラベル付けします。
- 鎮痛剤に経口アセトアミノフェン(200 mg / kg /日)を提供しますが、抗炎症剤はブドウ膜炎の誘発に影響を与える可能性があるため、NSAIDは提供しません。.
3.硝子体内注射のための抗原ストック製剤
- 硝子体内Mtb懸濁液の汚染を防ぐために、適切な無菌条件下でこのセクションのすべての手順を実行してください。
- 硝子体内懸濁液を作ります。
- 軽度から中等度の汎ブドウ膜炎の誘発のために、5 mgのマイコバクテリア抽出物を1 mLの1x PBSに加えることにより、硝子体内懸濁液を5 mg / mLの濃度で作ります。.
- 中等度から重度の汎ブドウ膜炎の誘発のために、10 mgのマイコバクテリア抽出物を1 mLの1x PBSに加えることにより、硝子体内懸濁液を10 mg / mLの濃度で作ります。.
- 30秒間一度渦を流してから、氷の上に置きます。
- PBS中のH37Raの微細懸濁液を生成するには、ステップ1.4に記載されているように、氷上で10分間懸濁液を超音波処理します。このストック溶液を100 μLの容量で分注し、-20°Cで保存します。
- 使用前に、室温で解凍し、1分間強気でボルテックスします。動物施設に輸送している間、アリコートを氷上に保管してください。
4.0日目の硝子体内注射手順
- 動物の準備
- 装着された検査用手袋を着用し、マウスを計量天秤の上に置き、グラム単位で重量を取得します。
- 100 mg / mLのケタミンと20 mg / mLのキシラジンを含む溶液を0.02 mL / g体重の腹腔内注射を滅菌水と混合して動物に麻酔をかけます。.別のアプローチには、~1.5%イソフルラン(吸入)を使用した誘導が含まれます。
- マウスが眠りにつくまで約2分待ってから、マウスを保温ボックスに入れて蓋をします。耳、つま先、尾のつまみなどの痛み反射テストを実行して、手順32の麻酔の深さを評価します。
- 眠ったら、0.5%(v / v)テトラカインを1滴で角膜に麻酔します。マウスの鼻や口の近くにテトラカインが入らないようにしてください。10秒後、余分な液体を軽くたたきます。
注:局所麻酔を投与すると、虹彩拡張と前房(AC)の視覚化が改善されることが観察されており、おそらく全身麻酔と局所麻酔の組み合わせによる角膜反射抑制の改善によるものです。.ただし、必要に応じてこの手順を省略できます。 - 2.5%(v / v)フェニレフリンを1滴垂らして瞳孔を拡張します。鼻や口に入る可能性のある過剰な飛沫を避けるために注意してください。2〜3分後、余分な液体を軽くたたきます。
- 眼内炎のリスクを減らすには、目の表面と周囲の髪に5%ベタジンを1滴加えます。2〜3分間目につけたままにします。
注意: 眼内炎を防ぐために、適切な無菌条件下でこのセクションのすべての手順を実行してください。 - ベタジンを除去し、麻酔下での乾燥を防ぐために、ヒプロメロース(0.3%)またはカルボマーアイジェル0.2%w / w)で目を覆います。.これは白内障の形成を防ぐのにも役立ちます。
- マイクロインジェクションシステムのセットアップ
- マイクロシリンジポンプコントローラーと注射シリンジに接続されたマイクロポンプを使用して硝子体内注射を実行します(図1A-C)。または、サブセクション33で説明されているように、ハミルトンシリンジに取り付けられた4.4G針を注入します。
- 34Gの針をインジェクションホルダーに接続して、インジェクターを組み立てます。注射ホルダーの前端にある銀色のスクリューキャップを緩め、針をホルダー本体に半分ほどスライドさせます。銀色のスクリューキャップの指をしっかりと締めます。
- 手順4.2.4〜4.2.5で説明されているように、チューブを射出ホルダーに接続します。
- インジェクションホルダーにチューブを挿入するには、ホルダーの後端にあるプラスチックネジを緩め、チューブを内側のガスケットに通してネジを締めます。
- 注入中のチューブの損傷を防ぐために、チューブの端とわずかな隙間を空けてください。 図1Cを参照してください。
- 100 μLのアリコートのマイコバクテリウムストック懸濁液を解凍します。
- 3 μLの1%フルオレセインナトリウム(AK-Fluor)溶液を加え、ボルテックスウェルを加えます。
- 10 μLのシリンジに、気泡を含まない抗原とフルオレセインの混合物を入れます。
- シリンジからローディングニードルを取り外し、先端がシリンジ本体のゼロマークに達するまで、チューブを銀色のスクリューキャップガスケットに通します。
- チューブの先端が目的の位置に正しく位置合わせされたら、スクリューキャップの指をしっかりと締めます。
- 注射管を通してシリンジ内の溶液を洗い流し、システムを完全にロードします。次に、手順4.2.8〜4.2.11を繰り返して、注射用のシリンジをリロードします。
- ロードされたシリンジをマイクロポンプに取り付けるには、clを押しますamp マイクロポンプの端にあるリリースボタンを押して、シリンジclを開きますamps。
- プランジャーのキャップをマイクロポンプの後端にあるプランジャーキャップホルダーに配置します。
- 次に、シリンジカラーをカラーストップにスライドさせ、シリンジ本体をシリンジクランプにスライドさせます。
- clを放しますamp ボタンとプランジャー固定ネジを締めます。 図1Dを参照してください。
- 注射ホルダーと針を定位注入装置のOクランプに通します。これはカスタムプラットフォームです。あるいは、シリンジを手動で保持して配置することもできます。
- マイクロシリンジポンプコントローラーの注入量と注入速度を、それぞれ40 nL/sの速度でサイクルあたり500 nLを注入するように設定します。
注意: より速い注入速度を使用できますが、針の再配置を達成する前に、より多くの逆流が発生する可能性があります。 - 硝子体内注射を実行する前に、システムをテストして正しく機能していることを確認します。.
注意: 噴射システムが正常に機能している場合、フットペダルまたはコントロールパッドを使用して噴射サイクルをアクティブにすると、プランジャーキャップホルダーが目に見える動きをし、針の先端に緑がかった液体の小さな液滴が見られます。液体が生成されない場合は、追加のサイクルをアクティブにするか、シリンジをフラッシュしてリロードします。 - 目を注入する前に、95%エタノールパッドで針をそっと拭きます。
- 硝子体内注射手順
- マウスを定位固定装置に置き、注射手順を実行する。
- マウスが置かれているステージ/プラットフォームの表面に2〜3枚のペーパータオルを取り付けて、暖かく保ちます。
- マウスをプラットフォーム上で腹臥位に置きます。左右のイヤーバーを使用して、動物の頭をそっと固定します。 図1Eを参照してください。
- マウスを置き、右目の上鼻面が見えるようにスコープの下に向きを変えます。
- 30 Gの針を使用してまつげを移動させ、強膜を露出させます。辺縁と橈骨血管を視覚化します。
- 滅菌した30 Gの針を使用して、四肢の後方1〜2 mmの強膜にガイド穴を開けます。
- 注射ホルダーに取り付けられた34Gの針を、レンズを避ける角度でガイド穴から目に挿入しますが、針先を硝子体腔に入れます。
- マイクロシリンジポンプコントローラーを使用して、1 μLのMtb抽出物を硝子体腔に注意深く注入します。一貫した逆流の場合は、適切な用量送達を確保するために、注入量を1.5μLに増やします。.
注:偽コントロールの場合は、1μLのPBSを動物の目に注入します。 - 目の緑がかった反射を視覚化することにより、硝子体内配置を確認します。 図1Fを参照してください。
- 10秒後、針を目から引き抜きます。逆流に注意してください。
- プラットフォームからマウスを取り外し、角膜保護のために0.3%ヒプロメロースまたは0.2%w / wカルボマー眼軟膏を両眼に配置し、回復加温ボックスに移動します。
- 胸骨横臥を維持するのに十分な意識を取り戻すまで、マウスを放置しないでください。.完全に回復するまで他の動物の会社に戻らないでください。
- マウスが完全に目覚めたら、ケージに戻り、アセトアミノフェン(200-300 mg / kg /日)薬用ウォーターボトルを追加します。.ケージカードにIVT注射の日付をラベル付けします。
- 硝子体内注射は一般的に忍容性が良好です。.痛みと研究からの除去の必要性を示す可能性のある臨床徴候には、眼周囲脱毛症(自己外傷を示す)、角膜潰瘍、体重減少、および猫背姿勢が含まれます。
- 硝子体内注射の代替方法
注:この手順は、手術顕微鏡とマイクロシリンジの33G針を使用して実行されます。- 目を支え、鉗子で所定の位置に保持します。
- 次に、カルボマーアイジェル0.2%w / wまたは0.3%ヒプロメロースアイジェルを塗布し、円形のカバーガラス(直径7 mm)を目の上に置きます。
- 33 Gの皮下注射針を5 μLのハミルトンシリンジに取り付け、角膜の縁に対して約2 mmの円周方向に~45°の注入角度で挿入します。
- 針の斜角を硝子体に導き、レンズと視神経乳頭の間で停止し(外科医の相対的な観点から、これは視神経乳頭の上/カバー-挿入部位から約1.5 mm)、2 μLのMtb(PBSで2.5 ug / μL)をゆっくりと注入します。
- 針を短時間所定の位置に保持してから(注射液の逆流量を減らすため)、取り外します。
- 注射後、鉗子を解放して地球を置きます。注射後の眼内炎からのさらなる保護を提供するために、この時点で1%w / wクロラムフェニコール軟膏の滴を眼に投与することができる。
- 注射後、手順4.3.11〜4.3.13で説明されているように、回復加温ボックスに移動します。
5.ブドウ膜炎を検出および定量するためのOCTイメージング
- 動物の準備
- 手順4.1.2-4.1.4の説明に従ってマウスを麻酔します
- 1滴の2.5%フェニレフリンで瞳孔を拡張します。鼻や口に入る可能性のある過剰な飛沫を避けるために注意してください。2〜3分後、余分な液体を軽くたたきます。
- 麻酔下での乾燥を防ぐために、0.3%ヒプロメロースまたは0.2%w / wカルボマーゲルを目に置きます。これは白内障の形成を防ぐのにも役立ちます。
- 体の暖かさを維持するために外科用ガーゼの層でマウスを包み、動物カセットの上に置きます。バイトバーで頭を配置します。
- 前房と後房のOCT画像を取得します。
注:前房と後房の画像を取得する場合は、白内障形成後の画像の劣化を防ぐために、最初に後房(PC)画像を取得してください。白内障の形成は、頻繁な潤滑と0.3%ヒプロメロースまたは0.2%w / wカルボマーアイジェルの塗布で防ぐことができます。長時間のイメージング(>10分)の場合、(ヒートパッドを使用して)マウスを暖かく保つことも役立ちます。- OCTイメージングシステムの電源を入れた後、正しいイメージングレンズを固定し、必要に応じて基準アームの位置を調整します。
- イメージングソフトウェアを開き、一意のマウスIDを作成して、OCTメーカーのプロトコルに従ってイメージングを開始します。
- 高速スキャンプロトコルで フリーラン オプションを使用して、視神経を後房画像の中心に置くか、角膜の頂点を前房画像に配置します。
注: 表1 には、市販の2つの小動物イメージングシステムのイメージングプロトコルパラメータが含まれています。製品仕様については、材料表 を参照してください。 - 後房イメージングの場合は、OCTを目の表面に近づけます。レンズの表面を目に接触させないように注意してください。
- 目が正しく配置されたら、高速スキャンを停止してボリュームスキャンプロトコルを選択し、[ 照準 ]オプションでスキャンをアクティブにします。
- 後部セグメント画像の場合は、視神経が水平B-スキャンアライメント画像の中心にくるように調整し、網膜が垂直アライメント軸に整列するように調整します。
- 前眼部画像の場合は、水平B-スキャンアライメント画像と垂直アライメントB-スキャンアライメント画像の両方で角膜の頂点を中央に配置する位置を調整します。両方の画像に反射アーティファクトが存在すると、適切な位置合わせが確認されます。次に、反射アーティファクトを取り除くのに十分なほど水平画像をシフトします。 図2を参照してください。
- [ スナップショット ]をクリックしてボリュームスキャンイメージをキャプチャし、[ 保存]をクリックします。
- 次に、平均化された中心線スキャンを取得します。スキャンプロトコルを開き、[ 目的 ]、[ スナップショット]の順にクリックします。同じパネルを右クリックし、[ 平均]をクリックします。
- 両方のレンズで各目に対して手順5.2.1〜5.2.9を繰り返します。
- すべての画像が収集されたら、マウスをカセットから取り外し、手順4.3.11〜4.3.13にリストされているように、回復中に角膜を保護します。
6.OCTによる炎症のスコアリング
- 治療条件にマスクされている採点者の助けを借りてOCT画像をスコアリングします。
注: マウス モデルの PMU では、 表 2 に示すスコアリング システムをお勧めします。 - 前房(AC)と後房(PC)の両方の画像が得られた場合は、これらのスコアを組み合わせて、各眼の最終スコアを取得します。
注:前房の炎症は、後房の炎症の前に解消します。
7.死後組織学による炎症のスコアリング
- 実験の最後に、除核によって個々の眼を採取し、4%ホルムアルデヒドで一晩固定し、パラフィン包埋、切片化、およびH&E染色に進みます33。
注:瞳孔視神経軸に沿った複数の4〜8μmセクションが推奨されます。
注:表3に記載されているスコアリングシステムを使用して、マスクされたグレーダーによって片目の3つのセクションがスコアリングされ、 3つのセクションの平均スコアが最終的な組織学的炎症スコアとして報告されます。
結果
このプロトコルは、プライミングされたマイコバクテリアブドウ膜炎モデル(PMU)を使用してマウスにおけるブドウ膜炎の誘発を実証します。皮下注射の一貫性と硝子体内注射の精度を確保することは、プライミングされたマイコバクテリアブドウ膜炎モデル(PMU)を開発する上で重要なステップです。 図1 は、定位固定装置を用いたマウス硝子体内注射手順を示す。イヤーバーは、顕微鏡下で頭を同じ場所にそっと配置するのに役立ちます(図1E)。また、硝子体内注射の手順中に頭を安定させ、注射外傷のリスクを減らします。注入が成功すると、注射液中のフルオレセインは、図 1Fに示すように、顕微鏡または側面図から見ることができる目の内側から緑がかった反射を生成します。
概説どおりに実行すると、プロトコルは堅牢な急性ブドウ膜炎を生成し、硝子体内注射後10時間でOCTおよび眼底イメージングを使用して検出できます。図2は、OCTイメージングのための目の正しい位置合わせを示しています。表 1A に、OCT プロトコルで使用されるパラメータを示します。画像を取得するための体系的なアプローチは、時間の経過とともに比較できる高品質の画像を提供します。前房画像は、虹彩を水平面と垂直面の両方に平行に整列させた虹彩(図2B、C)を使用して角膜の頂点を中心にしています。ボリュームスキャンとラインスキャンは、下位領域と上位領域を同時に表示できるように垂直方向の位置合わせでキャプチャされます。後部セグメント画像は、顔のSLO画像を使用して視神経を中心に配置され(図2D)、RPEの明るいバンドを使用して、網膜を水平面と垂直面の両方に平行に整列させます(図2E、F)。
図3は、OCTイメージングを用いたPMU眼炎症の典型的な所見を示す。硝子体内注射の24時間後に、水性および硝子体に炎症細胞が見られる(図3B)。中等度または重度の炎症の存在下では、ACの下角に低血圧が見られます。眼の炎症の程度は、 表2に列挙された基準を用いてこれらのOCT画像上でスコアリングすることができる。各スコアに典型的な炎症性特徴を示す画像の代表例を 図4に示す。ACチャンバースコアとPCチャンバースコアを加算して、組み合わせたOCTスコアを生成できます。合計スコア>0、≤2.5は軽度の炎症を表します。中等度の炎症はスコア>2.5ですが≤4.5です。スコア>4.5は重度の炎症を識別します。炎症は通常、硝子体内注射の48時間後にピークに達し、ACおよびPCのOCTスコアは1〜3です(合計スコアは2〜6)。.0.5または4のACおよびPCスコアはあまり一般的ではありません。典型的な範囲外のスコアが頻繁に発生する場合は、外れ値スコアに寄与する要因を特定するためにトラブルシューティングが必要になる場合があります(ディスカッションセクションを参照)。前房の炎症スコアは、硝子体内注射後1週間以内にゼロに戻る傾向があります。対照的に、事後スコアはゼロに戻りません。代わりに、低レベルの慢性炎症は硝子体炎の形で持続し、血管周囲リンパ球は硝子体内注射後1〜2か月間網膜に浸潤します。
PMUにおける炎症スコアは、組織学を用いて決定することもできる。 図5 は、組織学によるPMUの重症度をスコアリングする際に使用する代表的なH&E切片を示す。水性および硝子体中の炎症細胞の数を計数し、 表3に列挙したスコア基準を用いて重症度を決定するために使用した。毛様体の炎症性細胞浸潤は、軽度または中等度の炎症において組織学的切片の片側によく見られる(片側性の関与)。炎症がひどい場合、これは水晶体の両側の毛様体に浸潤する炎症細胞の存在によって反映されます(両側性関与と呼ばれます)。硝子体内注射後の後の時点で、血管周囲および網膜内白血球および網膜外側のひだの存在を含む慢性炎症症状も特定することができる。組織学は、不十分な注射技術の影響を受けた目を特定するのにも役立ちます。硝子体内注射中の水晶体への外傷は、外傷領域に隣接する水晶体嚢の外側にアモルファスエオジン染色された(ピンク色の)水晶体タンパク質の存在によって識別することができる。硝子体内mTBの結膜下腔への逆流は、切片に存在する眼周囲構造を注意深く検討することによって識別できる眼の外側の炎症を引き起こす。mTB抽出物を目内に保持できないため、これらの目は通常、炎症のOCTスコアが低くなります。
明視野眼底イメージングは、低血圧、硝子体炎、網膜または血管周囲の炎症性細胞浸潤の発症など、PMUの臨床的に関連する側面を特定するためにも使用できます。 図6 は、眼底画像に網膜および血管周囲の炎症が見られる2つの例を示しています。これらの2つの目は、PMUモデルで一般的な炎症の範囲も示しています。 表1B は、眼底/網膜OCTイメージングシステムで使用されるパラメータをリストしています。重度の炎症が画質に与える影響(図6、2日目、一番上の行のOCTおよび眼底画像)と21日目に存在する疾患の程度に注意してください。角膜浮腫はまた、急性炎症中の画質を低下させる可能性があります。しかし、角膜浮腫は炎症のみで重症になることはまれです。より一般的には、画像化および麻酔イベント中の不完全な表面保護に起因する上皮損傷によって画質が低下します。
PMUモデルは、任意のマウスの品種または遺伝子型においてブドウ膜炎を誘発するために使用することができる。アルビノの眼では、OCTを使用して炎症をスコアリングできますが、眼底色素がないため、明視野イメージングによる炎症の視覚化は困難です13,34。死後の研究は、眼組織、所属リンパ節、または脾臓に対して行うことができます。いくつかの例には、フローサイトメトリーや免疫組織化学などの免疫細胞の存在に関するアッセイ、および炎症性サイトカインの測定が含まれます。PMUによる炎症の開始後(1日目から56日目)に試験されたすべての時点で、マルチパラメータフロー分析によって眼内の多くの主要な白血球集団を検出するのに十分なCD45+炎症細胞が個々の眼に存在する12,35。水性(2-5μL)および硝子体(5-10μL)の体液は、タンパク質濃度の決定、プロテオミクス研究、またはサイトカイン濃度の決定のために炎症を起こした眼から収集することができる36。

図1:マウス硝子体内注射のセットアップ。硝子体内注射は、(A)マイクロポンプに接続されたマイクロシリンジポンプコントローラーおよび(C)注射シリンジを使用してマウス眼に対して行われる。シリンジはロードされ、(D)マイクロポンプに取り付けられます。マウスヘッドは、硝子体内注射手順中の安定性と一貫性を確保するために、(E)イヤーバーを使用して配置されます。(F)注射液中のフルオレセインは、手順が成功した後、目の内側から緑がかった反射を生成します。この図の拡大版を表示するには、ここをクリックしてください。
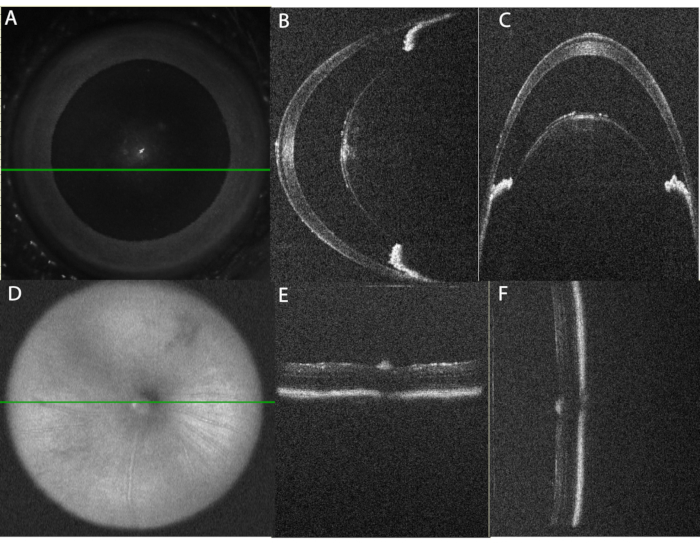
図2:OCTイメージングのための目の適切な位置合わせ 。 (A)エンフェイススキャンレーザー検眼鏡(SLO)画像を使用して、眼を前房イメージングの中心に配置します。緑の線は、パネル(B)に示す水平線スキャンの位置を示す。中心角膜は反射アーチファクトを減少させるために回避されることに注意してください。(C)傍中心前房を通る垂直B-スキャン。このスキャンは、水平スキャンから90°で取得されます。レンズの両側の虹彩セクションの位置合わせは、水平スキャン(パネルB)では水平であり、垂直スキャン(パネルC)では上下に配置されていることに注意してください。(D)SLO画像を用いて、後房像は視神経を中心にする。(e)水平B-スキャンアライメント、(f)垂直B-スキャンアライメント。 この図の拡大版を表示するには、ここをクリックしてください。
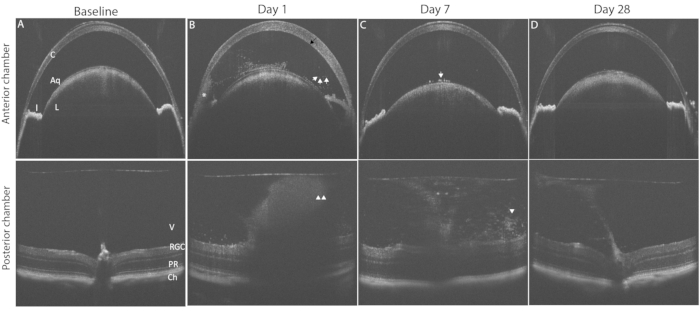
図3:PMUの誘導は、縦方向のOCTイメージングによって監視できる汎ブドウ膜炎を生成します。 一番上の行は前房(AC)を示しています。下の行は、疾患経過の病理学的変化を強調するための後房(PC)OCT画像を示しています。(a)ブドウ膜炎誘発前のAC(上)およびPC(下)のベースラインOCT画像は、いずれもスコア0.(B)硝子体内注射後1日目に角膜浮腫(黒矢印)、ACにおける腹賊下垂(*)多発性浮遊炎症細胞(白矢印)、およびPCにおける硝子体炎(白矢印)の存在を示す。(C)硝子体内注射後7日目、前水晶体嚢にAC細胞がほとんどなく(白い矢印)、硝子体炎が減少した(白い矢印)。(D)硝子体内注射後28日目 AC炎症と軽度の硝子体炎が解消した前房。略語:C-角膜、L-水晶体、I-虹彩、Aq-水性、硝子体V、RGC-網膜神経節細胞、PR-光受容体、Ch-脈絡膜。 この図の拡大版を表示するには、ここをクリックしてください。

図4:OCTスコアの例。0〜4のOCTスコアは、表2に示すカテゴリシステムを使用して、各AC画像とPC画像に割り当てられます。ACスコアとPCスコアが組み合わされて、目の最終的なOCTスコアになります。(A,D)スコアが 0 の例。(B,E)0.5 のスコアの例。(C,F)スコア 1 の例。(G,J)スコア 2 の例。(H,K)スコア 3 の例。(I,L)4のスコアの例をパネルIおよびLに示す。この図の拡大版を表示するには、ここをクリックしてください。
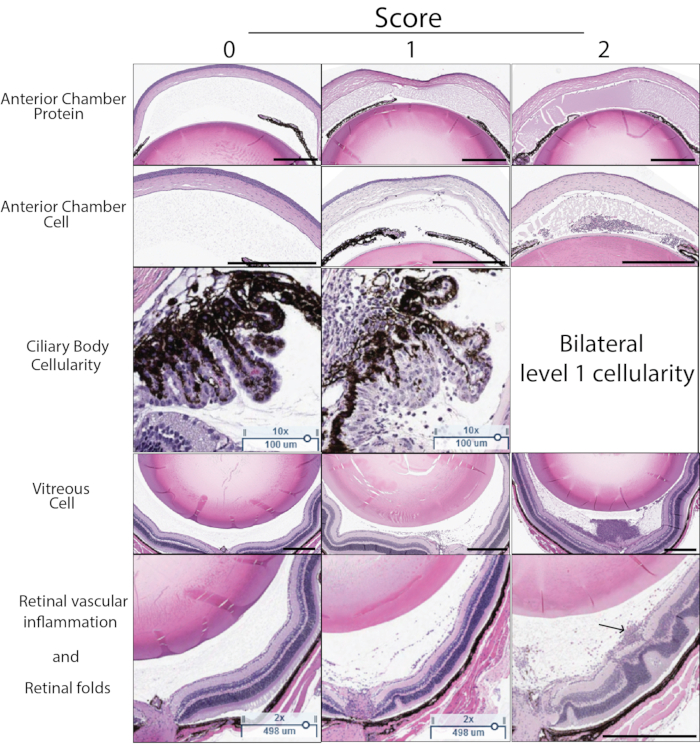
図5:組織学スコアの例。 組織学スコアは、H&Eセクションで見られる5つの特徴、すなわち前房タンパク質密度、前房細胞数、毛様体の免疫細胞浸潤、硝子体細胞密度、網膜血管炎症、および網膜構造変化に基づいて決定されます。各特性に0-2のスコアが割り当てられます。各スコアの説明を 表3に示します。各特性の0〜2の代表的なスコア例をこの図に示します。左側の列は、スコアが 0 であることを示しています。中央の列は、スコア 1 の例を示しています。右側の列は、スコア 2 の例を示しています。毛様体スコアのスコア2は、同じセクションの水晶体の両側の毛様体が細胞の炎症を示す場合に割り当てられます。最終的な組織学スコアは、5つの基準のそれぞれのスコアの合計です(最大スコア10)。右下パネルの矢印は、網膜表在血管に関連する血管周囲白血球を示す。黒いスケールバーは500μmを示します。毛様体スケールバーは100μmを示します。 この図の拡大版を表示するには、ここをクリックしてください。
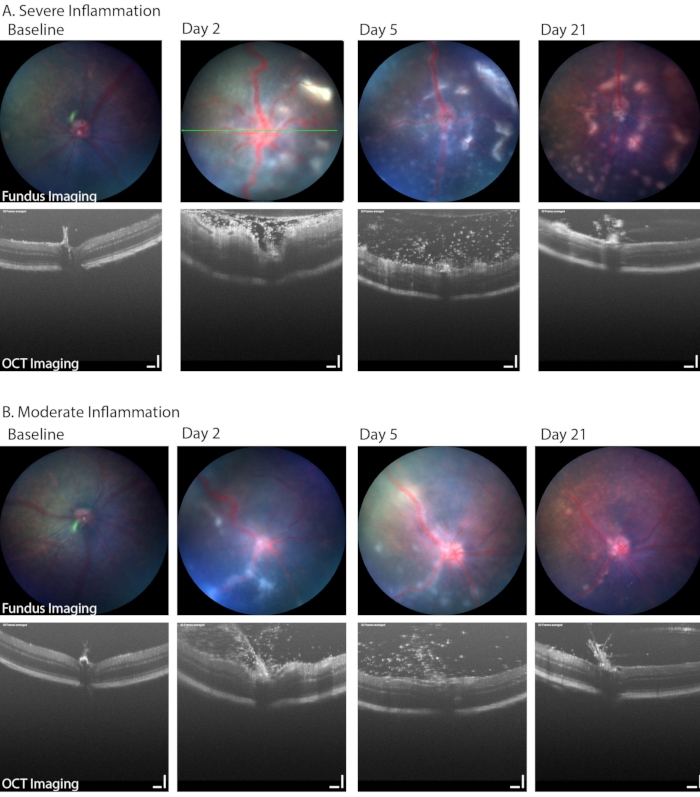
図6:PMUにおける縦断的眼底イメージングは、疾患の重症度の範囲を特定 した。 (A)重度の炎症を起こした眼は、2日目のカラー眼底イメージング(上段)で網膜に複数の白い浸潤と血管の曲がり、OCT(下段)で高密度の硝子体炎と網膜浮腫を示します。網膜病変の数の進行は、硝子体炎が改善する間、時間の経過とともに見ることができます。緑の線はOCT画像の位置を示す。(B)軽度の炎症を起こした眼は、眼底の離散的な線状病変が少なくなり、硝子体腔に多くの浸潤細胞を示します。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
| ある | |||
| マウス前房 | 高速スキャン | ボリュームスキャン | リニアスキャン |
| 長さ X 幅 | 4.0 ミリメートル x 4.0 ミリメートル | 3.6 ミリメートル X 3.6 ミリメートル | 3.6 ミリ |
| 角 | 0 | 90 | 90 |
| A-スキャン/B-スキャン | 800 | 1000 | 1000 |
| # B-スキャン | 50 | 400 | 1 |
| フレーム/B-スキャン | 1 | 3 | 20 |
| マウス後房 | 高速スキャン | ボリュームスキャン | リニアスキャン |
| 長さ X 幅 | 1.6 ミリメートル X 1.6 ミリメートル | 1.6 ミリメートル X 1.6 ミリメートル | 1.6 ミリ |
| 角 | 0 | 0 | 0 |
| A-スキャン/B-スキャン | 800 | 1000 | 1000 |
| # B-スキャン | 50 | 200 | 1 |
| フレーム/B-スキャン | 1 | 3 | 20 |
| B | |||
| マウス後房 | ボリュームスキャン | リニアスキャン | |
| 長さ X 幅 | 0.9 ミリメートル x 0.9 ミリメートル | 1.8 ミリ | |
| 角 | 0 | 任意 (通常は 0 または 90) | |
| A-スキャン/B-スキャン | 1024 | 1024 | |
| # B-スキャン | 512 | 1 | |
| フレーム/B-スキャン | 1 | 30 |
表1:スキャンパラメータ。 (A) OCT スキャン パラメータ。(B)眼底/網膜OCTスキャンパラメータ
| OCT スコアの説明 | ||||||
| スコア | 前房 | 後房 | ||||
| 該当なし | 角膜前部を超えて見えない | 後部セグメントのビューなし | ||||
| 0 | 炎症なし | 炎症なし | ||||
| 0.5 | 水性の1〜5個の細胞 | 硝子体領域の10%未満を占める細胞はほとんどありません | ||||
| または角膜浮腫 | 網膜下または網膜内浸潤または網膜構造の破壊なし | |||||
| 1 | 水性の6〜20個の細胞 | 硝子体の10〜50%を占めるびまん性細胞(密な塊なし)。 | ||||
| または前水晶体嚢上の細胞の単層 | 網膜下または網膜内浸潤または網膜構造の破壊なし | |||||
| 2 | 水性中の20〜100個の細胞 | 硝子体領域の>50%を占めるびまん性細胞(密な塊なし) | ||||
| または20未満の細胞と低血圧が存在する | 網膜下または網膜内浸潤または網膜構造の破壊なし | |||||
| 3 | 水性中の20〜100個の細胞 | グレード2および1に等しいびまん性細胞 | ||||
| そして 低血圧 または瞳孔膜 | そして 硝子体領域の10%〜20%を占める少なくとも1つの密な硝子体混濁 またはグレード2に等しい硝子体細胞の存在 まれな(≤2)網膜下または網膜下混濁 | |||||
| 4 | 任意の数の水性細胞 | 硝子体領域の>20%を占める密な硝子体混濁。 | ||||
| そして 大きな低血圧および瞳孔膜 または 重度の炎症による前部構造の喪失 | または大きな網膜下または網膜内混濁を有するびまん性硝子体細胞 | |||||
表 2: PMU OCT スコア基準: OCT 画像は、表に記載されている基準に従ってスコアリングされます。ACスコアとPCスコアを加算して、目の最終スコアを取得します。眼の鮮明な視野が得られなかった場合、画像にNAのスコアが割り当てられ、これらは研究から除外されました。
| 組織学スコアの説明 | |||
| 特性 | 0 | 1 | 2 |
| 前房(AC)タンパク質 | AC中のエオジンによるわずかな無細胞粒子染色 | ACのどこかで中等度の、しかしコンフルエントではない細胞外エオジン染色 | AC全体にわたるコンフルエントまたはコンフルエントに近い細胞外エオジン染色 |
| 前房(AC)細胞 | セルなし | 1〜100個の細胞ですが、細胞の密集した凝集はありません | >100個の細胞、または細胞の密集した凝集体 |
| 毛様体炎症 | 毛様体または周囲の硝子体への白血球浸潤なし | 毛様体および/または周囲の硝子体に浸潤する白血球の片側性の存在。 | 毛様体および/または周囲の硝子体に浸潤する白血球の両側性の存在。 |
| 網膜血管炎症 | 血管周囲白血球を有する網膜血管がない | 血管周囲白血球を有する切片につき1本の血管 | 血管周囲白血球を有する切片あたり>1血管 |
| 網膜のひだまたは損傷 | 網膜損傷なし | セクションごとに1〜3個の網膜のひだ | 切片あたり>3本の網膜襞、またはその他の網膜層の破壊または網膜内出血 |
表3:PMU組織学スコア基準: 眼のH&E切片は、表に記載されている基準に基づいて採点した。同じ眼からの3つの切片をスコアリングし、平均して、眼の最終的な組織学スコアを得た。
ディスカッション
ブドウ膜炎の動物モデルは、眼の炎症と恒常性のメカニズムを理解し、ブドウ膜炎患者の医学的および外科的治療の前臨床評価を可能にするのに役立ちました37。PMUモデルのウサギとラットの両方のバリアントは、概念実証研究38、39、40を通じて前臨床治療におけるその価値を実証しています。マウスには多様なトランスジェニック株が利用できるため、マウスPMUモデルシステムを確立することで、この病気の病態に寄与する特定の細胞型、経路、および遺伝子を特定するためのより詳細な機構研究が可能になりました。
ブドウ膜炎の動物モデルは、炎症の発生率と強度における動物間の変動性を示すことができます41。C57BL/6マウス系統では、ここで概説したプロトコルを使用してPMUを確実に生成します。ブドウ膜炎の経過と強度の株特異的な変動は、EAUとEIUの両方で報告されています42,43。.PMUの重症度と経過に対する株特異的な影響は実験的に測定されていませんが、このモデルは野生型C57BL / 6Jおよびアルビノマウス(B6(Cg)-Tyrc-2J / J)で使用され、同様の炎症反応を引き起こしました。PMUモデルを生成する際に、以下にリストされている考慮事項を制御することは、新しい研究者が変動性を制限し、最も一貫性があり再現性のあるブドウ膜炎を生成するのに役立ちます。
皮下注射の一貫性を確保します。
一貫した皮下注射を提供するには、すべての気泡がエマルジョンから除去されていることを確認してください。考慮事項には、シリンジをロードする前に、事前に作成されたエマルジョンの短い遠心分離機(400 x gで30秒)が含まれます。これにより、エマルジョンに閉じ込められた空気が除去されます。また、シリンジを装填するときは、定期的に反転(チップアップ)して軽くたたいて気泡を取り除きます。注射中は、筋肉内注射を避けるために注射器を深く入れすぎないでください。逆に、浅い(皮内)注射は、皮膚を通してエマルジョンの侵食をもたらし得る。濃厚な粘性エマルジョンを完全に注入し、皮膚からの逆流を防ぐために、注射部位から注射器を取り外す前に少し一時停止することを忘れないでください。
皮下注射をしてから7日後に、後肢の両側に触知可能な結節の存在を確認します。結節が特定できない場合は、エマルジョンではなく空気が注入された可能性があります。この場合、急性炎症はそれほど堅牢ではない可能性があり、慢性炎症は発症しない可能性があります。
感染性眼内炎の発症を予防する:
細菌性または真菌性眼内炎は、予防されない場合、交絡変数を生成します44。細菌性眼内炎を予防するために、硝子体内懸濁液を作るときは、常に優れた無菌技術を実践し、目に触れるすべての再利用可能なツールを取り扱い、洗浄してください。滅菌済みの使い捨てアイテムの使用、オートクレーブ、または95%アルコール洗浄またはワイプによる洗浄が重要です。眼の表面、まぶた、および眼周囲の毛皮に適用されるベタジンの適切な使用も、眼内炎の予防に役立ちます45。注射後の経過中に眼の構造が極度の炎症によって消滅するため、感染のある目を認識するのは簡単です。これはPMUでは一般的ではありません。眼内出血の存在はまた、眼内炎または注射による外傷を示唆し得る。そのような場合は、これらの動物を研究から除外してください。
硝子体内注射の一貫性を確保します。
硝子体内注射は、PMUにおける信頼性が高く再現性のある炎症の誘発における重要なステップです。各注射で一定量のMtb懸濁液を提供すること、外傷を回避すること、および懸濁液の逆流を防ぐことはすべて、注射を行う際に考慮すべき要素です。一貫した懸濁液を確保するために、解凍時およびシリンジに装填する前に、ストック懸濁液を完全にボルテックスします。使用されるこのMtb抽出物は溶液を形成しないため、懸濁液は時間の経過とともに沈降する可能性があります。各注射でMtb抽出物の濃度を均一にするには、装填後15分以内にシリンジを使用または排出してリロードします。フェニレフリンは、後眼に広い視野を提供し、注射中の眼への外傷のリスクを低減するために拡張に使用されます。この落下は、自然な蓋の収縮と地球のわずかなプロトーシスを生成し、鉗子で目をつかむ必要なしに、辺縁の後方1〜2 mmの領域を良好に視覚化できます。鉗子を使用して眼を拘束すると、潜在的な外傷を引き起こし、眼圧を一時的に上昇させ、Mtb懸濁液の逆流のリスクを高める可能性があります。外傷は、目に過度の量を注入しようとすることによっても引き起こされる可能性があります。眼圧の有意かつ長期にわたる上昇および眼への外傷を防ぐために、注入量は2μLに制限されている。さらに、若い動物は成体マウスよりも小さい目を持っています。典型的には、6〜8週間のマウス(20〜25g)は、均一な眼球サイズを提供し、Mtb注射後の炎症のより大きな一貫性を確保する。マイコバクテリア懸濁液の注射後逆流のより高い頻度が、より小さなマウスで観察された。これは、順番に、予想よりも少ない急性炎症につながります。希フルオレセイン溶液は、初心者のインジェクターに注入技術の成功に関する視覚的なフィードバックを提供するために使用されます。注射時の拡張は、硝子体腔内の注入された物質の直接視覚化を可能にし、水晶体外傷の証拠に注意する機会を与える。水晶体外傷の場合、水晶体の透明度が変化し、OCTで視覚化できる白内障を引き起こす可能性があります。眼の外傷の場合、水晶体誘発性ブドウ膜炎の可能性があるため、眼を研究から除外する必要があります46。Mtb懸濁液を眼内に分散させ、逆流を減少させるために、注射器を眼から取り外す前に10秒間一時停止することをお勧めします。
PMUモデルは、硝子体内注射におけるMtbの濃度を変えることによって急性炎症の強度を変えるように修正することができる。2.5 μg/μLから15 μg/μLまでのさまざまな投与量が、私たちのラボで以前にテストされています。しかし、10 μg / μLを超える用量は、自発的な水晶体破裂、重度の角膜浮腫と瘢痕化、および催眠症を含む重度の眼の損傷を引き起こすことが判明しました。.この程度の重症度は、感染後のブドウ膜炎を有するヒト患者では典型的ではないため、これらの濃度は推奨されない。5 μg / μLの用量は、軽度から中等度の急性炎症および軽度の慢性ブドウ膜炎を確実に引き起こすことがわかりました。10μg/μLの用量は、確実に中等度から重度の急性疾患およびより顕著な慢性疾患を引き起こす。したがって、硝子体内濃度を変化させることは、実験的質問に基づいて必要に応じて使用するための代替疾患重症度を提供することができる。結果がmTBへの反応によるものであり、皮下または硝子体内注射に関連する外傷ではないことを確認するために、コントロールを選択する必要があります。.偽注射コントロールでは、mTB抽出物の代わりにPBSを使用できます。曝露されていない動物と比較するために、真のナイーブサンプルは、仲間の目が常に同等であるとは限らないため、考慮する必要があります。
マウスの眼のサイズが小さいため、OCTは、直接可視化や顕微鏡明視野写真よりも前房の炎症を検出するためのより感度の高いアッセイになります。ラット25のPMUを用いた以前の研究では、OCTよりも組織学によってより多くの細胞を検出できるが、2つのモダリティの間には良好な相関関係があることが判明した。OCTには、同じ動物における炎症を縦方向にモニターするために使用できるという追加の利点があります。EAUやEIUなどの他の主要なブドウ膜炎モデルも、定量分析にOCTを採用しています12、47、48。マウスのPMUモデルでは、前房細胞はOCTでのみ見え、大きな低血圧が存在しない限り臨床検査では見ることができません。硝子体炎症(硝子体炎)はカラー眼底イメージングで観察できますが、定量的変化の検出はOCTイメージングでのみ可能です。網膜血管の炎症や網膜の損傷など、モデルの他の側面は、OCTと顕微鏡明視野眼底写真のいずれかで簡単に識別できます。
OCTを使用する場合、炎症の程度の地域差によって局所イメージングがどのように影響を受けるかを考慮することが重要です。以前の報告では、ヒトの前房内の細胞の分布が不均一であり、より多くの細胞が劣っていることが確認されています49。マウスでは、同様の素因が一般的です。したがって、ACを介した垂直または放射状のスキャンは、炎症の範囲をキャプチャする画像を確保するのに役立ちます。さらに、同じ場所でイメージングを実行すると、同じ目で縦方向に収集された画像にも一貫性が保たれます。目の同じ部分で画像を取得するには、安定したランドマークと体系的なアプローチを使用します。前房画像の場合、画像は角膜の頂点のすぐ隣の中心にあり、下角で低血圧の存在を検出できるように垂直に向けられています。後部セグメント画像の場合、画像は視神経を中心にしています。地域変動を確実にキャプチャするために、スコアリングに少なくとも3つのラインスキャンを使用することを検討することをお勧めします。炎症が末梢の場所に限定されている場合は、ボリュームスキャンを取得すると便利です。ボリュームスキャンの収集は、地域の変動をキャプチャするのにも役立ちますが、データストレージ要件が増加します。
PMUマウスモデルにおける炎症を特徴付けるために使用することができる他のインビボアッセイには、生物発光イメージングが含まれる13、35。マルチパラメータフローサイトメトリー分析のような死後アッセイを実施して、眼の水腔および後房に浸潤する免疫細胞型集団を同定および定量することができる12,26。PMUモデルでは、急性炎症は、好中球浸潤が優勢な自然応答と、それに続く慢性で持続的な適応T細胞優性応答が1か月以上持続することを特徴とします35。死後組織に対して実施することができる免疫機能の他のアッセイには、眼液サイトカイン分析が含まれる。さらに、mRNAシーケンシングや免疫蛍光イメージングなどの他のダウンストリームアッセイを使用して、ブドウ膜炎における網膜免疫細胞集団の遺伝子およびタンパク質発現パターンを評価することができます50,51。
PMUモデルは、異なる種に適した適応を使用して、他のげっ歯類システムで複製することができます。PMUモデルは、以前にラットおよびウサギで使用されてきた38、39、40。ラットでは、急性汎ブドウ膜炎は硝子体内注射後に発症し、組織学による慢性炎症の兆候を発症することなく14日間で自然に解消します24。ウサギでは、ブドウ膜炎の誘発は硝子体内注射の前に2ラウンドの皮下注射を利用しますが、強力な汎ブドウ膜炎も生成します。マウスモデルを使用する利点の1つは、ブドウ膜炎の基本的なメカニズムを理解するのに役立つ多数のトランスジェニックおよびノックアウト株がすぐに利用できることです52。すべてのげっ歯類モデルは、薬剤が全身または局所ドロップとして投与される場合、前臨床療法試験に使用できます。.ただし、サイズが大きいため、ラットとウサギの目は、ブドウ膜炎の埋め込み型または局所注射治療オプションの前臨床試験で使用するためのより良いモデルです。
要約すると、このプロトコルは、眼抗原による事前免疫に依存しない新しいツールを使用して、慢性眼の炎症のメカニズムを研究することに関心のある研究者を提供します。
開示事項
著者らは、開示すべき金銭的対立はない。
謝辞
この研究は、米国メリーランド州ベセスダの国立衛生研究所(KP)K08EY0123998、(KP)R01EY030431、(KP)R21 EY02939、UWビジョン研究コア助成金(NEI P30EY01730)、マークデイリー、MD研究基金、クリストファーアンドアリダレイサム研究基金からの贈り物、失明予防研究からの無制限の部門助成金、および失明予防研究(KP)からのキャリア開発賞。ブリストルで実施された作業は、サイトリサーチUKとアンダーウッドトラストからの追加資金提供によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| AK-FLUOR | Akorn Pharmaceuticals, IL, USA | 10% Fluorescein sodium 100 mg/mL in 5 mL vial | |
| AnaSed | Akorn Animal Health, IL, USA | NDC 59399-110-20 | Xylazine 20 mg/mL |
| Betadine 5% Sterile Ophthalmic Prep Solution | Alcon, TX, USA | 8007-1 | |
| B-D Precision Glide Needles -25 G | Becton, Dickinson and Company, NJ, USA | 305122 | |
| B-D Precision Glide needle -30-G | Becton, Dickinson and Company, NJ, USA | 305106 | |
| Bond MAX, Bond Rx | Leica Biosystems, IL,USA | Automated IHC staining system | |
| Chloramphenicol ointment | Martindale Pharma, Romford, UK | 1% w/w Chloramphenicol | |
| EG1150H | Leica Biosystems, IL,USA | Tissue Embedding | |
| Envisu R2300 | Bioptigen/Leica | OCT Machine | |
| Freund's Incomplete Adjuvant | BD Difco, NJ, USA | 263910 | |
| GenTeal lubricant eye ointment | Alcon, TX, USA | --- | |
| GenTeal lubricant eye gel | Alcon, TX, USA | --- | |
| H37Ra lyophilized Mycobacteria extract | BD Difco, NJ, USA | 231141 | |
| Hamilton RN Needle (33/12/2)S | Hamilton, Reno, NV | 7803-05(33/12/2) | 33 G |
| Hamilton syringe | Hamilton, Reno, NV | CAL7633-01 | 5 µL |
| Insulin needle | Exel International, USA | 26029 | 1 mL |
| Isoflurane | |||
| Ketaset | Zoetis, USA | 377341 | Ketamine HCL 100 mg/mL |
| Microinjection Syringe Pump and Micro4Controller | World Precision Instruments, FL, USA | UMP3 | |
| Micron IV | Phoenix Research Laboratories, Pleasanton, CA | Alternative Imaging/OCT Machine | |
| Nanofil 10 µL syringe | World Precision Instruments, FL, USA | NANOFIL | |
| Nanofil Intraocular Injection Kit | World Precision Instruments, FL, USA | IO-KIT | |
| Olympus SZX10 | Olympus | Dissection scope | |
| PBS | Gibco | 14190 | |
| Phenylephrine Hydrochloride Ophthalmic Solution USP 2.5% Sterile 15 mL | Akorn Pharmaceuticals, IL, USA | 17478020115 | |
| RM2255 | Leica Biosystems, IL,USA | Tissue Sectioning | |
| TB Syringe | Becton, Dickinson and Company, NJ, USA | 309602 | 1 mL |
| Tetracaine 0.5% | Alcon, TX, USA | 1041544 | |
| Tissue Tek VIP series | Sakura Finetek USA, Inc.,CA. | Histology Tissue Processing | |
| Tropicamide 1% | Chauvin Pharmaceuticals, Romford, UK | Minims | |
| Tylenol | Johnson & Johnson Consumer Inc, PA, USA | NDC 50580-614-01 | Acetaminophen |
| Viscotears | Novartis Pharmaceuticals, Camberley, UK | Carbomer eye gel 0.2% w/w |
参考文献
- American Academy of Ophthalmology. Aao 2019-2020 Basic and Clinical Science Course, Section 09: Uveitis and Ocular Inflammation. American Academy of Ophthalmology. , (2019).
- Caspi, R. R. Animal models of autoimmune and immune-mediated uveitis. Drug Discovery today. Disease Models. 3 (1), 3-9 (2006).
- DeVoss, J., et al. Spontaneous autoimmunity prevented by thymic expression of a single self-antigen. The Journal of Experimental Medicine. 203 (12), 2727-2735 (2006).
- Caspi, R. R., et al. A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. Journal of Immunology. 140 (5), 1490-1495 (1988).
- Tang, J., Zhu, W., Silver, P. B., Su, S. -B., Chan, C. -C., Caspi, R. R. Autoimmune uveitis elicited with antigen-pulsed dendritic cells has a distinct clinical signature and is driven by unique effector mechanisms: Initial encounter with autoantigen defines disease phenotype. The Journal of Immunology. 178 (9), 5578-5587 (2007).
- Broekhuyse, R. M., Kuhlmann, E. D., Winkens, H. J. Experimental melanin-protein induced uveitis (EMIU) is the sole type of uveitis evoked by a diversity of ocular melanin preparations and melanin-derived soluble polypeptides. Japanese Journal of Ophthalmology. 40 (4), 459-468 (1996).
- Pennesi, G., et al. A humanized model of experimental autoimmune uveitis in HLA class II transgenic mice. The Journal of Clinical Investigation. 111 (8), 1171-1180 (2003).
- Caspi, R. R. Understanding autoimmune uveitis through animal models. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 52 (3), 1872-1879 (2011).
- Bansal, S., Barathi, V. A., Iwata, D., Agrawal, R. Experimental autoimmune uveitis and other animal models of uveitis: An update. Indian Journal of Ophthalmology. 63 (3), 211-218 (2015).
- Smith, J. R., Hart, P. H., Williams, K. A. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunology and Cell Biology. 76 (6), 497-512 (1998).
- Rosenbaum, J. T., McDevitt, H. O., Guss, R. B., Egbert, P. R. Endotoxin-induced uveitis in rats as a model for human disease. Nature. 286 (5773), 611-613 (1980).
- Chu, C. J., et al. Multimodal analysis of ocular inflammation using the endotoxin-induced uveitis mouse model. Disease Models & Mechanisms. 9 (4), 473-481 (2016).
- Gutowski, M. B., Wilson, L., Van Gelder, R. N., Pepple, K. L. In vivo bioluminescence imaging for longitudinal monitoring of inflammation in animal models of uveitis. Investigative Ophthalmology & Visual Science. 58 (3), 1521-1528 (2017).
- World Health Organization. Global tuberculosis report 2019. World Health Organization. , (2019).
- Biswas, J., Badrinath, S. S. Ocular morbidity in patients with active systemic tuberculosis. International Ophthalmology. 19 (5), 293-298 (1995).
- Donahue, H. C. Ophthalmologic experience in a tuberculosis sanatorium. American Journal of Ophthalmology. 64 (4), 742-748 (1967).
- El-Asrar, M. A., Abouammoh, M., Al-Mezaine, H. S. Tuberculous uveitis. Middle East African Journal of Ophthalmology. 16 (4), 188-201 (2009).
- Bodaghi, B., et al. Chronic severe uveitis: etiology and visual outcome in 927 patients from a single center. Medicine. 80 (4), 263-270 (2001).
- Cunningham, E. T., Forrester, J. V., Rao, N. A., Zierhut, M. Post-infectious uveitis. Ocular Immunology and Inflammation. 24 (6), 603-606 (2016).
- Wroblewski, K. J., Hidayat, A. A., Neafie, R. C., Rao, N. A., Zapor, M. Ocular tuberculosis: a clinicopathologic and molecular study. Ophthalmology. 118 (4), 772-777 (2011).
- Yeh, S., Sen, H. N., Colyer, M., Zapor, M., Wroblewski, K. Update on ocular tuberculosis. Current Opinion in Ophthalmology. 23 (6), 551-556 (2012).
- Tagirasa, R., Parmar, S., Barik, M. R., Devadas, S., Basu, S. Autoreactive T cells in immunopathogenesis of TB-associated uveitis. Investigative Ophthalmology & Visual Science. 58 (13), 5682-5691 (2017).
- Agrawal, R., et al. Insights into the molecular pathogenesis of ocular tuberculosis. Tuberculosis. 126, 102018(2021).
- Pepple, K. L., et al. Primed mycobacterial uveitis (PMU): Histologic and cytokine characterization of a model of uveitis in rats. Investigative Ophthalmology & Visual Science. 56 (13), 8438-8448 (2015).
- Pepple, K. L., Choi, W. J., Wilson, L., Van Gelder, R. N., Wang, R. K. Quantitative assessment of anterior segment inflammation in a rat model of uveitis using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (8), 3567-3575 (2016).
- Pepple, K. L., Wilson, L., Van Gelder, R. N. Comparison of aqueous and vitreous Lymphocyte populations from two rat models of experimental uveitis. Investigative Ophthalmology & Visual Science. 59 (6), 2504-2511 (2018).
- Basu, S., Elkington, P., Rao, N. A. Pathogenesis of ocular tuberculosis: New observations and future directions. Tuberculosis. 124, 101961(2020).
- Basu, S., Rao, N., Elkington, P. Animal models of ocular tuberculosis: Implications for diagnosis and treatment. Ocular Immunology and Inflammation. , 1-7 (2020).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative Ophthalmology & Visual Science. 53 (6), 2921-2927 (2012).
- Underwood, W., Anthony, R. AVMA guidelines for the euthanasia of animals: 2020 edition. 2013 (30), 2020-2021 (2020).
- Donovan, J., Brown, P., et al. Handling and restraint. Current protocols in immunology. Coligan, J. E., et al. , John Wiley & Sons, Inc. Chapter 1, Unit 1.3 (2006).
- Tremoleda, J. L., Kerton, A., Gsell, W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents: considerations on experimental outcomes and animal welfare. EJNMMI Research. 2 (1), 44(2012).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor protocols. 2014 (6), 655-658 (2014).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- John, S., Rolnick, K., Wilson, L., Wong, S., Van Gelder, R. N., Pepple, K. L. Bioluminescence for in vivo detection of cell-type-specific inflammation in a mouse model of uveitis. Scientific Reports. 10 (1), 11377(2020).
- Fortmann, S. D., Lorenc, V. E., Hackett, S., Campochiaro, P. A. Murine Vitreous Tap (MurViTap): a novel technique to extract uncontaminated mouse vitreous humor, quantify retinal vascular permeability, and compare proteins secreted by diseased and normal retina. Investigative ophthalmology & visual science. 58 (8), 5978(2017).
- Caspi, R. R. Understanding autoimmunity in the eye: from animal models to novel therapies. Discovery Medicine. 17 (93), 155-162 (2014).
- Mruthyunjaya, P., et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Archives of Ophthalmology. 124 (7), 1012-1018 (2006).
- Jaffe, G. J., Yang, C. S., Wang, X. C., Cousins, S. W., Gallemore, R. P., Ashton, P. Intravitreal sustained-release cyclosporine in the treatment of experimental uveitis. Ophthalmology. 105 (1), 46-56 (1998).
- Pepple, K. L., et al. Uveitis therapy with shark variable novel antigen receptor domains targeting tumor necrosis factor alpha or inducible t-cell costimulatory ligand. Translational Vision Science & Technology. 8 (5), 11(2019).
- Mattapallil, M. J., et al. Characterization of a New epitope of IRBP that induces moderate to severe uveoretinitis in mice with H-2b haplotype. Investigative Ophthalmology & Visual Science. 56 (9), 5439-5449 (2015).
- Silver, P. B., Chan, C. C., Wiggert, B., Caspi, R. R. The requirement for pertussis to induce EAU is strain-dependent: B10.RIII, but not B10.A mice, develop EAU and Th1 responses to IRBP without pertussis treatment. Investigative Ophthalmology & Visual Science. 40 (12), 2898-2905 (1999).
- Li, Q., Peng, B., Whitcup, S. M., Jang, S. U., Chan, C. C. Endotoxin induced uveitis in the mouse: susceptibility and genetic control. Experimental Eye Research. 61 (5), 629-632 (1995).
- Astley, R. A., Coburn, P. S., Parkunan, S. M., Callegan, M. C. Modeling intraocular bacterial infections. Progress in Retinal and Eye Research. 54, 30-48 (2016).
- Lau, P. E., Jenkins, K. S., Layton, C. J. Current evidence for the prevention of endophthalmitis in anti-VEGF intravitreal injections. Journal of Ophthalmology. 2018, 8567912(2018).
- Nche, E. N., Amer, R. Lens-induced uveitis: an update. Graefe's Archive for Clinical and Experimental Ophthalmology. 258 (7), 1359-1365 (2020).
- Chu, C. J., et al. Assessment and in vivo scoring of murine experimental autoimmune uveoretinitis using optical coherence tomography. PLoS ONE. 8 (5), 63002(2013).
- Harimoto, K., Ito, M., Karasawa, Y., Sakurai, Y., Takeuchi, M. Evaluation of mouse experimental autoimmune uveoretinitis by spectral domain optical coherence tomography. The British Journal of Ophthalmology. 98 (6), 808-812 (2014).
- Li, Y., Lowder, C., Zhang, X., Huang, D. Anterior chamber cell grading by optical coherence tomography. Investigative Ophthalmology & Visual Science. 54 (1), 258-265 (2013).
- Bell, O. H., et al. Single eye mRNA-seq reveals normalisation of the retinal microglial transcriptome following acute inflammation. Frontiers in Immunology. 10, 3033(2019).
- Lipski, D. A., et al. Retinal endothelial cell phenotypic modifications during experimental autoimmune uveitis: a transcriptomic approach. BMC Ophthalmology. 20 (1), 106(2020).
- Agarwal, R. K., Silver, P. B., Caspi, R. R. Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity. Methods in Molecular Biology (Methods and Protocols). Perl, A. , Humana Press. Totowa, NJ. 443-469 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved