Method Article
ワクチン開発のためのクラ ミジア・ムリダルム 由来の組換え主要外膜タンパク質への無細胞スケール生産とアジュバント添加
* これらの著者は同等に貢献しました
要約
このプロトコルでは、市販の無細胞タンパク質発現キットを使用して、サブユニットワクチンの抗原として使用できるナノディスクに支持された膜タンパク質を産生することを説明しています。
要約
サブユニットワクチンは、安全性、安定性、および標準製造において、従来の不活化または弱毒化全細胞由来ワクチンよりも優れています。効果的なタンパク質ベースのサブユニットワクチンを達成するために、タンパク質抗原はしばしば天然のような立体構造を採用する必要があります。これは、膜結合タンパク質である病原体表面抗原にとって特に重要です。一般にナノディスクとして知られているナノリポタンパク質粒子(NLP)の共翻訳を通じて、正しく折り畳まれた機能的な膜タンパク質を製造するために、無細胞法が首尾よく使用されています。
この戦略は、脂質結合環境で膜タンパク質からなるサブユニットワクチンを製造するために使用できます。ただし、無細胞タンパク質の生産は、多くの場合、小規模(<1 mL)に限定されます。小規模生産工程で生産されるタンパク質の量は、通常、生化学的および生物物理学的研究に十分です。ただし、動物モデルでのワクチン研究に十分なタンパク質を得るために、無細胞プロセスをスケールアップ、最適化、および慎重にテストする必要があります。精製、アジュバント添加、凍結乾燥など、ワクチン製造に関連する他のプロセスは、並行して最適化する必要があります。この論文では、膜結合タンパク質サブユニットワクチンを発現、精製、および製剤化するためのスケールアッププロトコルの開発を報告します。
スケールアップした無細胞反応では、複数のプラスミド発現ベクターを使用する場合のプラスミド濃度と比率の最適化、脂質の選択、およびアジュバント添加により、製剤化されたナノリポタンパク質粒子を高レベルで生産する必要があります。この方法は、クラミジア主要外膜タンパク質(MOMP)の発現でここで実証されていますが、他の膜タンパク質抗原にも広く適用できます。抗原の有効性は、ここで示されているように、抗体産生を測定するための免疫研究を通じて in vivo で評価できます。
概要
タンパク質を無細胞発現させるための原核生物または真核生物ライセートは、目的のタンパク質を合成するための市販製品として容易に入手可能です(完全なレビューについては、 1を参照)。これらの発現系はさまざまなスケールで利用可能であり、 大腸菌、タバコ植物、哺乳類培養物など、さまざまな生物のライセートを利用しています。無細胞ライセートは、使いやすさや堅牢で迅速なタンパク質生産など、従来の組換えタンパク質生産アプローチに比べて複数の利点があります。これらのアプローチは主に可溶性タンパク質の生産に使用されますが、このグループは膜タンパク質を発現するためのアプローチを開拓しました。
この新しいアプローチは、発現のための2つのタンパク質産物、アポリポタンパク質および目的の膜タンパク質をコードするDNAを含むことにより、既存の無細胞発現系にわずかな変更を加える。発現したアポリポタンパク質(ApoA1またはApoE4の誘導体)は、無細胞ライセートに添加された脂質と相互作用して、自発的に(~20 nm)NLPを組み立てます。目的の膜タンパク質と共翻訳すると、NLPと膜タンパク質は可溶性ナノ粒子複合体を形成し、膜タンパク質はNLP脂質二重層内に埋め込まれます。したがって、膜タンパク質は可溶性の離散粒子内に含まれるため、ダウンストリームアプリケーションによりアクセスしやすくなります。このアプローチは、NLP二重層2 内で機能的なオリゴマータンパク質複合体を生成することができ、サブユニットワクチンの抗原成分を生成することができ、その後、親油性アジュバントと混合して、 in vivo 評価に適した共局在抗原およびアジュバントを特徴とするナノ粒子ワクチンを形成することができる。
この現在の方法は、以前に公開されたプロトコル3から変更されています。重要な修飾は、無細胞反応のスケールアップとそれに続くタンパク質-NLP複合体の精製に焦点を当てています。さらなる修飾は、テロデンドリマーとして知られる両親媒性ポリマーの添加を含み、これは、無細胞反応への添加の前に最初に脂質と混合される。テロデンドリマーおよび脂質の存在下でのプラスミドの共翻訳は、テロデンドリマーNLP(tNLP)を生じる。テロデンドリマーの添加はまた、得られるtNLPナノ粒子のサイズおよび単分散性を調節するのを助けます4。このプロトコルは、膜結合サブユニット抗原タンパク質であるクラミジアMOMP5,6を産生するための大規模なワクチン研究に特に最適化されています。この方法は、tNLPに関連する組換えMOMPを生成して、MOMPオリゴマー化を保持する溶解性の高いMOMP-tNLP複合体を形成します。典型的な3 mLのスケールアップ生産では、>1.5 mgの精製MOMPが得られます。無細胞で産生されたMOMP-tNLPは、in vivo免疫原性試験のための迅速なアジュバント添加に適しています。
プロトコル
すべての動物実験は、カリフォルニア大学アーバイン校の公衆衛生サービス(PHS)保証施設で、施設動物管理および使用委員会によって設定されたガイドラインに従って実施されました。
1.ガラス製品の準備
注:動物用のワクチングレードの製剤の製造に使用されるすべての材料は、エンドトキシンを含みません。
- 汚染されたエンドトキシンを破壊するには、バッファーを保持する洗浄ガラス製品を180°Cのオーブンで4時間焼きます。
2. バッファー調製
- 表1に記載のNiアフィニティー精製バッファーを250mL調製します。4°Cで最大6か月間保管してください。
3. 反応準備
- 20 mgの1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(DMPC)をエンドトキシンを含まない1.5 mL遠沈管に計量します。それを1mLのエンドトキシンフリー水に溶解し、プローブ超音波処理を6Aで1分間、1分間、透明になるまで1分間休止させる。13,000 × g で22°Cで2分間遠心分離してプローブから汚染物質金属を除去し、可溶化脂質を新しい1.5 mLエンドトキシンフリーチューブに移します。
- 1 mgのPEG5k-CA8テロデンドライナーを1.5 mLのエンドトキシンフリーチューブに計量します。エンドトキシンを含まない水に20 mg/mLの濃度まで溶解します。完全に溶解するまで渦化し、2 mg/mLに希釈します。
- 新しいエンドトキシンフリーチューブで、210 μLの20 mg/mL DMPC溶液と210 μLの2 mg/mLテロデンドリマー溶液を組み合わせます。
4. サブユニットワクチン製剤のためのMOMP-tNLPの無細胞生産
- 以前に公開されたプロトコルから変更された無細胞法を使用してMOMP-tNLPを調製する5.
- 無細胞反応を開始する2時間前に、原核生物の無細胞タンパク質発現キットを開き、再構成バッファーの1つを解凍します。解凍したら、EDTAフリーのプロテアーゼ阻害剤カクテルを1錠加え、完全に溶かします。
- 5 x 1 mL反応を実行するように設計されたキットを使用して、このプロトコルに従ってください。
注:一般的なスケールアップ生産は3 x 1 mLです。- 1 mLの反応ごとに、525 μLの再構成バッファーを 大腸菌 ライセートボトルに加え、穏やかに転がして溶解します。反応添加剤(ATP、GTPなど)を入れたボトルに250 μLの再構成バッファーを加え、穏やかに転がして溶解します。
- 反応供給ボトルに再構成バッファー8.1 mLを加え、ゴム栓でキャップし(ゴム栓の内側に触れないように注意してください)、静かに反転/転がして溶解します。
- 3 mLの再構成バッファーをアミノ酸混合ボトルに加え、ゴム栓でキャップし、穏やかに反転/転がして溶解します。
注意: ゴム栓の内側には、汚染につながる可能性があるため、触れないように注意してください。 - 1.8 mLの再構成バッファーをメチオニンボトルに加え、穏やかに転がして溶解し、使用するまで氷上で保存します。
- 反応液を調製する。
- 大腸菌ライセートボトルに、225 μLの再構成反応ミックス、270 μLのメチオニンを含まない再構成アミノ酸ミックス、および30 μLの再構成メチオニンを加えます。さらに、DMPC/テロデンドリマー混合物400 μL、MOMPプラスミド15 μg、およびΔ49ApoA1プラスミド0.6 μgを追加します。転がす/軽く振って混ぜます。
注:両方のプラスミドが同じプラスミド骨格から構築されていることを確認してください。渦巻かないでください。 - 全溶液20 μLを取り、GFP発現制御反応のために1.5 mLチューブに入れておきます(下記参照)。
- 大腸菌ライセートボトルに、225 μLの再構成反応ミックス、270 μLのメチオニンを含まない再構成アミノ酸ミックス、および30 μLの再構成メチオニンを加えます。さらに、DMPC/テロデンドリマー混合物400 μL、MOMPプラスミド15 μg、およびΔ49ApoA1プラスミド0.6 μgを追加します。転がす/軽く振って混ぜます。
- 飼料溶液を調製する。フィードミックスボトルに、メチオニンを含まない再構成アミノ酸ミックス2.65 mLと再構成メチオニン300 μLを追加します。転がす/軽く振って溶かします。
注意: この時点で、未使用の再構成バッファーとメチオニンは冷凍庫に戻して保管することができます。 - 無細胞反応キットに設けられた内部反応室に反応液1mLを移し、充填したら密封する。10 mLの供給溶液を反応容器の外室に移し、密閉する。
注意: チャンバーをいっぱいにしないでください!内側の反応室と内側の供給室の両方の上部に気泡が存在すると、反応に悪影響を及ぼします。残りの反応溶液は1.5 mLチューブに入れ、メイン容器と一緒に混合することができます。 - 0.5 μLのGFPコントロールプラスミド(0.5 mg/mL)を、予め分注した20 μLの反応混合物に加えます。
注:多くのキットには、品質管理を目的としたコントロールプラスミドが付属しています。T7プロモーターと 大腸菌 リボソーム結合部位(RBS)を有するほとんどのGFP発現プラスミドもコントロールプラスミドとして用いることができる。 - 反応物を300 rpm、30°Cで最大18時間シェーカーに入れます。反応が成功したことを確認するには、UV光源を使用して、わずか15分のインキュベーション後にコントロールGFP(図1A)の合成による蛍光を確認します。
注:これらの条件、特に温度は、他の膜タンパク質の発現のために最適化する必要があるかもしれません。
5. MOMP-tNLP精製
- 固定化ニッケルアフィニティークロマトグラフィーを使用して、Δ49ApoA1タンパク質上のHisタグを使用して、無細胞反応混合物からMOMP-tNLPナノ粒子複合体を精製します。
- His-Tag 精製樹脂の 50% スラリー 1 mL を使い捨ての 10 mL クロマトグラフィーカラムに移し、3 mL の結合バッファーで平衡化します。
- バッファーを排出し、出口にキャップをして、250 μLの結合バッファーを樹脂に加えます。
- 無細胞反応をカラムに加える前に、後でSDS-PAGEで分析するために20 μLを保存してください。無細胞反応を平衡化樹脂と混合し、実験室のロッカーで4°Cで1時間インキュベートします。
- カラムのキャップを外し、500 μLの追加結合バッファーでキャップを洗浄し、この液体をカラムの残りの部分に加えます。
- 後でSDS-PAGEで分析するために、カラムから液体フロースルーを収集します。
- 20 mM イミダゾールを含む 1 mL の洗浄バッファーでカラムを 6 回洗浄し、画分を収集します。洗濯の合間にレジンが乾かないように注意してください。2回目の洗浄では、1 mLピペットを使用して上下にピペッティングして樹脂を激しく攪拌します。
- MOMP-tNLPを6つの300 μLの溶出バッファー1(250 mMイミダゾールを含む)で溶出し、続いて300 μLの溶出バッファー2(500 mMイミダゾールを含む)で1回溶出します。2回目の溶出では、1 mLピペットを用いて上下にピペッティングして樹脂を激しく撹拌します。
6. SDSページによる分析
注:すべての溶出画分をSDS-PAGEで分析し、目的のタンパク質の量と純度をスクリーニングする必要があります。
- 全ライセートとフロースルーをそれぞれ1 μLロードし、次に収集したすべての洗浄液と溶出画分に対して5 μLをロードします。
- 溶出したMOMP–tNLP、洗浄液、フロースルー液、および全ライセートのアリコートを4x SDS-PAGEサンプルローディングバッファーと混合します。特に明記されていない限り、サンプルを10倍のサンプル還元剤と混合して熱変性させます。
- 1.0 mm、4〜12%のビストリスSDS-PAGEゲルと1x MES-SDSランニングバッファー、および適切な分子量標準を使用したゲル電気泳動により画分を分析します。ゲルを200 Vで35分間実行します。
- 製造元の指示に従ってゲルを染色します。
- カセットからゲルを取り出し、60 mLのゲルステインに入れます。ゲルステインでゲルを30秒間電子レンジで加熱し、容器を30秒間静かに揺り動かして熱を均等に分散させます。染色剤中のゲルをさらに30秒間80〜85°Cに電子レンジで加熱し、ゲルをオービタルシェーカーに置いて5分間揺り動かします。
- ゲルを3回目に電子レンジで30秒間加熱してから、オービタルシェーカーに戻ってさらに23分間揺り動かします。
- ゲルを清潔な容器に移し、100 mLの洗浄液(10%メタノール、7%酢酸)で30分間洗浄します。
注意: 洗浄液の加熱を避けることが不可欠であるため、これは重要なステップです。そうしないと、最終的なゲル画像に背景の汚れや不規則性が生じる可能性があります。 - 洗浄後、ゲルを超純水で5分間2回リンスします。
- ゲルイメージャーを用いてゲルを600 nmで画像化します(図2)。SDS-PAGEを使用して、比較用のタンパク質標準がある場合は、ナノ粒子溶液中の個々のタンパク質の量を定量します。
注:この例では、組換え発現したMOMPの連続希釈はSDS-PAGEによって分解され、バンドの密度は装置ソフトウェアを使用して定量化されます。 - MOMP バンドの密度を使用して検量線を生成します。同じSDS-PAGEゲル上でMOMP-tNLPサンプルを分解し、MOMP標準曲線を使用して粒子のMOMP成分を計算します (図3)。
7.ウェスタンブロットとドットブロットとストレージ
- ウェスタンブロッティングの場合は、SDS-PAGEでサンプルを分離し、メーカーのプロトコルに従った標準設定の市販のドライブロッティングシステムを使用してゲルを転写します。
- 転写が完了したら、ブロットをスタックから取り出し、0.2% Tween 20およびΔ49ApoA1タンパク質由来のHisタグに対する0.5 mg/mL MAb40または0.2 mg/mL MAbHIS抗Hisタグ抗体を含む適切なブロッキングバッファー中で、各ブロットを4°Cで一晩インキュベートします。
注:ブロッティングに使用される抗体希釈液は、MAb40の場合は1:1,000、MAbHIS抗体の場合は1:500〜1,000です。 - 各ブロットをPBS-T(1x PBS、0.2%トゥイーン20、pH 7.4)で5分間3回洗浄します。
- 蛍光色素に結合した二次抗体(IRDyeなど)を含むブロッキングバッファー中で、1:10,000希釈でブロットを1時間インキュベートします。
- ブロットをPBS-Tで5分間3回再洗浄します。蛍光イメージャーを使用して、最終洗浄後のブロットを画像化します。
- 転写が完了したら、ブロットをスタックから取り出し、0.2% Tween 20およびΔ49ApoA1タンパク質由来のHisタグに対する0.5 mg/mL MAb40または0.2 mg/mL MAbHIS抗Hisタグ抗体を含む適切なブロッキングバッファー中で、各ブロットを4°Cで一晩インキュベートします。
- ドットブロットの場合は、精製MOMP-tNLP3 μgおよび空のtNLPをドットブロット装置を用いてブロッティングします。ブロッキングをブロックし、ウェスタンブロッティングについて上記で説明したのと同じ方法を用いて現像します。
8.エンドトキシン評価
- リムルスアメーバ細胞ライセート(LAL)アッセイに基づくエンドトキシン試験システムを使用して、エンドトキシンレベルを定量化します。1 M トリス塩酸塩溶液とエンドトキシンフリー水を使用して、エンドトキシンフリーの25 mM Tris、pH 7.4、サンプルバッファーを調製します。
注:通常、サンプルはこのサンプルバッファーを使用して希釈し、個々のサンプルに適した範囲を見つけるように希釈を調整する必要があります。ここでは、MOMP-tNLPサンプルをサンプルバッファーで500倍に希釈し、25 μLを0.05 EU/mLの感度でデバイスカートリッジの各ウェルにロードします。以下に説明するマウス研究で使用されるMOMP-tNLPおよび空のtNLPのエンドトキシンレベルは、サンプルに応じて0.4〜12 EU / μgタンパク質です。
9.凍結乾燥
- MOMP-tNLPナノ粒子を凍結乾燥し、-20°Cで長期間(最大数年)使用できるように保存します。 凍結乾燥用のtNLPおよびMOMP-tNLP懸濁液を調製するには、凍結および凍結乾燥プロセス中に保護剤としてトレハロースを添加します。
注:このプロセスは、さまざまなtNLP製剤7、8について広く検証されています。 - MOMP-tNLP溶液の現在の容量を9で割って、0.1 Mトレハロースの最終濃度に達するために必要な滅菌エンドトキシンフリーの脱イオン水中の1 Mトレハロースの容量を取得します。最終容量をメモし、必要に応じてエンドトキシンフリーの15 mLまたは50 mLポリプロピレンチューブに分注します。
- 混合溶液をドライアイス上で凍結し、凍結乾燥機を使用して一晩凍結乾燥します。乾燥した製剤を必要になるまで-20°Cで保管してください。
- エンドトキシンフリー水を使用して凍結乾燥tNLPを再構成します。凍結乾燥ケーキが完全に溶解して再水和されるまで静かに転がします。トレハロースを除去するには、3.5 kDaカットオフ透析膜を使用してPBSに対して溶液を透析します。
10.アジュバント添加
注:これらおよび他の同様のNLPベースのサブユニットワクチン製剤は、CpG-ODN1826およびFSL-1などの親油性アジュバントを容易に組み込むことができる。CpG-ODN1826は、5'コレステロール部分(5'-chol-C6)を有する完全なホスホロチオエート骨格を有する修飾クラスBCpGオリゴヌクレオチド(5'-tccatgacgttcctgacgtt-3')です。CpG-ODN1826のtNLPへの結合は、コレステロール部分とtNLPのリン脂質二重層との間の疎水性相互作用によって媒介され、以前に報告されているように実証され、十分に特徴付けられています9,10。
- これらの製剤に組み込む前に、コレステロール修飾CpGを逆相クロマトグラフィーで精製し、汚染されたエンドトキシンおよび未修飾のCpG分子を除去します。
- ベンダーから受領後、凍結乾燥された CpG 材料をエンドトキシンを含まない水で再水和し、10 mM トリエチルアンモニウムアセテート(TEAA)(移動相 A)とアセトニトリル(移動相 B)からなる分離勾配を使用して分取 C4 RP-HPLC カラムで精製します。
メモ: 詳細については、 表 2 を参照してください。 - コレステロール修飾CpGを含む画分をプールして凍結乾燥する。残留TEAAを完全に除去するには、CpGを15 mLのエンドトキシンフリー水で再構成し、3回再凍結乾燥します。
- 最終凍結乾燥後、エンドトキシンフリー水(最終CpG濃度>20 mg/mL)でCpGを再構成し、分注し、必要になるまで-80°Cで保存します。製剤に加えて、CpGを1〜2.5 mg / mLの濃度に希釈します。
注:FSL-1は、ワクチングレードの凍結乾燥粉末として入手可能です。これは、1 mg/mLの濃度の滅菌およびエンドトキシンを含まない水を使用して再構成されます。ワクチンは筋肉内(i.m)に投与され、各用量は総容量50μLに10μgのMOMPを含む。
- ベンダーから受領後、凍結乾燥された CpG 材料をエンドトキシンを含まない水で再水和し、10 mM トリエチルアンモニウムアセテート(TEAA)(移動相 A)とアセトニトリル(移動相 B)からなる分離勾配を使用して分取 C4 RP-HPLC カラムで精製します。
- 所望の製剤用量を達成するには、ナノ粒子をPBSに透析し、アジュバント添加前に遠心真空濃縮器を使用して濃縮します。サンプルが完全に乾燥しないように注意してください—遠心分離中は20〜30分ごとにサンプル量を確認してください。
- バイオセーフティキャビネット内の無菌条件下でアジュバントを追加します。組み込みの成功を評価するには、分析サイズ排除クロマトグラフィー(SEC)によって最終製剤とその成分を分析します。
注:これらの調製では、PBSバッファー(流速0.5 mL/m)中でSECカラムを使用し、UV-visダイオードアレイ検出器を使用して溶出を検出しました。取り込みは、214および280nmにおけるアジュバント粒子の吸収を非アジュバント粒子の吸収と比較することによって評価した。 - アジュバント投与されたMOMP-tNLPと空のtNLPは、動物の使用前に4°Cで最大14日間保管してください。新しいtNLP製剤の安定性を完全に評価するには、保存されたtNLPをSECで定期的に分析します。
注:安定性は製剤ごとに異なります。
11.血清検査
- 雌の3週齢マウス(BALB/c、n = 6)を得る。
- 5μgのCpGおよび1μgのFSL-1(注射当たりの総容量= 50mL)でアジュバントしたMOMP-tNLPの形態のMOMP-tNLPの形態で、各後肢のマウスに筋肉内(すなわち)にワクチン接種する。
- ワクチン接種後、胸骨臥を維持できるようになるまでマウスを観察します。
- 最初のワクチン接種(プライム)の4週間後、5μgのCpGおよび1μgのFSL-1(注射あたりの総容量= 50mL)でアジュバントしたMOMP-tNLPの形で10μgのMOMPを動物に2回目(ブースト)ワクチン接種する。
- 最初のワクチン接種後56日目に、血液を採取して抗体価を評価します。キシラジン(0.3 mg / 20 g体重)とケタミン(3.0 mg / 20 g体重)の溶液を注射してマウスに麻酔をかけることから始めます。前足と後足をつまんで、けいれんが発生しないことを確認します。麻酔中の目の乾燥を防ぐために、目の周りにワセリンを塗ります。
- マイクロヘマトクリット毛細管を使用して、後眼窩神経叢を穿刺する。マイクロ遠心チューブに100 mLの血液を採取します。
- 採血後、麻酔から回復し、胸骨横臥を維持できるようになるまでマウスを観察します。
- 室温で30分間血栓を凝固させた後、2,000 × g で10分間スピンダウンします。血清を収集し、-80°Cで凍結します。
- この時点で、 クラミジア・ムリダルム で動物に挑戦するか、安楽死させます。最初にキシラジン(0.3 mg / 20 g体重)とケタミン(3.0 mg / 20 g体重)の溶液を注射し、続いて頸部脱臼を注射することにより、マウスを安楽死させます。
- MOMPに特異的な血清抗体を上記のようなウェスタンブロッティング技術を用いて試験する。すべての免疫マウスからマウス血清をプールし、1:5,000希釈で一次抗体の代わりにプール血清を使用する。
結果
1 mL無細胞反応からのMOMP-tNLPのNiアフィニティー精製のSDS-PAGEプロファイルを 図1Bに示します。この反応により、MOMPとΔ49ApoA1タンパク質の両方で高レベルの発現が得られました。以前の結果は、DMPCおよびテロデンドリムの存在下でのΔ49ApoA1の無細胞発現がテロデンドリムナノリポタンパク質粒子(tNLP)の形成をもたらすことを示しました4。MOMPとΔ49ApoA1の同時溶出は、HisタグがtNLP足場Δ49ApoA1にのみ存在し、MOMPには存在しないため、MOMPがtNLPに関連していることを示しました。MOMPは非常に不溶性の高いタンパク質であり、膜タンパク質の可溶化を促進することが示されているtNLPとの複合体形成によってのみ溶出できます。
MOMP-tNLPを含む溶出画分をプールし、タンパク質定量に関する製造元の指示に従って、蛍光ベースの定量装置、または280 nmの吸光度で濃度を測定する装置を使用して総タンパク質濃度を測定しました。MOMPワクチンの正確な投与を可能にするために、精製複合体中のMOMPの濃度を決定することも重要です。我々は、既知濃度の精製組換えMOMPを標準物質としたゲル密度測定法(図2)を用いてMOMPを定量する方法を開発した。検量線を確立し、MOMP-tNLPサンプルと比較することにより、MOMP濃度を正確に定量することができます。精製サンプル中のMOMP濃度を測定することで、さまざまなスケールでの無細胞反応におけるMOMPの収率を推定することができ、これは下流の研究に適した反応セットアップを計画するために重要です(表3)。
MOMPは、強力な免疫応答を誘発するためにオリゴマーを形成する必要があります11。MOMPのオリゴマー状態を試験するために、MOMP-tNLPを、熱および還元剤ジチオスレイトール(DTT、50mM、 図3A)の両方の存在下および非存在下で分析した。MOMPの高次オリゴマーは、サンプルを熱およびDTTで処理しない場合にSDS-PAGEによって同定されました。比較すると、DTTの存在下で熱で処理されたサンプルは、主にMOMPおよびΔ49ApoA1に対応する2つの異なるバンドをゲル上に示しました(それぞれ約40 kDaおよび22 kDa)。これらの結果は、MOMPのオリゴマー形成に起因するゲルバンディングパターンによく似ており、その有効性に重要です。
さらにMOMPタンパク質の可変ドメイン上の線状エピトープに対する抗体であるMAb40を用いたウェスタンブロット解析は、同様のバンディングパターンを示し、非変性状態でのMOMPタンパク質によるオリゴマー形成を確認した(図3B)。MOMPオリゴマー形成に影響を与える重要な因子は、無細胞反応セットアップ中のMOMPプラスミドとΔ49ApoA1プラスミドの比率です。 表4 は、プラスミドの比率と結果として生じるtNLPへのMOMPの挿入率を示しています。以前の研究では、クラミジアMOMPおよび他の外膜タンパク質が主に三量体として存在する可能性があることが示されました12。無細胞反応における三量体形成を最大化するには、挿入速度をNLPあたり3つのMOMPタンパク質に近く、これは~25:1のMOMP対Δ49ApoA1プラスミド比に相当します。
ドットブロットアッセイは、MOMPおよびtNLPの存在を検出するためのより合理化された方法として使用されました。MAb40抗体を用いて、総MOMPを検出した。tNLPのΔ49ApoA1足場上のHisタグを標的としたMAbHIS抗体を用いて、tNLPの存在を評価した。MAb40抗体とMAbHIS抗体の共シグナル伝達は、MOMP-tNLPの形成を示しました。対照反応は空のtNLPを生成し、MAbHISからの陽性シグナルのみを示しました(図3C)。無細胞反応で産生されたMOMP-tNLPの免疫原性を試験するために、MOMP-tNLPをCpG+FSL-1でアジュバントし、上記のプライムブーストレメンでマウスに筋肉内注射(i.m.)しました。免疫したマウスから血清を採取し、ウェスタンブロットアッセイを用いてMOMP特異的IgG抗体を測定した(図4)。アジュバント投与されたMOMP-tNLPを注射したマウスの血清は、強いMOMP結合を示し、MOMP-tNLPが in vivoで免疫応答を誘発できることを示しています。
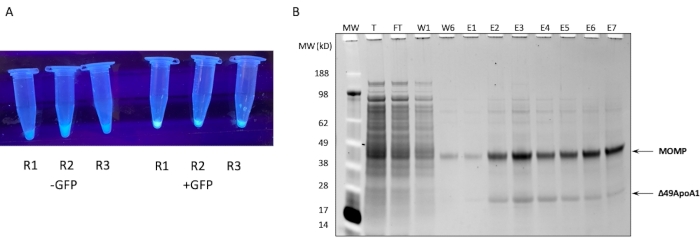
図1:MOMP-tNLPの発現と精製。 (A)GFPプラスミドを含まないライセート(左)と比較して、UV光源下で発光するGFPコントロールを正常に発現させた無細胞反応の少量のアリコートを含むチューブの画像(左)。(B)SDS-PAGE後にSYPROルビーで染色したプロテインゲルの、MOMP-tNLPの精製プロファイルを示す。MOMP は 40 kDa で移行し、49ApoA1 は 22 kDaで移行します。略語:MOMP =クラミジア主要外膜タンパク質;tNLP = テロデンドリマーナノリポタンパク質粒子;MOMP-tNLP = MOMP-tNLP complex;GFP = 緑色蛍光タンパク質コードプラスミド;MW = 分子量マーカー;T =全無細胞ライセート;FT =フロースルー;R1-R3 = 無細胞反応アリコート;W1、W6 =洗浄1および6。E1-E7 = 溶出 1 から 7;Δ49ApoA1 = Hisタグ付きマウスApoA1誘導体。 この図の拡大版を表示するには、ここをクリックしてください。

図2:MOMP-tNLPサンプルにおける MOMPの定量。 (A)MOMPの定量のためにSYPROルビーで染色したSDS-PAGEゲル。既知濃度の組換えMOMPをゲル上に負荷し、標準曲線を得た。各レーンには、0.1 μg、0.5 μg、1.0 μg、2.0 μg、および4.0 μgのMOMPが含まれていました。定量されていたMOMP-tNLPサンプルを同じゲルにロードしました。(B)MOMP濃度標準曲線をデンシトメトリーを用いて作成した。正規化されたバンド密度とMOMPの量に関する式が確立された。この式を使用して、未知のサンプルのMOMP含有量を計算しました。略語:MOMP =クラミジア主要外膜タンパク質;tNLP = テロデンドリマーナノリポタンパク質粒子;MOMP-tNLP = MOMP-tNLP complex;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動。 この図の拡大版を表示するには、ここをクリックしてください。
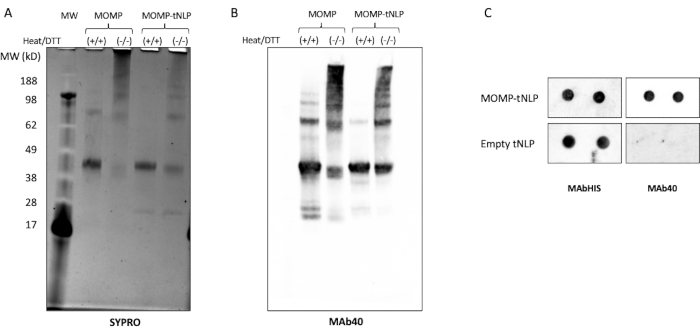
図3:無細胞産生MOMP-tNLPにより、MOMPは高次構造を形成できます。 (a)DTTおよび還元剤の熱処理の有無にかかわらずMOMP-tNLPのSDS-PAGEゲルを、SYPRO Rubyで染色した。熱とDTTでは、熱と還元剤が高次MOMP構造の大部分を分解するため、MOMPは主に~40 kDaでモノマーバンドとして現れました。熱とDTTがない場合、高次バンドが存在し、MOMPオリゴマー立体配座を示しています。(B)MOMP-tNLPおよびMOMP単独のウェスタンブロットを、未処理、熱およびDTTで処理した。転写後、メンブレンをMAb40(1:1,000希釈)でプローブしました。SYPRO Ruby染色ゲルと同様のバンディングパターンが観察され、より分子量の高いバンドが実際にMOMPオリゴマーであることが確認されました。(C)MAb40およびMAbHISでプローブしたMOMP-tNLPおよび空のtNLPサンプル(重複)のドットブロット。略語:MOMP =クラミジア主要外膜タンパク質;tNLP = テロデンドリマーナノリポタンパク質粒子;MOMP-tNLP = MOMP-tNLP complex;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;DTT = ジチオスレイトール。 この図の拡大版を表示するには、ここをクリックしてください。
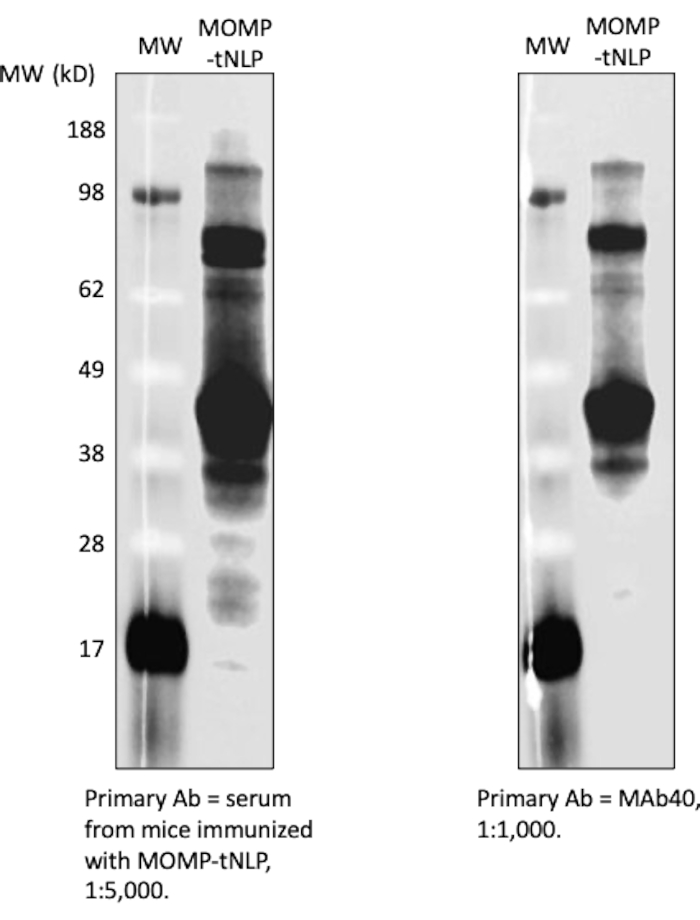
図4:無細胞産生MOMP-tNLPは免疫原性が高い。 免疫マウス由来の血清は、強い抗MOMPシグナルを示した。CpG+FSL-1でアジュバントしたMOMP-tNLPを用いてマウスを免疫した。6匹の免疫マウスからの血清を回収し、プールし、MOMP-tNLPのプローブに使用した。血清はウェスタンブロッティングアッセイでMOMPに結合することができ、強いIgGシグナルを示しました(左)。MAb40を一次抗体として用いたウェスタンブロット(右)でも同様のバンドが見られ、血清にMOMP特異的IgGが含まれていることが分かりました。略語:MOMP =クラミジア主要外膜タンパク質;tNLP = テロデンドリマーナノリポタンパク質粒子;MOMP-tNLP = MOMP-tNLP complex;CpG = コレステロール修飾CpGアジュバント;FSL-1 = 親油性アジュバント。 この図の拡大版を表示するには、ここをクリックしてください。
| バッファー名 | NaH2PO4 | ナクル | イミダゾール | pH: |
| バインド バッファー | 50ミリリットル | 300ミリリットル | 10ミリリットル | 8.0 |
| ウォッシュバッファー | 50ミリリットル | 300ミリリットル | 20ミリリットル | 8.0 |
| 溶出バッファー 1 | 50ミリリットル | 300ミリリットル | 250ミリリットル | 8.0 |
| 溶出バッファー 2 | 50ミリリットル | 300ミリリットル | 500ミリリットル | 8.0 |
表 1: ニッケルアフィニティー精製に必要なバッファーのリストで、各成分の濃度とpHを詳述しています。
| 実行中 | 50分 |
| 流量 | 6.0ミリリットル/分 |
| グラデーションの種類 | バイナリ |
| バッファ A | H20中の10 mM TEAA |
| バッファ B | メック |
| 勾配 | % バッファ B |
| 0 ミン | 25% |
| 30分 | 60% |
| 30.5分 | 100% |
| 40分 | 100% |
| 40.5分 | 25% |
| 50分 | 25% |
表 2: コレステロール修飾CpGの逆相HPLC精製の条件。 略語:TEAA =酢酸トリエチルアンモニウム;MeCN = アセトニトリル。
| 無細胞ライセート(mL) | DMPC脂質(ミリグラム) | テロデンドリマー(mg) | モンププラスミド(μg) | 精製MOMP収率(ミリグラム) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
表 3: 異なるスケールの無細胞反応に使用される脂質、テロデンドリマー、プラスミドの量と、対応する収率。略語:MOMP =クラミジア主要外膜タンパク質;DMPC = 1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン。
| プラスミドインプット比 MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| 産生タンパク質量の比率、MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| tNLP あたりの MOMP 挿入の推定回数 | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
表 4: 無細胞反応におけるプラスミド比率を、得られたMOMP挿入率とした。略語:MOMP =クラミジア主要外膜タンパク質;tNLP = テロデンドリマーナノリポタンパク質粒子;Δ49ApoA1 = Hisタグ付きマウスApoA1誘導体。
ディスカッション
クラミジアは、男性と女性の両方に影響を与える最も一般的な性感染症です。クラミジアのワクチン研究は何十年にもわたっていますが、大量生産に拡張できる安全で効果的なワクチンはとらえどころのないままです13。クラミジアMOMPは、防御ワクチン抗原としての主要な候補と考えられています。ただし、MOMPは非常に疎水性が高く、誤った折り畳みが発生しやすい14,15。さらなる研究により、MOMPはその免疫原性に不可欠なオリゴマー状態に存在することが明らかになりました11。ここでは、tNLPナノ粒子内で形成されたオリゴマーMOMPをワクチンとして生成し、ライセート3 mLあたり約1.5 mgの精製MOMPを生成する、検証済みの無細胞共発現法について詳しく説明しています。この完全に照合された手順は、工業生産のためにさらに拡張することができ、ワクチンを生成するための有用なアプローチとしての見通しを高めます。
我々は以前、無細胞発現を用いてNLP3,16内に埋め込まれた膜タンパク質を産生すること、およびテロデンドリマー安定化ディスクへの発現について発表しています。しかしながら、この後者の技術は、より大きな不均一性およびより低い溶解性を有する膜タンパク質粒子を生成した。4さらに、MOMPテロデンドリマー粒子の免疫原性は、MOMP-tNLP粒子と比較して不明です6。
この手順は、サブユニットワクチンで使用するための抗原として有望な候補である細菌膜タンパク質の発現を拡大するために適用することができます。この手順は、可溶化された細菌膜タンパク質を生成するだけでなく、コレステロール部分またはFSL-1に結合したCpGを含むがこれらに限定されない様々な親油性ワクチンアジュバントを使用して、ナノ粒子構造全体をさらなる修飾に受け入れることができます。細菌由来の他の候補抗原の発現は可能ですが、最適な収量を達成するためには、発現温度、脂質の選択、発現系の種類などのパラメータを探索する必要があるかもしれません。
さらに、このプロセスではプラスミドの選択と比率が重要です。使用する両方のプラスミドは、同じ骨格から構築する必要があります。インサートの長さがほぼ同じ場合、比率は、ここで説明するように、添加されたプラスミドの質量に基づくことができます。ただし、モルに基づく比率は、特に反応をスケーリングする場合に、より再現性のある結果をもたらします。スクリーンスケール反応(< 0.5 mL)でうまく機能する比率は、より大きな反応には適用できない場合があり、追加の最適化が必要になる場合があります。非膜タンパク質は、無細胞キットを使用して発現させることができますが、可溶性生成物を生成するために脂質ナノ粒子(共発現)を必要としない場合があります。さらに、このプロトコルはCpGおよびFSL-1によるアジュバントについて説明していますが、このシステムは、他の親油性アジュバントとの製剤化または所望により可溶性アジュバントとの混合に適しています。
無細胞発現反応を設定する際には、収率に影響を与える可能性があるため、汚染を避けることが不可欠です。プラスミド自体を含む反応への添加物は、高純度でなければなりません。さらに、発現タンパク質は、エンドトキシン汚染のない材料および溶液とのみ接触する必要があります。候補製剤中のエンドトキシン汚染は、免疫学的アッセイの一貫性のない偽の結果につながる可能性があり、十分な量で有害である可能性があります。ここでは説明しませんが、SDS-PAGEなどの後続の分析ステップで多くの汚染物質が観察される場合は、ニッケルアフィニティークロマトグラフィー後の追加の精製が必要になる場合があります。これはSECで実現できますが、条件によっては定式化ベースでの最適化が必要になる場合があります。
開示事項
著者らは、この論文で報告された研究に影響を与えたと思われる可能性のある既知の競合する金銭的利益や個人的な関係はないと宣言しています。
謝辞
この作業は、国立アレルギー感染症研究所の公衆衛生サービス助成金R21 AI20925およびU19 AI144184によってサポートされました。この作業は、米国エネルギー省の後援の下、ローレンスリバモア国立研究所が契約DE-AC52-07NA27344 [LLNL-JRNL-822525、LLNL-VIDEO-832788]に基づいて実施しました。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
参考文献
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved