Method Article
一過性発現システムを用いた哺乳類細胞における完全長ヒトハンチンチン変異体の効率的かつスケーラブルな生産
要約
HEK293細胞における完全長ヒトハンチンチンタンパク質変異体のコンストラクトデザイン、一過性トランスフェクション、発現および精製をカバーするスケーラブルなプロトコルを提供しています。
要約
全長ハンチンチン(FL HTT)は、質量約350 kDaの大きな(aa 1-3,144)遍在的に発現するポリグルタミン(polyQ)含有タンパク質です。FL HTTの細胞機能は完全には理解されていませんが、~36回以上のpolyQ路の変異体拡張はハンチントン病(HD)と関連しており、polyQ長は発症年齢とほぼ相関しています。変異型HTT(mHTT)の機能に対する構造の影響をよりよく理解するためには、大量のタンパク質が必要です。哺乳動物細胞におけるFL HTTのサブミリグラム産生は、ドキシサイクリン誘導性の安定細胞株発現を用いて達成された。しかし、安定な細胞株からのタンパク質生産には、一過性トランスフェクション法で克服できる限界があります。
この論文は、ポリエチレンイミン(PEI)を用いた一過性トランスフェクションによるコドン最適化プラスミドからのFL HTTおよびその変異体の低ミリグラム量生産のための堅牢な方法を提示します。この方法はスケーラブル(>10 mg)で、高度に精製されたFL HTTの細胞培養液を一貫して1〜2 mg/L得られます。以前の報告と一致して、FL HTTの精製溶液状態は非常に動的であることがわかりました。このタンパク質は、二量体および高次オリゴマーを形成する傾向がある。オリゴマー形成を遅らせる鍵は、サイズ排除クロマトグラフィー中に二量体および高次オリゴマー画分から単量体画分を迅速に分離することです。
多角度光散乱を用いたサイズ排除クロマトグラフィー(SEC-MALS)を使用して、精製HTTの二量体および高次オリゴマー含有量を分析しました。FL HTT polyQ長(Q23、Q48、およびQ73)とオリゴマー含有量の間に相関は観察されなかった。exon1欠失コンストラクト(aa 91-3,144)は、FL HTT(aa 1-3,144)と同等のオリゴマー化傾向を示した。SEC/MALS屈折率(RI)、ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)、ウェスタンブロット、ネイティブPAGE、およびブルーネイティブPAGEによる製造、精製、および特性評価の方法を本明細書に記載します。
概要
ハンチントン病(HD)は、主に不安定で不随意の運動運動、ならびに人格変化や無関心などの認知的および精神的変化を特徴とするまれな神経変性疾患です1,2。HDは、ハンチンチン遺伝子(HTT)のエクソン1に位置するCAGリピート路の35リピートへの拡大と関連しており、CAGリピートの数が多いほど、疾患の早期発症と相関しています3,4。HTTの翻訳産物であるハンチンチンタンパク質(HTT)は、ニューロンの生存率と脳の発達に関与しています5,6,7,8,9。
HTTは、幅広い細胞プロセス、小胞輸送、細胞分裂、繊毛形成、およびオートファジーに関与すると報告されている足場タンパク質です10,11。しかし、HDの分子病因は完全には明らかではなく、polyQ拡張mHTTの病理学的影響を媒介する主要なタンパク質相互作用因子の同定は不足しています。いくつかの研究は、HTT凝集体がHD患者および疾患の動物モデルのニューロンおよびグリアで同定されているため、拡張HTTタンパク質のオリゴマー化傾向によって引き起こされるmHTTからの毒性機能の獲得を示唆しています12,13,14,15,16,17.FL HTTおよびmHTTバリアントの機能と構造の調査を促進し、アッセイ開発のための高品質のタンパク質標準を研究者に提供するには、均一組換えタンパク質の堅牢でスケーラブルな供給が必要です。
FL HTTは、そのサイズ(aa 1-3,144、polyQ長Q23に基づくナンバリング)、タンパク質分解不安定性、および凝集傾向により、可溶性タンパク質として発現および単離することが困難であることが証明されています。これまで、HTTのエクソン1領域(aa2-90)は、大腸菌18,19,20におけるタンパク質の溶解度を高めることができる様々なタグを用いて大規模に発現および精製されてきた。FL HTTは、バキュロウイルス21,22を用いた昆虫細胞発現系で最初に発現および精製され、化学的に架橋されたFL Q23-HTTおよびQ78-HTTの低分解能30 Å電子顕微鏡(EM)構造が報告されました23。HTT構造の調査は、天然の翻訳後修飾(PTM)を有するFL Q17、Q46、およびQ128-HTTの生産が、安定した細胞株またはアデノウイルス発現系を用いてヒト細胞において達成されたときにさらに進んだ24。これらの研究は、精製HTTは主に単量体状態で存在するが、高次のオリゴマーおよび凝集体を形成する傾向があることを示唆している。
高度に拡張されたpolyQ領域を有するFL Q128-HTTの分析超遠心分離は、非拡張polyQ領域を有するタンパク質よりも多くのオリゴマーおよび凝集画分を得た24。安定した細胞株を用いて、相互作用パートナーHAP40との共発現によってFL HTTを安定化させる戦略が成功裏に採用されている。FL HTTおよびHAP40複合体のクライオEM構造は、精製タンパク質複合体(PDB:6EZ8)を用いて平均4 Åの分解能で解かれています25。この共発現戦略は、バキュロウイルス系に首尾よく適合されており、異なるpolyQ長を有する一連の高品質HTT変異体が、昆虫細胞から発現および精製されている26。それ以来、可変polyQ長とHAP40およびより高い分解能構造を有するHTTの複合体のより多くのクライオEM構造が解明され、タンパク質データベース27,28(PDB:7DXK、7DXH、6X9O)に寄託された。
FL HTTの迅速な一過性発現のために、ポリエチレンイミン(PEI)を使用してHEK293細胞でのトランスフェクションおよび発現方法を最適化しました。原理の証明として、23個のグルタミンを含むFL HTT変異体(FL Q23−HTT)を最初に精製し、前述の精製方法の改変を用いて特徴付けた24。この一過性トランスフェクション法は、便利で、非常に効率的で、スケーラブルです。1〜2 mg/Lの収率で精製HTTを生産でき、これは報告されている安定細胞株法に匹敵します24。タンパク質はヒト細胞株で産生されるため、質量分析プロテオミクス分析に供すると、産生されるHTTは天然のヒトPTMを有する可能性が高くなります11、29、30、31。FL HTTのFL Q48-HTT、FL Q73-HTT、およびexon1-欠失(ΔExon1-HTT)変異体のミリグラム量が作製され、一過性発現法が、生産のための安定した細胞株を確立するために必要な時間のかかる労力に依存することなく、HTTの代替変異体を迅速に生産するのに特に有用であることを実証しました。
以下のプロトコルは、2 L細胞培養からFL Q23-HTTを産生するために、細胞培養、トランスフェクション、タンパク質精製、および精製後のタンパク質特性評価のためにこれらの著者の研究室で使用されている標準的な方法を例示しています。このプロトコルは、より大きな培養物にスケールアップすることも、他のHTT変異体を精製するように適合させることもできます。FL HTTの最大10 L細胞培養、およびHTTおよびHTTホモログのさまざまな部位または切断変異が、同じプロトコルを使用して実験室で正常に実行されています。精製されたFL HTTには、ダイマーや高次オリゴマーとともに高い割合のモノマーが含まれています。生成されたバリアント(Q23、Q48、Q73、および削除されたExon1)間で同じ凝集プロファイルが観察されます。適切な注意を払わないと凝集が起こる可能性があるため、製剤および凍結融解安定性試験を実施して、タンパク質の取り扱いに最適な条件を特定しました。ブルーネイティブページやSEC/MALS-RIなどの方法も、品質管理プロセスの一環としてHTTオリゴマー含有量を分析するために説明されています。HD研究コミュニティに利益をもたらすために、この研究に記載されているプラスミドとHTTタンパク質は、コリエル研究所(www.coriell.org/1/CHDI)のHDコミュニティリポジトリにも登録されています。
プロトコル
1. FLAGタグ付き HTT 哺乳類発現コンストラクトの設計と作製
- 国立バイオテクノロジー情報センター(https://www.ncbi.nlm.nih.gov/)から完全長ヒトHTTタンパク質配列(P42858)を取得します。
注:研究者は、HTT変異体の構造を設計する際に、HTTのドメイン組織に精通し、HTTコア3D構造を維持する必要があります。 - P42858の配列に基づいてヒト細胞発現のコドン最適化を実行するための遺伝子合成サービスをリクエストします。polyQ番号をQ16から所望のQ長に変更し(ここではQ23を最初の構築物として選択した)、全長 HTT 遺伝子を合成する。
注:合成されたコドン最適化全長Q23-HTTコンストラクトは、この研究でpUC18プラスミドのインサートとして提供されました。 - オプション:コンストラクト内の異なるQ長のクローニングおよび精製を容易にする機能を追加します。
注:タバコエッチングウイルス(TEV)切断部位とFLAG精製タグ(AAAENLYFQGDYKDDDDK)をコンストラクトのC末端に追加しました。2つのHindIII部位は、polyQ領域を包含するように構築物において設計した(翻訳されたタンパク質配列は、HindIII部位を導入することによって変化しない)。これにより、研究者はHTT遺伝子を完全に再合成することなく、制限酵素消化とライゲーションによって HTT のQ長を変更することができます。
2. 合成したHTTコンストラクトをpcDNA3.1にクローニングします。
- それぞれ2 μLのNheIおよびPmeIを使用して、5 μgのpUC18-Q23-HTTおよび5 μgのpcDNA3.1を37°Cで2時間消化します。
- 0.5% w/v アガロースゲルを実行し、アガロースゲル抽出キットを使用して Q23-HTT フラグメントと消化された pcDNA3.1 ベクターを精製します。マイクロリットルのサンプルを測定できるUV分光計を使用して、OD280 によって精製されたDNAの濃度を定量します。
注:通常、1.8から2.0の範囲のOD260/280 が観察されます。合成されたFL HTTは、pUC18プラスミドの両末端にNheIとPmeIを備えたインサートとして供給されます。 HTT の合成が異なる場合は、他の制限酵素を使用してください。 - 反応には10 ngの消化pcDNA3.1ベクターを使用します。T4 DNAリガーゼを用いて、10 μLの反応で精製したDNAを1:1(HTT:pcDNA3.1)のモル比でリゲートし、室温で5分間反応させます。
- ライゲーゼメーカーによって指定されたプロトコルを使用して、ライゲーションされた製品を有能な 大腸菌 細胞に変換します( 材料表を参照)。
- 6つの単一コロニーをピックアップし、100 μg/mLのカルベニシリンを添加した4〜6 mLのLBで37°Cで一晩培養します。
- 各一晩培養から1 mLを割り当てます。グリセロールを25%v/vに添加し、グリセロールストックを-80°Cで保存します。 ユーザーズマニュアルで指定された手順に従って、ミニプレップキットを使用して残りの一晩培養を精製します。
- プラスミドの転写領域にまたがるシーケンシングプライマーを使用して、すべてのプラスミドをシーケンシングします。マスターグリセロールストックとして正しいシーケンスを持つグリセロールストックを1つ選択し、残りを廃棄します。
- オプション:pcDNA3.1-Q23-HTTプラスミドの2つのHindIIIサイトにまたがる異なるQ長(Q48、Q73、およびExon1)のDNAを合成するための遺伝子合成サービスをリクエストします。HindIIIを用いてpcDNA3.1-Q23-HTTおよび新たに合成したDNAを消化し、ステップ2.2-2.7と同様にT4リガーゼでライゲールして、pcDNA3.1プラスミドに異なるpolyQ長を有するFL HTTを作製する。
注:この研究で使用されたプラスミド構築物は、コリエル研究所のHDコミュニティリポジトリから直接入手することもできます(www.coriell.org/1/CHDI)。材料表を参照してください。
3. GIGAプレップエンドトキシンフリープラスミドDNAによる大規模トランスフェクション
- カルベニシリン(100 μg/mL)を含むLB寒天プレートにpcDNA3.1-Q23-HTT-TEV-FLAGの細菌グリセロールストックをストリークします。単一のコロニーが現れるまで、プレートを37°Cで16〜24時間インキュベートします。
- 単一のコロニーをピックアップし、カルベニシリン(100 μg/mL)でプラスミド増幅用に処方されたリッチ培地に5 mLスターター培養液を接種し、37°Cで8時間増殖させます。
- エンドトキシンフリーのGIGAプラスミド精製キットをお選びください。プラスミドGIGAキットのマニュアルに記載されている手順に従って、pcDNA3.1-Q23-HTT-TEV-FLAGプラスミドを精製します。
- リムルスアメーバ細胞溶解液(LAL)ベースのエンドトキシン定量キットを使用して、プラスミドエンドトキシンレベルを測定します。製造元のマニュアルに記載されている手順に従ってください。
注:優れたトランスフェクション効率を得るには、高品質で低エンドトキシンレベルのプラスミド精製が不可欠です。このプロトコルを使用すると、プラスミド濃度が4 mg/mLの細菌培養液1 Lあたり20〜40 mg>プラスミド(スーパーコイル型>80%)が得られます。適切に精製されたプラスミドは、エンドトキシンレベルが30 EU/mg<必要があります。 OD260/280 は1.8から2.0の範囲で観察されます。
4. ポリエチレンイミン(PEI)によるHEK293細胞2Lの大規模トランスフェクション
- 攪拌しながら、1 gのPEI 25Kを1 Lのエンドトキシンフリー水に加えます。100 mM HClを使用してpHを2.0に調整し、すべてのPEI 25Kが溶解するまで攪拌します。100 mM NaOH溶液を使用してpHを7.0に調整し、0.2 μmフィルターでろ過します。分注し、-20°Cで最長1年間保管します。
注:PEIのアリコートは、最大2週間4°Cに保つことができますが、解凍後に再凍結しないでください。 - ペニシリン-ストレプトマイシン(ペニシリンの場合は5 U / mL、ストレプトマイシンの場合は5 μg / mLの最終濃度)を添加した増殖培地( 材料の表を参照)中のHEK293細胞を加湿シェーカーインキュベーター内で37°C、90 rpm、5%CO2 で18〜24時間増殖させます。トランスフェクションの1日前に、5 L三角フラスコ中の増殖培地を使用して、細胞を~1.2 ×10 6 細胞/mLの密度で2 Lに希釈します。
- 細胞を37°C、90rpm、5%CO2 で18〜24時間増殖させ続ける。ユーザーズマニュアルに従って細胞密度と生存率を測定できる自動セルカウンターを使用して、細胞パラメータを測定します。
注:細胞密度は2倍になり、生存率は>95%である必要があります。トランスフェクション前の細胞密度は、約2.0 × 10 6-2.4 × 106 cells/mLである必要があります。必要に応じて、トランスフェクションの前に細胞を希望の濃度に希釈してください。 - トランスフェクションに必要なプラスミドとPEIの量を計算します。細胞培養液1リットルあたりのトランスフェクションには、1 mgのプラスミドと3 mgのPEIを使用してください。2 L トランスフェクションに必要なプラスミド 2 mg と PEI 6 mg を割り当てます。
- プラスミドとPEIを個別に希釈して、細胞培養の全容量の1 /20に相当するリン酸緩衝生理食塩水(2 Lトランスフェクションの場合はそれぞれ100 mL)に希釈し、室温で5分間インキュベートします。希釈したプラスミドとPEIを穏やかな旋回で混合し、室温で30分間インキュベートします。
注:インキュベーション後、混合物はわずかに濁って見えます。 - 混合物を細胞培養物に加え、穏やかに旋回して混合します。
- 細胞を37°C、5%CO2、90rpmで24時間増殖させる。
- 2 M酪酸ナトリウム溶液を最終濃度2 mMまで加えます。1:1000(v/v)凝集防止剤と1:1000(v/v)の消泡剤を培養液に加えます。
- フラスコを加湿シェーカーインキュベーターに移し、32°C、90rpm、5%CO2で、48時間増殖を続ける。
- ユーザーマニュアルに従って、自動セルカウンターを使用して、細胞密度や生存率などの細胞パラメータを測定します。
- 2.0 × 106 セル(Vol = 2.0 × 106 /セル密度)をマイクロ遠心チューブに移します。セクション5のウェスタンブロッティング用の遠心分離機で細胞を2,000 × g で1分間ペレット化します。
- 2,000 × g で30分間遠心分離して細胞を回収し、精製前に細胞ペレットを-80°Cで保存します。
5. HTT発現量を推定するためのHEK293細胞ライセートのSDS-PAGEおよびウェスタンブロット
- HEK293細胞培養物の大規模トランスフェクションから、予め凍結した2.0×106 細胞のアリコートを取る(ステップ4.11)。50 μg/mLのジギトニン、5 mM EDTA、および1xプロテアーゼ阻害剤カクテルを添加した250 μLのトリス緩衝生理食塩水(TBS)を追加し、ピペットを使用して数回吸引して細胞ペレットを再懸濁します。
- ミニローテーターを使用してチューブを4°Cで30分間穏やかに回転させ、細胞を溶解します。不溶性物質を17,000 × g で5分間遠心分離してペレット化します。
- 上清に4倍還元ドデシル硫酸リチウム(LDS)ローディングバッファーの1/3の量を加え、70°Cで10分間加熱します。
- 5〜20 μLの細胞ライセートをプレキャスト3〜8%酢酸トリスPAGEゲルにロードします。ゲル互換の1xトリスアセテートSDSランニングバッファーを使用して、ゲルを150Vの定電圧モードで60分間実行します。
注:トリスアセテートSDS-PAGEは、分子量が300 kDaを超えるタンパク質に対して他のタイプのSDS-PAGEよりも高い分解能を生成するため、FL HTT分析に使用されました。この研究で使用されたタンパク質は、コリエル研究所のHDコミュニティリポジトリから直接入手することもできます(www.coriell.org/1/CHDI)。材料表を参照してください。 - ウェスタンブロッティングを実行するには、転写バッファー平衡化された厚手転写紙、メタノール活性化ポリフッ化ビニリデン(PVDF)メンブレン、およびSDS-PAGEゲルを使用して転写サンドイッチを組み立てます。製造元のユーザーマニュアルに従って、セミドライウェスタンブロッターを使用してタンパク質をPVDFメンブレンに移します。
注意: 通常、20 cm x 135 cmのメンブレンには135mAで10〜10分で十分です。 - トランスファーサンドイッチを分解し、5%w/vの無脂肪乳を添加したTBST(20 mM Tris pH 7.4、150 mM NaCl、および0.1% v/v Tween-20)でメンブレンをブロックします。
- メンブレンをロッカー上で室温で1時間インキュベートし、15 mLの一次抗体(抗FLAG抗体モノクローナル抗体の場合は1:2,500希釈、他のすべての一次抗体の場合は1:2,000希釈)を使用します。
注:この研究で使用された一次抗体は、抗フラグM2、MAB5492、MAB5490、MAB2166、MAB3E10、MAB4E10、MAB2168、MAB8A4です( 材料の表を参照)。 - 30〜50 mLのTBSTを使用してメンブレンを3 x 5分洗浄します。
- 蛍光色素を結合したヤギ抗マウスIgG二次抗体を含むロッカー上でメンブレンを、5%w/v粉ミルクを含む15 mLのTBST中で1:15,000、室温でインキュベートします。
- 二次抗体に特異的な波長を使用して、蛍光イメージャー上のウェスタンブロットバンドを視覚化します。ユーザーズマニュアルに従って、イメージャに付属のソフトウェアを使用してバンド信号を定量します。
注:定量的ウェスタンブロッティングは、精製HTTを標準物質として使用して実行できます。HTTの線形標準範囲は機器固有であり、抗FLAG抗体を使用してレーンあたり25 ngから250 ngのHTTまでこの研究室で確立されました。HTTの西側のしみは劣化していないはずです。2〜4 pg /細胞の総HTT発現レベルが典型的に観察される。定量的ウェスタンブロットを実行する方法の詳細については、以前に公開されたプロトコル32 を参照してください。
6. 抗FLAGカラムとSECを用いたHTTの高速タンパク質液体クロマトグラフィー(FPLC)精製
- アンチフラッグ精製
- 精製に必要なFLAG樹脂の量を見積もります(通常、2〜4 Lのトランスフェクト細胞培養物の精製用の12 mLの抗FLAG M2アフィニティー樹脂)。バッファーA(表1)を使用して、FPLCを使用して4 mL/分の流速で12〜25 mLの抗FLAG樹脂を空のカラム(材料の表を参照)にパックします。プランジャーの端と樹脂のベッドの間に隙間がないように、プランジャーの高さを調整します。
- 細胞ペレット1 gあたり10 mLの溶解バッファーの比率を使用して、細胞ペレットを解凍し、冷たい溶解バッファーに懸濁します(表1)。
- 細胞懸濁液を10,000psiの高剪断ホモジナイザーに一度通します。ライセートは、互換性のある固定角ローターを備えた遠心分離機で20,000 × g で1時間遠心分離することにより、清澄化します。
- FPLCをプログラムし(研究で使用したソフトウェアの 材料表 を参照)、次のシーケンスを実行します。
- 清澄化されたライセートをサンプルポンプでロードします。
- バッファーAの4カラム容量(CV)で洗浄します(表1)。
- 4 CVのバッファーBで洗浄します(表1)。
- 8 CVのバッファーCで洗浄します(表1)。
- 3 CVのバッファーDで洗浄します(表1)。
- 3 CVの溶出バッファーで洗浄します(表1)。
- SDS-PAGEを使用して10 μLのピーク画分を分析します。ピーク画分を収集し、所望の純度と組み合わせます。SDS-PAGE分析用に結合された溶出液を~50 μL節約できます。
注:通常、単一のピークが現れ、ピークで溶出されるすべての画分には~90%の純粋なHTTが含まれています。 - 5 CVの再生成バッファー(表1)を使用してアンチフラグカラムを再生成し、5 CVのバッファーAを使用してカラムを再平衡化します。
注:アンチフラッグ樹脂は、最大5回、または相対収率/リットルが最初の精製の50%に低下するまで再利用できます。
- SECカラムを使用したサイズ排除カラム(SEC)精製
- 2 × CVのSECバッファー(表1)を使用して、分子量(MW)が500 kDa>タンパク質を分離できるSECカラムを事前平衡化します(使用するカラムの材料表を参照)。
- アンチFLAG溶出液(ステップ6.1.5から)を50 mLスーパーループ経由で直接ロードします。インジェクションごとに 1.2 × CV の SEC バッファーを実行します。SEC分離を4°Cで一晩実行します。
注:この研究で選択したSECカラムには、最大5 mLまたは15 mLのタンパク質サンプルをロードできます。複数の注入を自動的に実行できるようにFPLCをプログラムします。サンプルメソッドスクリプトは、補足ファイル 1 および 補足ファイル 2 としても含まれています。 - 溶出プロファイルを標準のHTT溶出プロファイルと比較して、モノマー、二量体、および高次オリゴマーピークを区別します。SECカラムの溶出プロファイルに基づいてモノマーHTT画分をプールします。必要に応じて、高次オリゴマーおよび二量体HTT画分を別々にプールします。
- プールされたHTTタンパク質を100 kDa遠心濃縮器を使用して4°Cで濃縮します。 OD280の値をそれぞれの吸光係数で割ってタンパク質濃度を計算します(計算上のQ23-HTT、Q48-HTT、Q73-HTT、およびΔExon1-HTTの理論吸光係数はそれぞれ0.776、0.769、0.762、および0.798(mg / mL)-1 cm-1です)。HTT濃度を1.0 mg/mL≤維持してください。
注:過濃縮は凝集をもたらすため、濃縮プロセスを監視することが不可欠です。 - 精製したHTTタンパク質を極低温安全マイクロ遠心チューブに100 μL<分注します。 液体窒素を使用してアリコートをフラッシュ凍結し、-80°Cで保存します。
7. HTT多分散性を分析するための分析用HPLC SEC-MALS-dRI
- UV検出器、多角度光散乱検出器、および示差屈折率(dRI)検出器と組み合わせた高速液体クロマトグラフィー(HPLC)システムで、4°Cですべての分析SEC-MALSを実行します。
- UHPLC カラムをシステムに接続する前に、ポンプと検出器をろ過した HPLC グレードの水でパージします。
- UHPLCカラム(使用するカラムの 材料表 を参照)をシステムに接続します。すべての検出器信号がベースラインに達するまで、ろ過した(0.1 μm)水でカラムを平衡化し、次にSEC-MALSバッファー(表1)で平衡化します。
- 2 μLの6 mg/mLウシ血清アルブミン(BSA)を0.3 mL/分の流速で1回の注射で15分間注入し、データ品質を検査します。BSA プロファイルに基づいて正規化、ピーク アライメント、およびバンド幅拡大補正を実行し、次の HTT サンプル実行のテンプレートを作成します。
- フロートを使用して、FL Q23-HTTサンプルのバイアルを室温の水浴ですばやく解凍します。HTTを0.1μmのスピンフィルターでろ過します。HTTサンプルを2〜4 μL注入し、0.3 mL/分の流速で4°Cで15分間実行します。
- 付属のソフトウェアを使用してクロマトグラフィーおよび光散乱データを分析します( 材料表を参照)。dRI検出器を濃度検出器として使用し、HTTの屈折率増分(dn / dc)として0.185を使用します。Zimmプロットを生成し、各ピーク33、34の重量平均分子量を決定した。
注:HTTの屈折率増分は、プログラムSEDFITソフトウェア35 およびHTTの一次アミノ酸配列を入力として使用して0.185として計算されます。
注:HTTモノマーMWは、~370 kDa±30 kDaでSEC-MALSによって決定されます。精製HTTは通常、モノマー含有量が60〜75%です(この実験室では)。モノマー含有量が低いということは、凝集を防ぐために取り扱いにもっと注意を払う必要があることを示している可能性があります。
8. HTT多分散性を分析するためのブルーネイティブページ
- 50 mLの20xブルーネイティブPAGEランニングバッファー(材料表を参照)と950 mLのH 2 Oを混合して、1 Lのアノードバッファーを調製します。 100mLの20xブルーネイティブPAGEランニングバッファーと100 mLのブルーネイティブPAGEカソード添加剤(20x)を1,800 mLのH 2 Oと混合することにより、2Lのダークブルーカソードバッファーを調製します。 使用前にバッファーを4°Cに冷却します。
- フロートを使用して、室温の水浴でFL Q23-HTTサンプルのバイアルをすばやく解凍します。使用前に解凍したタンパク質を氷の上に保管してください。
- 5 μgのFL Q23-HTT(~1 mg/mL)、1 μLの0.5%G250添加剤、2.5 μLの4x Blue Native PAGEサンプルバッファー、および水を混合して、最終容量を10 μLにします。
- 混合したFL Q23-HTTサンプルを3〜12%のプレキャストビストリスゲルにロードします。7.5 μLの未染色タンパク質標準物質を標準物質と同じゲルにロードします。
- タンクの前面をダークブルーカソードバッファーで満たし、タンクの背面をアノードバッファーで満たします。
注:サンプルをロードするときに簡単に視覚化できるように、サンプルがロードされた後にバッファーを充填します。 - ゲルを150Vで120分間冷蔵室で実行します。
- バンドが観察されるまで脱染液(表1)でゲルを脱色します。ゲルを水に移します。イメージングステーションでゲルを視覚化して文書化します。
注:Blue Native PAGEはもともと膜タンパク質を分析するために設計されました。この研究室では、HTTのモノマー含有量を推定するための代替方法として採用されました。HTTの疎水性領域に結合し、界面活性剤が不足している緩衝条件下で凝集体を形成するのを防ぎます。クーマシーブルーG250を使用しない従来のネイティブPAGEは、おそらくHTTに存在する多くの疎水性ポケットのために、HTTに可溶性オリゴマーと凝集体を形成します。
9. SDS PAGEに続いて、HTT純度を分析するためのクーマシーまたは銀染色
- 精製されたFL Q23-HTTに4x LDSサンプルバッファーと10x還元試薬を加えて、ローディングバッファーと還元試薬の最終濃度を1倍にします。
- サンプルを70°Cの乾式加熱ブロックで10分間加熱します。
- ウェルあたり最大1 μgのタンパク質を3〜8%のトリスアセテートゲルにロードし、トリスアセテートSDSランニングバッファーを使用して150 Vで1時間実行します。
注:この研究で使用されたタンパク質は、コリエル研究所(www.coriell.org/1/CHDI)のHDコミュニティリポジトリから直接入手することもできます。材料表を参照してください。 - クーマシーステイン
- ゲルをH2Oで5分間洗浄する。
- ゲルを30 mLの染色溶液中で15分間揺動させることにより、クーマシー染色溶液(表1)でゲルを染色します。
- ゲルを50 mLのH 2 O中で5分間揺り動かして脱染色し、2回繰り返します。クーマシー染色されたゲルをイメージングステーションで視覚化し、文書化します。
- 市販の銀染色キットを使用した銀染色。
- SDS-PAGE後、固定溶液(表1)を使用してゲルを室温で1時間から一晩固定します。
- キットの指示に従って、染色、洗浄、現像を行います。
- バンドが希望の強度に達したらすぐに現像ステップを停止します。
- 可視光源を備えたゲルドキュメンテーションシステムでゲルを文書化します。
注:>95%で精製されたHTTは、このプロトコルでクーマシー染色と銀染色によって検出できます。定量的タンパク質分析を実行する方法の詳細については、以前に公開されたプロトコル32 を参照してください。
結果
一過性発現ベクター(pcDNA3.1-Q23-HTT-TEV-FLAG、図1A)は、FL Q23-HTT(aa 1-3,144、Q23ナンバリングに基づく)の哺乳類細胞における迅速な産生のために操作されています。このコンストラクトは、カセットクローニングによって様々なHTT変異コンストラクトを迅速に生成し、最小限のクロマトグラフィーステップでHTTタンパク質を高品質かつ均質に精製しやすくし、タグなしFL HTTを生成するオプションを有するように設計された特徴を有する。機能のリストには1が含まれています。HTTエクソン1におけるCAGリピートを取り囲むHindIII制限消化部位は、制限酵素消化およびライゲーションによって様々な長さのpolyQストレッチを有するFL HTT変異体を生成するために使用することができる。2. FL HTTのC末端は、TEVプロテアーゼ認識部位を有するFLAGエピトープでタグ付けされており、高純度のFL HTTのワンステップアフィニティー精製およびTEVプロテアーゼ切断を使用したタグフリーFL HTTタンパク質のオプション生成。3.HEK293細胞での高発現のためのヒト細胞コドン使用のためのコドン最適化FLHTTシーケンス。pcDNA 3.1(+)ベクターは、哺乳類細胞株におけるCMVプロモーターの高い転写活性化活性を利用するための構築物のバックボーンとして使用されます。
pcDNA3.1-Q23-HTT-TEV-FLAGを開始テンプレートとして使用して、2つのHindIII制限酵素部位にまたがる適切なQ長のDNA断片を合成し、テンプレート内の同じ領域を交換することにより、Q48およびQ73 FL HTT構築物を作製しました。FL HTT(aa 91-3,144)のΔExon1変異体(図1B)を、鋳型中のエクソン1領域にまたがる欠失残基を指向したプライマーを用いて作製した。PEIを用いてpcDNA3.1−Q23−HTT−TEV−FLAGを導入したHEK293細胞を、5%CO2下の5L振とうフラスコ中で増殖させた。典型的な大規模精製では、6.0 ×10 9-3.0 × 1010セルを含む2〜10 Lセルペレットを使用します。精製に進む前に、各トランスフェクションからのHTT発現レベルを、精製した組換えFLAGタグ付きHTTを標準物質として、抗FLAG抗体を第1抗体として用いた定量的ウエスタンブロッティングにより推定した。HTT発現レベルが≥2 pg HTT/細胞と推定されたペレットを精製に用いた。
FL HTTの精製は、最初に抗FLAGアフィニティー精製を行い、次にHTTに適した分離範囲を持つゲルろ過カラム上でSECを使用する2段階のカラムプロセスで構成されます(図2A;例については 材料表 を参照)。両方のステップの後、HTTは、分析SEC-MALSに基づいてクーマシーブルーおよび>65%のモノマー含有量を有するSDS-PAGEによって決定された>95%のサンプル純度で得られた。精製時間と温度の両方が最終的なHTTモノマー含有量に悪影響を与えるため、取り扱いを最小限に抑え、一貫したサンプル品質を得るために、FPLCを両方の精製ステップで使用しました。抗FLAG精製中の主要な汚染物質は、質量分析によって測定されたシャペロンHsp70でした(図2B、レーン2)。これは、Hsp70がヒト細胞株24において安定に発現するFL HTTと共精製されるという知見と一致しており、Hsp70が in vivoでのFL HTTの一般的な安定化剤であり得ることを示唆している。
Hsp70汚染は、抗FLAGアフィニティー精製ステップ中に塩化マグネシウムとATPで広範囲に洗浄することで除去できます(図2B、レーン1)。Hsp70を除去すると、FL HTTは高次オリゴマー24 を形成する傾向があり、1 mg/mL≤濃度に維持する必要があります。SEC前の濃縮ステップは、多くの場合、有意な凝集をもたらす可能性があります。したがって、ベストプラクティスは、濃縮せずに、抗FLAG精製からのピーク画分をサイズ排除カラムに直接ロードすることです。SEC後、モノマーFL HTTの最大回収率のためにサンプルを≤1 mg / mLまで濃縮しました。各精製工程から回収されたHTTの量は、定量標準として精製FL HTTを用いたクーマシーブルーまたは定量的ウエスタンブロッティングのいずれかによって推定した(表2)。記載された方法で生産された精製FL HTTタンパク質の典型的な収量は、細胞培養で約1 mg/Lですが、バッチ間のばらつき、または抗FLAG精製樹脂が複数回再利用された場合、それ(表3)をはるかに下回る可能性があります。
FL HTTの過剰発現は、タンパク質22の断片化をもたらし得る。ここに記載の方法で製造されたFL Q23-HTTは、SDS PAGEによって350 kDaの正しいMWを有する単一バンドとして分離され、クマシーG250または銀染色のいずれかによって染色された(図2C)。ウェスタンブロッティングにより、FL Q23-HTTは、N末端、C末端、およびいくつかの中間ドメインのエピトープに対して産生された抗体と反応し、追加のフラグメント関連バンドは観察されず、タンパク質が有意な検出可能な切断なしに単離されたことを示しています(図3A)。FL HTTポリQ長バリアントQ23、Q48、およびQ73は、ウェスタンブロットで予想どおりに反応し、Q長の増加と相関するpolyQ指向性mAb MW1のシグナルが次第に強くなりました:Q23-HTT図3B)。N末端エクソン1を標的とする抗体MW1およびMAB549でプローブした場合、ΔExon1-HTT(aa 91-3,144)のシグナルは観察されませんでした(図3B)。
SEC-MALSを用いて、精製HTTタンパク質の凝集状態および分子量を解析した。サンプルは、UV、MALS、およびdRI検出器によって監視される分析SECによって分析されました。SEC-MALSから得られる絶対モル質量は、分子の形状に依存しない33,34;したがって、SEC-MALSは、モノマー画分とオリゴマー画分がよく分離されている場合、MWの偏りのない推定値を提供します。テストしたHPLCカラムの中で、SECカラム(材料表を参照)は、HTTモノマーとダイマーの間で十分な分離能を示し、モル質量を区別できました(図4)。タンパク質濃度はdRI検出により決定した。FL HTTの屈折率増分(dn / dc)は、SEDFITソフトウェア35によって計算された0.1853mL / gです。ΔExon1 HTT(91-3,144)、FL Q23、Q48、およびQ73 HTT(1-3,144)についても同様の分析SEC溶出パターンが観察され、それぞれがマイナーダイマーおよびオリゴマーピークを持つ主要なモノマーピークで構成されています(表4)。単量体形態について計算されたMWは、理論MWよりも大きい。これはおそらく、高次オリゴマーピークからの種の重複と、HTTタンパク質が高次オリゴマーの形成を避けるために低濃度に維持されるため、弱いdRIシグナルに起因するエラーが原因です。精製されたFL HTT変異体のいくつかのバッチのUVピークを統合することにより、polyQ長と凝集体プロファイルとの間に明確な相関は観察されませんでした(表4)。
分析SECに加えて、FL HTTオリゴマー状態を特徴付けるための補完的な方法として使用できるかどうかを判断するために、従来のネイティブPAGEを実施しました。高次オリゴマーは、界面活性剤を含まないネイティブバッファーを使用して3〜8%トリスアセテートゲルを介して分離されました。SECから精製されたFL HTTは、オリゴマー化状態に対応する複数のバンドを示した(図5A)。最も低いバンドは、天然マーカー480 kDaと720 kDaの間に位置し、昆虫細胞から精製されたFL HTTについて報告された以前の結果と同様でした22。しかし、HTTモノマーは、従来のネイティブPAGEを使用した場合、最も豊富なバンドではなく、結果は分析SEC-MALSによって決定された凝集プロファイルと相関していません。FL HTT36、37、38に存在するいくつかの疎水性パッチ、特にHAP40とFL HTT25との間の疎水性界面は、ゲル内の移動中の高次オリゴマーの形成に寄与する可能性があります。これは、疎水性領域が界面活性剤または安定化タンパク質間相互作用の非存在下で互いに相互作用することが知られているためである。HTTの疎水性特性と一致して、FL HTTは、SEC精製ステップ中にCHAPSの非存在下で、増加する量の高次オリゴマー画分を形成します。
疎水性パッチ39を含む膜タンパク質および大きなタンパク質複合体の研究に広く使用されているBlue Native PAGEを、従来のネイティブPAGEと比較した。精製HTTは、Blue Native PAGE上に3つの主要なバンドを示し、推定MWは643、927、および1070 kDa(図5B)で、それぞれHTTの単量体種、二量体種、および三量体種を表す可能性が高い。モノマーバンドは、Blue Native PAGEで最も豊富なバンドであり、同じサンプルの分析SECプロファイルによく対応しています。Blue Native PAGEによるHTTモノマーのMWの過大評価は、対応する分子量マーカー11、23、25に対してより遅い移動を引き起こすHTTの独特の中空球状構造または疎水性領域に起因する可能性がある。全体として、FL Q23-HTT、FL Q48-HTT、FL Q73-HTT、およびΔExon1-HTTは、分子量の違いによりタンパク質バンドの移動にわずかな違いがあるだけで、類似したブルーネイティブPAGEプロファイルを持っています。
精製タンパク質の品質の追加チェックとして、TEVプロテアーゼで処理することにより、C末端FLAGタグをFL HTTから除去することができます。タンパク質分解切断後、4つの抗体を用いたウェスタンブロットによりサンプルを分析し、FLAGタグの除去を確認し、HTT分解を検出しました。抗FLAG M2およびHTTのN末端、中間ドメイン、およびC末端にエピトープを有する3つのハンチンチン特異的抗体に対する免疫反応性は、FLAGタグの除去に成功し、HTT特異的分解産物は示されなかった(補足図S1)。
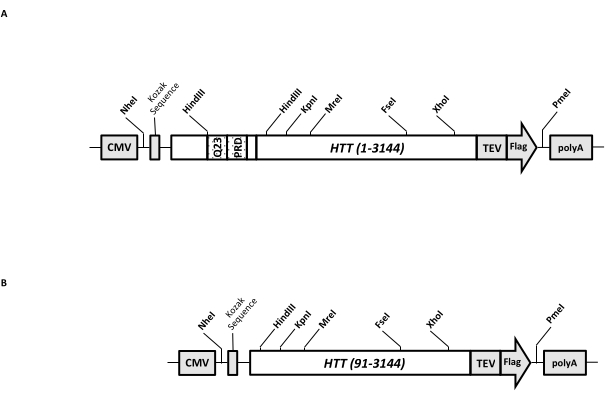
図 1: 全長 HTT 式の構成。 (A)全長Q23 HTT をコドン最適化し、pcDNA3.1(+)プラスミドにクローニングした。HTTの3'末端にフラグエピトープとTEVプロテアーゼ切断部位をタグ付けして、タグフリーHTTタンパク質を生成しました。ポリグルタミンストレッチとプロリンリッチドメインは、カセットクローニング( Q48 およびQ73)を使用して追加のCAGリピートを挿入し、異なるpolyQ長のHTTバリアントを生成するために、隣接するHindIII制限エンドヌクレアーゼサイトで操作されました。(b)ΔExon1コンストラクトを鋳型としてpcDNA3.1-Q23-HTTを用いてPCR変異誘発を行った。HTTの残基91〜3,144は、発現のためにΔExon1構築物中に残った。略語: HTT = ハンチンチン;CMV =サイトメガロウイルス;Q23 =ポリグルタミンストレッチ;PRD = プロリンリッチドメイン;TEV = タバコエッチングウイルス切断部位。 この図の拡大版を表示するには、ここをクリックしてください。
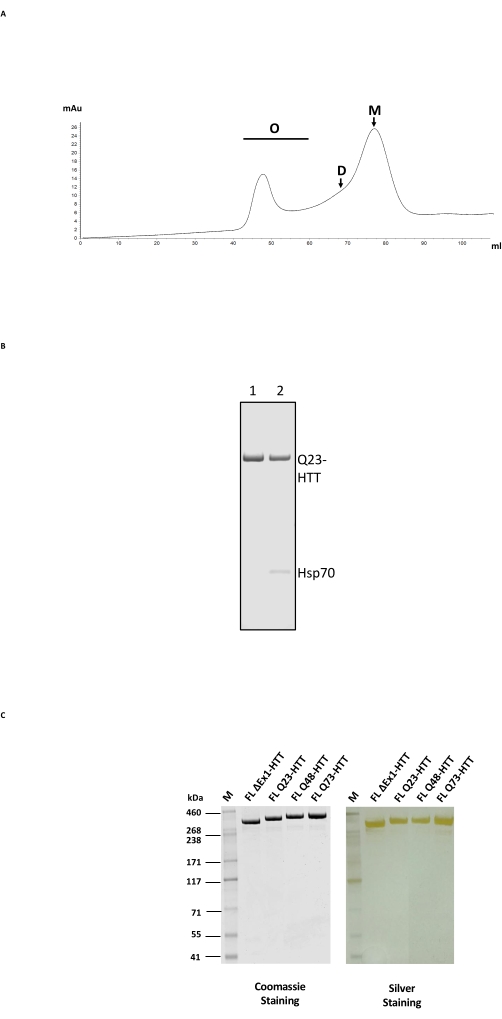
図2:HTTの大規模精製 。 (A)FPLCカラム上のアンチフラグ精製全長Q23-HTTのSECプロファイル。Q23-HTTの高次オリゴマー、二量体、およびモノマーピークが標識されています。モノマーを含む画分を最終HTTサンプルとして回収した。(B)精製Q23-HTTのSDS-PAGEにATP/マグネシウム洗浄ステップ(レーン1)またはATP/マグネシウム洗浄を行わないと、Hsp70共溶出(レーン2)が得られます。(C)クーマシーブルーG-250または銀染色で染色されたSDS-PAGE上の最終精製全長HTTバリアント。略語: FL = 全長;HTT = ハンチンチン;SEC = サイズ排除クロマトグラフィー;FPLC =高速タンパク質液体クロマトグラフィー;O =オリゴマー;D =二量体;M =モノマー;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;Hsp70 =ヒートショックタンパク質70。 この図の拡大版を表示するには、ここをクリックしてください。
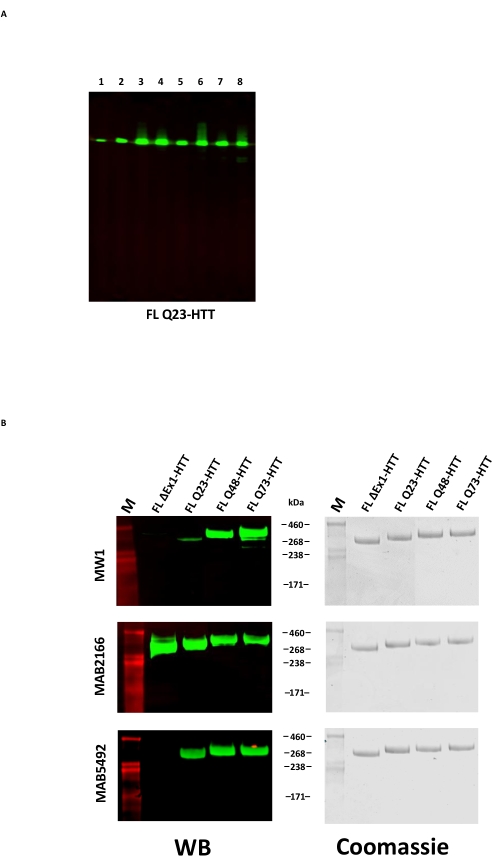
図3:精製HTT変異体のウェスタンブロット分析 。 (a)精製したFL Q23-HTTをSDS-PAGE上で実行し、PVDFメンブレンに移した。一次抗体および相互作用するエピトープは、レーン1、α-FLAG M2、FLAGタグです。レーン2、MAB5492、HTT aa。1-82;レーン3、MAB5490、HTT aa 115-129;レーン4、MAB2166、HTT aa 181-810;レーン5、MAB3E10、HTT aa 1,171-1,177;レーン6、MAB4E10、HTT aa 1,844-2,131;レーン7、MAB2168、HTT aa 2,146-2,541;レーン8、MAB8A4、HTT aa 2,703-2,911。(B)1 μgの精製FL HTT変異体をSDS-PAGE上で実行し、PVDFに移し(左)、複製したSDSゲルを実行し、クマシーブルーで染色しました(右)。一次抗体および相互作用するエピトープは、行1、MW1、拡張PolyQリピートです。行 2, MAB2166, HTT aa 181-810;行3、MAB5492、HTT aa 1-82。略語:FLL Q23-HTT =23個のグルタミン残基を含む完全長ハンチンチンタンパク質;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;WB = ウェスタンブロット;M =マーカー;PVDF =ポリフッ化ビニリデン。 この図の拡大版を表示するには、ここをクリックしてください。
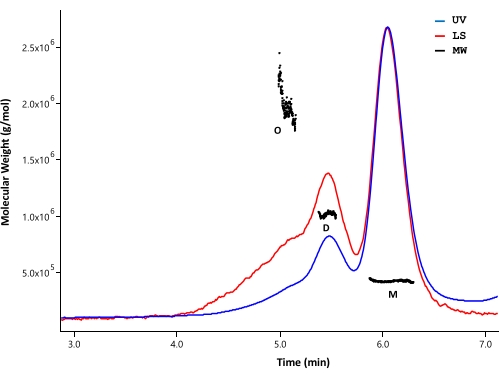
図4:全長HTTのSEC-MALS分析。 精製した全長Q23-HTTをUPLCカラムで溶出しました。予測されるモノマー、ダイマー、およびオリゴマーのピーク位置が示されます。分子量は、モノマー、二量体、および三量体のピークについて計算し、 表5に列挙した。Q48、Q73、およびΔExon1 HTTについても同様の溶出プロファイルが観察され、各精製でモノマー、ダイマー、オリゴマーの含有量はさまざまです。略語: SEC-MALS = 多角度光散乱によるサイズ排除クロマトグラフィー;UV =紫外線;LS =光散乱;MW =分子量;Q23-HTT = 23個のグルタミン残基を含むハンチンチンタンパク質;M =モノマー;D =二量体;O =オリゴマー。 この図の拡大版を表示するには、ここをクリックしてください。
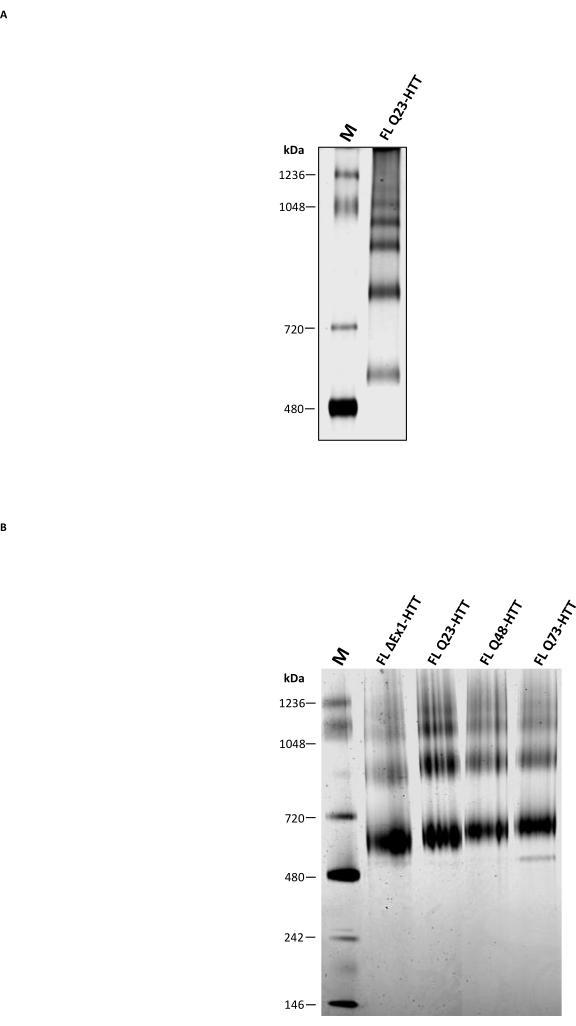
図5:クリアネイティブPAGEまたはブルーネイティブPAGEゲルを使用した精製HTTの特性評価。 SECからのネイティブマーカーおよび見かけのモノマーQ23-HTTは、非変性PAGEシステム(A)およびブルーネイティブPAGEシステム(B)の3〜8%トリスアセテートゲル上で分離されました。略語: FL = 全長;Q23-HTT = 23個のグルタミン残基を含むハンチンチンタンパク質;PAGE = ポリアクリルアミドゲル電気泳動;M =マーカー。 この図の拡大版を表示するには、ここをクリックしてください。
| 歩 | 名前 | 組成 | ||
| 6.1.1 | バッファ A | 50 mM トリス、500 mM NaCl、5% v/v グリセロール、5 mM EDTA、0.01% v/v Tween-20、pH 8.0。 | ||
| 6.1.2 | 溶解バッファー | 50 mM トリス、500 mM NaCl、5% v/v グリセロール、5 mM EDTA、および 1x プロテアーゼ阻害剤カクテル | ||
| 6.1.4.2 | バッファ A | 50 mM トリス、500 mM NaCl、5% v/v グリセロール、5 mM EDTA、0.01% v/v Tween-20、pH 8.0。 | ||
| 6.1.4.3 | バッファ B | 50 mMトリス;500ミリリットルキロカロリー;5 mM MgCl2;5%v / vグリセロール;0.01% V/V トゥイーン-20, pH 8.0 | ||
| 6.1.4.4 | バッファ C | 20 mMトリス;200ミリリットルキロカロリー;5 mM MgCl2;5 mM ATP;0.01% V/V トゥイーン-20;5%V / Vグリセロール、pH 8.0 | ||
| 6.1.4.5 | バッファ D | 50 mMトリス;500 mM NaCl;5%v / vグリセロール;5 mM EDTA;0.5% w/v チャプス, pH 8.0 | ||
| 6.1.4.6 | 溶出バッファー | 50 mMトリス;500 mM NaCl;5%v / vグリセロール;0.5%(チャップス付き)0.2 mg/mL DYKDDDDKペプチド、pH 8.0 | ||
| 6.1.6 | 再生成バッファ | 0.1 M グリシン塩酸塩、pH 3.5;0.01% V/V トゥイーン-20 | ||
| 6.2.1 | SEC バッファ | 50 mM トリス, 500 mM NaCl, 5% v/v グリセロール, 0.5% w/v CHAPS, 1 mM TCEP | ||
| 7.3 | SEC-MALS バッファ | 50 mM HEPES, pH 7.2, 500 mM NaCl, 5% v/v グリセロール, 0.5% w/v CHAPS | ||
| 8.7 | 脱染液 | 40%V/Vメタノールおよび7%V/V酢酸 | ||
| 9.4.2 | クーマシー染色液 | 0.01% w /v クーマシー G250, 50% v/v/ メタノール, 10% v/v 酢酸 | ||
| 9.5.1 | 固定ソリューション | 50% v/v メタノール、10% v/v 酢酸、ホルムアルデヒド 50 μL/100 mL 溶液 | ||
表1:バッファーと溶液の組成
| ステップス | HTT濃度 (ミリグラム/ミリリットル) | 総容量(mL) | HTT含有量(ミリグラム) | 細胞あたりのHTT収量(pg/細胞) | % 利回り |
| 上澄み | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| アンチフラッグ | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| 秒 | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
表2:pcDNA3.1-Q23-HTT-TEV-Flagをトランスフェクトした2 L HEK293ペレットからのHTT収率。 略語:FL Q23-HTT =23個のグルタミン残基を含む完全長ハンチンチンタンパク質;TEV =タバコエッチングウイルス切断部位;SEC = サイズ排除クロマトグラフィー。
| HTT サンプル | HTT収量 (mg/L) | 平均純度(%) | ||
| ティッカー | A280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
表3:4つのFL HTT変異体精製のタンパク質収率およびそれらの最終純度の要約。 略語:FLL HTT =完全長ハンチンチンタンパク質。
| HTT サンプル | ある | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
表4:精製からのFL HTT変異体の代表的な凝集体、二量体、およびモノマー含有量の要約。 略語:FL HTT =完全長ハンチンチンタンパク質;A = 集計;D =二量体;M =モノマー;SEC = サイズ排除クロマトグラフィー。
補足図S1:TEVプロテアーゼ消化後のウェスタンブロット解析。 精製したFL Q23-HTTおよびFL Q48-HTTをSDS-PAGE上で実行し、PVDFメンブレンに移し、TEV消化後のウェスタンブロッティングで分析しました。使用した一次抗体は、抗フラグM2(フラグタグ)、MAB5492(HTT aa 1-82)、MAB3E10(HTT aa 997-1,276)、およびMAB2168(HTT aa 2,146-2,541)でした。レーン1、タンパク質標準;レーン2、Q23-HTT-TEVフラグ;レーン3、Q48-HTT-TEVフラグ;レーン4、Q23-HTT-TEV-フラグをTEVプロテアーゼで1:5で処理し、4°Cで一晩処理します。レーン5、Q48-HTT-TEV-フラグをTEVプロテアーゼで1:5で処理し、4°Cで一晩処理しました。 略語:FL HTT =完全長ハンチンチンタンパク質;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;TEV =タバコエッチングウイルス;PVDF =ポリフッ化ビニリデン。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:凍結融解サイクルを受けたFL HTT変異体のSEC-MALS分析。 精製したQ23-HTT(A)およびQ48-HTT(B)を-80°Cで凍結し、室温で最大6回解凍しました。次に、最初の凍結融解および6回目の凍結融解サイクル後のQ23-HTTおよびQ48-HTTをSEC-MALSによって分析した。モノマー分率のわずかな減少と二量体および高次オリゴマー画分の増加は、凍結融解サイクルを繰り返した後の光散乱によって観察されました。予測されるモノマー、ダイマー、および高次オリゴマーのピーク位置が示されます。略語:FL HTT =完全長ハンチンチンタンパク質;O =オリゴマー;D =二量体;M =モノマー;SEC-MALS = 多角度光散乱によるサイズ排除クロマトグラフィー。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S3:凍結融解サイクルを受けたFL HTT変異体のSDSページ。 精製したQ23-HTT(レーン2-7)およびQ48-HTT(レーン9-14)を-80°Cで凍結し、室温で最大6回解凍しました。Q23-HTTおよびQ48-HTTのアリコートは、各凍結融解サイクルの後に保存され、次いでSDS PAGEによって分析された。凝集物または分解生成物の増加は観察されなかった。サンプルは、バンドデンシトメトリーによって安定で>95%純粋であると見なされました。略語:FL HTT =完全長ハンチンチンタンパク質;SDS-PAGE = ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:FPLC 15 mLアンチフラグHTTスクリプト。 略語 = FPLC = 高速タンパク質液体クロマトグラフィー;HTT =ハンチンチンタンパク質。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル 2: FPLC SEC_MALS HTT スクリプト。 略語: SEC-MALS = 多角度光散乱によるサイズ排除クロマトグラフィー;FPLC =高速タンパク質液体クロマトグラフィー;HTT =ハンチンチンタンパク質。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、イムノアッセイおよびMSアッセイ開発の標準物質、ウェスタンブロット解析のコントロール、および構造機能研究に使用するのに適した純度と均質性を備えた複数のFL HTTタンパク質コンストラクトを生成するための一過性トランスフェクション、発現、および精製方法について説明します。この一過性発現法はスケーラブルで汎用性が高く、ユーザーは、安定した細胞株または前述のウイルスベースの方法を使用するよりも効率的に低ミリグラム量のFL HTT変異体を生成することができます21、22、23、24。通常、プラスミドが構築されると、一過性発現法を使用して、2 Lスケールのタンパク質生産から2〜5 mgの高度に精製されたFL HTTを1週間未満で生成でき、細胞培養1リットルあたり1〜2.5 mgのFL HTTの典型的な収量が得られます。
ここで説明する一過性発現法は、細胞株の樹立に要する時間が長いことや、安定した細胞株の保存・維持の難しさなど、安定した細胞株発現における多くの障害を克服します。また、PEIは市場に出回っている他のトランスフェクション試薬と比較して比較的安価であるため、大規模なトランスフェクションを経済的に実行可能です。トランスフェクションの効率は、プラスミドの品質、最適な細胞増殖、およびPEIの保存と調製の程度に大きく依存します。オペレーターは、タンパク質収量の大幅な低下を回避するために、これらの重要なステップで特別な注意を払い、品質管理を実行する必要があります。プロトコルで使用される抗FLAG樹脂も比較的高価であり、数回の精製および再生後にFL HTTの捕捉が減少しています。一部の研究者は、親和性樹脂のより堅牢な再生を可能にするために、別のタグに切り替える方が実用的であると感じるかもしれません。
FL HTT発現レベルを最適化するために、様々な細胞株および発現条件を試験した。HEK293細胞は、タンパク質の発現が高く、浮遊培養フォーマットでの取り扱いが容易であるため、FL HTTの発現に選択され、シェーカーまたはバイオリアクターでの大規模発現に適しています。通常の温度である37°Cを使用するのではなく、32°Cなどの低い培養温度でより高いFL HTTタンパク質発現レベルを達成できます。 温度が低いとタンパク質合成が遅くなり、FL HTT40の正しい折り畳みが促進される可能性があります。ただし、この現象は、FL HTTまたはテストされた細胞株に特異的ではありません。トランスフェクション後の温度の低下は、CHO細胞における医薬品タンパク質発現に広く使用されています。メカニズムは完全には理解されていませんが、低温はG1期の細胞周期を停止させ、細胞エネルギーをタンパク質産生に向けると考えられています41。
哺乳動物細胞から精製された全長HTTは、シャペロンHsp7024と共溶出し、かつMg−ATP洗浄ステップにより、Hsp70タンパク質を除去することができる。興味深いことに、共溶出したHsp70は、昆虫細胞発現系21、22、23から精製されたFL HTTでは観察されない。これは、哺乳類細胞および昆虫細胞におけるFL HTTの過剰発現に対するFL HTTまたは熱ショックタンパク質応答のPTMの違いを反映している可能性があります。組換えタンパク質からHsp70が除去されたら、FL HTTの単量体形態を安定化させるために、CHAPSやDDMなどの非イオン性界面活性剤が必要です。
FL HTT変異体のオリゴマー化状態は、Blue Native PAGEおよびSEC-MALSを用いて解析した。二量体および高次オリゴマーHTTのごく一部は、Blue Native PAGEまたはSEC-MALSのいずれかで分析した場合に存在していました。注目すべきことに、FL HTTによって形成される高次オリゴマーはpolyQ長と相関していないようであり、Exon1欠失変異体でさえ同様のオリゴマー-二量体-モノマー比を示します。これらのコンストラクト間のオリゴマー含有量の実際の変動は、各バッチの製造および取り扱いにおけるわずかな違いによるものと考えられる。HTT Exon140,41によって形成された凝集体およびフィブリルとは対照的に、FL HTTの高次オリゴマーは可溶性のままであり、SECおよびNative PAGEによって分析することができた。
精製されたモノマーFL HTTは比較的安定です。4°Cでの長期保存、室温での短時間のインキュベーション、または1 mg/mLの濃度>、これらの条件下で目に見える沈殿が観察されなくても、単量体FL HTTはすべて二量体および高次オリゴマー型に変換されます。≤1 mg/mLに維持された精製モノマーFL HTTは、前述のように、保存バッファー(50 mM Tris、pH 8.0、500 mM NaCl、5% v/vグリセロール、0.5% w/v CHAPS、および5 mM DTT)中で-80°Cで比較的安定なままでした24。この方法で調製および保存されたFL HTTの最大6回の凍結融解サイクルは、タンパク質の目に見える沈殿を引き起こしませんでしたが、SEC-MALSによってより高いオリゴマー状態へのわずかなシフトが観察されました(補足図S2)。サンプルは、凍結融解サイクルを繰り返した後、SDS PAGEによっても分析されました。目に見える沈殿物は観察されませんでした。SDS-PAGEでは凝集体や追加の分解生成物は見られませんでした(補足図S3)。精製されたFL HTTの長期安定性はまだ調査中です。決定的な長期データがない場合は、精製したFL HTTを-80°Cで6か月以内に保存することをお勧めします。
高品質の組換えFL HTTタンパク質変異体とその製造方法は、HD研究コミュニティから高い需要があります。これらのタンパク質は、イムノアッセイおよびMS分析標準として、構造研究において、ならびに新規FL HTT特異的アッセイの開発に使用されています。ここで説明する大規模な一過性発現法は、>95%の純度でミリグラム量のFL HTTバリアントを一貫して生成し、HTT研究に不可欠なツールを提供します。HD研究を支援するために、数十ミリグラムの高度に精製されたFL HTT polyQバリアントおよびその他の変異体の産生が日常的になっています。
開示事項
著者は、この記事の内容と利益相反がないことを宣言します。
謝辞
HTTのMS分析を実施してくれたニューヨーク州立大学バッファロー校の薬学部に感謝します。この作業は、CHDI財団との共同作業でした。エリザベス・M・ドハティに特に感謝します。イグナシオ・ムニョス・サンフアン;ダグラスマクドナルド、CHDI財団;ロリー・カーティス、キュリア、この原稿の準備中の彼らの貴重な意見のために。また、ミケーレ・ルーチェ、ミスラ・マフモウディ、ステファニー・フォックスがこの研究活動を支援してくれたことに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
参考文献
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846 (2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184 (2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055 (2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54 (2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved