このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
同時光遺伝学的変調と電気的神経記録のためのオプトロードアレイ
* これらの著者は同等に貢献しました
要約
ここでは、光伝達用光ファイバと神経記録用電極アレイを用いたオプトロードシステムの製造方法について紹介する。チャネルロドプシン-2を発現するトランスジェニックマウスを用いた インビボ 実験は、同時光遺伝学的刺激および電気生理学的記録のためのシステムの実現可能性を示す。
要約
過去10年間、光遺伝学は、選択的神経調節またはモニタリングの独自の能力のために、神経シグナル伝達の調査に不可欠なツールとなっています。特定のタイプのニューロン細胞をオプシンタンパク質を発現するように遺伝子改変することができるので、オプトジェネティクスは、選択されたニューロンの光刺激または阻害を可能にする。光遺伝学のための光学系にはいくつかの技術的進歩がありました。最近、光送達のための光導波路と電気生理学的記録を組み合わせて、光遺伝学的刺激または阻害に対する神経応答を同時にモニターすることが提案されている。本研究では、マルチチャネル電極を埋め込んだ埋め込み型オプトロードアレイ(2x2光ファイバ)を開発しました。
光源として発光ダイオード(LED)を用い、微細加工したマイクロレンズアレイを集積し、光ファイバの先端に十分な光パワーを与えた。オプトロードアレイシステムは、使い捨て部品と再利用可能な部分で構成されています。使い捨て部品には光ファイバと電極があり、再利用可能な部分には光制御と神経信号処理用のLEDと電子回路があります。移植可能なオプトロードアレイシステムの新規設計は、オプトロド移植手術、光遺伝学的光刺激、および電気生理学的神経記録の手順に加えて、添付のビデオで紹介されている。 in vivo 実験の結果は、マウスの海馬興奮性ニューロンからの光刺激によって誘発される時間ロックされた神経スパイクを首尾よく示した。
概要
神経活動の記録と制御は、脳がニューラルネットワークや細胞レベルでどのように機能するかを理解するために不可欠です。従来の電気生理学的記録方法は、マイクロピペットを用いたパッチクランプ1,2,3,4およびマイクロニューラル電極5,6,7,8を用いた細胞外記録を含む。神経調節法として、電気刺激は、神経細胞の直接的または間接的な脱分極を介して焦点脳領域を直接刺激するために頻繁に使用されてきた。しかし、電気的方法は、電流があらゆる方向に広がるため、記録または刺激のための神経細胞型を区別することができない。
新興技術として、光遺伝学は、神経系がどのように機能するかを理解する上で新しい時代を先導しました 9,10,11,12,13,14,15,16.光遺伝学的技術の本質は、遺伝子組み換え細胞によって発現される光感受性オプシンタンパク質の活性を制御するために光を使用することである。したがって、光遺伝学は、複雑な神経回路14、17における遺伝的に選択された細胞の洗練された調節またはモニタリングを可能にする。光遺伝学的アプローチのより広範な使用は、光学的神経調節を直接確認するために同時神経記録を必要としてきた。したがって、光制御および記録機能を備えた統合デバイスは、16、18、19、20、21、22、23、24、25と非常に貴重であろう。
従来のレーザーベースの光遺伝学的刺激には限界があり、これはかさばる高価な光送達システム26、27、28、29、30を必要とする。したがって、いくつかの研究グループは、光送達システム31、32、33、34のサイズを最小限に抑えるためにμLEDベースのシリコンプローブを採用した。しかし、LEDのエネルギー変換効率が低いため、μLEDとの直接接触による熱脳損傷のリスクがあります。光ファイバ、SU-8、および酸窒化ケイ素(SiON)などの光導波路は、熱的損傷を避けるために適用されている30、35、36、37、38、39。しかし、この戦略には、光源と導波路間の結合効率が低いという欠点もあります。
マイクロレンズアレイは、LEDと光ファイバ40との間の光結合効率を高めるために予め導入した。オプトロードシステムは、マイクロスケール40での光刺激および電気記録のためのマイクロエレクトロメカニカルシステム(MEMS)技術に基づいて開発された。LEDと光ファイバ間のマイクロレンズアレイにより、光効率が3.13dB向上しました。 図1に示すように、2x2光ファイバアレイが4x4マイクロレンズアレイ上に整列され、LEDがマイクロレンズアレイの下方に配置される。脳の損傷を軽減するために、4x4の代わりに2x2光ファイバが取り付けられています。タングステン電極アレイは、電気生理学的記録用のシリコンビアホールを使用して、オプトロードアレイに隣接して配置される(図1B)。
システムは、上部の使い捨て部品と取り外し可能な下部部品で構成されています。光ファイバアレイ、マイクロレンズアレイ、タングステン電極アレイを含む上部の使い捨て部品は、 in vivo 実験のために脳に永久に移植されるように設計されています。下部にはLED光源と外部電源ラインが含まれており、簡単に取り外し可能で、別の動物実験に再利用できます。取り外し可能な部分を取り外すと、取り付け可能なプラスチックカバーが使い捨て部品を保護します。
このシステムの実現可能性は、Ca2+/カルモジュリン依存性プロテインキナーゼII陽性ニューロン(CaMKIIα::ChR2マウス)においてチャネルロドプシン-2(ChR2)を発現するトランスジェニックマウスの脳への移植によって検証される。記録電極は、ニューロンの光刺激中に個々のニューロンからの神経活動を記録するために使用された。
プロトコル
動物の世話と外科的処置は、梨花女子大学の施設動物ケアおよび使用委員会(IACUC)によって承認されました(番号20-029)。
1. オプトロードアレイの作製(図1、図2)
- マイクロレンズアレイに光ファイバを取り付けます。
- 光ファイバのパッシベーションコーティングを除去し、精密光ファイバクリーバーを用いて長さ5mmの小片に切断する。
- 光ファイバを透明なUVレジンに浸し、マイクロレンズアレイ上に光ファイバを配置します。
- UVランプを用いて樹脂を硬化させる。
- エポキシを使用してマイクロレンズアレイを3Dプリントされたハウジングに取り付けます。
- パーフルオロアルコキシ(PFA)コーティングされたタングステン線を整列させます。
- 長さ30mmのPFAタングステン線4本と銀線1本を5ピン、1.27mmピッチのメスコネクタにはんだ付けします。参照電極として銀線を使用してください。
- 1.27 mmピッチのメスコネクタをヘッドステージプリアンプに接続します。
- タングステン電極の微調整を助けるために、タングステンワイヤを穴(図1B)を介してシリコンに慎重に通します。
- 整列したタングステン線を光ファイバ長より1mm短く切断する。
- エポキシを使用してコネクタを 3D プリントされたハウジングに接続します。
- LEDの配置
- LEDを3Dプリントされたハウジングに配置します。
- パルス幅変調(PWM)を生成する駆動回路にLEDを接続します。
メモ:PWMパルスはマイクロコントローラによって生成されます。 - LED駆動回路によって誘起されるノイズを考慮して、記録電極がLED駆動回路から50mm離れていることを確認してください。
- フォトダイオードを用いて光ファイバ先端の端部の光強度を測定する。
- タングステン電極と光ファイバをアルコールに15分間浸漬する。次いで、システムを滅菌D.I水に浸漬し、エチレンオキシドガスで滅菌する。
2. 移植手術(図3、図4)
注:手術中は滅菌技術に従わなければなりません。
- 特定のタイプのニューロン細胞において光感受性オプシンタンパク質を発現するように遺伝子改変されたトランスジェニック動物を準備する。
注:Ca2+/カルモジュリン依存性プロテインキナーゼII陽性ニューロンでチャネルロドプシン-2(ChR2)を発現する生後2ヶ月の雄のトランスジェニックマウス(CaMKIIα::ChR2マウス)を本研究で使用した41。 - ケタミン - キシラジンカクテル - ケタミン(100mg / kg)とキシラジン(10mg / kg)の混合物 - 腹腔内投与によりマウスを麻酔する。
- 30分ごとに麻酔をかけられた動物を、ひげの動きと足のピンチに対する反応を監視してチェックしてください。
- 追加の麻酔が必要な場合は、ケタミン - キシラジンカクテルを初期用量の半分で注射する。
- 頭の皮膚を剃り、麻酔をかけられたマウスを定位フレームに入れます。
注:外科的皮膚準備とドレープ動物を行います。皮膚調製物は、脱毛に続いて抗菌剤による皮膚の洗浄を含む。- 定位フレーム内に頭を置き、イヤーバーをミータスに挿入します。
- マウスヘッドを定位フレームの中央に配置し、イヤーバーを緩めたり締めたりして、正確な位置決めを繰り返します。
- 上側の切歯が前面内側の端に引っ掛かるように切歯バーを置きます。
- 切歯バーの高さを設定するために切歯バーを調整し、鼻に対してノーズクランプを締め付けます。
- 定位フレームに埋め込まれた熱加熱パッドを事前にオンにして、手術中、体温を37°Cに維持してください。
- 熱プローブをマウスの直腸に入れ、恒常性調節を行います。
メモ:イヤーバーの配置は、鼻を軽くつかんで振って確認する必要があります。鼻を横方向に約4mm以上動かすことができる場合は、イヤーバーを再調整する必要があります。
- 乾燥を防ぐためにワセリン( 材料表を参照)で目を覆う。
- 頭皮に1%のリドカインを注入する。鉗子で頭の皮膚を持ち上げ、注射スペースを確保し、頭皮の下にリドカインを注入する。
- メスと細かいはさみを使って矢状切開を行います。切開した皮膚をマイクロクランプで保持し、手術領域の視認性を広げます。
注:切開の長さは、頭頂間骨のブレグマおよび尾縁から<1cm上である。 - 綿棒を使用して骨膜を除去します。出血がある場合は、血管を密封するために牛肉を使用して頭蓋骨を焼灼する。
- 頭蓋骨を生理食塩水で清掃し、マニピュレーターアームを使用して開頭部位に印を付けます:海馬前後部(AP)-1.8〜-2.8mm、内側側方(ML)0.5〜2.5mm、および背側腹(DV)-1〜-2mm。
メモ:マウスの頭蓋骨の厚さを考慮して、露出した脳領域から-1.2〜-2.2mmのオプトロードアレイを挿入します。海馬経路を考えると、CA3の錐体細胞は軸索をCA1に送る。したがって、光ファイバは記録電極よりも1mm長いため、光ファイバはCA3に配置され、記録電極はCA1に配置される。 - 小脳の上に穴を開け、地面にネジを差し込みます。アースネジを精密ネジで深さ0.5mm、小脳の上部に達するまで入れます。
注:歯科用セメントの接着のために3次元表面を増加させるため、接地電極および支持構造として使用されるネジをしっかりと挿入して、移植の長期安定性を最大化してください。 - マークされた領域をドリルし、鉗子で頭蓋骨の一部を取り除きます。
- 26Gの針先を時計回りに120°曲げ、針の面取り側を上向きに挿入して脳領域を露出させます。脳や血管を傷つけないように注意してください。
- 露出した脳を生理食塩水できれいにして、骨粉や無関係な物質を洗い流します。
- マニピュレータアームにオプトロードアレイを固定し、露出した部分の近くに移動します。
メモ:デバイスを配置するときに、ブレグマからターゲット領域を再度計算すると、配置の精度が向上する可能性があります。 - オプトロードアレイをゆっくりと挿入し、アースネジをシステム42に取り付けられた銀線に接続する。
メモ:このプロセスでは、挿入中の微小運動による脳の損傷を防ぐために、揺れを最小限に抑えるために、アレイをマニピュレータアームにしっかりと固定する必要があります。挿入はゆっくりと行い、挿入後に押された可能性のある脳の腫れを説明するために10分間休ませなければならない。脳組織への1μm/s未満の挿入速度は、高品質の信号対雑音比および分離可能な単一ユニット42の数のために推奨される。 - 出血がある場合は、乾いた綿棒で出血者に直接圧力をかけるか、焼灼を使用してください。出血が完全に止まるまで次のステップに進まないでください。
- 露出した脳とデバイスの間にゲルフォームを挿入して、化学物質を脳との直接接触から保護します。
注:ゲルフォームはまた、止血を助け、脳を湿らせます。 - 綿棒で頭蓋骨を拭いて水分をできるだけ取り除き、次の固定ステップに進みます。
- 頭蓋骨に歯科用セメントを慎重に塗布して装置を固定し、ゲルフォームを覆う。歯科用セメントが完全に硬化する前に、歯科用セメントに取り付けられている場合は頭皮を分離してください。硬化した歯科用セメントを覆うために鉗子で切開した皮膚を引っ張り、頭皮を縫合する。次に、マニピュレータアームからデバイスを離します。
注:歯科用セメントが皮膚にくっつかず、頭蓋骨領域のみを覆っていることを確認してください。皮膚が成長すると、セメントを押しのけることができ、最終的には装置が脱落します。これは、長期的な in vivo 実験にとって重大な問題を引き起こすであろう。
3. 回復とインプラントケア
- マウスを定位フレームから取り出します。
- 26G針を用いてカルプロフェン溶液を投与する。痛みを軽減するために、手術前に1回、午後の手術の場合は翌朝、手術後24時間で1回注射してください。
注:ボトル内の薬物濃度は50mg/mLで、4°Cで保存されています。 カルプロフェンは粘性があり、滅菌水で1:10に希釈する必要があります。無菌性が維持されている場合、溶液は最大4週間保存することができる。薬物の有効持続時間を維持するために、カルプロフェン溶液を12時間間隔で注入する。 - マウスを加熱パッドの上に置き、麻酔からうまく回復するかどうかを確認します。
注:動物は十分な意識を取り戻すまで放置されません。 - 手術後7〜10日で縫合糸を除去します。
- 動物が1週間回復するのを許してください。回復時間中に食物と水の摂取量を監視します。鎮痛剤を投与し、不快感や痛みの兆候を確認してください。
注:手術を受けた動物は、完全に回復するまで他の動物と一緒にいることはできません。- 回復期間中、毎日マウスの体重を量って体重の変化を確認します。年齢および性別が一致した対照動物と比較して20%の体重減少がある場合(セクション6を参照)、マウスを犠牲にする。
4. 光遺伝学的刺激と電気生理学的記録
- マウスを麻酔し、麻酔をかけられたマウスを定位フレームに配置する。
- 刺激パラメータを設定します。
- 光パルスレシピを4%デューティサイクル、10Hz周波数43に設定します。神経記録中に2秒間(20パルス)の光刺激を設定します。
- 50mAの電流を使用して、光ファイバ先端で3mW/mm2 の光強度を駆動します。フォトダイオードとパワーメータを用いて光パワーを測定し、光パワーを光ファイバファセット面積で除算します。
- プラスチックカバーを外し、ライトデリバリーシステムを含む上部に再利用可能なLEDと回路を取り付けます。
- ヘッドステージプリアンプを埋め込み型5ピンコネクタに接続します。
- ソフトウェアを開いて神経信号を記録します。
- ソフトウェア・フィルターをセットアップします。0.1 ~ 20 kHz のバンドパスフィルタと 60 Hz のノッチフィルタを使用します。アンプのサンプリングレートを 20 kHz に設定します。
- 記録する前に、ニューラルスパイク信号が検出されたかどうかを確認します。
メモ: ニューラル信号が小さすぎるため、ノイズキャンセレーションは重要です。ノイズレベルが高すぎると、神経信号がノイズによって覆い隠され、見えなくなる可能性があります。適切な接地と電磁波シールドを使用して、ノイズを低減します。 - 信号チェックの後、ベースライン記録のために光刺激なしで神経信号を記録します。
- LEDライトを照射し、同時にニューロン応答を記録します(図5 と 図6)。
注:刺激を受けたら、次の刺激実験は、前の刺激によって誘発されたニューロン活動が次の実験に影響を与えないように、少なくとも5分の間隔の後に行わなければならない。
5. データ解析
- MATLABプログラムを使用して集録したデータをロードします。
- スパイクソートアルゴリズム「Wave-Clus」44,45を使用して単一の神経活動を取得します。各チャンネルのスパイクをEq(1)45のように振幅スレッショルドで検出します。
しきい値 = 5 ×中央値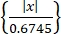 (1)
(1)
ここで、x はバンドパスフィルタ処理された信号です。- 「Wave-Clus」をインストールするには、 資料表のダウンロードリンクを参照してください。
- グラフィカル ユーザー インターフェイス (GUI) を開くには、MATLAB のコマンド プロンプトで wave_clus と入力します。
- スパイク検出用に準備されたファイル拡張子に Get_spikes('filename.ext') 関数と入力します。次に、スパイクソートのために Do_clustering('filename_spikes.mat') を実行します。
- 光刺激の前、最中、および後にソートされたスパイクを特定の時間ビンでカウントします。分析には 0.2 秒と 2 秒の時間ビンを使用します。
- 各録音チャンネルからのスパイク数をプロットします。
注:平均の標準誤差(SEM)を用いて、8回の繰り返し実験の結果からデータを算出し、プロットした。
6. 安楽死
- 全ての実験の後、二酸化炭素(CO2)吸入によりマウスを屠殺する。
- チャンバーを予備充電せずに、CO2 の供給および/または漏れのない透明な安楽死チャンバーにマウスを置きます。
- CO2ガスをオンにし、毎分安楽死室の空気の体積の30〜50%の割合で空気を置換する。
注:流量計をCO2 ガスボンベに接続して、空気置換率が1分間に安楽死チャンバの容積の30〜50%になるようにする必要があります。 - 屠殺されたマウスの呼吸不足を監視し、目の色を変えた。
注:安楽死の予想時間は通常10〜15分以内です。 - 死の兆候を観察した後、安楽死室からマウスを取り外します。
- 安楽死手順を完了するには、呼吸停止と心停止を確認して死亡を確認します。
結果
オプトロード系は、標的ニューロンを活性化するのに十分な光力を提供するために首尾よく作製される。タングステン電極の微細位置合わせは、孔を介して微細加工されたシリコンを介して達成される。測定された光強度は、50mAの電流を印加したときの光ファイバ先端で3.6mW/mm2 です。マイクロレンズは光効率を3.13dB向上させた。光結合を強化するマイクロレンズアレイのために、印...
ディスカッション
光遺伝学的刺激と電気生理学的記録を同時に行うためのシステムの実現可能性を検証した(図6)。光刺激中の大きなスパイクは、光刺激と同時に発生する光電アーチファクトです(図6A)。これは、赤色の破線の長方形の波形のズーム表示で明らかです(図6A)。図6Aに示すように、記録された波形から光電気ア...
開示事項
著者らは、開示する利益相反はありません。
謝辞
この研究は、韓国国立研究財団(NRF)を通じたConvergent Technology R&D Program for Human Augmentationの支援を受け、科学情報化部(NRF-2019M3C1B8090805)が資金提供し、韓国政府(MSIT)が資金提供する韓国国立研究財団(NRF)助成金(No. 2019R1A2C1088909)の支援を受けました。韓国大田(テジョン)のKAIST生物科学科にあるイ・スンヒ氏の研究室には、トランスジェニックマウスを提供してくださったことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
参考文献
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved