このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞レベルで真菌 - 微生物相互作用をプロービングするためのマイクロ流体ツール
要約
土壌の不透明度のために、その構成微生物間の相互作用は、細胞分解能で容易に視覚化することができない。ここでは、真菌と微生物の相互作用を調査するための新しい機会を提供する2つのマイクロ流体ツールを紹介します。これらのデバイスは汎用性と使いやすさを備えており、細胞レベルでの高時空間制御と高解像度イメージングを可能にします。
要約
糸状菌類は土壌の成功した住人であり、有機物や無機物の分解、栄養レベルの調節など、土壌生態系において大きな役割を果たしています。彼らはまた、細菌や他の真菌のような様々な他の微生物と相互作用する機会を数多く見つけます。しかし、細胞レベルで真菌の相互作用を研究することは、土壌のブラックボックスのような性質のために困難な場合があります。真菌相互作用の研究のために新しいマイクロ流体ツールが開発されています。細菌 - 真菌および真菌 - 真菌相互作用を研究するために設計された2つのプラットフォームが強調表示されています。これらのマイクロチャネル内では、真菌 - 微生物相互作用は、制御された物理化学的環境において、以前よりも高い時間的および空間的分解能で監視することができる。これらのツールの適用は、菌糸への細菌極性付着の観察や、特徴のない真菌 - 真菌拮抗作用の暴露など、多数の新しい生物学的洞察をもたらしてきた。これらの方法論の主な特徴は、非専門家によるこのツールの使いやすさであり、微生物学ラボで使用するための高度に翻訳可能な技術を生み出していることです。
概要
土壌は、炭素とリンのサイクルに不可欠な微生物を豊富に含む非常に多様な環境です1,2。糸状菌は、有機物および無機物の分解剤として多数の生態系の主要な構成要素であり、共生関係の形成を通じて植物の栄養を高めることができる3,4。土壌内では、真菌は、他の真菌5、細菌6、ウイルス7および線虫8などの多数の微生物と動的に相互作用する。これらの相互作用は、土壌と植物の健康に重大な影響を及ぼします。しかし、相互作用する微生物を高解像度でイメージングできる適切な実験システムがないため、多くは未定義のままです。
細菌-真菌相互作用(BFI)および真菌-真菌相互作用(FFI)に関する研究は、医学における抗菌剤および農業における生物学的防除剤を含む幅広い分野で貴重な用途を有する。例えば、真菌コプリノプシス・シネレアはペプチドコプシンを産生し、これはヒト病原体リステリア・モノサイトゲネス9に対して抗菌活性を示すことが示されている。同様に、真菌由来化合物であるグリセオフルビンは、ヒト真菌感染症の治療薬として広く使用されており、植物病原性真菌Alternaria solani10,11の増殖をさらに阻害することができる。土壌に生息する細菌バチルス・サチルスのいくつかの菌株もまた、真菌性植物病原菌リゾクトニア・ソラニ12、13の有効な生物防除剤であることが実証されている。それにもかかわらず、従来の方法論に関連する制限のために、BFIおよびFFIは単一細胞レベルではあまり理解されていない。
従来の研究では、通常、2種以上の種が対立する寒天プレートを使用して、マクロスケールでBFIおよびFFIを探索します。それらの相互作用は、対峙する種の増殖速度および代謝産物産生を測定することによって評価される14,15,16;しかし、この方法論はコロニーレベルにのみ解決されています。細胞レベルでの相互作用を研究するために、細菌および真菌接種剤を、寒天でコーティングしたガラス顕微鏡スライド上で培養し、次いで顕微鏡17下で画像化することができる。それにもかかわらず、閉じ込められていないため、顕微鏡スライドを使用して単一の菌糸をたどることは困難であり、タイムラプス画像を得るのが難しくなることを意味する。さらに、真菌菌糸体の定義された領域内に他の微生物を空間的に閉じ込めたり、摂動し得る定義された化学的環境を作り出す機会は、例えば、そのようなセットアップでは不可能である。土壌の「ブラックボックス」の性質はまた、単一細胞レベルでの真菌 - 微生物相互作用の研究の複雑さを増す18。土壌マイクロバイオームの信じられないほどの多様性から離れて相互作用する種を観察することによって、個々のメンバーが相互作用する正確な方法を評価することができます。したがって、BFIおよびFFIの高解像度、単一細胞イメージングを可能にする汎用性の高いプラットフォームが引き続き必要とされています。
マイクロ流体技術、いわゆるラボオンチップシステムは、単一細胞レベルでのBFIおよびFFIの研究に理想的なプラットフォームを提供します。マイクロ流体学の分野は、化学分析やマイクロエレクトロニクスのために開発された技術に由来し、生物科学19によって採用されています。マイクロ流体技術は、マイクロメートルスケールで少なくとも1つの次元を有する、小型化されたチャネルのオーダーメイドネットワーク内で少量の流体を調節し、生物学的研究におけるそれらの使用は20拡大している。特に、糸状菌21、22、23、24、25、26、27、28、29、30の生育を調べるためにマイクロ流体デバイスが開発されている。この技術を使用する利点の1つは、菌糸の閉じ込めおよびマイクロチャネル内の栄養素の分布が、従来の寒天法31よりも土壌環境の構造によく似ていることである。最近、マイクロ流体プラットフォームは、ヒト好中球と真菌病原体32、細菌と植物の根33、ならびに真菌と線虫34、35との間の相互作用を調査するために使用されている。
微生物相互作用を研究するためにマイクロ流体学を使用することの多くの利点の1つは、マイクロ流路環境の特定の制御を含む。例えば、層流レジームを利用して、定義された濃度勾配を生成することができ、これは、細菌の走化性36を調べる際に特に有用である。別の利点は、マイクロ流体装置の製造に一般的に使用される安価で生体適合性のエラストマーポリマーであるポリ(ジメチルシロキサン)(PDMS)の透明な性質が、明視野および蛍光顕微鏡を用いた単一細胞の高解像度イメージングを容易にすることである37。同様に、マイクロチャネル内に微生物が閉じ込められるということは、単一細胞を追跡するタイムラプス実験を実施できることを意味し、個々の細胞応答を記録し、定量化することができる37。最後に、マイクロ流体デバイスは、ユーザーフレンドリーであるように設計することができるので、非専門家38によって容易に使用することができる。
土壌に生息する微生物間の相互作用に関する知識を深めることは、生物多様性を維持し、気候変動が陸域環境に与える影響を緩和する持続可能な生態系管理慣行を改善するために重要である39。したがって、新しいマイクロ流体ツールの開発は、真菌とその相互作用の細胞レベルでの理解を広げるための基本です。ここでのプロトコルは、図1に示すように、BFIs40およびFFI41の研究のために製造された2つのマイクロ流体デバイスに焦点を当てます。

図1:細菌 - 真菌相互作用(BFI)および真菌 - 真菌相互作用(FFI)デバイスの視覚的および概略図。菌糸プラグは、マイクロチャネルの一端への入り口に配置され、装置への菌糸の成長を可能にする。細菌入口は反対側の端にある。(B)BFI装置の概略概要、相互作用マイクロチャネルを通る細菌入口の位置決めおよび菌糸増殖の方向を描写する。チャンネルは深さ10μm、幅100μm、長さ7mmで、合計28の観測チャンネルがあります。(c)コプリノプシス・シネレアと枯草菌NCIB 3610との間の寒天プレート上での対決アッセイ、スケールバー=20mm(左)。マイクロ流路内(中央および右)内のC.シネレアと枯草菌NCIB 3610との間の相互作用、すなわち真菌菌糸への細菌の極性付着を示す顕微鏡観察画像。スケールバー = 25 μm (中央) と 10 μm (右)。(d)FFI装置をガラス底のシャーレに貼り合わせ、菌糸栓を二重接種した画像。スケールバー = 1 cm. (E) FFIデバイスの概略概要。2つの真菌接種プラグが装置の両端の入口に導入され、マイクロチャネルの菌糸探索を可能にする。制御チャネルは、1つの真菌入口にのみ接続され、デッドエンドチャネルを有し、試験真菌間の相互作用を防止する。相互作用チャネルは、両方の真菌入口を接続し、マイクロチャネル内の試験対象間の菌糸相互作用を可能にする。各相互作用チャネルは、18個のダイヤモンド状のセクションで構成され、全長8.8mm(ダイヤモンドあたり490 x 430 μm)、深さ10 μm、各ダイヤモンド間の接続領域は20 μmです。チャネルタイプは複製され、スケールバー = 1 mm. (F) 相互接続された相互作用チャネルの両端から成長する、接近する2つの菌糸前部間の相互作用ゾーン。位相差顕微鏡観察像は、スケールバー=250μmである。この図のパネルは、Stanley et al., 2014 (A-C)40 および Gimeno et al., 2021 (D-F)41 から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
メモ: このプロトコルで概説されている手順の概要を 図 2 に視覚的に示します。
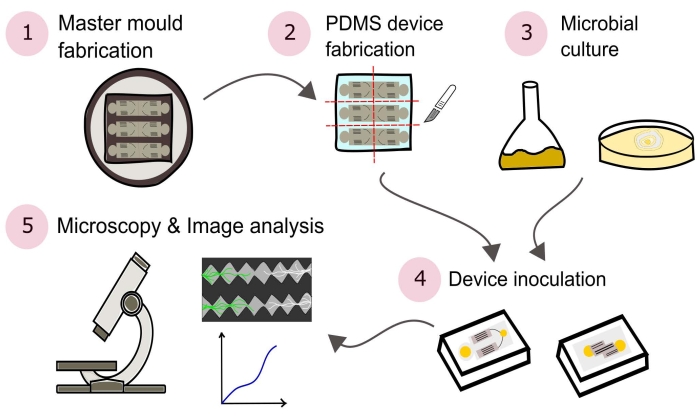
図2:このプロトコルで詳述されている5つの主要なセクションからなる提示された方法論の概略図。 デバイス設計は、コンピュータ支援設計(CAD)ソフトウェアとフォトリソグラフィー(1)を使用して製造されたマスターモールドを使用して作成されます。これは、ポリ(ジメチルシロキサン)(PDMS)を鋳造するために使用され、その後、スラブにダイシングされ、ガラス底のペトリ皿に接着されてマイクロ流体デバイス(2)を形成する。研究に含まれる微生物は培養され(3)、装置を接種するために使用される(4)。相互作用は顕微鏡法を用いて研究され、画像解析技術を用いて定量化される(5)。 この図の拡大版を表示するには、ここをクリックしてください。
1. マスターモールド製作
- フォトマスク製造
- コンピュータ支援設計(CAD)ソフトウェアを使用してマイクロ流体デバイス設計を生成します。提示された装置の寸法は 図1 に与えられ、特定の設計特徴に関するより詳細な詳細は、それぞれの刊行物40、41に包括的に列挙されている。
- CAD 設計ファイルを適切な形式 (.dwg、.dxf など) を使用してエクスポートします。エクスポートしたCADデザインファイルを印刷用の商用プロバイダーに送信して、フィルムフォトリソグラフィマスクを印刷します。
- 写真石版
メモ: 次の手順は、層流フードやクリーンルーム設備など、ほこりがなく、光が制御された環境で実行する必要があります。ここで提供する実験条件は目安であり、社内で最適化する必要があります。著者らは、確立されたプロトコル42に特定のトレーニングとコンサルティングを求めることを推奨している。- 200°Cのオーブンで2時間焼成することにより100mmシリコンウェーハを作製した。シリコンウエハーをSU-8 2010フォトレジストでスピンコートし、目標膜厚10μmを目指し、500rpmで10秒(加速100rpm/s)、3,000rpmで45秒(加速度300rpm/s)の条件で塗布します。
警告: SU-8フォトレジストは危険ですので、取り扱いには注意し、吸入や皮膚への接触を防止してください。それは可燃性であり、潜在的に発癌性であり、環境に有毒である。 - コーティングされたシリコンウェーハを95°Cで2.5分間ベイクする(ソフトベーク)。フィルムフォトリソグラフィーマスクを使用し、マスクアライナーを使用して365nm波長で140mJ/cm2 のエネルギー線量でフォトレジストを紫外線(UV)光に露光する。
- 塗布したシリコンウェーハを95°Cで3.5分間ベークする(露光後ベーク)。シリコンウェーハを現像液に3分間浸漬して攪拌し、未露光のフォトレジストを除去することにより微細加工構造を明らかにする。
警告: 現像液は可燃性になる場合があり、取り扱いや保管の際は適切な注意を払ってください。 - 新鮮な現像液で10秒間すすいでください。イソプロピルアルコールで10秒間すすぎ、風乾します。ろ過された圧縮空気を使用して、構造物が完全に乾燥していることを確認してください。SU−8構造の高さを、例えば、プロフィロメーターを用いて測定する。
- 各マスターモールドを50 μLのクロロトリメチルシランでシラン化し、50 mbarの真空圧力を2時間印加します。著者らは、マスターモールドの再サイラナイゼーションは必要ではないと指摘している。
警告: クロロトリメチルシランは有害物質です。適切な個人用保護具(PPE)を着用し、取り扱いには注意してください。皮膚や目との接触を避け、吸入を防ぎます。発火源から遠ざけ、換気の良い場所で使用してください。
- 200°Cのオーブンで2時間焼成することにより100mmシリコンウェーハを作製した。シリコンウエハーをSU-8 2010フォトレジストでスピンコートし、目標膜厚10μmを目指し、500rpmで10秒(加速100rpm/s)、3,000rpmで45秒(加速度300rpm/s)の条件で塗布します。
2. デバイス製造
メモ: 次の手順は、層流フードなど、ほこりのない環境で実行する必要があります。
- ポリ(ジメチルシロキサン)(PDMS)スラブの調製
- 清潔なプラスチックカップにヘラを入れて、主剤と硬化剤を10:1の比率で十分に混合して、約40gのPDMSを調製する。混合物を脱気し、PDMSを入れたプラスチックカップを真空チャンバ(真空圧力=50mbar)に1時間置いてすべての気泡を除去した。
- マスターモールドを透明なテープを使用してプラスチック製のマウントに固定します。圧縮ろ過された空気を使用して清掃し、ほこりの粒子を取り除きます。
注:あるいは、アルミニウム箔をガラスのペトリ皿の周りに成形し、マスターモールドを収容し、PDMS43を収容するために使用することもできます。 - PDMS混合物をマスターモールドの中央に注ぎ、平らな表面にあることを確認し、沈降させます。
メモ:PDMS混合物は、マスターモールドの表面にできるだけ近づけて注ぎ、気泡の導入を最小限に抑えるために連続的な流れを維持する必要があります。気泡は、圧縮空気を気泡の上に向けるか、細い針を使用してすくい取ることによって除去することができる。 - マスターモールドをプラスチック製の蓋でゆるやかに覆い、PDMSの表面にほこりの粒子が落ち着かないようにします。マスターモールドをオーブンに移し、70°Cで一晩硬化させた。
- オーブンからマスターモールドを取り外し、冷却します。硬化したPDMSをマスターモールドとプラスチックフレームから剥がし、マスターモールド/PDMSの損傷を防ぐように注意してください。
- PDMSにエンボス加工されたマイクロチャンネルの上に透明なテープを貼り、ほこりのない表面を維持します。接着する前にテープが取り外されていることを確認します。
- PDMSをスラブに切断する(すなわち、マスターモールド上の設計に複数の装置が含まれている場合、多くは単一の鋳造から製造できる)ように、取り付けられたギロチンまたはカミソリの刃を使用して設計によって指定される。BFI PDMSスラブの横方向の開口部を切断するときは、マイクロチャネルが完全に開いていることを確認してください(図1A)。FFI PDMSスラブの場合は、 図1Dに示すガラス底のペトリ皿に収まるように各コーナーがトリミングされていることを確認します。
- デバイスの設計に応じて、所望の入口/出口穴をパンチします。精密カッターを使用して、手本となるBFIおよびFFIデバイス用にそれぞれ3.18mmおよび4.75mmの入口穴をパンチします。
- デバイスを作成するためのPDMSスラブの接合
注:以下の洗浄ステップ(2.2.1-2.2.2)では、37kHzの精製水(ddH2O)で満たされた超音波洗浄機を使用します。PDMSスラブを洗浄することは、接合の成功44 を強化し、汚染のリスクを低減するのに役立つ。PDMSスラブを操作するには、マイクロチャネルまたはデバイス表面の損傷を避けるために、清潔な鉗子を使用し、入口穴を使用して持ち上げます。- PDMSスラブを0.5 M NaOHに浸し、5分間超音波処理します。滅菌ddH2O. PDMSスラブを70%エタノール溶液に移し、5分間超音波処理します。滅菌ddH2 0ですすいでください。
- PDMSスラブを滅菌ddH2Oに浸し、5分間超音波処理する。滅菌ddH2OからPDMSスラブを取り出し、濾過された圧縮空気を用いて乾燥させ、滅菌正方形のペトリ皿に入れる。
- PDMSスラブを入れた四角いシャーレを70°Cのオーブンに1時間置いて乾燥させる。オーブンから取り出し、ほこりのない環境で冷ましてください。PDMSスラブの表面からほこりを取り除き、テープやろ過された圧縮空気を使用します。
- プラズマクリーナーを使用して接着するPDMSスラブとガラス底ペトリ皿の表面を、真空圧力0.75mbar、電力50%、コーティング時間1分で活性化します。活性化する(そしてその後接着する)表面をプラズマクリーナーで上向きに置きます。
- PDMSスラブとガラス底のペトリ皿をプラズマクリーナーから取り外し、活性化された表面を互いにコンフォーマルに接触するように静かに配置して接着します。BFI および FFI PDMS スラブを、それぞれ直径 35 mm および 50 mm のガラス底シャーレ (ガラス厚 0.17 mm) に接着します。
メモ:接着時に圧力をかけすぎないように注意してください。これにより、マイクロチャネルが崩壊する可能性があるためです。 - ピンセットでガラス底のペトリ皿からPDMSスラブを引き抜くだけで、接合が成功したことを確認します。目または汎用顕微鏡を使用してデバイスを視覚化し、接種インレットまたはマイクロチャネルの崩壊がないようにします。
注:飽和条件(すなわち、水飽和および/または栄養が豊富な条件)の場合、プロトコルのステップ2.2.7を含めてください。水不飽和条件が必要な場合は、ステップ 2.2.8 に進みます。装置は水か媒体で満たすことができる。 - 接合直後に、BFIデバイス用の所望の溶液(細菌入口および側方開口部)100 μLまたはFFIデバイス用の各入口(合計60 μL)に30 μLの培地をピペッティングして充填する。気泡が存在する場合、PDMSは多孔質であるため、充填後約10分で消散します。
- 滅菌ddH2O(〜100〜200μL)をペトリ皿に加え、湿度を維持する。
3. 微生物培養
注:以下のステップは、真菌および細菌培養のための一般的な微生物学的手順を提供し、所望の微生物に必要な封じ込めのレベルに適した滅菌条件下(すなわち、火炎または微生物学的安全キャビネットを使用)で実施されるべきである。関心のある種について、各セクションの最後に具体例を示す。
- 真菌文化
- 寒天を添加した所望の培養液を調製する。培地を121°Cで15分間オートクレーブした。培地を50°Cまで冷却し、滅菌状態を維持しながら直径9cmのペトリ皿に注ぐ。
- コルクボーラーを使用して、菌糸体を含む寒天の直径4mmのプラグを所望の真菌株の冷蔵庫ストックコロニーから除去し、単離物を活性化する。これは、装置接種前に真菌の標準化された活発な増殖を確実にするために行われる。
注:微生物は、グリセロールストック、すなわち、-70°C41の50%グリセロール溶液中の寒天プラグ上に保存された真菌分離株から活性化することもできる。 - 菌糸体が寒天表面に接するプラグの側面を未接種ペトリ皿の中央に置く。シャーレの上部にある蓋を交換して密封してから、所望の株に適した温度で必要な時間(通常は約3〜4日間)インキュベートします。
注: トリコデルマ・ロシカムの培養条件例:麦芽エキス寒天培地、暗所にて25°Cで48時間インキュベートした。
- 細菌培養
- 所望の細菌単離物をソースストック(例えば、グリセロールストックまたは寒天プレートからの単一コロニー)から寒天プレート上にストリークアウトして、単一の細菌コロニーを達成し、汚染がないようにする45。プレートをフィルムでシールします。
- 個々のコロニーが観察されるまで、目的の単離物に固有の温度および期間でインキュベートする。
- 所望の培養液を調製する。例えば、ddH2O1Lあたり10gのトリプトン、10gのNaClおよび5gの酵母抽出物を加えて、枯草菌の培養のためのLB培地を調製する。培地を121°Cで15分間オートクレーブした。
- 培地を室温まで冷却します。培地を滅菌培養フラスコ内滅菌環境に加える。
- 滅菌接種ループを用いて寒天プレートから単一の細菌コロニーに触れる。接種したループを滅菌培養培地に移し、ループで液体に短時間触れる。
- 滅菌蓋またはホイルを使用してフラスコを密封し、選択した種に適した設定を使用して一晩振とう培養器内に置きます。
注:枯草菌の培養条件の例:i)液体培養-LB培地中で200rpmで37°Cで好気的増殖し、ii)プレート培養-LB寒天プレート上で室温。異なる真菌株の培養の詳細については、FFI/BFI論文40,41を参照されたい。
4. 装置接種
メモ: 次の手順は、滅菌装置を使用して層流フード内で実行する必要があります。
- 真菌接種
- 滅菌コルクボーラー(ø = 4mm)を使用して、3日齢の培養物の周囲にあるコロニーから寒天プラグを除去します(ステップ3.1)。成長する菌糸の前面が無傷のままであることを確認します。
- 真菌の注入口にプラグを導入し、菌糸体側を下にして、菌糸体前面の成長方向をマイクロチャネル開口部に向け、チャネルの菌糸浸潤を促す。
- 2番目の真菌種(FFIデバイスを使用している場合)に対して手順4.1.1-4.1.2を繰り返し、プラグを反対側の入口に導入します。BFI デバイスを使用している場合は、この手順を省略して、手順 4.1.4 に進みます。
- シャーレを透明フィルムで密封し、イメージングが開始されるまで暗闇の中で25〜28°Cでインキュベートする。観察される意図された生物学的事象、例えば、真菌と真菌の対立、および装置内に含まれる種の増殖速度に応じて、事前イメージングインキュベーション時間を決定する。
- 細菌接種
- 一晩培養(ステップ3.2)からの細菌を、ステップ3.2.3で詳述したのと同じ培養培地を用いて1:25の比率で希釈する。37°Cで3時間培養する。
- 遠心分離機を用いてペレット培養物を2000 x g で10分間洗浄することによって細菌を洗浄する。上清を捨て、細胞を所望の量の0.9%w/v塩化ナトリウム溶液に再懸濁する。
- 再度遠心分離し、ペレットを得た。上清を捨て、細胞を液体培地(例えば、 C. cinerea 最小培地をOD600 of 1)に再懸濁する。問題の細菌株のOD600 値を最適化します。
- BFIデバイスをインキュベーターから取り外し、滅菌環境で開きます。細菌導入口への懸濁液10μLのピペット。
注:問題の細菌 - 真菌相互作用の正確な接種タイミングを最適化してください。例えば、 C. cinereaを使用する場合は真菌接種後18時間にBFI装置に細菌を導入する。 - シャーレを透明フィルムで密封し、イメージングが開始されるまで暗所で25°Cでインキュベートする。デバイスを直立して保管します。
5. 顕微鏡と画像解析
- 顕微鏡
注:研究者は、実施する実験の性質と一致する適切なイメージング方法、例えば、反転広視野落射蛍光または共焦点顕微鏡を選択する必要があります。ここでは、具体的な詳細が選択した顕微鏡のセットアップの属性に依存するため、一般的な概要が提供されています。- 顕微鏡コンピュータ、顕微鏡本体(該当する場合)、カメラ、温度制御インキュベーター、および光源の電源を入れます。顕微鏡が正しくセットアップされていること、例えば、Köhler照明がサンプルの均一な照明に対して正しく適用されていることを確認してください。イメージングソフトウェアパッケージを起動します。
注:温度制御されたインキュベーターを使用する場合、実験を開始する前に顕微鏡の温度を数時間平衡化させることが重要です。 - マイクロ流体デバイスをステージインサートに取り付けます。アクティブなステージの移動中にデバイスが外れないように、テープでデバイスが正しく固定されていることを確認します。
- 接種された装置の画像、例えば、シングルポイントまたはタイムラプス実験のいずれかを取得する。BFIおよびFFI装置を用いて実施された実験に関連する包括的な画像化仕様は、それぞれの前述の刊行物40、41に提供される。
注:明視野画像は、位相差顕微鏡を使用して取得し、オートフォーカスソフトウェアと10倍の倍率、0.30 NA(開口数)または20倍の倍率、0.45 NAの対物レンズを使用して、成長チャネルを通る菌糸の増殖を視覚化しました。蛍光レポータータンパク質の励起は、蛍光色素に特異的な波長を有する高出力発光ダイオード光エンジンを用いて達成された。 - 後続の画像処理に適した形式に画像をエクスポートします。たとえば、.tiffのようにします。
- 顕微鏡コンピュータ、顕微鏡本体(該当する場合)、カメラ、温度制御インキュベーター、および光源の電源を入れます。顕微鏡が正しくセットアップされていること、例えば、Köhler照明がサンプルの均一な照明に対して正しく適用されていることを確認してください。イメージングソフトウェアパッケージを起動します。
- 画像解析
注:著者はフィジーをお勧めします46 画像解析用のツールとして使用できますが、他のソフトウェアパッケージも利用できます。以下は、提示されたBFIおよびFFIデバイス出版物からフィジーを使用して実施された画像解析の例です。これらの手順はMacに固有のもので、PCを使用している場合は若干異なる場合があります。
結果
代表的な結果は、手本BFI40およびFFI41デバイスから提示される。菌糸増殖速度の測定は、基本的な顕微鏡技術と組み合わせてこれらの装置を使用して容易に得ることができる。図3A−Bは、C.シネレア菌糸と枯草菌NCIB 3610との間の細菌−真菌相互作用を示す。枯草菌の存在は、同時接種後約5?...
ディスカッション
この記事では、チャネルマイクロフルイディクスを用いた真菌-微生物相互作用の研究のためのプロトコルを提示する。著者らは、これらの装置の汎用性を実証し、研究者の興味に合うように適応させることを目指している。手本となるBFIおよびFFIデバイスを使用して、真菌 - 微生物相互作用を以前にアクセス可能であったよりも詳細に研究することができる。土壌の背景の複雑さと不均一性...
開示事項
著者らは、競合する利害関係を宣言していない。
謝辞
我々は、インペリアル・カレッジ・ロンドンの生物工学科及びレバーハルム・トラスト(研究助成金参照:RPG-2020-352)からの財政的支援を認める。
資料
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
参考文献
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved