このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ポリ(I:C)を用いた妊娠中期の母体免疫活性化の再現モデルの生成による子孫の感受性と回復力の研究
要約
母体感染は神経発達障害の危険因子です。母体免疫活性化(MIA)のマウスモデルは、感染が脳の発達と機能に与える影響を解明する可能性があります。ここでは、MIAにさらされた確実に回復力があり感受性のある子孫を産出するための一般的なガイドラインと手順が提供されています。
要約
妊娠中の母親の免疫活性化(MIA)は、子孫の神経発達障害および神経精神障害のリスクの増加と一貫して関連しています。MIAの動物モデルは、因果関係をテストし、メカニズムを調査し、これらの障害の診断と治療法を開発するために使用されます。広く使用されているにもかかわらず、多くのMIAモデルは再現性の欠如に苦しんでおり、ほとんどすべてがこの危険因子の2つの重要な側面を無視しています:(i)多くの子孫はMIAに対して回復力があり、(ii)感受性の子孫は表現型の異なる組み合わせを示す可能性があります。再現性を高め、MIAに対する感受性と回復力の両方をモデル化するために、妊娠前の雌マウスのベースライン免疫反応性(BIR)を使用して、どの妊娠が回復力のある子孫またはMIAへの曝露後に定義された行動的および分子的異常を持つ子孫をもたらすかを予測します。ここでは、妊娠12.5日目に二本鎖RNA(dsRNA)ウイルス模倣ポリ(I:C)の腹腔内(i.p.)注射 を介して MIAを誘導する詳細な方法が提供される。この方法は、ダムで急性炎症反応を誘発し、その結果、マウスの脳発達に混乱が生じ、ヒトの精神障害および神経発達障害(NDD)の同様の影響を受けるドメインにマッピングされます。
概要
疫学的証拠は、母親の感染を、統合失調症(SZ)および自閉症スペクトラム障害(ASD)を含む精神医学的およびNDDのリスク増加に関連付けています1,2,3,4,5,6,7。MIAマウスモデルは、これらの障害の病因におけるMIAの因果関係と機構的役割をテストし、分子バイオマーカーを特定し、診断ツールと治療ツールの両方を開発するために開発されました4,6。このモデルの有用性と人気の高まりにもかかわらず、フィールド内のMIA誘導プロトコルにはかなりのばらつきがあり、研究間で結果を比較し、調査結果を再現することは困難です8,9。さらに、モデルのほとんどの反復は、MIAの2つの重要な翻訳的側面を調査していません:(i)多くの子孫はMIAに対して回復力があり、(ii)感受性子孫は表現型の異なる組み合わせを示す可能性があります8。
再現可能なMIAモデルを生成するために、研究者はダムで誘発されたMIAの大きさの少なくとも1つの定量的測定値を報告する必要があります。妊娠中にMIAを誘導するために、私たちの研究室では、ポリイノシティックを模倣した二本鎖RNAウイルスであるポリシチジル酸[ポリ(I:C)]の腹腔内(i.p.)注射を行います。 Poly(I:C)は、toll様受容体3(TLR3)10によって認識されるため、インフルエンザウイルスと同様の免疫カスケードを誘導します。その結果、ポリ(I:C)は急性期応答を活性化し、炎症誘発性サイトカインの急速な上昇をもたらします8,11,12。以前の研究では、MIA11,12,13の結果として、インターロイキン-6(IL-6)を含む炎症誘発性サイトカインの上昇が子孫に行動異常および神経病理学を引き起こすために必要であることが実証されています。したがって、ポリ(I:C)注射後2.5時間のピーク時に収集された母体血清中のIL-6のレベルは、フィールド内の検査室間で結果を比較するために使用できるMIAの説得力のある定量的尺度です。
単一の誘導プロトコル8,14で回復力と感受性の翻訳的に不可欠な要素に対処するMIAモデルを生成するために、研究者は典型的な誘導アプローチと妊娠前のダムのベースライン免疫反応性(BIR)の特性評価を組み合わせることができます8。最近、処女の雌C57BL/6マウスが、妊娠前のポリ(I:C)への低線量曝露に対して広範囲のIL-6応答を示すことが発見されました8。感受性の高い子孫を産み続けるのはこれらの雌のサブセットのみであり、BIRとポリ(I:C)用量8の組み合わせによって決定される特定の大きさの免疫活性化でのみ発生します。MIAは逆Uパターンで表現型を誘導します。子孫は、ダムが中程度の免疫反応性であり、母親の炎症の大きさが臨界範囲8に達するが、それを超えない場合に、最大の行動的および分子的異常を示します。ここでは、ポリ(I:C)の妊娠中期注射の結果として、異なる行動表現型を持つ回復力のある子孫と感受性のある子孫の両方を確実に作成する方法の詳細な方法が提供されています。
プロトコル
すべてのプロトコルは、カリフォルニア大学デービス校の施設動物管理および使用委員会(IACUC)の承認の下で実行されます。
1.動物の準備
- 動物を取得するときは、最大の再現性を確保するために、次のパラメーターを一貫してください。
- ベンダーとベンダーの場所:以前に報告されたように、野生型C57BL / 6Jマウスは、ベンダーに応じて同じ用量のポリ(I:C)に対して異なる反応を示します8。一貫した応答を示すベンダーとマウス系統を選択します。ここでの実験では、チャールズリバーから得られたC57BL / 6マウスは、妊娠中期のMIAへの曝露後に一貫した行動の変化を示しましたが、タコニックから購入したマウスは、チャールズリバーマウスと比較して治療群間でいくつかの違いがあり、より大きな大きさの反応を示します8。
- 系統:C57BL / 6Jマウスが最も一般的に利用されていますが、BTBRマウスおよび他の系統は、妊娠中期のMIA9に対して異なる反応を示します。これらの異なる応答は、方法の再現性を高め、子孫の異なる結果に寄与する潜在的な変数になる可能性があるため、注意してください。
- 変動を最小限に抑えるために、MIA研究8 には処女女性のみを使用し、方法の詳細を明確に書き留めてください。
- 出荷時年齢および順応期間:7週間前に出荷されたマウスは、調節不全の内分泌系を示す15。動物が最低48時間16,17の間順応するのを待ちます。マウスを7週間(±2日)で出荷するように注文し、8週間(±2日)にBIRを注射します。
- 交尾年齢:動物の免疫システムは、その寿命にわたって動的です。交配/注射時の年齢を可能な限り一定に保つことにより、変動を最小限に抑えるように注意してください18,19,20。雌マウスを9週目(±2日)で交尾させる。生後6ヶ月以上の男性を交尾に使用しないでください。
2.ポリ(I:C)ロットテストと準備
- 下記のように高分子量ポリ(I:C)を調製します。
- 保管用のオートクレーブ1.5mLマイクロ遠心チューブ。再懸濁されたポリ(I:C)は-20°Cで保存できますが、凍結融解を繰り返すと効力に影響を与える可能性があります。水浴を70°Cに加熱する。
- 滅菌技術を使用して、注射器を使用して凍結乾燥ポリ(I:C)に10 mLの滅菌生理食塩水(NaCl 0.9%)を追加します。70°Cの水浴中で15分間加熱し、完全なアニーリングを可能にします。取り外して室温まで冷まします。
- 滅菌フードで、さらに40 mLの生理食塩水をボトルに加え、数回反転させて混合します。ポリ(I:C)ボトルの上部を取り外すか、シリンジを使用して1.5 mLの微量遠心チューブに分注します。-20°Cで保存してください。
- 下記のように混合分子量ポリ(I:C)を調製する。
- 保管用のオートクレーブ1.5mLマイクロ遠心チューブ。再懸濁されたポリ(I:C)は-20°Cで保存できますが、凍結融解を繰り返すと効力に影響を与える可能性があります。ウォーターバスを50°Cに設定します。
- 滅菌技術を使用して、凍結乾燥ポリ(I:C)に10 mLの滅菌0.9%NaClを加え、蓋を固定します。50°Cの水浴中で25分間加熱し、完全なアニーリングを可能にします。取り外して室温まで冷まします。
- 滅菌技術を使用して、1.5 mLの微量遠心チューブに分注し、-20°Cで保存します。
- 以下に説明するように、腹腔内(IP)注射を通じてポリ(I:C)を投与します。.
- マウスの体重を測定して、正確な投与量を決定します。0.5 ccのインスリン針を使用して、再懸濁されたポリ(I:C)を作成します。 マウスを首筋にして裏返し、腹部が露出するようにします。
- もう一方の手を使用して、針を前部の2つの乳首の間に約0.5cmの深さまで約45°の角度で挿入します。
- 注射する前に、血液や尿が注射器に入らないことを確認するために作成します。どちらかが発生した場合は、針の位置を変えて再試行してください。ゆっくりと注入します。ポリ(I:C)が泡立つ場合、注射は皮下であった可能性があります。注入の配置が成功すると、針を挿入すると何も作成されず、針が取り外されると漏れることはありません。
- MMWポリ(I:C)ロットの効力を以下に説明するようにテストします 8.
- 目的の形のポリ(I:C)を入手します。 一部のメーカーは、効力がテストされている間、研究者が完全または部分的なロットを保持することを許可して、後で複数のボトルを同時に入手できるようにします。通常、凍結融解を回避すれば、これらは-20°Cで数年間凍結乾燥して保存できます。
- テストのために30の妊娠中のダムを入手または繁殖させます。E12.5では、用量あたり最低10匹のマウスに20、30、および40 mg / kgのi.p.注射を行います。.
- 注射後2.5時間で、尾部出血で採血 します 。.末梢血と体幹血はサイトカインレベルが異なる可能性があるため、研究内で収集方法を一貫して保ってください。
- 室温で一晩血液を凝固させます。12〜24時間後、血液サンプルを3,768 x g で4°Cで8分間スピンダウンします。血清を収集し、分析されるまで-80°Cで保存します。
- 血清を単離し、ELISAまたはルミネックス を介して IL-6レベルを測定します。異なるモダリティやメーカーで測定された総濃度には大きなばらつきがあるため、測定ツールの一貫性を保ちます。パイロットコホートを利用して表現型を誘導するために必要なIL-6応答の大きさを決定します。
3.ベースライン免疫反応性(BIR)テスト
メモ: 図 1 に、手順の概略を示します。BIR検査には、妊娠と比較して異なる分子量のポリ(I:C)を使用して、化合物に対する適応免疫応答の可能性を低くします。
- 処女の雌マウスを7週齢で出荷するように注文します。到着したら、4〜5匹のマウスをケージにグループ化して収容し、交尾するまでグループを収容し続けます。イヤーノッチまたはその他の識別システムを使用してください。
- 到着後1週間で、女性に5 mg / kgのポリ(I:C)を腹腔内注射します。.注射後2.5時間で、循環IL-6が最も高い6の場合 、尾切り を介して注射された動物から全血を採取します。
- 室温で一晩血液を凝固させます。12〜24時間後、血液サンプルを3,768 x g で4°Cで8分間スピンダウンします。
- 各サンプルから最低32 μLの血清を収集します。サイトカインを試験する準備ができるまで、-80°Cで凍結します。IL-6レベルを最も一貫して測定するには、Luminexなどのマルチプレックスアッセイを利用します。異なるモダリティやメーカーで測定された総濃度には大きなばらつきがあるため、測定ツールの一貫性を保ちます。
- ルミネックスアッセイプロトコルについては、Bruceら21を参照してください。
- 相対IL-6レベルを使用して、動物を低(下四分位数)、中(中央の2四分位数)、および高(最高四分位)のBIRグループに分けます。
4.採血のためのテールブリード法
注:免疫調節の可能性のある鎮静剤の使用を避けるために、テールブリード法の採血を使用してください。
- セットアップするには、利き手でない手の側面の表面にはんだ付けスタンドと拘束カップを置きます。35 mmのペトリ皿に、1〜2 mLの食品グレードの食用油を加えます。クイック血液ストッパーからキャップを取り外し、セットアップの近くに置きます。
- はんだ付けスタンドとクリップの最初のキャピラリーチューブにペーパータオルを数層置き、マウスのテールチップが保持され、テーブルの表面と平行に保たれる場所の近くに配置します。かみそりの刃を手元に用意してください。
- 血液を採取するには、次の手順を実行します。
- 必要なタイミングで、マウスをケージから取り出し、尾がベースのノッチから出ている状態でカップの下に置きます。新しいかみそりの刃を使用して、尾の一番端(1〜2 mm)を切り取り、はんだ付けスタンドにクリップされた毛細管に最初の一滴の血液を集めます。
- 利き手の指を食用油に浸し、尾の付け根から先端まで絞って、尾の先端を毛細管に導き、結果として生じる血液の滴を集めます。~200 μLの血液が採取されるまで続けます。
- トップキャップの前にキャピラリーチューブのテーパーエンドに小さなエンドキャップを置きます。トップキャップを最初に装着すると、サンプルはチューブのテーパー端から排出されます。チューブを保護外殻に入れます。
- 室温で一晩凝固させます。微量遠心分離機を4°Cに冷却し、ステップ3.3に記載されているように血液をスピンダウンします。

図 1.処女雌のベースライン免疫反応性と交配をテストするためのタイムライン。 マウスに7週齢で到着し、1週間施設に順応するように命じます。動物に5 mg / kgのポリ(I:C)を注射し、2.5時間後に採血します。血液を一晩凝固させた後、3,768 x g、4°Cで8分間遠心分離します。血清を収集し、ELISAまたはマルチプレックス を介して 相対的なIL-6レベルを評価します。9週齢で、交配ペアを設定します。を使用して作成 BioRender.com この図の拡大版を表示するには、ここをクリックしてください。
5.交配と妊娠のための体重ベースの方法 E12.5注射
メモ: 図 2 に、手順の概略を示します。2つの方法を使用して、嵌合ペアを設定し、E12.5時点を決定することができます。最初の時限交配は、他の場所で説明されています22。体重ベースの計算は、E12.5妊娠23の評価にも使用できます。このアプローチの利点は、交配時にダムの年齢をタイムロックし、免疫応答の変動を減らすことができることです。ここでは、この手順を使用します。
- 男性を清潔なケージに入れ、最低2時間順応させます。これは、男性がすでにケージ内で支配的な香りを形成するため、女性の攻撃性の可能性を減らします。
- オスのケージにメスを追加して、シングルオス、シングルメスの繁殖ペアを設定します。彼女をケージに入れる前に、彼女の体重を量り、体重を記録します。交配効率を高めるために、各ケージに一握りのヒマワリの種を追加します。
- 体重増加範囲を確認するには、次の手順に従います。
- 雌のテストグループを取得し、交尾ペアを設定し、交尾時の体重を記録します。
- 女性が目に見えて妊娠しているように見え始めたら、体重を量り、8.5 g、9.5 g、10.5 g、および11.5 gの体重増加のサブセットに分割します。E12.5の胎児は、足に明確な指を発達させ始めたばかりです。胎児の形態を使用して、E12.5に達するための平均体重増加を決定します。
- 交配後12日目に、雌の体重を量り、体重増加を決定します。試験施設では、雌は交尾時からE12.5まで一貫して9.5〜10.5 g増加します。女性の体重増加が所定の範囲内にある場合、ステップ2.3.2で決定された可溶化ポリ(I:C)の用量をi.p. 経由で 注射します。.
- 次のパラメータを使用して、ダム内のMIAへの応答を観察します。
- 酔い行動:1は取り扱われることに反応してダムがどのように活発になるかについて、1〜3のスケールで主観的なスコアを収集し、1は取り扱われることに反応してほとんどまたはまったく動きがなく、3は捕獲と拘束に対する通常の反応です。免疫応答が大きい動物は、取り扱いに対する耐性が低くなります8。
- 熱性応答:IR温度計を使用して、注射前温度と注射後2.5時間の温度を収集します。免疫応答が大きい動物は、免疫活性が高いことに反応して低体温を示すことがよくあります8。
- 体重変化:注射後24時間で動物の体重を量ります。免疫応答が大きい動物は、一般的に体重が大きくなります8。
- 妊娠IL-6レベルを次のように測定します8。
- 注射後2.5時間で、好ましい方法で採血する。室温で一晩血液を凝固させます。12〜24時間後、血液サンプルを3,768 x g で4°Cで8分間スピンダウンします。
- 血清を収集し、分析されるまで-80°Cで保存します。血清を単離し、ELISAまたはルミネックス を介して IL-6レベルを測定します。異なるモダリティやメーカーで測定された総濃度には大きなばらつきがあるため、測定ツールの一貫性を保ちます。
- 注入後のダムは、ネストレットや濃縮装置などの適切な濃縮装置で単独で収容します。濃縮の変化はげっ歯類の行動に大きな影響を与える可能性があるため、すべての濃縮の一貫性を保ちます24、25、26、27、28、29。
- C57マウスの妊娠期間は18.5〜20.5日の範囲です。同腹仔チェックを実行して、動物がこの範囲内で生まれたかどうかを判断して、正しい時点で注射が行われたことを確認します。ごみをチェックするときは、ケージをできるだけ邪魔しないでください。ごみが生まれた直後のストレスは、共食いのリスクを高める可能性があります。
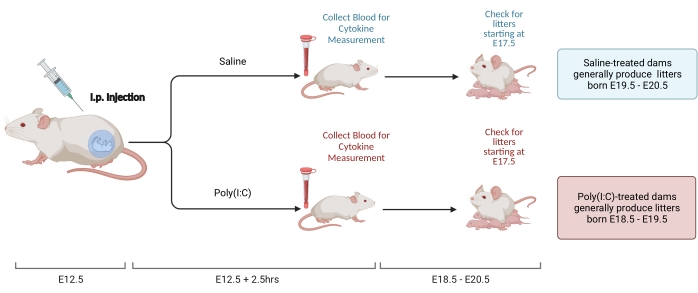
図 2.MIA誘導。 MIA導入には、妊娠の評価、ポリ(I:C)の注射、および母親の炎症の正しいタイミングを確認するためのごみチェックが必要です。時限交配または体重増加法 のいずれかを介して 妊娠日を評価した後、E12.5でポリ(I:C)のi.p.注射を行います。注射後2.5時間で血液サンプルを収集し、免疫活性化を確認し、IL-6活性化のレベルを決定します。同腹仔は約E18.5-E20.5で生まれます。を使用して作成 BioRender.com この図の拡大版を表示するには、ここをクリックしてください。
6.成人MIAと対照子孫の行動の変化の調査(オプション)
- P60から行動試験を実施する前に、動物を1日1分間、3日間連続して穏やかな取り扱いで人間との接触に順応させます。ケージ交換日が行動テストが実施された同じ日に発生しないことを確認してください。
- 行動テストを開始する前に、常にマウスをテストルームに30〜60分間順応させてください。不安を最小限に抑えるために、薄暗い(15〜20ルクス)部屋を使用してください。
- グルーミングを繰り返す場合は、マウスを蓋付きの清潔で寝具のないケージに一人で入れます。カメラを使用して、これらのケージ内のマウスを20分間記録します。最初の10分は順化期間として機能し、後の10分は試験期間である。
- 保存したビデオとストップウォッチを使用して、10分間のテスト期間中の各マウスの累積グルーミング時間をスコアリングします。これらのビデオからスコアリングできる他の行動には、飼育(後ろ足で立つ)、凍結、ジャンプなどがあります8。
- プレパルス抑制(PPI)14,30,31,32、オープンフィールド12,33,34、3室ソーシャルアプローチ13,35,36、新規物体認識37、y迷路30、高架プラス迷路33、コンテキスト/キュー恐怖条件付け38など、MIAモデルの他の一般的なテストを使用します。
- 出生後イムノブロッティング8 (オプション)
- P0で速やかに断頭し、HBSSで胎児の脳組織を解剖し、液体窒素で凍結し、-80°Cで保存する。
- 2x Laemmliバッファー中で5秒間振幅20%のプローブ超音波処理器を使用してサンプルを破壊し、85°Cで5分間変性させます。遠心分離溶解液を16,000 x g で室温で10分間。上清を採取し、-80°Cで保存する。
- 市販のBCAタンパク質アッセイキットを使用して、製造元の指示に従って総タンパク質含有量を測定し、校正標準としてウシ血清アルブミンを使用します。
- 還元剤としてジチオスレイトールを最終濃度100 mMとしてサンプルに加えます。ゲルにロードする前に、85°Cに2分間加熱します。
- 7.5% TGSゲル上で還元条件下で5 μg/レーンのタンパク質を実行し、PVDFメンブレンに電気泳動で転写します。ブロッキングバッファーでメンブレンをブロックし、選択した抗体でインキュベートします。
- TBS + 0.05% Tween 20で3回洗浄し、蛍光タグ付き二次抗体でメンブレンを45分間インキュベートします。
- TBS / Tween 20でさらに4回洗浄し、画像結果を表示します。抗βチューブリンを使用して検出されるβチューブリンを使用して結果を標準化します。
結果
E12.5で30 mg / kgのポリ(I:C)に曝露されたすべての動物が、一貫した行動異常を伴う子孫を産むわけではありません8,31。30 mg/kgと40 mg/kgのポリ(I:C)はどちらも、活動レベルの低下、低体温反応、体重減少など、ダムで確実に病気行動を引き起こし、IL-6の大幅な上昇を引き起こしますが、MIAに曝露された同腹仔のサブセットのみが、人間の精神医学的およ?...
ディスカッション
母体感染は、ヒトおよびげっ歯類および非ヒト霊長類の両方の脳発達の過程を変える4,5,7。ここでは、ポリ(I:C)を用いて妊娠中期の時点でマウスにMIAを誘導する手順を概説する。この方法には、妊娠前のBIRの評価が組み込まれているため、再現性が向上し、MIA8に対する子孫の回復力と感受性につながるメ?...
開示事項
著者は開示する利益相反を持っていません。
謝辞
マウスMIAモデルの変動性に対処することに固執してくれたMyka Estes博士と、ここで説明するメソッドプロトコルの開発につながったEstesら8 のすべての貢献者に感謝します。ここで報告された研究は、NIMH 2P50 MH106438-06(A.K.M.)およびNIMH T32MH112507(K.P.)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
参考文献
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved