このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
動的界面の共焦点顕微鏡可視化のためのマイクロテンシオメータ
要約
本稿では、界面形態を可視化しながら界面張力と表面拡張レオロジーを同時に測定するためのマイクロテンシオメータ/共焦点顕微鏡の設計と操作について述べる。これにより、技術や生理学において重要な界面の構造と特性の関係をリアルタイムに構築することができます。
要約
界面活性分子の流体-流体界面への吸着は、本質的に遍在している。これらの界面を特徴付けるには、界面活性剤吸着速度を測定し、バルク界面活性剤濃度の関数として平衡表面張力を評価し、平衡化後の界面領域の変化と表面張力がどのように変化するかを関連付ける必要があります。高速共焦点顕微鏡による蛍光イメージングによる界面の同時可視化により、構造機能関係を直接評価することができます。キャピラリー圧力マイクロテンシオメータ(CPM)では、半球状の気泡がキャピラリーの端部に固定され、1mL容の液体リザーバに固定される。気泡界面を横切る毛細管圧力は、ラプラス方程式に基づくモデルベースの圧力、気泡曲率、または気泡面積制御を可能にする市販のマイクロ流体フローコントローラ を介して 制御される。Langmuirトラフやペンダントドロップなどの以前の技術と比較して、測定と制御の精度と応答時間が大幅に向上しています。毛細管圧力の変化は、ミリ秒単位で適用および制御できます。気泡界面の動的応答は、気泡が膨張および収縮するにつれて、第2の光学レンズ を介して 視覚化される。気泡の輪郭は円形プロファイルにフィットし、気泡の曲率半径 R と、結果を無効にする円形度からの偏差を決定します。ラプラス方程式は、界面の動的表面張力を決定するために使用されます。平衡化に続いて、コンピュータ制御のマイクロ流体ポンプによって小さな圧力振動を課して気泡半径(0.001〜100サイクル/分の周波数)を振動させて拡張弾性率を決定することができ、システムの全体的な寸法は、マイクロテンシオメータが高速共焦点顕微鏡のレンズの下に収まるほど十分に小さく、蛍光タグ付き化学種をサブミクロンの横方向分解能で定量的に追跡することができる。
概要
界面活性剤膜で覆われた空気と水の界面は、日常生活の中で遍在しています。界面活性剤 - 水注入は、枯渇した油田からの油回収を強化するために使用され、シェールガスおよび油の水圧破砕ソリューションとして使用されます。気液フォームおよび液液エマルジョンは、潤滑剤および洗浄剤として多くの工業的および科学的プロセスに共通しており、食品において一般的である。界面における界面活性剤およびタンパク質は、包装、保存、および投与中に抗体立体配座を安定化させ1、2、3、4、5、眼における涙液膜安定性6、7、8、および肺力学9、10、11、12、13、14、15。
界面に吸着する界面活性剤または界面活性剤およびその特性の研究は、多くの異なる実験技術16、17、18、19、20、21、22、23、24、25、26、27.最近の開発は毛細血管圧力マイクロテンシオメータ(CPM)であり、これは他の一般的な方法よりも大幅に少ない材料を使用しながら、はるかに小さな長さスケールで高度に湾曲した界面上の界面特性の検査を可能にする9,23,24,25。共焦点蛍光顕微鏡(CFM)は、CPM 22またはラングミュアトラフ20、26、27、28、29の空気 - 水界面における脂質およびタンパク質の形態を研究するために使用することができる。ここでは、CPMとCFMを組み合わせて、形態学的現象を動的および平衡界面特性に結びつけ、生物学的および技術的インターフェースの構造機能関係を発展させています。
CPM-CFMがアクセス可能な界面界面活性剤系には、多数の重要なパラメータがあります。CPMでは、直径30〜200μmの気泡がガラスキャピラリーチューブの先端に固定されています。CPMの以前のバージョンでは、気泡の内側と外側の間の毛細管圧力差は、水柱および振動シリンジポンプを介して制御された9,30;ここで説明する新しいバージョンは、これらを高精度のコンピュータ制御マイクロ流体ポンプに置き換えます。表面張力(γ)は、ポンプによって設定された界面を横切る圧力損失ΔP、および気泡の曲率半径Rの光学分析から、ラプラス方程式ΔP = 2γ/Rを介して決定されます。界面の動的表面張力は、可溶性界面活性剤を含むバルク液体と接触する新しい気泡の発生に続く10msの時間分解能で決定することができる。界面活性剤吸着ダイナミクスは、拡散度、表面被覆率、およびバルク濃度と平衡表面張力の関係を含む界面活性剤の本質的な特性を決定するために、古典的なワードトルダイ式10、31によって記述することができる。平衡表面張力が達成されると、界面面積を振動させて拡張弾性率を測定することができ、、気泡表面積の小さな変化によって誘発される表面張力の変化を記録することによって、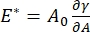 A32。絡み合ったポリマーまたはタンパク質などの独自の内部構造を発達させるより複雑な界面の場合、表面張力は、、より一般的な表面応力4、33、
A32。絡み合ったポリマーまたはタンパク質などの独自の内部構造を発達させるより複雑な界面の場合、表面張力は、、より一般的な表面応力4、33、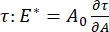 によって置き換えられる。
によって置き換えられる。
呼吸中の肺安定性は、肺胞空気液界面9、10における低い表面張力および高い拡張弾性率の両方を維持することに直接結びついていてもよい。すべての内部肺表面は、組織水和34を維持するために、上皮ライニング液の連続したミクロン厚の膜で裏打ちされている34。この上皮内層液は主に水であり、塩および様々な他のタンパク質、酵素、糖、および肺界面活性剤を含む。湾曲した液体 - 蒸気界面の場合と同様に、毛細管圧力は、肺胞(または気泡)の内側の圧力が高いほど誘導される。しかし、表面張力が肺内のあらゆる場所で一定であった場合、ラプラス方程式ΔP = 2γ/Rは、小さな肺胞は大きな肺胞と比較してより高い内圧を有し、小さな肺胞のガス含有量はより大きく、より低い圧力の肺胞に流れることを余儀なくされることを示している。これは「ラプラス不安定性」9,35として知られています。最終的な結果は、最小の肺胞が崩壊して液体で満たされ、再膨張が困難になり、肺の一部が崩壊し、他の部分が過剰に膨張し、どちらも急性呼吸窮迫症候群(ARDS)の典型的な症状である。しかし、適切に機能している肺では、呼吸中に肺胞界面領域の空気 - 上皮液界面が伸縮するにつれて、表面張力が動的に変化する。ラプラス圧力が半径の減少とともに減少し、半径の増加とともに増加してラプラスの不安定性を排除すると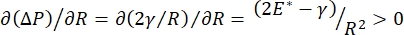 、肺9が安定化する。
、肺9が安定化する。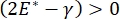 したがって、、それが周波数、単層形態および組成、
したがって、、それが周波数、単層形態および組成、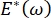 ならびに肺胞液組成にどのように依存するかは、肺安定性に不可欠であり得る。CPM-CFMはまた、界面活性剤吸着25、単層形態22および拡張弾性率9に対する界面曲率の影響の最初の実証を提供した。CPM内のリザーバの小容量(〜1mL)は、液相の迅速な導入、除去、または交換を可能にし、高価なタンパク質または界面活性剤10の必要量を最小限に抑える。
ならびに肺胞液組成にどのように依存するかは、肺安定性に不可欠であり得る。CPM-CFMはまた、界面活性剤吸着25、単層形態22および拡張弾性率9に対する界面曲率の影響の最初の実証を提供した。CPM内のリザーバの小容量(〜1mL)は、液相の迅速な導入、除去、または交換を可能にし、高価なタンパク質または界面活性剤10の必要量を最小限に抑える。
CPM−CFM画像におけるコントラストは、界面16、27における蛍光的にタグ付けされた脂質またはタンパク質の小さな画分の分布によるものである。二次元界面活性剤単層は、しばしば表面張力または表面圧力の関数として横方向の相分離を示すπ、 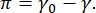 γは、清浄な流体−流体界面の表面張力(γ0)と界面活性剤被覆界面との差π、純粋な流体表面張力を低下させるように作用する界面における界面活性剤分子の相互作用によって引き起こされる2−D「圧力」と考えることができる。低い表面圧力では、脂質単層は液体のような無秩序な状態にある。これは液体膨張(LE)相として知られています。面圧が上昇し、脂質分子当たりの面積が減少するにつれて、脂質は互いに配向し、長距離秩序液体凝縮(LC)相への一次相転移を受けることができる16、20、27。LE相およびLC相は、様々な表面圧力で共存することができ、蛍光的にタグ付けされた脂質がLC相から除外され、LE相に分離されるので視覚化することができる。したがって、CFM16で撮像すると、LE位相は明るく、LC位相は暗い。
γは、清浄な流体−流体界面の表面張力(γ0)と界面活性剤被覆界面との差π、純粋な流体表面張力を低下させるように作用する界面における界面活性剤分子の相互作用によって引き起こされる2−D「圧力」と考えることができる。低い表面圧力では、脂質単層は液体のような無秩序な状態にある。これは液体膨張(LE)相として知られています。面圧が上昇し、脂質分子当たりの面積が減少するにつれて、脂質は互いに配向し、長距離秩序液体凝縮(LC)相への一次相転移を受けることができる16、20、27。LE相およびLC相は、様々な表面圧力で共存することができ、蛍光的にタグ付けされた脂質がLC相から除外され、LE相に分離されるので視覚化することができる。したがって、CFM16で撮像すると、LE位相は明るく、LC位相は暗い。
この原稿の目的は、複合共焦点顕微鏡マイクロテンシオメータを構築して操作するために必要なステップを記述することです。これにより、読者は吸着研究を行い、表面張力、レオロジー挙動を測定し、ミクロンスケールの空気/水または油/水の界面で界面形態を同時に調べることができます。これには、必要な毛細血管を引っ張り、切断し、疎水化する方法、圧力、曲率、および表面積制御モードを使用するための指示、およびマイクロテンシオメータ湾曲界面への不溶性界面活性剤の界面移動に関する議論が含まれる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. キャピラリーチューブの作製
- キャピラリーをキャピラリープーラーに入れ、目的の引っ張りプログラムを実行して、先端に外径(OD)が〜1μmのテーパーキャピラリーを2つ作ります。
注: 引っ張る前のキャピラリーの OD は、マイクロテンシオメーターセルのキャピラリーホルダーに収まるように指定された OD である必要があります。キャピラリーの内径(ID)はさまざまですが、引っ張った後のキャピラリーの臨界半径に影響します。結果として生じるテーパが最初にキャピラリーODおよびIDを迅速に減少させ、次に所望のキャピラリーODおよびIDの近くの半径に達し、次いでよりゆっくりと直径を減少させるように、引っ張りプログラムが選択される。これにより、より大きなキャピラリー長が作成され、IDで30〜100μmの使用可能なキャピラリーが得られるようにスコアリングできます。 - 毛細血管の先端を所望のスポットにスコア付けして、30〜100μmのIDを取得し、先端を切断する。これで、毛細血管の先端に所望の半径のODとIDが与えられます(図1A)。毛細血管はステップ2まで保存することができる。
メモ:キャピラリーの切断エッジは、90°のクリーンブレイクでなければなりません。切断エッジに欠陥があると、キャピラリーへの気泡のピン留め不良や表面特性測定不良につながります。テーパー毛細血管の先端は非常に繊細です。溶液以外のもの(バイアル壁、エアノズルなど)と接触すると破壊されます。
2. 毛細血管の疎水化
- 引っ張ったガラスキャピラリー、酸洗浄液、プラスチックピンセット、脱イオン(DI)水、疎水化溶液(エタノール中の2%シラン)、真空ポンプ、エタノール溶液を集めます。詳細については 、材料表 を参照してください。
警告: 酸洗浄液は毒性があり、皮膚や目の腐食/刺激を引き起こし、酸化します。疎水化溶液は、皮膚/眼/呼吸器刺激物です。目の保護具、白衣、手袋を着用し、ヒュームフードで溶液で作業してください。 - キャピラリーを酸洗浄
注:キャピラリーを酸洗浄すると、キャピラリー内の有機残留物が除去され、キャピラリーを疎水性にするシラン化反応のためにガラス表面が準備されます。- ピンセットで毛細血管の広い端付近をしっかりとつかみます。
- テーパ状の先端を酸洗浄液に浸し、真空ポンプからホースをキャピラリーの広い端に取り付けます。これは溶液を毛細血管に吸い込みます。
メモ: キャピラリーホースの端にピペットチップを取り付けて、キャピラリー端部とのフィット感を高めることができます。 - 酸洗浄液がキャピラリーの約半分を満たしたら停止します。
注:酸洗浄液からキャピラリー先端を除去した後、キャピラリーの外側にある溶液は、しばしばキャピラリー先端の近くにビーズを形成する。キャピラリーを溶液バイアルの首にそっと触れて、余分な溶液を除去します。 - 酸洗浄液をキャピラリー内に少なくとも30分間留まらせ、液体のプラグがキャピラリーのテーパ端に残っていることを確認する。
- ピンセットでキャピラリをしっかりと保持し、真空ホースを使用してキャピラリの大きな端から液体を引き出すことによって、キャピラリから酸洗浄液を取り外します。
- 毛細血管をすすいでください
- キャピラリーのテーパ状端部をDI水に沈め、酸洗浄液に浸した外部を覆うのに十分な深さまで浸すようにします。先端が水没している間に、真空ホースを使用してDI水をキャピラリーに引っ張ります。水から毛細血管を取り外し、真空ホースで残りの水を取り除きます。
- 上記の手順を少なくとも4倍繰り返します。
- 工程2.3をDI水にエタノールを代入して再度実行する。
- エタノールがキャピラリーの内部から完全に蒸発するまで、吸引を連続的に適用します。エタノールが蒸発し始めると、毛細血管は曇り、触れると涼しくなりますが、30〜45秒後には透明になります。
- キャピラリーを疎水化処理液でコーティングする
- キャピラリーの広い端部をエタノール溶液中の〜2%シランに短時間浸漬する。毛細管現象は、コーティング溶液を毛細血管内で上昇させる。キャピラリー内に〜1cmサイズのプラグが浮かび上がったら、溶液からキャピラリーを取り外します。
- テーパ状の先端が下を向くようにキャピラリーを向け、コーティング溶液がテーパ状の先端に向かって重力で落下するようにします。
- コーティング溶液をキャピラリー内に少なくとも3分間留まらせる。
メモ:テーパチップの内部に接触しているコーティング溶液のプラグに気泡があってはなりません。気泡がある場合、キャピラリー内部はステップ2.5で十分に乾燥していない可能性があります。これを解決するには、必要に応じて手順 2.4 ~ 2.6 を繰り返します。
- 工程2.3と同様にして毛細血管をエタノール1xですすいでください。
- 疎水性コーティングをキャピラリーにセットする
- 清潔で乾燥したシンチレーションバイアルを120°Cに設定した真空オーブンに入れます。 コーティングされた毛細血管をバイアル(理想的にはバイアルあたり1つの毛細血管)に配置し、広い端をバイアルの基部に置きます。キャピラリーを少なくとも6時間(一晩が好ましい)オーブン内に留まらせて、疎水性シラン層とキャピラリーとの永久的な結合を達成する。毛細血管はステップ4まで保存することができる。
3. サンプルの準備と保管
- 界面活性剤と蛍光色素分子溶液を混合し、清潔な酸洗浄バイアルに保管して、汚染を回避します。
注:市販の脂質は、最高純度のものでなければならず、使用中は〜20°Cで保存する必要があります。 古いまたは汚染された脂質は、しばしば結果を再現するのが困難になります。
4. マイクロテンシオメータの設定
- 図2の説明に従ってCPMセルを組み立てます。
- キャピラリーの大きな側面をCPMセルの上部に、セルの下側に押し込むまで置きます。
- PEEKプラグを静かに締めてキャピラリーを固定し、マイクロ流体ポンプからチューブをキャピラリーの大きな側面に取り付けます。先細りの毛細血管先端に触れないように注意してください。
- 必要に応じて、リザーバ交換ホースおよび/または温度制御ホースをCPMセルのそれぞれの入口と出口に取り付けます(図2)。それ以外の場合は、未使用の入口とコンセントを差し込みます。
- CPMセルを共焦点顕微鏡ステージに取り付け、CFM対物レンズ、CPMカメラ、CPM光源に大まかに合わせます(図3)。
- マイクロ流体ポンプへのガス流をポンプの推奨動作圧力(ここで使用するマイクロ流体ポンプの場合は150mbar)で開き、キャピラリーへの流れが開いていることを確認します。
- CPM仮想インタフェース(補足符号化ファイル1:マイクロテンシオメータ仮想 Interface.vi)を、キャピラリー圧力振動周波数と振幅をゼロに設定して圧力制御モードで実行を開始します(図4-7)。図 4 に、仮想インターフェースのスクリーンショットを示します。DI水および約35μmのキャピラリー半径の場合、〜20mbarの圧力は、水がキャピラリーに入らないようにします。
- ピペットを使用してCPMセルを水で満たします。
- マイクロテンシオメーターカメラを使用して毛細血管先端に焦点を合わせます。
- CFMで毛細血管先端に焦点を合わせます。キャピラリーを見つけるのが難しい場合は、CPMカメラを使用してCFM対物レンズを見つけます。これは、CFM目標とバブルの間の距離を近似し、正しい作動距離を達成するのに役立ちます。
- 環状(グリーンセクター投影)がバブルの中心になったら、バブルエッジがはっきりと見えるように手動でフォーカスを調整します(図4-3)。
メモ: 環状の位置、開始角度と終了角度、内側と外側の半径は、ビュー ウィンドウの下のメニューから 調整できます。 - [バブルのリセット]をクリックし、新しいバブルが形成されていることを確認します(古いバブルポップが聞こえ、新しいバブルがコントロールパネルの表示ウィンドウから観察可能になります)。図 4-3)。バブルがはじけない場合は、表示ウィンドウの下にある「バブルリセット」タブの「リセット圧力」を上げるか、「リセット遅延時間」を増やします。表面張力が約73 mN/m(生理食塩水または水/気泡の場合)であるかどうかを確認します(図4-9)。
- 細胞直噴シリンジ(図 3-13)から水を取り出し、空にしてから取り付け直します。サンプルを読み込んで実験を実行する準備ができました。
5. 吸着試験
- CPMソフトウェアを 圧力制御 モードに保ちながらオートクレーブ処理されたピペットを使用して、セルに目的のサンプルを充填します。新しいバブル界面を作成するときの初期表面張力が約73 mN/mであることを確認してください。
- 新しく形成されたバブルの半径を決定し、その値を中心線エリアコントロール(図 4-7)に入力し、[エリアコントロール]タブ(図4-8)をクリックしてコントロールタイプをエリアコントロールに変更します。
メモ: 一定の圧力制御を使用することもできますが、これにより、界面の表面張力が変化するにつれて気泡半径が連続的に変化します。この変化領域は、界面活性剤吸着率の分析を複雑にし、研究中に気泡をはじきさせる可能性がある。 - 共焦点ビデオの録画を開始します。
- [バブルのリセット](図 4-5)をクリックし、すぐに[データの収集](図 4-6)をクリックします。ボタンのシグナリングライトが緑色に変わります。
- 図4-6に示すバーをスライドさせて試料の濃度に応じてデータ記録速度を調整します。吸着が遅い場合は、記録速度を遅くします。これは、早い段階で高い記録レートが必要な場合は、実行の途中で調整できますが、ファイルサイズを小さくするために、長いスタディでは遅いレートが望ましいです。
- 実験終了後(最終的な表面張力プラトーに達したとき)、正しいファイルパスを選択し(図4-1)、保存ボタン(図4-2)をクリックしてファイルを保存します。
- 記録を停止してCFMにも保存します。
6. 振動・リラクゼーション研究
- CPMソフトウェアを 圧力制御 モードに保ちながらオートクレーブ処理されたピペットを使用して、セルにサンプルを充填します。新しいバブル界面を作成するときは、表面張力が約73 mN/mであることを確認してください。
- サンプルが界面に完全に吸着するまで待ちます。これは、新しいバブル界面で最初からやり直すのではなく、吸着研究の直後に実行できます。
- 振動が圧力振動、面積振動、曲率振動のいずれになるかは、適切なタブ(図4-8)を選択し、目的のベースライン値、振動%、発振周波数(図4-7)を入力して決定します。
メモ: 鋸歯状、矩形波、および三角波の領域振動は、[ その他の領域の振動] タブのドロップダウンメニューからもアクセスできます。 - 共焦点ビデオの録画を開始し、CPMソフトウェアの [データの収集](図4-6)をクリックします。
- 振動を開始します。最良の結果を得るためには、少なくとも7つのサイクルを記録してください。データ集録レート(図4-6)を選択して、各発振サイクルに適切な数のデータポイントを提供します。
- 他の発振振幅または周波数が必要な場合は、実験中に値を変更します。
- 手順 5.6 および 5.7 のように結果を保存します。
7. 溶剤交換研究
- CPMソフトウェアを圧力制御モードに保ちながら、オートクレーブ処理されたピペットを使用してセルにサンプルを充填します。新しいバブル界面を作成するときに、表面張力が約 73 mN/m であることを確認してください。
注:吸着および/または振動研究は、溶媒交換研究の前に実施することができる。 - 導入チューブを目的の交換溶液のボトル(図 3-11)とともに蠕動ポンプ(図 3-10)に接続します。
- 共焦点ソフトウェアでビデオの録画を開始し、CPM ソフトウェアの「データの収集」(図 4-6)をクリックします。
- ペリスタルティックポンプの速度を設定します。これは流体交換の速度を制御し、実験の要件、すなわち溶媒を交換する必要がある速度に基づいて選択する必要があります。
- 複数の流体を交換する必要がある場合は、ペリスタルティックポンプを停止し、入口を別の交換溶液に接続します。
- 交換が終了したら (約 20 分)、手順 5.6 および 5.7 のように結果を保存します。
8. 不溶性界面活性剤吸着
注:吸着される界面活性剤がリザーバ液体に可溶でない場合、この方法を使用して、セルの空気/水界面から気泡表面に単層を移動させることができる。多くの二重層形成脂質は、生理食塩水にほとんど不溶性であり、リザーバ溶液に懸濁したときに自発的に気泡に吸収しない。
- CPMソフトウェアを 圧力制御 モードに保ちながらオートクレーブ処理されたピペットを使用して、セルにサンプルを充填します。新しいバブル界面を作成するときに、表面張力が約 73 mN/m であることを確認してください。
- 揮発性有機溶液中の溶液から細胞の空気水界面に不溶性界面活性剤の単層を堆積させる。シリンジを使用して、界面に小さな液滴を堆積させ、溶媒が蒸発して脂質を薄膜として残すことを可能にする。
注意:クロロホルムは、ホスファチジルコリンや脂肪酸などのリン脂質の溶媒として使用されます。拡散溶液は、通常、溶媒のmLあたり0.01〜0.02mgの脂質である。クロロホルムは急性毒性があり、皮膚や眼の刺激を引き起こす可能性があり、発がん性があります。適切な目の保護具、白衣、手袋を着用し、ヒュームフードで溶液を作ります。 - 気泡の中心線圧力制御(図 4-7)を使用して、バブルがほぼ平坦になるまで表面積を小さくします。これにより、界面活性剤が吸着した後に気泡がはじけるのを防ぎます。
- 空気/水界面がキャピラリーの先端を通過するまで、細胞への直接シリンジ を介して 細胞からリザーバ液体を除去します。シリンジポンプを使用することができるが、このステップは、シリンジを手動で使用することによって達成することができる。
- リザーバの液体の高さを初期レベルまで上げます。
注:先端を再水没した後、界面に吸着した界面活性剤のために気泡が大きくなります。単分子膜は、振動または溶媒交換実験の準備が整いました。
9. クリーンアップ
- CFM をオフにします。
- 圧力制御モードに変更します。
- ピペットを用いて細胞から試料を除去する。セルにDI水をロードし、圧力を〜50mbarに上げて、泡が常にキャピラリーから逃げ出し、キャピラリー先端をきれいにします。このプロセスを 2 回繰り返します。
- 安全弁を閉じ、左上隅にある赤いボタンをクリックしてCPMをオフにし、ライトと青の圧力コントロールパネルをオフにして、圧力源を閉じます。
- 共焦点顕微鏡ステージから細胞を取り外します。エタノールとDI水で細胞を洗い流します。CPMセルからキャピラリーチューブを取り外します。
10. セルのクリーニング
- セルを分解します。DI水ですすぎながら歯ブラシで内壁をブラッシングします。エタノールに部品を浸し、〜30分間超音波処理します。
- DI水ですべての部品を数回すすいでください。部品を窒素ガスで吹き込むか、真空オーブン内で乾燥させて乾燥させます。
11. 振動解析
- Dilatational_Rheology_Analysis.m コード(補足コーディングファイル 2)を実行し、CPM 仮想インタフェースから保存するファイルを選択します。サンプル データは補足ファイルに含まれています。
- 圧力対時間プロットは、 補足図1に示すように表示されます。振動が始まる点を左クリックし、振動が終了する点をもう一度左クリックします。データに複数の振動が含まれている場合は、すべての振動に対してこのプロセスを繰り返します。
- すべての始点と終点が左クリックされたら、マウスを任意の場所で右クリックします。たとえば、 補足図 1 に示すように、ポイント 1、2、3、および 4 で左クリックし、その後に右クリックすることができます。
注: このコードでは、拡張係数と位相角が計算され、その結果が元のファイルの場所にある新しい.csvファイルに書き込まれます。サンプル データの結果は、 補足コーディング ファイル 2 に記載されているコード結果で確認できます。MATLAB は、 補足図 2 に示すように、データのいくつかのグラフィカル表現も生成します。
- すべての始点と終点が左クリックされたら、マウスを任意の場所で右クリックします。たとえば、 補足図 1 に示すように、ポイント 1、2、3、および 4 で左クリックし、その後に右クリックすることができます。
Access restricted. Please log in or start a trial to view this content.
結果
測定誤差の主な原因は、切断プロセス(図5A、B)またはコーティングプロセス(図5D)のいずれかに欠陥がある毛細血管から生じます。どちらのタイプの欠陥も、光学画像解析システムによる気泡の形状およびサイズを決定する際にエラーをもたらし、不正確な表面張力値につながる。新しいキャピラリーを引っ張ってコーティングした後?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
結合されたCPM/CFMは、界面ダイナミクス、平衡、および形態を調べるための強力なツールです。このプロトコルでは、CPM/CFM を使用してデータを取得するために必要な手順について説明します。
図2 は、キャピラリー、溶媒、および熱交換用のチャネルが示されているセル設計を示しています。溶媒交換の入口はセルの下部にあり、出口は上部になけ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示すべき利益相反はありません。
謝辞
全ての共焦点顕微鏡像は、ニコンA1RHDマルチフォトン直立共焦点顕微鏡を用いて得られた。我々は、ミネソタ大学のユニバーシティ・イメージング・センターにおけるサポート・スタッフ、特にギレルモ・マルケスの指導及び支援に感謝する。この研究はNIH Grant HL51177によって支援された。SIはルース・L・キルシュシュタインNRSA機関研究訓練助成金F32 HL151128の支援を受けた。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
参考文献
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved