このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フローサイトメトリーによる老化腫瘍細胞の同定と濃縮のための遠赤色蛍光老化関連β-ガラクトシダーゼプローブ
要約
細胞培養またはマウス腫瘍モデルにおける化学療法薬によって誘導された老化癌細胞の蛍光フローサイトメトリー定量のためのプロトコルが提示されます。オプションの手順には、共免疫染色、大規模なバッチまたは時点分析を容易にするためのサンプル固定、およびフローサイトメトリーソーティングによる生細胞濃縮が含まれます。
要約
細胞老化は、生物学的損傷によって誘発される増殖性停止の状態であり、通常は老化した細胞で何年にもわたって発生しますが、さまざまな癌治療によって誘発される損傷への応答として腫瘍細胞に急速に現れることもあります。老化細胞は死に抵抗性になり、腫瘍の悪性度と治療抵抗性を悪化させながら腫瘍の寛解をブロックするため、腫瘍細胞の老化は一般的に望ましくないと考えられています。したがって、老化した腫瘍細胞の同定は、癌研究コミュニティにとって継続的な関心事です。様々な老化アッセイが存在し、その多くは、よく知られている老化マーカーである老化関連β−ガラクトシダーゼ(SA−β−Gal)の活性に基づいている。
典型的には、SA-β-Galアッセイは、固定細胞上の発色基質(X-Gal)を用いて行われ、光学顕微鏡による「青色」老化細胞のゆっくりとした主観的な列挙が行われる。C12-FDG(緑色)およびDDAO-ガラクトシド(DDAOG;遠赤色)を含む、細胞透過性の蛍光SA-β-Gal基質を使用した改良されたアッセイにより、生細胞の分析が可能になり、フローサイトメーターを含むハイスループット蛍光分析プラットフォームの使用が可能になりました。C12-FDGはSA-β-Galのプローブとして十分に文書化されていますが、その緑色蛍光発光は、リポフスチン凝集体の蓄積により老化中に生じる固有の細胞自家蛍光(AF)と重複しています。遠赤色のSA-β-GalプローブDDAOGを利用することにより、緑色の細胞自家蛍光を老化を確認するための二次パラメータとして使用でき、アッセイの信頼性が向上します。残りの蛍光チャネルは、細胞生存率染色またはオプションの蛍光免疫標識に使用できます。
フローサイトメトリーを使用して、老化した腫瘍細胞を同定するためのデュアルパラメーターアッセイとしてDDAOGとリポフスチン自家蛍光の使用を実証します。生細胞の割合の定量が行われる。所望により、目的の細胞表面抗原を評価するための任意の免疫標識ステップが含まれていてもよい。同定された老化細胞は、フローサイトメトリーで選別し、ダウンストリーム分析のために収集することもできます。集められた老化細胞は、直ちに溶解(例えば、イムノアッセイまたは'オミクス分析のために)またはさらに培養することができる。
概要
老化細胞は通常、通常の生物学的老化の間に何年にもわたって生物に蓄積しますが、放射線や化学療法を含むさまざまな癌治療によって誘発される損傷への応答として腫瘍細胞で急速に発達することもあります。もはや増殖しないが、治療誘発老化(TIS)腫瘍細胞は治療抵抗性に寄与し、再発を引き起こす可能性がある1,2,3。TIS細胞によって分泌される因子は、免疫回避または転移を促進することにより、腫瘍の悪性腫瘍を悪化させる可能性があります4,5。TIS細胞は、複雑な状況特異的な表現型、変化した代謝プロファイル、および独自の免疫応答を発達させます6,7,8。したがって、さまざまな癌治療アプローチによって誘導されるTIS腫瘍細胞の同定と特性評価は、癌研究コミュニティにとって継続的な関心事です。
TIS腫瘍細胞を検出するために、従来の老化アッセイが広く用いられており、主として老化マーカー酵素であるリソソームβ-ガラクトシダーゼGLB19の活性の増加を検出することに基づいている。(酸性ではなく)中性に近いリソソームpHでの検出により、老化関連β-ガラクトシダーゼ(SA-β-Gal)10を特異的に検出できます。数十年にわたって使用されてきた標準的なSA-β-Galアッセイは、青色発色ベータガラクトシダーゼ基質であるX-Gal(5-ブロモ-4-クロロ-3-インドリル-β-D-ガラクトピラノシド)を使用して、光学顕微鏡によって固定細胞中のSA-β-Galを検出します11。X-Galアッセイは、一般的に入手可能な試薬や実験装置を利用してTISを定性的に視覚的に確認することができます。基本的な透過光顕微鏡は、青色色原体の存在を評価するために必要な唯一の機器です。ただし、X-Gal染色手順は感度に欠ける可能性があり、色が発色するまでに24時間以上かかる場合があります。染色に続いて、光学顕微鏡下で青色色原体のある程度の強度を示す細胞をカウントすることに基づいて、個々の老化細胞の低スループットの主観的スコアリングが行われます。X-Galは細胞不透過性であるため、このアッセイには溶媒固定細胞が必要であり、ダウンストリーム分析のために回収することはできません。動物や患者からの限られたサンプルを扱う場合、これは大きな欠点になる可能性があります。
C 12-FDG(5-ドデカノイルアミノフルオレセインジβ-D-ガラクトピラノシド、緑色)およびDDAOG(9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン-7-イル)β-D-ガラクトピラノシド、遠赤色)を含む、細胞透過性の蛍光酵素基質を用いた改良されたSA-β-Galアッセイは、文献12,13,14,15にすでに登場しています。DDAOGの化学プローブの構造と光学特性を補足図S1に示します。これらの細胞透過性プローブは(固定ではなく)生細胞の分析を可能にし、発色プローブではなく蛍光プローブは、ハイコンテントスクリーニング装置やフローサイトメーターなどの高速ハイスループット蛍光分析プラットフォームの使用を容易にします。ソーティングフローサイトメーターを使用すると、細胞培養物や腫瘍から濃縮された老化細胞の集団を回収して、ダウンストリーム分析(ウェスタンブロッティング、ELISA、オミクスなど)を行うことができます。蛍光分析は定量的シグナルも提供し、特定のサンプル内の老化細胞の割合をより正確に決定できるようにします。生存率プローブや蛍光色素標識抗体などの蛍光プローブも容易に追加でき、SA-β-Gal以外のターゲットのマルチプレックス解析が可能です。
DDAOGと同様に、C12-FDGはSA-β-Galの蛍光プローブですが、その緑色の蛍光発光は、細胞16にリポフスチン凝集体が蓄積するために老化中に生じる固有の細胞AFと重なります。遠赤色DDAOGプローブを利用することにより、緑色セルラーAFを老化17を確認するための二次パラメータとして使用できます。これにより、老化18の単一マーカーとして信頼性が低いことが多いSA-β-Galに加えて、2番目のマーカーを使用することでアッセイの信頼性が向上します。老化細胞における内因性AFの検出はラベルフリーのアプローチであるため、DDADOGベースのアッセイの特異性を拡大するための迅速かつ簡単な方法です。
このプロトコルでは、 in vitro 培養から、またはマウスで確立された薬物治療腫瘍から単離された生存可能なTIS腫瘍細胞を同定するための迅速なデュアルパラメータフローサイトメトリーアッセイとしてDDAOGおよびAFを使用する方法を示します(図1)。このプロトコルは、市販の幅広い標準的なフローサイトメトリー分析装置およびソーターと互換性のある蛍光色素を使用しています(表1)。標準的なフローサイトメトリー分析を用いた生細胞の割合の定量が可能です。所望により、任意の免疫標識ステップを実施して、老化と同時に目的の細胞表面抗原を評価してもよい。同定された老化細胞は、標準的な蛍光活性化セルソーティング(FACS)方法論を使用して濃縮することもできます。
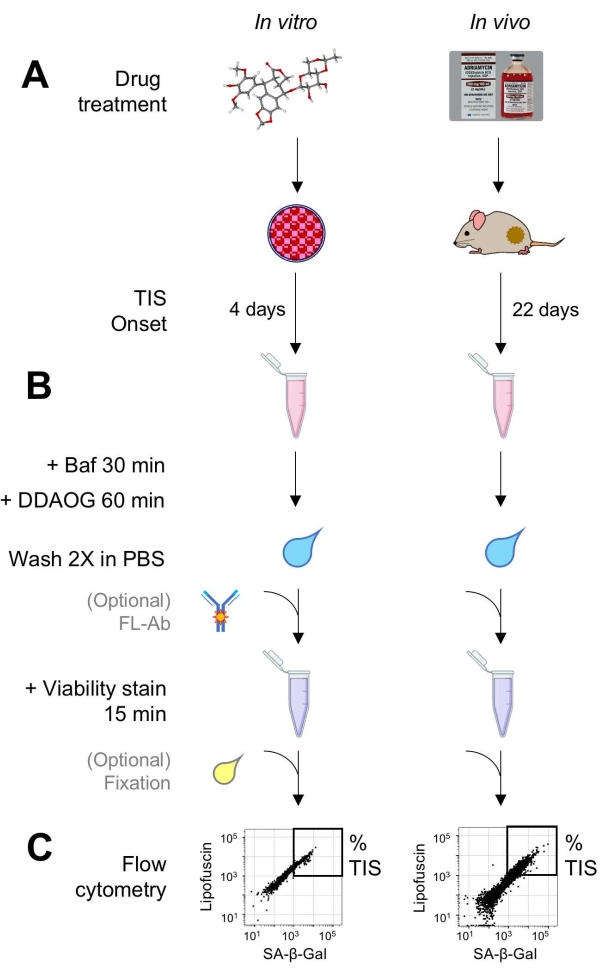
図1:実験ワークフロー。 DDAOGアッセイの要点をまとめた概略図。(A)哺乳類培養細胞にTIS誘導薬を添加するか、担がんマウスに投与する。その後、TISの発症に時間が与えられます:細胞の場合、治療後4日。マウスの場合、合計22日間、5日ごとに3回の治療と7日間の回復。細胞を採取するか、腫瘍を解離して懸濁液にします。(B)サンプルをBafで処理して、SA-β-Galを検出するためにリソソームpHを30分間調整します。次に、DDAOGプローブを60分間追加して、SA-β-Galを検出します。サンプルをPBSで2回洗浄し、生存率染色剤を短時間加えます(15分)。オプションで、サンプルをオープン蛍光チャネルで蛍光抗体で染色したり、後で分析するために固定したりすることができます。(C)サンプルは、標準のフローサイトメーターを使用して分析されます。生細胞は、赤色のDDAOG(SA-β-Galを示す)と緑色の自家蛍光(リポフスチン)を示すドットプロットで視覚化されます。TIS細胞の割合を決定するためのゲートは、未処理の対照試料(図示せず)に基づいて確立される。ソーティングサイトメーター(FACS)を使用する場合、TIS細胞を回収して培養液に戻してin vitro アッセイを行ったり、分子生物学的アッセイのために溶解して処理したりすることができます。略語:DDAO = 9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン);DDAOG = DDAO-ガラクトシド;TIS =治療誘発性老化;FL-Ab = 蛍光色素標識抗体;Baf = バフィロマイシンA1;SA-β-Gal=老化関連β-ガラクトシダーゼ;PBS =リン酸緩衝生理食塩水;FACS = 蛍光活性化細胞選別。 この図の拡大版を表示するには、ここをクリックしてください。
| フルオロフォア | 検出 | 例/エム (ナノメートル) | サイトメーターレーザー(nm) | サイトメーター検出器/バンドパスフィルター(nm) |
| ダオグ | サβガル | 645/6601 | 640 | 670 / 30 |
| AF | リポフスチン | < 600 | 488 | 525 / 50 |
| CV450 | 生存 率 | 408/450 | 405 | 450 / 50 |
| ペ | 抗体/表面マーカー | 565/578 | 561 | 582 / 15 |
表1:蛍光色素およびサイトメーターの光学仕様。 このプロトコルで使用されるサイトメーターの仕様は、合計4つのレーザーと15の発光検出器を備えた機器についてリストされています。645/660 nmで検出されたDDAOGは、SA-β-Gal1によって切断されたプローブの形態です。切断されたDDAOGは、460/610 nmで低レベルの蛍光を示す可能性がありますが、プロトコルの洗浄ステップによって除去されます。略語:DDAO = 9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン);DDAOG = DDAO-ガラクトシド;AF =自家蛍光;PE =フィコエリスリン;SA-β-Gal =老化関連β-ガラクトシダーゼ。
Access restricted. Please log in or start a trial to view this content.
プロトコル
記載されているすべての動物実験は、シカゴ大学の施設動物管理および使用委員会によって承認されました。
1.原液の調製と保管
注:細胞をフローソーティングする場合は、滅菌技術を使用してすべての溶液を調製し、0.22 μmフィルター装置でろ過する必要があります。
- DDAO-ガラクトシドのストック溶液をDMSO溶液5 mg/mLで調製します。チューブあたり50 μL(または希望する容量)で分注します。.-20°Cで暗所で最長1年間保管してください。
- バフィロマイシンA1のストック溶液をDMSO中で1 mMで調製します。チューブあたり50 μL(または希望する容量)で分注します。.-20°Cで最大6ヶ月間保管してください。
- カルセインバイオレット450 AMのストック溶液をDMSO溶液1 mMで調製します。チューブあたり50 μL(または希望する容量)で分注します。.-20°Cで暗所で最長1年間保管してください。
- 培養細胞を in vitroで処理するには、老化誘導剤の10 mM濃縮ストック溶液を適切な溶媒に調製し、0.2 μmシリンジフィルターを使用して滅菌します。-20°Cまたは製造元の指示に従って保管してください。
注:老化誘発化学療法剤 をin vivo (確立された腫瘍を有するマウスに)送達する場合、薬剤はUSPグレードであり、注射直前に濃縮ストックから生理食塩水に希釈する必要があります。 - 使用する細胞株用の完全な培地を準備します。
注:例えば、DMEM 1x + 10%FBS + 1xグルタミン代替物+ 1xペニシリン/ストレプトマイシンを含むB16-F10またはA549細胞用の培地を調製します。培地は無菌状態に保たなければなりません。他の細胞株特異的培地製剤を使用することができる。グルタチオンなどの特定の成分は、場合によっては、老化の発症を妨げる可能性があります。老化の発症が予想よりも低い場合、または対照化学療法剤で観察されない場合は、さまざまな培地製剤の実証試験を実施する必要があります。. - 染色バッファーと洗浄バッファーを準備します。
- 染色手順で使用するために、1x PBS中の1%ウシ血清アルブミン(BSA)を調製します。2 gのBSAを200 mLのPBSに溶解し、室温で10分間、または完全に溶解するまで攪拌します。
- 洗浄バッファーとして1x PBS中の0.5%BSAを調製します。ステップ1.6.1で調製した1%BSAの100 mLを、0.5%BSA用の1x PBSの100 mLに希釈します。
- バッファーを4°Cで最長1ヶ月間保存します。
- 1x PBSで4%パラホルムアルデヒドを調製します。利便性と安定性のために、市販の密封パラホルムアルデヒドアンプル(16%v/vなど)を使用してください:16%PFAの2.5 mL + 1x PBSの7.5 mL(= 4%PFAの10 mL)。実験ごとに必要な総量に応じて、準備した量を調整してください。
注:細胞固定のみの必要に応じて準備します。毎回新鮮な準備をしてください。 - FACSソーティングバッファーを調製します:1x PBS、1 mM EDTA、25 mM HEPES、1% BSA(pH 7.2)。0.22 μmのろ過装置に通した滅菌フィルターで、4°Cで最長1ヶ月間保存します。
メモ: 必要に応じて、FACS ソート専用に準備します。フローソーティングバッファーの配合は、FACS機器によって異なる場合があります。上記の処方は、この研究で使用された機器と互換性があります( 材料の表を参照)。製造元のガイドラインを参照してください。 - 腫瘍解離溶液を調製する:RPMI-1640培地中の20 μg/mLリベラーゼTL + 100 μg/mL DNAse I(FBSまたは他のサプリメントなし)。ストック溶液は、リベラーゼTL(製造元の指示に従って調製および保存)およびDNAseI(二重蒸留水[ddH2O]中の100 mg / mL、-20°Cで保存)を手元に保管するのに役立ちます。
注:腫瘍のみを使用する場合は、必要に応じて準備してください。毎回新鮮な準備をしてください。
2. 化学療法薬による培養癌細胞における老化誘導
注:このセクションのすべての細胞操作手順は、無菌慣行を使用してバイオセーフティキャビネットで実行する必要があります。このセクションは、接着細胞タイプについて書かれています。浮遊細胞は、記載したように適宜改変して使用してもよい。
- 使用する特定の細胞株を提供したサプライヤーまたは研究所からの標準プロトコルに従って癌細胞株を増殖させます。
注:低継代細胞(p < 10)は、未処理の細胞サンプルでは、複製老化のレベルが低い、つまりバックグラウンドが低いため、一般的に好まれます。 - 薬物による老化誘導の1日前に、トリプシン-EDTA0.25%(または推奨)で細胞を回収します。等量の完全培養培地を加えてトリプシンを中和し、細胞懸濁液を滅菌円錐管に移します。
注:この手順は、浮遊細胞には必要ありません。 - 標準的な血球計算法を使用して細胞をカウントし、細胞/ mLを記録します。標準的な6ウェルプラスチック培養皿に1 ×10 3-10 × 10 3 細胞/cm2 で細胞をプレートします。
注:最適なめっき密度は細胞の増殖速度に依存し、ユーザーが決定する必要があります。細胞は、処理時に約10%〜20%のコンフルエントで対数期増殖している必要があります(すなわち、.、メッキ後の18〜24時間のインキュベーション後)。.浮遊細胞の開始密度(細胞/ mL)は、ユーザーが決定する必要があります。6ウェルプレートは、通常、1ウェルあたり1つの標準フローサイトメトリー分析サンプルに対して十分な老化細胞を生成します。フローソーティングの場合、ダウンストリームアッセイに十分な数の老化細胞を回収できるように、はるかに大きな表面積(例えば、複数のP150プレート)を使用する必要があります(≥1×106)。 - 5%CO2 と湿度パンを備えた37°Cのインキュベーターで、播種細胞を一晩(18〜24時間)インキュベートします。
- 播種した細胞を老化誘発化学療法薬で治療します。少なくとも1つの陽性対照、例えば、エトポシド(ETO)またはブレオマイシン(BLM)を含む。薬ごとに重複したウェルを準備します。コントロールとして車両のみで処理された1セットを含みます。
注:各実験薬剤の用量曲線は、使用されている細胞株の老化誘導に最適な濃度を決定するために、ユーザーがテストする必要があります。. - 5%CO2 と湿度パンを備えた37°Cのインキュベーターで細胞を4日間インキュベートし、老化の開始を可能にします。光学顕微鏡を使用して、予想される形態変化について毎日調べます。
注:老化の発症率によっては、3〜5日の潜伏時間が許容される場合があります。培地を変更し、必要に応じて薬剤を再適用(または適用しない)して、老化細胞の許容可能な割合を達成しながら健康な増殖条件を促進することができます。 - 老化の開始後、トリプシン-EDTA 0.25%を添加して37°Cで5分間細胞を回収します。 細胞が懸濁液に解離したら、等量の完全培地でトリプシンを中和します。
注:このステップは、懸濁状態で増殖する細胞には必要ありません。表面マーカー染色を行う場合は、細胞の表面抗原を一時的に破壊する可能性があるため、トリプシン-EDTAの使用は避けてください。代わりに、滅菌プラスチックセルスクレーパー(または表面抗原を保存するように設計された代替解離試薬)を使用して単層を穏やかに解離します。 - 血球計算盤を使用して各サンプルの細胞をカウントします。各サンプルの細胞/mLを計算します。
注:この時点での死細胞の割合を評価するためにトリパンブルーを追加することができます(つまり、薬物処理による)が、細胞死もDDAOG染色ワークフロー中に蛍光生存率色素で決定されます。 - サンプルあたり≥0.5×106 セルを1.7 mLマイクロ遠心チューブに分注します。
注:サンプルあたりの細胞数は、すべてのサンプルで標準化する必要があります。 - チューブを4°Cのマイクロ遠心分離機で1,000 × g で5分間遠心分離します。 上清を取り除きます。
注:冷蔵マイクロ遠心分離機が利用できない場合は、特定の弾力性のある細胞タイプに対して周囲温度で遠心分離を行うことが許容される場合があります。 - セクション4のDDAOG染色に進みます。
3. マウスに樹立した腫瘍に対する化学療法薬による老化誘導
注:腫瘍細胞をFACSで分類する場合は、バイオセーフティキャビネットで作業し、滅菌器具、手順、および試薬を使用して作業することにより、各ステップで無菌性を確保します。
- 標準的な方法に従って、癌細胞を皮下注射することにより、マウス腫瘍モデルを作成します(例えば、Appelbeら19)。
注:注射するがん細胞の数、注射部位、および適切なマウス系統は、プロトコルごとに最適化する必要があります。ここでは、B16-F10細胞を0.1 mLの生理食塩水(1 × 107 cells/mL)中の1×10 6細胞で皮下注射した。- 注射を行う前に、トリパンブルーを使用した細胞の生存率が>90%であることを確認してください。マウスをイソフルランで麻酔する。
- 6〜7週齢の雌C57 / BL6マウスを3%イソフルランと空気の混合物で麻酔し、滅菌バイオセーフティキャビネット内に置かれた誘導チャンバーでこれらの条件下で維持します。マウスの足をそっとつまんで麻酔を確認します。手術中の角膜の乾燥を防ぐために、滅菌獣医軟膏を両眼に塗布します。処置中は、加熱ランプを使用してマウスの体温を維持します。
- 滅菌バイオセーフティキャビネット内で作業し、マウスを誘導チャンバーから取り出し、3%のイソフルラン供給を提供するノーズコーンと接触させます。清潔な電気かみそりを使用して、注射部位の側面領域を剃ります。注射直前にチューブを手動で反転させて調製した細胞懸濁液を短時間混合し、滅菌27 G針を取り付けた滅菌0.5 mLシリンジを使用して、細胞懸濁液を剃毛した脇腹に皮下注射します。フードからマウスを取り外し、リカバリケージに移します。
- 回復ケージでは、マウスが胸骨横臥を維持するのに十分な意識を取り戻し、右反射を示し、ケージ内を安全に動き回ることができるようになるまで、マウスのバイタルサインを継続的に監視します。完全に回復するまで、マウスを放置したり、腫瘍細胞接種を受けた動物を他の動物と一緒に戻したりしないでください。.接種されたすべてのマウスを毎日監視して、体重減少、活動/可動性の低下、および神経学的症状を確認します。あらゆるカテゴリーで重篤な症状を示すマウスを安楽死させる。接種後に痛みの症状を示すマウスには、ブプレノルフィン(0.1〜0.2 mg / kg)を皮下に1回投与します。.
注:ブプレノルフィン後に持続的な痛みを示すマウスは安楽死させる必要があります。.
- がん細胞接種後5〜7日から、2〜3日ごとにノギスで腫瘍の成長を測定します。腫瘍の体積が50 mm 3±10 mm3に達したら、プロセネッセント治療を開始します。
注:この作業では、USPグレードの塩酸ドキソルビシン(DOX)またはPEG化リポソームドキソルビシン(PLD)の用量を10 mg / kgで0.9%塩化ナトリウム注射(USP)で投与しました。薬物は、腫瘍が50mm3±10mm3に達したときから、5日に1回、腹腔内注射された。マウスは、腫瘍におけるTISの発症を可能にするために最終処置後7日間回復した。他の治療および/または腫瘍モデルの老化誘導投与量および条件を最適化する必要があります。. - 最終薬物治療の7日後に、実験動物作業ガイドラインに準拠したCO2 過剰摂取および頸部脱臼または他の承認された方法によってマウスを屠殺する。腫瘍を切除し、滅菌RPMI増殖培地で満たされた滅菌チューブまたは6ウェルプレートに収集します(処理中の生存率を維持するため)。
注:組織学的検査(X-Galや免疫組織化学など)を行う場合、腫瘍をここで二分し、O.C.T.包埋培地で半分を急速凍結し、凍結組織学の標準的な手順を使用して凍結することができます。残りの腫瘍の半分は、解離およびDDAOG染色のための豊富な材料をもたらすはずです。 - 1つの腫瘍を5 mLのRPMI培地を含むP100プラスチック皿に移します。メスを使って腫瘍を細かく刻みます。
- 浮遊細胞と破片を含む腫瘍片の懸濁液5 mLを15 mLのコニカルチューブに移します。大きな破片が存在する場合は、25 mLの血清学的ピペットの広い先端を使用して、この懸濁液を移します。材料を集めるために、追加の量の滅菌RPMIで皿をすすぎます。円錐形のチューブに蓋をして氷の上に置きます。
- 残りの腫瘍について手順3.45〜3.5を繰り返します。相互汚染を避けるために、腫瘍ごとに別々のプレートとメスを使用するか、腫瘍の間にPBSでよくすすいでください。各腫瘍を細切するために5mLの新しい培地を使用してください。
- 腫瘍解離溶液を調製します:RPMI-1640培地(FBSなし)中の20 μg/mLリベラーゼTL + 100 μg/mL DNAse I。
注:腫瘍解離溶液のための多くの効果的な製剤が存在し、異なるメーカーの様々な酵素および他の成分を含むことができる。成分の最適濃度は、腫瘍の種類によって大きく異なります。赤血球が腫瘍内に高度に存在する場合、赤血球溶解がさらに行われることがあります。死細胞が問題になる場合は、死細胞除去キットを使用できます。ユーザーは、高い生存率と汚染細胞、結合物質、および破片の存在が少ない最適な腫瘍解離条件を独自に決定することを強くお勧めします。 - すべての腫瘍サンプルをコニカルチューブに入れて、1,000 × g (4°C)で5分間遠心分離します。上清を取り除きます。
- 腫瘍材料の量に応じて、各腫瘍サンプルに1〜5 mLの腫瘍解離溶液を追加します。チューブ内に腫瘍材料ペレットが1〜2mL過剰にあることを確認してください。適度な速度で渦を流して混合します。
- サンプルを37°Cのインキュベーターに入れ、45分間急速回転させます。15分ごとに短時間渦を巻きます。
- 各サンプルを100 μmのセルストレーナーでろ過し、50 mLのコニカルチューブに入れます。サンプルの粘性が高すぎてフィルターを通過できない場合は、10 mLのRPMI-1640培地を加えて希釈します。フィルターをRPMI培地ですすぎ、残留細胞を収集します。
- 血球計算盤を使用して、各サンプルの細胞/ mLをカウントします。
- 腫瘍サンプルあたり5×106 細胞の2つ以上の反復を分注します。
- 1,000 × g (4°C)で5分間遠心分離します。上清を取り除きます。
- (オプション)必要に応じて、後でDDADOG染色するために腫瘍サンプルを凍結保存します。
- 解離した腫瘍細胞ペレットを凍結保存培地(50% FBS、40% RPMI-1640、10% DMSO)に再懸濁し、5 ×10 6 細胞/mLの無菌条件下で調製します。
- 1 mLの細胞懸濁液を各クライオバイアルに分注します。
- -80°Cのイソプロパノール細胞凍結容器でクライオバイアルを24時間凍結します。その後、液体窒素凍結保存に移して長期保存(>1週間)します。
- 染色が必要な場合は、氷上でクライオバイアルを解凍し、セクション4のDDAOG染色に進みます。
注:一部の腫瘍は凍結保存によって生存し続けることができない場合があり、このプロセスに対する回復力は、関心のある腫瘍モデルについてユーザーが評価する必要があります。
- DDAOG染色のセクション4に進みます。
4.細胞または腫瘍サンプル中のSA-β-GalのDDAOG染色
- 1 mMバフィロマイシンA1ストックをDMEM培地(FBSなし)に1:1,000倍で希釈し、最終濃度1 μMにします。
- 調製したBaf-DMEM溶液を細胞ペレットサンプル(ステップ2.11またはステップ3.16から)に1×106 細胞/mLの濃度で加えます。
注:たとえば、サンプルあたり0.5×106 細胞を使用する場合は、0.5 mLのBaf-DMEMを追加します。腫瘍の場合、5 × 106 細胞を5 mLのBaf-DMEMで染色することができます。 - 低速に設定したローテーター/シェーカーで37°C(CO2なし)で30分間インキュベートします。
注:染色プロセスには、溶液を酸性化し、それによってBafおよびDDAOG染色を妨げる可能性のあるCO2 インキュベーターは避けてください。 - 洗浄せずに、DDAOGストック溶液(5 mg/mL)を1:500x(最終10 μg/mL)で各サンプルに加えます。混合するピペット。ローテーター/シェーカーで37°C(CO2なし)で60分間交換します。直射日光から保護してください。
- チューブを4°Cで1,000 x g で5分間遠心分離します。 上清を取り除きます。
- チューブとピペットあたり1 mLの氷冷0.5%BSAで洗浄して混合します。チューブを4°Cで1,000 x g で5分間遠心分離し、上清を除去します。この手順を2回繰り返して、細胞を完全に洗浄します。上清を取り除き、続行します。
注:手順4.6の洗浄手順を実行して、望ましくない蛍光発光(460/610 nm)を示す可能性のある未解決のDDAOGを除去することが重要です。
注:細胞表面マーカーの免疫染色の場合は、以下のセクション5に進んでください。 - (オプション)DDAOG染色細胞の固定と保存(後の解析用)
- 洗浄した各サンプルに0.5 mLの氷冷4%パラホルムアルデヒドを滴下します。混合するピペット。
- 室温で10分間インキュベートします。
- 細胞を1 mLのPBSで2回洗浄します。
- サンプルは、フローサイトメトリー分析の前に4°Cで最大1週間保存してください。
注: 固定サンプルの場合は、手順 4.8 をスキップします。
- カルセインバイオレット450 AMストック(1 mM)を1:1,000倍で1%BSA-PBS(最終1 μM)に希釈します。ステップ4.6で洗浄した細胞ペレットに300 μL(培養細胞サンプルの場合)または1,000 μL(腫瘍サンプルの場合)を追加します。暗闇の中で氷の上で15分間インキュベートします。
- フローサイトメトリーのセットアップ(セクション6)に進みます。
5.(オプション)DDAOGと組み合わせた細胞表面マーカーの免疫染色
注:他のフローサイトメトリー実験と同様に、DDAOGのみおよび蛍光抗体のみを含む単一染色コントロールサンプルは、蛍光チャネル間のクロストーク(存在する場合)を決定するために調製する必要があります。クロストークが観察された場合は、標準的なフローサイトメトリー補正を実施する必要があります20。
- ステップ4.6で得られた細胞ペレットを100 μLの染色バッファー(1x PBS中の1%BSA)に再懸濁します。
- 細胞種(マウスまたはヒト)に適したFc受容体遮断試薬を、メーカー推奨の滴定で添加します。24°Cで10分間インキュベートします。
- 蛍光色素標識抗体は、メーカーが推奨する(またはユーザーが決定した)滴定で添加します。光から保護された氷上で20分間インキュベートします。
- チューブを4°Cで1,000 × g で5分間遠心分離します。 上清を取り除きます。
- チューブとピペットあたり1 mLの氷冷洗浄バッファー(0.5%BSA-PBS)で洗浄し、混合します。チューブを4°Cで1,000 × g で5分間遠心分離し、上清を除去します。この手順を2回繰り返して、細胞を完全に洗浄します。
- 1 mMカルセインバイオレット450 AMを1:1,000倍で1%BSA-PBSに希釈します。ステップ5.5で洗浄した細胞ペレットに300 μLを加えます。暗闇の中で氷の上で15分間インキュベートします。
- フローサイトメトリー分析に進みます(セクション6〜7)。
6. フローサイトメーターのセットアップとデータ取得
- 細胞サンプルをフローサイトメトリー装置と互換性のあるチューブに移します。チューブを氷の上に置き、光から保護してください。
注:細胞懸濁液に凝集体が観察された場合は、分析前に懸濁液を70〜100μmの細胞ストレーナーに通してください。40μmのストレーナーは、より大きな老化細胞の一部を排除する可能性があるため、使用しないでください。 - 参照ソフトウェア( 材料表を参照)で、次のプロットを開きます:1)FSC-A対SSC-Aドットプロット、2)バイオレットチャンネルヒストグラム、3)遠赤色チャンネル(APC-Aなど)対緑チャンネル(FITC-Aなど)ドットプロット。
注:ダブレット除外プロットとシングルチャンネルヒストグラムも使用できますが、厳密には必須ではありません。 - サイトメーターのデータ取得を開始します。
- DDAOGで染色された車両専用コントロールサンプルを吸気ポートに置きます。低い吸気速度で、サンプルデータの取得を開始します。
- FSC電圧とSSC電圧を調整して、事象の>90%がプロット内に含まれるようにします。セルがプロットにうまく収まらない場合は、面積スケーリング設定を0.33〜0.5単位に下げます。
- データを記録せずに車両専用サンプルを削除します。
- (オプション)レインボーキャリブレーションミクロスフェアを1 mLのPBSを含むサイトメーターチューブに1滴加えます。チューブをサイトメーターの吸気ポートに置きます。サンプルデータの取得を開始します。
- 紫、緑、遠赤のチャネル電圧を調整して、レインボーミクロスフェアのトップピークが各チャネルで104〜105 単位の相対蛍光の範囲になり、すべてのピークが各チャネルで十分に分離されるようにします。10,000 件のイベントを記録します。チューブを取り外します。
- DDAOGで染色されたポジティブコントロールサンプル(BLM、ETOなど)を吸気ポートに置きます。低速で、サンプルデータを取得します。FSC、SSC、紫、緑、遠赤の各チャネルのイベントを観察して、イベントの90%以上がすべてのプロットに含まれていることを確認します。AFおよびDDAOG信号と車両のみの制御の増加を探します。
- ソーティングサイトメーターを使用する場合は、このステップでソーティングを開始します。
- 記録保持の目的で、コントロールサンプルと各ソートサンプルの10,000個の細胞を記録します。
- 所望の量の細胞(通常≥1×106 が適しています)を、3〜5 mLの培養液を含む機器に適した収集チューブに分類します。
- 選別後、下流の培養または分析に進みます。
- 選別されたサンプルのルーチン分析については、セクション7にスキップしてください。
- 蛍光抗体を使用する場合は、セクション5で調製した非染色、単一染色、および二重染色のサンプルを使用して、ここでチャネル電圧を最適化します。
注:ここで使用されている校正済みフローサイトメーターの場合、最適なチャンネル電圧は通常250〜600(ミッドレンジ)でしたが、最適な電圧とチャンネル電圧範囲は機器によって異なります。信号を抑制したり、ノイズを増幅したりする可能性のある非常に低い範囲または高い範囲の電圧の使用は避けてください。 - 手順6.1〜6.5を完了し、必要に応じてサイトメーターの設定を調整した後、すべてのサンプルのデータを記録します。すべてのサンプル録音の設定が均一であることを確認してください。培養細胞サンプルあたり≥10,000イベント、または腫瘍細胞サンプルあたり≥100,000イベントを記録します。
注:ゲーティングと解析はデータ収集ソフトウェア(FACSDivaなど)を使用して実行できますが、別の解析ソフトウェア(FlowJo)を使用して取得後に実行される完全なゲーティングと解析のワークフローについては、以下のセクション7で説明します。サイトメーターワークステーションでの時間を短縮し、専用の分析ソフトウェアに含まれる追加ツールを利用するには、取得後の分析が推奨されます。 - サンプル データを .fcs ファイル形式で保存します。フローサイトメトリー解析ソフトウェア(FlowJoなど)を備えたワークステーションコンピュータにファイルをエクスポートします。セクション7に進みます。
7. フローサイトメトリーデータ解析
注:提示されたワークフローはFlowJoソフトウェアを使用しています。代替のフローサイトメトリーデータ解析ソフトウェアは、このセクションで説明する重要な手順に同様に従う場合に使用できます。
- FlowJo ソフトウェアを使用して、手順 6.7 の .fcs データ ファイルを開きます。
- レイアウト ウィンドウを開きます。
- すべてのサンプルをレイアウトウィンドウにドラッグアンドドロップします。
- 生細胞をゲートします。
- まず、車両専用コントロールのサンプル データをダブルクリックして、データ ウィンドウを開きます。
- データをバイオレット チャネル ヒストグラムとして視覚化します。CV450で染色された生細胞を、死細胞よりも明るい蛍光に基づいて同定します。
- シングルゲートヒストグラムツールを使用してゲートを描画し、生細胞のみを含めます。ゲートに実行可能な名前を付けます。
- 次に、サンプルレイアウトウィンドウから、生存可能なゲートを他の細胞サンプルにドラッグして、ゲートを均一に適用します。
- レイアウトウィンドウで、すべてのサンプルをバイオレットチャンネル(生存率)ヒストグラムとして視覚化します。続行する前に、サンプル間で生細胞ゲーティングが適切であることを確認してください。そうでない場合は、必要に応じて調整します。
注:生存率染色は、治療法や腫瘍によってばらつきを示すことがあります。
- 老化細胞をゲートします。
- 車両専用コントロールのゲート付き生存セルデータをダブルクリックして、そのデータウィンドウを開きます。
- 遠赤チャンネル(DDAOG)と緑チャンネル(AF)のドットプロットとしてデータを視覚化します。
- 矩形ゲーティングツールを使用してゲートを描画し、DDAOG+ および AF+ (右上の象限) であるセルの <5% を含めます。ゲートに老化という名前を付けます。
- 次に、サンプルレイアウトウィンドウから、老化ゲートを他の細胞サンプルの生存可能なサブセットにドラッグして、ゲートを均一に適用します。
- レイアウトウィンドウに、セクション7.4でゲートされたすべての実行可能なセルサブセットをドラッグアンドドロップします。すべての生存サンプルを、遠赤色(APC-Aなど)と緑色のチャネル(FITC-Aなど)のドットプロットとして視覚化します。
- ステップ7.5.3で描画された老化ゲートがすべてのプロットに表示され、車両のみの制御のゲートが≤5%〜10%の老化細胞を示すことを確認します。
- 上記の手順を使用して老化細胞の割合を決定したら、FlowJoプロットを使用して結果のデータを提示し、データテーブルに要約するか、標準ソフトウェアを使用して統計的に分析します。
Access restricted. Please log in or start a trial to view this content.
結果
SA-β-Galによる老化の検出について、DDAOGとX-GalおよびC12-FDGの比較可能性を実証するために、いくつかの実験が行われました。まず、X-Galを用いて、ETOにより誘導された老化性B16-F10メラノーマ細胞を染色した(図2A)。ETO処理細胞のサブセットでは濃い青色が発達しましたが、他の細胞はそれほど強くない青色染色を示しました。形態は、ほとんどのETO処理細胞で拡?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
過去10年ほどで、フローサイトメトリーは、腫瘍免疫学の人気の高まり、低コストのフローサイトメーターの開発、および学術機関での共有機器施設の改善により、癌研究においてより一般的なアッセイプラットフォームになりました。マルチカラーアッセイは現在標準であり、ほとんどの新しい機器には紫、青緑、赤から遠赤色の光学アレイが装備されています。したがって、このDDAOGプロ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、この研究のために宣言する利益相反はありません。
謝辞
シカゴ大学のサイトメトリーおよび抗体コアファシリティには、フローサイトメトリー機器のサポートに感謝します。シカゴ大学の動物研究センターは動物の住居を提供しました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
参考文献
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501(2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630(2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366(2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441(2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677(2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells - modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075(2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved