Method Article
哺乳類宿主における活動感染中のカンジダ・アルビカンス変異株の形態形成表現型をスクリーニングするためのin vivoイメージングの使用
要約
この原稿は、非侵襲的共焦点顕微鏡を使用して、哺乳類宿主における活動感染中の形態形成表現型について中等度のカン ジダアルビカンス 変異体ライブラリをスクリーニングする方法について説明しています。
要約
カンジダアルビカンスは重要なヒト病原体です。形態学的形態を切り替えるその能力は、その病因の中心です。これらの形態学的変化は、環境刺激に応答して制御される複雑なシグナル伝達ネットワークによって調節される。これらの調節成分は高度に研究されていますが、ほとんどすべての研究では、フィラメント形成を引き起こすためにさまざまなin vitro刺激を使用しています。病態形成過程で形態形成がどのように制御されるかを明らかにするために、哺乳類宿主内で菌糸形成を受けている生物の高空間分解能画像を取得するためのin vivo顕微鏡システムを開発しました。ここで紹介するプロトコルでは、このシステムを使用してC.アルビカンス変異株の小さなコレクションをスクリーニングし、感染部位で発生する形態形成の主要な調節因子を特定できるように説明しています。代表的な結果が提示され、転写調節因子Efg1などの形態形成のいくつかの調節因子は、インビトロおよびインビボで一貫した表現型を有するのに対し、アデニルシクラーゼ(Cyr1)などの他の調節因子は、インビトロと比較してインビボで有意に異なる表現型を有することを示す。
概要
カンジダ・アルビカンスは一般的なヒト真菌病原体であり、粘膜皮膚疾患、播種性疾患、および限局性組織感染症を引き起こします1。C.アルビカンスの生理学の重要な特徴は、その複雑な多型成長であり、これは共生および病原体の両方としての役割に関連しています2,3,4。30°Cのin vitroでの豊富な栄養条件下では、通常、卵形の出芽酵母として増殖します。栄養欠乏、pH変化、37°Cでの成長、血清への曝露、寒天に埋め込まれた場合の成長など、さまざまな環境トリガーにより、分極成長パターンに移行し、真の菌糸および/または偽菌糸5が形成されます。二極成長の開始とその結果としての糸状生物の成長は、形態形成と呼ばれます。
生物の病原性における形態形成の重要性のために、菌糸形成の調節は広く研究されてきた6,7。形態形成を引き起こすシグナル伝達経路と転写調節の複雑なネットワークがあります。C. albicansの形態形成と病因との関係にもかかわらず、形態形成を調査するほとんどの研究は、菌糸形成を引き起こすためにin vitro刺激を使用してきました。フィラメント化のさまざまなin vitroモデルは、刺激される個々の調節経路に関して同一ではないことがますます明らかになっています。さらに、宿主の複雑な環境と密接に対応するin vitro増殖条件はありません。ヒト病原体としてのC.アルビカンスの重要性を考えると、このプロトコルの目標は、中程度のスループットのシステムを使用して、哺乳類宿主における活性感染中の形態形成を調査し、研究者がC.アルビカンス変異体ライブラリをスクリーニングできるようにすることです。
これらの研究を容易にするために、倒立共焦点顕微鏡を用いて麻酔マウスの耳介に感染している間のC.アルビカンス細胞の高空間分解能画像を得ることができるin vivoイメージングシステムを開発しました8,9,10。耳介の皮膚は非常に薄いため、組織解剖を必要とせずにこれらの画像を得ることができます。したがって、定量的表現型データは、宿主組織内の活動性感染部位で測定することができる。ここで説明するプロトコルは、異なる蛍光タンパク質発現カセット11、12を有する参照株および1つ以上の変異株の形質転換を含む。次に、蛍光タンパク質発現株を混合し、皮内注射します。感染が確立された後、共焦点イメージングを使用して、フィラメント形成の頻度と形成されたフィラメントの長さの両方を定量化します。変異株から得られたデータは、同じ組織領域に存在する参照株から得られたデータに正規化され、したがって内部対照を提供する。このシステムにより、いくつかの一連のC.アルビカンス変異株のスクリーニングに成功し、その多くはin vitroで形態形成の欠陥を持っています9,10。これらの株の多くはインビボで容易にフィラメント化し、形態形成の調査のためのインビボモデルの重要性を強調している。
プロトコル
このプロトコルの研究は、アイオワ大学施設動物管理および使用委員会(IACUC)によって承認されました。BSL2生物を扱うための機器と手順については、CDCガイドラインを参照してください13。
1.カン ジダアルビカンス 株の調製
- ポジティブコントロールとして使用する適切な基準株を特定します。この株が、その系統と遺伝子操作の点で実験株と密接に一致することを確認してください。
注:ここに提示された代表的な実験のために、変異体は、SN152から構築されたHomannら14に記載されている株から作成されました。これらの変異体はArg-です。したがって、選択された基準株はSN250であり、これもSN152から作成され、Arg-でもあります。栄養ストレッサーは、酵母サッカロマイセス・セレビシエ15における二極成長の調節において重要です。それらはまた、C.アルビカンスおよび他の真菌のフィラメント化にも関与しています16,17,18。したがって、栄養ストレスによる潜在的な交絡効果を回避するために、参照株は可能な限り実験株と栄養要求性を一致させる必要があります。 - 蛍光タンパク質発現コンストラクトを選択します。さまざまな実験株をスクリーニングする場合は、1つの蛍光タンパク質を発現する参照株を作成し、他の蛍光タンパク質を使用して変異株をマークします。
注:ここに示す代表的なデータは、参照株にNEONを使用し、変異株にiRFPを使用しています。蛍光タンパク質は、高発現で比較的明るく、使用している顕微鏡で励起/検出できる場合は、任意の蛍光タンパク質を使用できます。異なる蛍光タンパク質を発現する参照株を比較した対照実験では、形態形成に対する蛍光タンパク質発現の影響は示されていません。 - 蛍光タンパク質発現コンストラクトで株を形質転換します。
注:多くの施設では、 C.アルビカンスを扱う作業に生物学的安全性レベル2の予防措置の使用を要求しています。すべての作業は地域の安全規制に従う必要があります。地域の規制に関係なく、 C.アルビカンス を扱う研究者は、生物の安全な取り扱いについて訓練を受ける必要があります。- 標準的な酢酸リチウムプロトコル19を使用して参照および実験株を形質転換する。
注:ここで説明する実験では、ロバート・ウィーラー博士から寛大に提供されたpENO1-NEON-NAT RおよびpENO1-iRFP-NATRプラスミドを使用しています11,12。プラスミドは、NotI9を用いて線状化した。 - ノルセオトリシンまたは他の関連する選択培地上での成長に基づいて形質転換体を選択する。
- 成功した変革者を特定します。つまようじを使用して各コロニーから少量の細胞を選び、顕微鏡スライド上で2.5 μLの水滴に混ぜます。カバーガラスを適用し、10x〜40倍の倍率で調べます。共焦点イメージングシステム(プロトコルの残りの部分に使用)または標準の広視野蛍光顕微鏡で検査します。適切な形質転換体は、適切な励起波長および発光波長を有する明るいシグナルを有するであろう。
注:代表的な結果として、NEON発現株は、472/30 nmバンドパス励起フィルター、520/35 nmバンドパス発光フィルター、および495 nmシングルエッジダイクロイックビームスプリッターを備えたロングパスフィルターを備えた正立蛍光顕微鏡を使用して視覚化されました。iRFPは目視では見えないため、iRFP発現株は、 in vivo イメージングに使用される共焦点顕微鏡システムを使用して視覚化され、励起に638 nmレーザーを使用し、655〜755 nmの発光光を検出しました。- あるいは、蛍光実体顕微鏡、ハンドヘルド蛍光励起システム、またはゲルやウェスタンブロットに通常使用される蛍光検出システムを使用して、巨視的なコロニー蛍光を評価します。
- 選択した形質転換体の冷凍庫ストックを作成します。
- 標準的な酢酸リチウムプロトコル19を使用して参照および実験株を形質転換する。
- YPD(酵母エキスペプトンデキストロース)固体培地に蛍光タンパク質発現基準および実験株を注射の3日前にフリーザーストックから接種し、つまようじを使用して生物のダブをフリーザーストックからYPD固体培地に移します。30°Cで2日間インキュベートします。
- 各菌株について、注射の1日前にいくつかのコロニーから採取した C.アルビカンス 細胞を25mLのYPDを含むフラスコに接種する。これを行うには、つまようじを使用して、あるコロニーからYPDに生物を少し移します。数回繰り返して、いくつかの異なるコロニーから細胞を取得します。オービタルシェーカーインキュベーターで30°C、175rpmで一晩インキュベートします。
注: C.アルビカンスは 自発的な遺伝的変化の頻度が高いため、接種源として複数のコロニーを使用することが重要です。接種材料培養を開始するときに複数のコロニーを使用すると、接種材料内のすべての生物が有意な自発的変化を伴う親から生じる可能性が最小限に抑えられます。 - 注射当日:
- 培養液1 mLを500 x gで2分間遠心分離する 。
- 培養液を1 mLの滅菌ダルベッコリン酸緩衝生理食塩水(dPBS)で3回洗浄します。最終洗浄後、ペレットを1 mLの滅菌dPBSに再懸濁します。
- 洗浄した培養液のサンプルを1:100で希釈し、血球計算盤を使用してカウントします。
- 洗浄した培養物の密度を、dPBSを用いて1mLあたり1 x 108 生物に調整します。
- 注入する菌株のセットごとに、等量の基準菌株と実験株を混合して接種材料を作成します。これにより、接種材料の密度が1mLあたり1 x 108 生物に維持されます。
注:耳ごとに評価できる株の数は、各蛍光タンパク質からのシグナルを明確に識別するために使用される顕微鏡システムの能力によって制限されます。 - 接種材料の準備ができたら、動物注射に直接進みます。使用前に接種材料を保管しないでください。
2.動物の準備
- 地元の施設動物管理および使用委員会または関連する地方自治体から承認を得てください。
- ベンダーまたは繁殖プログラムから6〜12週齢のマウスを入手します。接種前の少なくとも1週間は、実験全体を通して住む施設のハウスマウス。
注:代表的な結果については、6週齢の雌DBA2 / Nマウスを使用しました。 - 接種前に少なくとも7日間、動物にクロロフィルフリーの飼料を与えます。
3.脱毛と接種
- 麻酔の手術面を誘発します(図1)。
注意: 吸入麻酔薬は危険物であり、目や皮膚の炎症、神経系の毒性を引き起こす可能性があります。.吸入麻酔薬の使用に関するすべての施設の方針と手順、および一般的な実験室の安全慣行に従う必要があります。.吸入麻酔薬の使用について訓練を受けた個人のみがこれらの手順を実行できます。標準的な慣行には、手袋、白衣、目の保護具の着用、麻酔スカベンジャーシステムの使用、および施設のガイドラインに従った慎重な記録管理が含まれます。- マウスを予熱した麻酔導入室に入れます。全身麻酔中は動物を暖かい環境に保管してください。この目的のために設計された加温パッドと加温された顕微鏡ステージを使用してこれを達成します。市販の加熱パッドは過熱して火傷を引き起こす可能性があるため、使用しないでください。
- マウスが右反射を失い、呼吸が遅く安定するまで、誘導チャンバーに2%〜3%のイソフルランを供給します。.麻酔の導入室を一掃し、動物を1%〜2%のイソフルランを提供する非リブリーザーノーズコーンに移す。
- つま先のピンチ反射またはその他の検証メカニズムを使用して麻酔面を検証します。実験全体を通して、動物の呼吸パターンと麻酔面を監視し、必要に応じて麻酔薬の濃度を調整します。
- 角膜の乾燥を防ぐために目の潤滑剤を塗布します。
- 脱毛(図1C、D)
- 綿先の綿棒を使用して、市販の脱毛クリームを両耳の内面と外面にたっぷりと塗ります。
- 2〜3分後(または製造元の指示に従って)、乾いたガーゼパッドで耳をそっと拭いて、すべてのクリームと髪を取り除きます。滅菌水で飽和させたガーゼパッドでさらに2回拭いて、脱毛クリームの残留物を完全に取り除きます。すべての脱毛クリームを除去しないと、皮膚の炎症/炎症を引き起こします。
- インジェクション(図1E、F)
- 注射する耳の表面を70%エタノールで飽和させたガーゼパッドで拭き、風乾させます。
- 複数回反転させるか、ボルテックスして接種材料をよく混ぜます。
- 20〜30μLの接種材料をインスリン注射器に引き込みます。針を上に向けて、シリンジを軽くたたいて、バレル内の空気が上部にあることを確認します。空気と余分な接種材料を接種チューブまたは廃棄物チューブに慎重に排出して、プランジャーが10μLマークになるようにします。
- 利き手でない手の指または親指に指ぬきを着用し、指ぬきを横切って耳を安定させます。または、市販の両面スキンテープ(ファッションテープ)を小さな円錐形または丸底のプラスチックチューブに貼り付け、テープ全体に耳を垂らします。これを行う間、麻酔のノーズコーンを外さないように注意してください。ノーズコーンを作業面にテープで留めると便利です。
注:耳の内側または外側のいずれかを注射することができます 治験責任医師の身体的快適さに基づいて。顕微鏡検査の場合は、注入する耳の側面が対物レンズの方を向くようにマウスを配置してください。 - 注射針を皮膚とほぼ完全に平行に保ち、大きな静脈を避け、ベベルがちょうど覆われるまで針の先端を皮膚の最も外層に挿入します。
- 接種材料を皮内にゆっくりと注射します。良い皮内注射は皮膚に小さな泡を上げます。漏れを最小限に抑えるために、針を耳から取り外す前に、針を15〜20秒間所定の位置に保ちます。
- 動物の耳の下側が湿っている場合、針は深すぎて耳を完全に通過しました。その場合は、耳の別の領域に注射を繰り返します。
- 動物のもう一方の耳を使ってこのプロセスを繰り返します。これは、複製のために同じC.アルビカンス株で、または異なるセットのC.アルビカンス株で行うことができます。
- すぐに画像化しない場合は、動物を温めた回収室に入れます。麻酔から回復するまで動物を観察し、飼育ケージに戻します。
- 制度上のプロトコルに従って、ケージにバイオハザードラベルを明確にマークし、ケージ内の動物がカンジダアルビカンスに感染していることを示します。
- 動物の麻酔およびその他の必要な制度的慣行に関連する必要なすべての記録管理を完了します。
- 動物生物学的安全性レベル2の予防措置を使用して、動物施設の条件で動物を収容します。
4. in vitro の形態形成を定量し、 in vivo の結果と比較する
- 接種材料の調製に使用したのと同じ洗浄培養物を使用して、RPMI1640 + 10%熱不活化ウシ胎児血清中の生物の1:50希釈を作成し、タンブリングしながら37°Cで4時間インキュベートします。あるいは、 インビトロで 形態形成を刺激する他の培地を使用することができる。
- サンプルを500 x g で5分間遠心分離し、0.5 mLのdPBSに再懸濁します。
- サンプルを1:10の比率で希釈し、希釈したサンプル2.5 μLを顕微鏡スライドに置き、カバーガラスで覆います。
- 蛍光顕微鏡を使用してサンプルを調べます。少なくとも100個の細胞をカウントし、各株について酵母および糸状細胞の数を記録します。ここに提示された代表的な結果では、糸状細胞は、母細胞の長さの2倍以上の長さを有する任意の細胞として定義される。
注: in vitro 形態形成の定量化は、動物の接種と同じ日に行うことができます。注射用の接種材料を調製しながらin vitro 形態形成アッセイを開始し、4時間の潜伏期間中に動物の接種を行うことが可能である。4時間のインキュベーション期間が終了する前にすべての動物の手順が完了した場合は、 in vitro 刺激細胞の検査に直接進みます。あるいは、細胞をdPBS中の3.7%ホルムアルデヒドに再懸濁し(ステップ4.2)、4°Cで数日間保存することもできます。固定された生物は、時間が許す限り定量化することができる。動物の接種は、 インビトロ 定量アッセイのために遅延してはなりません。.
5. 生体 内イメージングの準備
- 顕微鏡を準備します(図2A)。
- すべての顕微鏡装置の電源を入れ、イメージングソフトウェアを起動します。
- 可能な場合は、事前に決定されたイメージング設定をロードします。
- 使用されている蛍光タンパク質を検出するために必要なレーザーと検出器をアクティブにします。
- 加熱した顕微鏡ステージの電源を入れ、37°Cまで温めます。
注:加熱ステージではなく、完全に密閉された環境チャンバーを備えた顕微鏡を使用することが可能です。 - 焦点面がカバーガラスの上面になるように Z 軸の基準点を設定します。 これは、ステージ開口部の上にカバーガラスを所定の位置にテープで留め、カバースリップに水滴を置くことによって行うことができます。 低倍率(10倍)の「ドライ」対物レンズを使用して水滴の端に焦点を合わせ、z軸の基準点を設定します。 ステージから取り外す前に、タオルを使用してカバーガラスから水分を吸収します。
- 非常に長い作動距離の対物レンズを所定の位置に回転させ、液滴をレンズに置きます。カバーガラスを配置するときに起こりうる損傷を避けるために、レンズを下げてください。
- ステージ開口部に#1.5カバーガラスを置き、所定の位置にテープで留めます。カバーガラスの下の液体が顕微鏡に吸い込まれないように、テープがカバーガラスのすべての端を完全に覆っていることを確認してください。対物レンズをz軸の基準点まで上げて、液浸液が対物レンズとカバーガラスの両方に接触するようにします。
- 感圧テープを複数用意して、ノーズコーンとマウスを配置するときにすぐに使用できるようにします。
- すべての顕微鏡装置の電源を入れ、イメージングソフトウェアを起動します。
- 上記のように画像化されるマウスに全身麻酔を誘導する(ステップ3.1)。
- マウスを置きます(図2B-D)。
- 動物がイメージングの位置にいるときに動物の鼻を完全に覆うようにノーズコーンを配置して、顕微鏡ステージに麻酔ノーズコーンを固定します。これは、2人の調査員でより簡単に達成できます。最初の研究者に麻酔をかけたマウスの鼻をノーズコーンに入れ、マウスをイメージングの位置に動かし、ノーズコーンを動物の鼻の上に保持し続けます。他の調査員に、ノーズコーンとチューブを所定の位置にテープで固定して、マウスの鼻の上に安定して収まるようにします。ノーズコーンが所定の位置にテープで固定されたら、イメージングセッションの残りの間そのままにしておきます。
- ノーズコーンを配置するのに最適な場所を確立したら、その位置に注意してください。その後のイメージングセッションでは、動物を顕微鏡に持ち込む前に、ノーズコーンをステージに固定することができます。
- 対物レンズの上のカバーガラスに滅菌水を一滴置きます。
- マウスを顕微鏡ステージに置きます。耳が水滴の上にあり、カバーガラスに対して平らであることを確認してください。
- 2番目(上)のカバーガラスを使用して、耳を平らにします。
- カバーガラスの端をマウスの本体と平行に置き、耳が頭と出会うマウスの端に触れます。
- カバーガラスの自由端をヒンジモーションで顕微鏡ステージに下げます。カバーガラスが顕微鏡ステージに当たると、耳が平らになります。耳に折り目や隆起を作らないように注意してください。
- 上部カバースリップをしっかりとテープで固定して、耳を平らに保つのに十分な圧力を保持します。テープにマウスの髪の毛やひげが引っ掛からないように注意してください。
- 環境チャンバーを備えた顕微鏡を使用しない限り、正常熱環境を維持するために、マウスの体を滅菌ドレープでゆるく覆います。
- 関心のあるフィールドを特定します。
- 対物レンズがz軸の基準点にあることを確認します。
- 白色光/広視野イメージングを使用して、焦点面を耳の組織に調整します。良い戦略は血管に焦点を合わせることです-赤血球が血管内を移動するのを見ることができれば、焦点の面は組織内の中にあります。
- 顕微鏡に広視野蛍光機能が装備されている場合は、それを使用して関心のあるフィールドを特定します。そうでない場合は、共焦点イメージングを使用します。一般に、広視野顕微鏡を使用して関心のある領域を特定する方が速く、耳組織の照射が少なくて済みます。
- 基準株で発現した蛍光タンパク質の検出にフィルターキューブを用いて、基準株からの蛍光シグナルを有する視野を特定する。焦点が合っていない光は、個々の生物に焦点を合わせる能力を妨げる可能性が高いことに注意してください。このステップの目標は、共焦点イメージングの対象領域を特定することです。
- 実験株によって発現された蛍光タンパク質を検出し、選択した視野での存在を確認するフィルターキューブに変更します。
6. イメージング
- 設定を決定します。
- イメージングソフトウェアがライブ共焦点モードのときに、焦点面がz軸を通って移動するときに関心のあるフィールドを調べます。使用するすべての蛍光タンパク質からの強いシグナルを持つz軸平面を選択してください。
- レーザー出力および/またはイメージング速度を調整して、視野内のすべての細胞の形態を決定できるように、十分に強い信号を取得します。組織の損傷を避けるために、可能な限り低いレーザー出力を使用してください。
注:すべてのイメージングと同様に、レーザー出力、取得速度、および解像度の間にはバランスがあります。耳組織の照射を最小限に抑えるために速度とレーザー出力のバランスを取りながら、生物の形態を明確に識別する設定を特定します。イメージングは真皮の外側を通して行われるため、スライドに取り付けられた従来のサンプルの共焦点イメージングに通常必要とされるよりも高いレーザーパワーが励起に必要です。幸いなことに、形態の解析に必要な空間分解能のレベルは極端ではありません。したがって、組織損傷を引き起こすことなく生物形態を決定するのに十分な信号を有する画像を得ることは容易に達成可能である。 - これらのパラメータが確立されたら、イメージングセッション全体でこれらを使用して、後続のイメージングセッションの開始点として機能します。したがって、イメージング設定を保存すると便利です。
注:感染の個々の領域は、組織内の浅いまたはより深い場合があります。より深い領域では、レーザー出力の増加が必要になる場合があります。このアッセイは、シグナルの強度ではなく空間分布に依存するため、必要に応じてフィールド間で画像設定を変更することができます。
- 画像を取得します。
- 基準株に明確なフィラメントが形成され、ほとんどの生物が十分に広がっていて形態を決定できる視野を選択してください。
- Z スタックのフォーカスの上面と下面を設定します。感染領域の深さ全体をカバーする必要はありませんが、画像ボリュームの上部または下部にある生物は通常、分析から除外されることに注意してください。
- zスタック画像を取得し、各チャンネルを疑似色して各ひずみを区別し、チャンネルを重ね合わせます。画像を保存します。
- 他の視野についても繰り返します。形態形成は場所によって異なります。したがって、各耳から少なくとも3つのフィールドを取得して分析することが重要です。
7.手動2次元分析:フィラメント化の頻度
- イメージングソフトウェアを使用して、Zスタックを2次元画像に最大投影します。ここで提供される手順は、FIJI / Image J用です。
- ImageJソフトウェアを使用して顕微鏡画像を開きます。
- 必要に応じて、各チャネルに擬似カラーを適用して、各 C.アルビカンス 株を簡単に識別できるようにします。このためには、[ LUTカラー>画像>ルックアップテーブル ]をクリックして、選択した擬似カラーを選択します。
- スタックファイルを最大強度投影2次元画像に変換します。
- Z スタック ファイルを選択します。画像 >スタック>Z投影をクリックします。
- 上面と下面を選択し、投影タイプとして[ 最大強度]を選択します。
- 最大投影画像に見られる各生物を、菌株タイプ(チャネルの色で区別される)および形態別にカウントします。
- 著しく重複している生物や生物密度が非常に高い領域は、正確にカウントすることは困難です。これらをカウントから除外しますが、重複する可能性が高い糸状フォームに対してバイアスを導入しないように注意してください。
- Z スタックにまっすぐに突き出た、または Z スタックからまっすぐに突き出た糸状のフォームは、最大投影では小さな丸いオブジェクトとして表示されます。同様に、画像の境界によって切り取られた生物は、フィラメントが視野外にあるため、酵母のように見える場合があります。したがって、二次元分析は常に酵母の形態の割合を過大評価します。これは参照株と実験株で等しく発生するため、常に実験結果を参照株の結果と比較してください。
- 実験計画で規定されている結果の統計的比較を実行します。
8.手動2次元分析:フィラメント長
- C.アルビカンスの場合、異常なフィラメント形成は、a)形態形成を受ける「母」酵母細胞が少ない、b)フィラメントの成長速度が遅い、またはc)糸状成長が開始されるが維持されないために発生する可能性があります。これらの可能性を評価するには、真の3次元長の代理として最大投影画像内の各フィラメントの曲線経路長を定量化する(後述)。
- 芽が母細胞上で発達しているとき、それがフィラメントになるのか酵母になるのかはわかりません。糸状細胞のみがこの分析に含まれるようにするには、娘細胞が母細胞の少なくとも2倍の長さである生物のみを測定します。
- 手順7で作成した最大投影画像を開きます。
- ImageJ ツールセットで、[ 直線/ セグメント ライン] ツールを右クリックし、[ セグメント ライン] オプションを選択します。セグメント化されたラインオプションを使用すると、C .アルビカンス フィラメントの可塑性を考えると、湾曲した経路に沿ったフィラメントの長さを測定できます。
- つぼみの首からフィラメントの成長端までのフィラメントの長さを測定します。つぼみの首を左クリックします。ポインタが小さな正方形に変わります。フィラメントの長さに沿ってフィラメントをトレースし、フィラメントの長軸のカーブ、ターン、または変化があるたびにフィラメントの中心をクリックします。フィラメントの成長している先端をダブルクリックします。
- コントロール+Mを押します。これにより、面積、平均、最小、最大、および長さの測定値を表にするポップアップウィンドウが開きます。各フィラメントを測定した後、Control + Mをもう一度押して、現在の測定値を測定値のテーブルに追加します。
- すべてのフィラメントを測定したら、長さ測定値をコピーしてデータ分析ファイルに貼り付けます。
- 統計解析を実行して、参照株と変異株のフィラメント長の分布を評価します。
9.手動3次元分析
- 酵母の形態の過大評価を回避し、偽菌糸と菌糸の識別を可能にする形態形成のより正確な測定値を取得するには、各生物の形態を3次元で評価しながら、zスタックを手動で上下にスクロールします。
- あるいは、各zスタックの3次元画像を作成し、画像を回転させながら各生物の形状を解析します。
10.自動分析
- イメージングソフトウェアを使用して、生物とその形態の2次元または3次元での列挙を自動化します。
注:形態タイプを識別するための一部のアルゴリズムは、バイアスを導入する可能性があります。したがって、自動化戦略は、実験計画に関連して慎重に検証する必要があります。適切に設計および検証された自動画像分析により、分析ステップのスループットを向上させることができます。
結果
ここに示されている結果は、以前に公開されたレポート9,10に基づいています。この分析の目的は、変異体の能力を定量的に評価することです C.アルビカンス株 活動性感染中に形態形成を受ける。偽菌糸と菌糸を区別する典型的なパラメータは、複雑なin vivo環境で3次元的に成長する生物では評価が困難な場合があります。これは、共焦点イメージングによって作成された2次元断面を見る場合に特に当てはまります。したがって、このスクリーニング分析は、酵母に対して糸状として成長する生物を特定することに焦点を当てています。3次元再構成を含む、より詳細な分析を使用した追跡調査では、この方法は酵母、菌糸、偽菌糸の識別に適応できます。
C. albicansの参照株または変異株における蛍光タンパク質の発現は、in vivoでの株形態の容易な検出を可能にする(図3および図4)。一般に、定量的光学顕微鏡分析は、画像内のピクセルがほとんどまたはまったく飽和していない場合に最適です。ただし、このプロトコルでは、画像の彩度によって分析が簡素化されることがよくあります。蛍光タンパク質の局在は細胞全体で均一ではなく、フィラメントよりも母酵母の方が高いことがよくあります。幸いなことに、形態形成の調査では、信号の強度ではなく空間分布が結果を定義します。したがって、多くのピクセルが飽和している画像を取得することで、このアッセイで形態形成を定量化する能力が向上します。
in vivoでの形態形成を評価することの重要性を説明するために、参照株(SN250)と2つの変異体(転写因子Efg1を欠く1つとアデニリルシクラーゼCyr1を欠く変異株)について代表的な結果が提示されます。インビトロでは、これらの株のいずれもフィラメントとして増殖しない20,21。10%血清を添加したRPMI培地でインビトロで増殖させると、基準株は急速にフィラメントを形成するが、efg1ΔΔおよびcyr1ΔΔ株は形成しない(図3および図4)。これらの条件下では、efg1ΔΔ変異体はやや分極した増殖を示し、娘細胞は母細胞と比較してわずかに伸長している。これは、フィラメント化の明確な定義を使用することの重要性を強調しています。そのような定義はデフォルトでは任意ですが、表現型の一貫した評価に必要です。これらの研究では、糸状成長パターンは、娘細胞の最長寸法が母細胞の2倍以上である生物として定義されます。この定義を使用すると、伸長したefg1ΔΔ細胞は糸状ではありません。
そのインビトロ表現型と一致して、efg1ΔΔはインビボで有意なフィラメント形成欠陥を示します:efg1ΔΔ細胞の約9%がインビボでフィラメントとして増殖しました(図3)。対照的に、cyr1ΔΔ変異細胞の53%は、生体内でフィラメントとして増殖した(図4)。インビボでフィラメント形成を受けるcyr1ΔΔ変異細胞の数は基準株よりも有意に低かったが、インビボでフィラメントを形成するcyr1ΔΔ変異体の能力は、インビトロでの形態形成の完全な欠如からの実質的な変化を表す。視覚的には、cyr1ΔΔ変異体によって形成されたフィラメントは、基準株よりも短いように見えた。これを定量的に評価するために、糸状細胞の曲線経路長を、生体内画像の2次元投影を用いて測定した(図4E)。cyr1ΔΔフィラメントの中央長は、基準株のフィラメントよりも29%短かった。
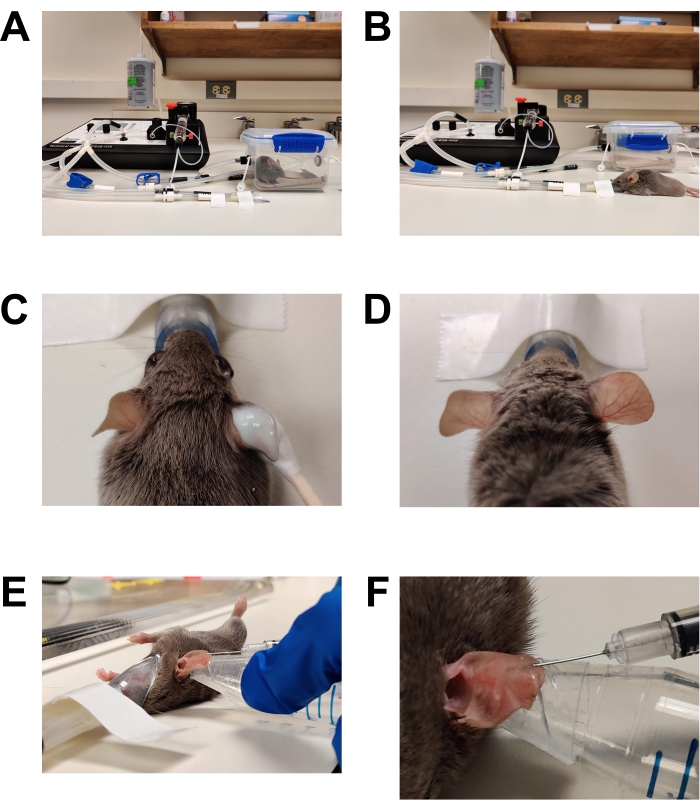
図1:麻酔と接種 。 (A)誘導チャンバーを使用した麻酔の誘導。(B)麻酔はノーズコーンを使用して維持され、必要に応じてマウスの位置を変えることができます。(C)脱毛クリームは、先端が綿のアプリケーターを使用して塗布されます。麻酔中に目を保護するために、目の潤滑ジェルが適用されています。(D)右耳の効果的な脱毛。未治療の左耳と比較してください。(E) C.アルビカンスの マウス耳への皮内注射。耳は、両面スキンテープ(ファッションテープ)で包まれた円錐形のチューブの先端を使用して所定の位置に保持されます。(F)皮内注射の接写。淡い泡が皮膚に形成され、これは皮内配置が成功したことを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:イメージングの準備 。 (A)イメージング用に準備された顕微鏡ステージ。麻酔ノーズコーンは所定の位置に固定されています。レンズ開口部を覆うステージにカバーガラスがテープで固定されています。追加のテープが利用可能です。加熱ステージは37°Cに予め加温される(図示せず)。(B)麻酔したマウスを麻酔鼻コーンに配置する。(C)マウスをわずかに回転させて、接種した耳の側面が下部カバースリップ/対物レンズの方を向くようにします。次に、耳を下部カバースリップに対して平らにし、耳の上に2番目のカバーガラスを置いて所定の位置に固定します。(D)トップカバースリップをステージにテープで固定し、顕微鏡ステージに対して耳を所定の位置に固定します。 この図の拡大版を表示するには、ここをクリックしてください。

図3:efg1ΔΔ変異株のインビトロおよびインビボ形態。 (a)RPMI+10%血清中で細胞を増殖させ、37°Cで4時間フィラメント化をin vitro誘導した後のWTおよびefg1ΔΔ変異株の広視野画像。スケールバーは10μmを表す。画像のコントラストは、見やすくするために写真編集ソフトウェアを使用して調整されました。(B)WTおよびefg1ΔΔ変異株において観察されたインビトロでのフィラメント化の割合。und = 検出不能 (フィラメントは検出されませんでした)。バーの高さは、少なくとも100個の細胞が定量化された3つの独立した実験からの糸状細胞の中央値パーセンテージを表す。エラーバーは標準偏差を示します(スチューデントのt検定で比較した結果、p < 0.001)。(C)接種後24時間でin vivoで成長するWT(緑)とefg1ΔΔΔ変異体(赤)の共焦点顕微鏡写真。矢印は、我々の「糸状」の定義を満たすefg1ΔΔ変異細胞の例を示す。スケールバーは50μmを表す。 (d)WTおよびefg1ΔΔ変異株において観察されたインビボでのフィラメント化の割合。バーの高さは、2つの独立した実験からの糸状細胞の割合の中央値を表します。エラーバーは標準偏差を示します(スチューデントのt検定で比較した結果、p < 0.001)。この図の拡大版を表示するには、ここをクリックしてください。
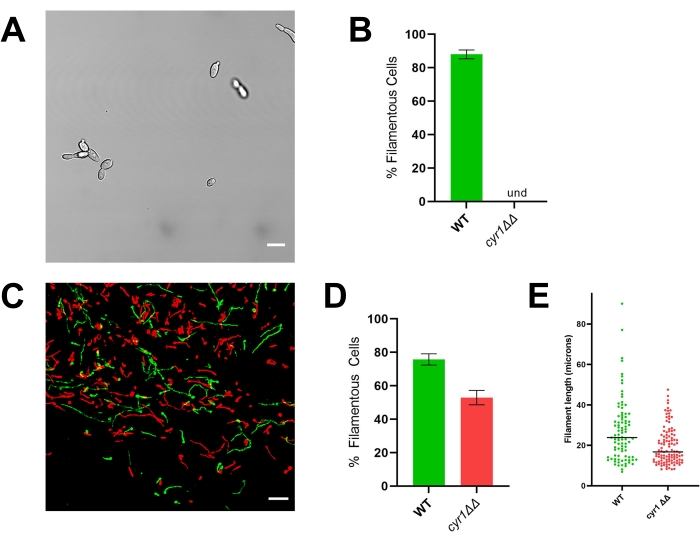
図4:cyr1 ΔΔ変異株のインビトロおよびインビボ形態。 (a)細胞をRPMI+10%血清中で37°Cで4時間増殖させてフィラメント化をインビトロ誘導した後のcyr1ΔΔ変異株の 広視野画像。スケールバーは10μmを表す。画像のコントラストは、見やすくするために写真編集ソフトウェアを使用して調整されました。(B)WTおよびcyr1ΔΔ変異株において観察されたインビトロでのフィラメント化の割合。und = 検出不能 (フィラメントは検出されませんでした)。バーの高さは、少なくとも100個の細胞が定量化された3つの独立した実験からの糸状細胞の中央値パーセンテージを表す。エラーバーは標準偏差を示します(スチューデントのt検定で比較した結果、p < 0.001)。(C)接種後24時間でインビボで増殖するWT(緑)とcyr1ΔΔΔ変異体(赤)の共焦点顕微鏡写真。スケールバーは50μmを表す。 (d)WTおよびcyr1ΔΔ変異株において観察される生体内でのフィラメント化の割合。バーの高さは、2つの独立した実験からの糸状細胞の割合の中央値を表します。エラーバーは標準偏差を示します(スチューデントのt検定で比較した結果、p < 0.001)。(e)生体内のフィラメント長の分布は、zスタックの2次元投影における曲線経路長によって測定される。各ドットは1本のフィラメントの長さを表す。酵母として増殖する細胞は、この分析には含まれなかった。バーはフィラメント長の中央値を示します。長さの分布は、マン・ホイットニーU検定(p < 0.001)を用いて分析すると有意に異なる。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このモデルは、共焦点顕微鏡を使用して、哺乳類宿主の組織内で成長するC.アルビカンス生物の画像を取得し、活動感染中の形態形成表現型を評価することを可能にします。形態形成のプロセスは、C.アルビカンスの病因の中心であり、さまざまなin vitroアッセイを使用して広く研究されています2,3,4。しかしながら、宿主の複雑な生化学的および構造的環境を完全にモデル化できるin vitroアッセイはない。
ここで説明するプロトコルは、このin vivoイメージングシステムを使用して、感染中の形態形成に関与する遺伝子を特定するためにC.アルビカンス変異体のシリーズ/ライブラリをスクリーニングすることに焦点を当てています。異なる蛍光タンパク質を発現するC. albicans株を用いることで、C. albicans変異株のin vivo形態形成を基準株と比較して定量することができます。変異体の形態形成を同じ感染領域内の参照株と比較することで、生物が同一の環境にさらされることが保証されます。これにより、フィラメント化を受けている細胞の割合、およびフィラメント化の程度を定量的に測定できます。変異株の測定値を参照株の測定値に正規化することで、ある変異株のパフォーマンスを別の変異株のパフォーマンスをより適切に比較できます。
ここに提示された代表的な結果は、インビトロとインビボの表現型の間に有意な不一致が生じる可能性を示しています。C. albicans efg1ΔΔ変異株は、ほとんどすべてのin vitro条件でフィラメント化できないため、形態形成アッセイの陰性対照としてよく使用されます20。in vivoの結果はin vitroの結果と非常に似ていましたが、このひどく妨げられた株でさえ、宿主組織環境でフィラメントを形成することがありました(図3)。これは、形態形成を誘発する宿主環境の強さを強調しています。
対照的に、cyr1ΔΔ変異株は、インビトロ成長とインビボ成長の間に実質的な不一致を示します。変異細胞はいずれもin vitroでフィラメント化を受けませんが、約半数の細胞はin vivoでフィラメントとして増殖します(図4)10,21。興味深いことに、これらのフィラメントは参照株によって形成されたフィラメントよりも有意に短く、CYR1がフィラメントの成長速度または糸状表現型を維持する能力のいずれかに寄与することを示唆しています。フィラメント長の分析を容易にするために、フィラメントの曲線経路長を、画像の2次元投影を用いて測定した。3次元で成長するフィラメントの2次元投影では、xy平面に平行でない軸上に成長するフィラメントは、その実際の長さよりも短く投影されます。この縮み率は参照株でも発生するため、2次元投影でフィラメント長の分布を評価することで、参照株と変異株の定量的な比較が可能になります。フィラメントの長さを3次元ではなく2次元で解析するには、それほど集中的な画像解析は必要ありません。したがって、一般的なデスクトップコンピュータで比較的迅速に実行できます。このより単純な分析を使用すると、スクリーニングプロトコルの一部としてフィラメントの長さ分布を含めることができ、スループットに大幅な遅延を引き起こすことなく、各変異体が形態形成を受ける能力をより微妙に理解できます。
ここで紹介する代表的な研究は、補体系に欠陥があり、好中球をC .アルビカンス 感染部位に動員できないDBA2/Nマウスを用いて実施されました22。これらの研究の目的は、宿主組織内の C.アルビカンスの フィラメント形成の調節のメカニズムを調査することでした。したがって、DBA2 / Nマウスは、個々の株の好中球に対する感受性または耐性のために結果を交絡させないようにするために使用されました。好中球抗C.アルビカンスの 反応はフィラメント形成に影響を与える可能性があるため23、感染部位への好中球の動員は形態形成アッセイの結果に影響を与える可能性があります。ある株が in vivo でフィラメント化できるが、好中球が存在するとフィラメント形成が強く阻害される場合、フィラメント形成はDBA2/Nマウスで検出されますが、無傷の好中球走化性を有するマウスを使用した場合には見られそうにありません。したがって、宿主として使用されるマウスの系統は、このプロトコルを使用する際の重要な要素である。
efg1ΔΔ変異株がin vivoでフィラメントに失敗するという観察は、この株もin vitroでフィラメントできないため、宿主好中球応答に関連している可能性は低いです。cyr1ΔΔ株でインビボで観察されるフィラメント形成は、インビトロでのフィラメント形成の失敗と一致しない。C. albicans感染のゼブラフィッシュモデルからのデータは、応答好中球が形態形成の予防に重要であることを示しています24。したがって、好中球応答を欠くDBA2/Nマウスの使用は、in vitroと比較してin vivoでのcyr1ΔΔのフィラメント形成の増加を説明する可能性は低い。それにもかかわらず、生体内環境は明らかにcyr1ΔΔ株の形態形成に影響を与えています。したがって、この株のさらなる調査は、活動性感染中のC.アルビカンスの形態形成の調節に関する重要な情報を提供する可能性がある。ここで説明するプロトコルは、将来の研究で使用されるcyr1ΔΔ株などの株を同定するためのスクリーニングアッセイとして設計されています。
低流量ガス麻酔システムの使用は、このプロトコルに非常に役立ちます(図1A、B)。このプロトコルの初期開発中に、マウスは、キシラジンと混合されたケタミンの注射可能な麻酔カクテルを使用して麻酔されました。その麻酔法では限られたイメージングを行うことができましたが、麻酔の持続時間は予測できず、イメージング中にマウスが麻酔から回復するのを避けるために、イメージングセッションを迅速に終了する必要がありました。従来の吸入麻酔システムはかさばり、麻酔ガスの流量が高い必要があり、多くの場合、ヒュームフード内で使用する必要があります。したがって、従来の吸入麻酔システムは、研究者を誤って麻酔薬にさらすことなく、共焦点顕微鏡のスペースの制約で使用することは非常に困難です。低流量吸入麻酔システムの使用は、研究者にとって安全な環境を維持しながら、動物の一貫した麻酔を可能にする。低流量のノーズコーンにより、接種と顕微鏡検査の両方で動物を簡単に位置決めできます。小口径で少量の送達チューブにより、比較的長いチューブを使用できるため、顕微鏡検査に干渉しないように麻酔器を十分な距離に配置することができます。
典型的なマウスチャウに存在するクロロフィルは、有意な組織自己蛍光をもたらす25。これにより、画像にかなりのノイズが発生し、高品質で空間解像度の高い画像を取得することが困難になります。イメージング前に7日間クロロフィルフリーの固形飼料を動物に与えた場合、自家蛍光によるバックグラウンドは組織で大幅に減少しましたが、毛髪に沈着したクロロフィルは引き続き問題でした。市販の化学脱毛クリームを使用して耳介の毛を除去することは、毛髪の自家蛍光を最小限に抑えるのに効果的です(図1C、D)。したがって、クロロフィルフリーの固形固形飼料と適切な脱毛の組み合わせにより、自家蛍光が大幅に減少し、画質が劇的に向上しました。髪はイメージングの前に耳から取り除かれるため、動物の髪の色はこのシステムに影響を与えません。このプロトコルは、BALB/c(白)、C57BL/6(黒)、およびDBA2/N(茶色)マウスにおける C.アルビカンス 感染症の研究に成功しています。このプロトコルは、さまざまな宿主遺伝子を欠損しているC57BL/6ノックアウトマウスでも使用できます。これにより、哺乳類の宿主免疫系がフィラメント形成にどのように影響するかについての将来の調査が可能になります。このプロトコルで議論されていないこのモデルの特徴の1つは、このイメージングシステムが非侵襲的であるため、同じ動物を数日間にわたって繰り返しイメージングすることができ、経時的に個々の感染の進行を追跡できることです。この特徴は、宿主と病原体の相互作用に関する将来の研究において重要な役割を果たす可能性があります。
要約すると、このプロトコルは、生きた哺乳動物宿主の組織で成長するC.アルビカンスの高空間分解能画像をもたらし、変異株における形態形成の正確な評価を可能にする8、9、10。ここに提示された結果は、このプロトコルを使用してC.アルビカンス変異体のライブラリをスクリーニングする方法を示しています。これまでに試験されたC.アルビカンス変異体のうち、インビトロでの形態形成に既知の欠陥を有する変異体の大部分は、インビボで容易にフィラメント化を受ける9,10。これは、C.アルビカンスの病因のメカニズムを解明するために設計された実験にこのようなin vivoシステムを含めることの重要性を強調しています。
開示事項
著者は開示する利益相反を持っていません。
謝辞
この研究は、NIH助成金1R01AI33409とアイオワ大学カーバー医科大学小児科の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
参考文献
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved