このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスとラットの骨格筋熱発生の測定
要約
マウスとラットに遠隔温度トランスポンダーを外科的に移植し、試験環境と手順に慣れさせます。筋肉温度の変化は、ホームケージ内の薬理学的または文脈的刺激に応答して、または所定の身体活動中(すなわち、一定の速度で歩くトレッドミル)中に測定される。
要約
骨格筋の熱発生は、代謝恒常性とエネルギー消費の根底にあるメカニズムをよりよく理解するための潜在的な手段を提供します。熱発生の神経、心筋、および分子メカニズムを筋肉温度の測定可能な変化に直接結び付ける証拠は驚くほどほとんどありません。この論文では、温度トランスポンダを使用して、マウスとラットの骨格筋温度の直接測定値を取得する方法について説明します。
リモートトランスポンダーは、マウスとラットの筋肉内に外科的に埋め込まれ、動物には回復する時間が与えられます。その後、マウスとラットは、テスト環境と手順に繰り返し慣れる必要があります。筋肉温度の変化は、ホームケージ内の薬理学的または文脈的刺激に応答して測定されます。筋肉温度は、これらの刺激によって引き起こされる筋肉温度の変化に寄与する活動の変化を考慮に入れるために、所定の身体活動(すなわち、一定の速度で歩くトレッドミル)中に測定することもできます。
この方法は、脳、交感神経系、骨格筋のレベルで筋肉の熱発生制御のメカニズムを解明することに成功しています。捕食者臭(PO;フェレット臭)を文脈刺激として、オキシトシン(Oxt)を薬理刺激として注射し、捕食者臭が筋肉の熱発生を誘発し、Oxtが筋肉の温度を抑制するというこの成功のデモンストレーションを提供します。したがって、これらのデータセットは、筋肉温度の急激な変化を検出する上でのこの方法の有効性を示しています。
概要
代謝研究において、骨格筋の熱発生の検査は、体重の恒常性を調べるための有望な新しい手段です。公表された文献は、体の最大の臓器系の1つである骨格筋の熱発生反応が、エネルギー消費やその他の代謝効果を増加させる手段を提供し、それによって肥満などの疾患内のシステムのバランスを効果的に再調整するという考えを支持しています1,2,3。筋肉が熱発生器官と見なすことができる場合、研究はこの器官内の熱発生変化を研究するための実用的な方法論を利用する必要があります。骨格筋の吸熱の影響を理解したいという願望と、震えのない筋肉の熱発生を研究するためのこの方法論の有用性は、代謝研究に固有のものではありません。進化論4、比較生理学5、生態生理学6,7などの分野は、筋肉の熱発生が吸熱に寄与する方法と、このメカニズムが環境にどのように適応するかを理解することに既得権益を示しています。提示されたプロトコルは、これらの質問に対処するために必要な重要な方法を提供します。
提供された方法は、捕食者の脅威を再現するためにコンテキストをシフトするために捕食者臭(PO)を提供する独自の技術を含む、筋肉温度の文脈的および薬理学的刺激調節の両方の評価に利用することができる。以前の報告では、POが筋肉の熱発生の大幅な増加を急速に誘導する能力が実証されています8。さらに、薬理学的刺激も筋肉の温度を変化させる可能性があります。これは、ナドロールを使用した末梢βアドレナリン作動性受容体の薬理学的遮断が、トレッドミル歩行中の収縮性熱発生に大きな影響を与えることなく、POが筋肉熱発生を誘導する能力を阻害したPO誘発性筋熱発生の文脈で実証されています8。ラットにおけるメラノコルチン受容体アゴニストの中枢投与は、熱発生を変化させる脳のメカニズムを識別するためにも使用されています9,10。
ここでは、神経ホルモンのオキシトシン(Oxt)がマウスの筋肉の熱発生を変化させる能力の予備調査を提供します。捕食者の脅威と同様に、同性の同種との社会的遭遇は体温を上昇させ、社会的温熱療法11と呼ばれる現象です。Oxtと社会的行動との関連性を考えると12、Oxtはマウスの社会的温熱療法のメディエーターであると推測されています。実際、オキシトシン受容体拮抗薬はマウスの社会的温熱療法を減少させ11、Oxtを欠くマウスの子犬は、熱発生を含む体温調節の行動的および生理学的側面に欠損を示します13。Harshaw et al. (2021)がβ3アドレナリン受容体依存性褐色脂肪組織(BAT)の熱発生と社会的温熱療法11を支持する証拠を見つけられなかったことを考えると、社会的温熱療法はOxtの筋肉熱発生の誘導によって引き起こされる可能性があると仮定されています。
骨格筋の熱発生を測定するために、以下のプロトコルは、マウスまたはラット内の関心のある筋肉に隣接する事前にプログラムされたIPTT−300トランスポンダの移植を使用する8、10、14、15。これらのトランスポンダは、対応するトランスポンダリーダーを使用して読み取られるガラスカプセル化マイクロチップです。この能力でこの技術を利用した研究はほとんどまたはまったくありませんが、研究はこの方法によって提供される特異性の必要性を示唆しています16,17。以前の調査では、この方法の信頼性と、他の温度試験方法18と比較して、または外科的方法(例えば、カニュレーション19)と組み合わせて温度トランスポンダを使用できるさまざまな方法が示されています。ただし、この種の研究では、全体的な体温20,21,22またはBAT23,24,25などの特定の組織を測定するために、さまざまな戦略的配置に依存しています。
これらの場所から、または耳または直腸温度計26を使用しながら温度を測定するのではなく、ここで説明する方法は、対象の筋肉に対する特異性を提供する。対象の筋肉に隣接するトランスポンダを直接埋め込むことによって部位を標的にする機能は、筋肉の熱発生を特異的に調べるためにより効果的です。これは、表面赤外線温度測定27、28または熱電対29を介した皮膚温度測定によって提供されるものに加えて、新しい道を提供する。さらに、この方法を通じて提供されるデータは、赤外線サーモグラフィ30、31、32などの大規模で高価なハイテク機器およびソフトウェアの必要性を回避して、研究の範囲の手段を提供する。
この方法は、片側または両側で大腿四頭筋および腓腹筋の温度を測定するために首尾よく使用されています。この方法は、定位固定装置手術との併用でも有効である14,15。トランスポンダの手足から~7-10cm以内では、ポータブルトランスポンダリーダー(DAS-8027 / DAS-7007R)を使用して温度をスキャン、測定、および表示します。この距離は、潜在的なストレッサーや、試験手順中の動物の取り扱いなどの温度変化変数を最小限に抑えるため、以前の調査8,9,10にとって重要かつ貴重でした。タイマーを使用すると、動物と直接対話することなく、一定期間にわたって測定値を記録および収集できます。
テスト中のマウスの妨害をさらに最小限に抑えるために、この方法では、PVC配管で作られたライザーの組み立てと使用について説明し、テスト中に実験者がホームケージの底にアクセスできるようにします。ライザーをデジタルリーダーと組み合わせて使用すると、刺激が配置された後、動物の介入なしにトランスポンダの手足の温度測定を行うことができます。最小限のコストで、この方法は薬理学的および文脈的刺激と組み合わせて使用 することができ、研究者にとって非常にアクセスしやすいものになります。さらに、この方法は、一度にかなりの数の被験者(~16匹のマウスまたは~12匹のラット)で採用できるため、あらゆる研究プロジェクトの全体的なスループットを向上させる時間を節約できます。
この方法では、ステンレスメッシュのティーインフューザーボールを使用してマウスに匂いを提示するための細工されたメカニズムが導入され、今後は「ティーボール」と呼ばれます。これらのティーボールはあらゆる臭い物質を含むのに理想的ですが、これらの研究では、マウスとラットの天敵であるフェレットのケージ内寝具として2〜3週間にわたって使用されたタオルが各治療ティーボール内に配置されます。各タオルは5 cm x 5 cmの正方形にカットされます。この分注は、他の点では同一の無臭コントロールタオルでも繰り返されます。バリア(すなわち、ティーボール)なしでこれらの匂いを提示すると、マウスはケージ内の繊維を細断し、身体活動を増加させました。この行動はラットではそれほど顕著ではありませんでした。ティーボールはタオルに通気性のあるケーシングを提供し、実験試験全体にわたって保護されたまま、臭いに完全にアクセスできるようにします。これらのティーボールは、動物の使用プロトコルに従って消毒し、調製し、手術直後に導入して、対照刺激とともに動物を構造に馴化させることができます。その後、マウスは追加の濃縮で生きることができ、急性刺激提示の顕著性を低下させます。
ティーボールの存在への慣れは、この方法にとって重要な慣れの1つの側面にすぎません。記載された慣れプロトコルはまた、試験環境を正常化するための試験手順への反復暴露(すなわち、人員、試験場所への輸送および移動、刺激への曝露)からなる。この拡張された慣れは、動物からの微妙な反応を最小限に抑え、所望の従属変数(例えば、薬理学的または文脈的刺激)に測定を集中させる。このプロトコルの以前の評価では、ラット8のホームケージ内の温度テストの前に必要な最小限の慣れとして4つの試験が特定されました。テストが長期間(2〜3週間以上)離れている場合、動物は再び慣れなければなりません。繰り返し慣れさせるには、最低1〜2回の試行で十分です。ただし、温度テストがより長い時間で分離されている場合は、より多くの試行を繰り返す必要がある場合があります。
マウスとラットを試験手順に慣れさせるための継続的な努力において、刺激提示前の順応期間をすべての実験試験に含めるべきである。この順応時間は、テスト場所に移された後、温度と活動のバランスを取り戻すために重要です。げっ歯類は転座により急激な温度上昇が見られる傾向があります。順応は、薬理学的物質または文脈刺激を添加する前に、試験当日に実験者からの相互作用なしに最低1時間からなるべきである。これはテストの毎日必要です。
概説されたホームケージの温度テストでは、マウスはテストされた刺激に応答して歩き回るホームケージの放し飼いを持っています。これは、活性の変動を引き起こし、温度測定値の精度に影響を与え、したがって、独立変数の熱発生効果の分析(例えば、薬理学的または文脈的刺激)に影響を及ぼす可能性がある。活動レベルによる温度の潜在的な変化を認識して、トレッドミルウォーキング中の温度の使用を説明するプロトコルが以下に含まれています。公表された文献は、ラットにおけるこの手順の成功した使用を記載しており、現在、マウス8、10、14、15で採用されている。トレッドミルウォーキングは、被験者の活動速度を一定に維持します。この研究では、トレッドミルは活動レベルを制御するために厳密に使用されているため、マウスの歩行を促進するためにトレッドミルで利用可能な最低速度に設定され、ラットの同様に低い設定に設定されます。
以下の手順は、マウスにおける片側性腓腹筋の温度測定および捕食者の臭いの提示について概説されている。このデザインは薬理学的物質と組み合わせて使用 することができ、マウスのラットおよび他の骨格筋群(すなわち、大腿四頭筋)に転写可能である。ラットの場合、トランスポンダは両側性腓腹筋および褐色脂肪組織に配置することができます。サイズと距離の制限により、マウスごとに使用できるトランスポンダは1つだけです。薬理学的物質に対する熱発生応答を評価するために、軽微な修正(例えば、文脈刺激の除去)を行うことができる。
プロトコル
これらの方法は、ラットモデルとマウスモデルの両方に適用でき、機関の承認を得て実施されました(ケント州立大学、IACUC承認#359および#340 CN 12-04)。プロトコルの実施前に、動物は 実験動物の世話と使用のためのガイドに準拠して飼育されるべきです。
1. トランスポンダリーダーの準備
注意: 使用する前に、トランスポンダリーダーを設定する必要があります。次の手順には、このスタディに必要な設定変更のみが含まれています。プロトコルのこの部分は、DAS-8027-IUSポータブルリーダーに直接関連付けられています。他のリーダーモデルは、プログラミング結果を得るためにマニュアルに記載されている指示に従う必要があります。
- ビープ音をオフに設定します。
- SCANボタンを押してデバイスの電源を入れ、OLEDディスプレイに照明が表示されるのを待ちます。戻る/メニューボタンを押し続けると、メニュー画面が表示されます。
- [次へ/入力]ボタンを使用して、[運用設定]までオプションをスクロールします。ここで、上矢印または下矢印を切り替えてYESをオンにし、操作サブメニューを開きます。
- [次へ/入力]ボタンを使用して、[ビープ音]までスクロールします。デフォルト設定が [オン] なので、上矢印または下矢印を切り替えて、設定を OFF に変更します。
- NEXT / ENTERボタンを押して、この設定の変更を保存します。
- [読み取り時のバイブレーション]を[オン]に設定します。
- ステップ 1.1 からステップ 1.2 に従うか、ステップ 1.4 の直後に次のステップを完了します。
- [次へ/入力]ボタンを使用して、[読み取り時にバイブレーション]までスクロールします。デフォルト設定はOFFなので、上下の矢印を切り替えて設定をONに変更すると、画面が見えなくても読み取りが完了したときにバイブレーションで感じることができます。
2. プログラムトランスポンダ
注意: 埋め込まれた各トランスポンダーは、最初に動物の識別(動物IDまたはトランスポンダーID)でプログラムする必要があります。この命名法は、被験者の二次識別として使用することができる(例えば、マウス系統の略語、トランスポンダの位置、および動物番号を示すための追加の3〜4桁の数字)。プログラミングは、手術前にトランスポンダを無菌状態に保ちながら、手術の数日前に完了することができます。
- トランスポンダにIDコードを入力します。
- ブースターコイルをリーダーヘッド(モデルDAS 8027-IUS用の特定のアクセサリ)に適用し、プログラミング手順に役立ちます。
- 手袋をはめた手を使用して、トランスポンダー(アプリケーター内)をブースターコイルに配置します。
- SCANボタンを押してデバイスの電源を入れ、OLEDディスプレイが点灯するのを待ちます。戻る/メニューボタンを押し続けると、メニュー画面が表示されます。
- [次へ/入力]ボタンを使用して、トランスポンダIDの書き込みまでオプションをスクロールします。ここで、上矢印または下矢印を切り替えてYESをオンにします。
- [次へ/入力]ボタンを使用して、[IDコードを入力]に切り替えます。
- 上下の矢印キーを使用して、数字と文字をスクロールします。各文字選択後に NEXT/ENTER を押して、次の文字に移動します。
- IDコードが完成したら、 SCAN を押してトランスポンダを書き込みます。
- トランスポンダをブースターコイルから取り外し、必要に応じて繰り返します。手袋をはめた手の間で密閉されたトランスポンダを温め、温度スキャナーを使用して測定することにより、トランスポンダが温度変化を読み取ることを確認します。
メモ: 自動マルチ書き込みおよびシーケンシャルカウント設定をオンに設定すると、セッション中に複数またはシーケンシャルなトランスポンダプログラミングが可能になります。各トランスポンダは、プログラミング中にテストする必要があります。
3.「ホームケージボール」を用意する
- 5 cm x 5 cmの無臭/コントロールタオルをティーボールに入れます。
- 手術後にこれらのホームケージボールを新しいホームケージに入れて、テスト中にコンテキスト刺激が提示される方法に動物を慣れさせ始めます。これらのホームケージボールは2週間ごとに交換してください。
4.手術と術後ケア
- 被験者の手術前の体重を量り、記録します。誘導チャンバーを使用して、動物に麻酔(例えば、2〜5%イソフルラン)を提供する。
- 電気バリカンを使用して、後肢を完全に剃ります。鎮痛を投与する(例:.、5 mg / kgのケトプロフェン、SC)施設のガイドラインに準拠しています。.
注:この手順を他の外科的方法と組み合わせると、追加の鎮痛が必要になる場合があります。 - 70%アルコール(または市販の滅菌アルコールワイプ)とポビドンヨードウォッシュ(または市販の滅菌、個別に包装されたベタジン綿棒)で少なくとも3回交互に、ポビドンヨードで終わる領域をきれいにします。
- 動物を誘導室に戻し、動物を外科的レベルまで麻酔します。次に、マウスをフェイスマスクに入れて、麻酔にさらし続けます。ネオマイシン眼科用軟膏を動物の目に塗り、麻酔下での乾燥を防ぎます。
注:マウスが痛みの受容の証拠を示さなくなるまで、手順を開始しないでください(すなわち、角膜反射、尾のピンチ反応、つま先のピンチ反射)。 - 外科用ハサミのみを使用して、右後肢の皮膚を浅く切り込みます。
- 腓腹筋と平行に移動し、事前にプログラムされキャップされていない滅菌トランスポンダーの鋭いエッジを切開部に配置します。緑色のプランジャーが上を向いていて見えることを確認します。トランスポンダーアプリケーターの開口部が見えなくなるまで、トランスポンダーアプリケーターを切開部に押し込み続けます。
注意: 手順4.6で、誤ってトランスポンダアプリケーターの緑色のプランジャーを押しないでください。トランスポンダの時期尚早の放電は、不適切な配置につながります。 - アプリケーターを180°回すと、緑色のプランジャーがマウスの手足に向かって下を向いており、実験者からは見えなくなります。トランスポンダアプリケータを最終的な位置に押し込みます。腓腹筋に隣接または部分的に囲まれた理想的な配置になったら、緑色のプランジャーを押して、アプリケーターの圧力で研究者の手をマウスから遠ざけます。
- 鉗子を使用して、開いた皮膚をまとめ、滅菌オートクリップまたは滅菌縫合糸で創傷クリップを配置します。必要に応じて、滅菌オートクリップの前に吸収性縫合糸を使用して筋膜層を閉じます。トランスポンダリーダーを使用して、マウスの筋肉の温度を確認します。
- マウスを麻酔から外し、回復のために 低く 設定された水循環加熱パッドの上に置かれた清潔なホームケージに入れます。ホームケージに無臭のタオルが付いたティーボールが含まれていることを確認して、慣れ始めます。
注:マウスは15分以内に手術から目覚めるはずです。回復日中に簡単にアクセスできるように、ケージの底に食べ物を置くことができます。 - 術後ケア
- 手術後少なくとも2日間、またはマウスが体重を回復または安定するまで、トランスポンダーリーダーを使用してマウスの体重と温度を毎日記録します。
- 非麻薬性鎮痛(例:.、5 mg / kgのケトプロフェン、s.c.)を手術後少なくとも2日間マウスに1日1回投与し、必要に応じて追加の用量を提供します。.
注:マウスとラットは手術後5〜8日以内に完全に回復し、慣れとテストの手順を受けることができます。
5.テストの準備-ホームケージ
- ライザーの構築
注意: 以下の手順は、194 mm x 181 mm x 398 mmのマウスフィルタートップケージに基づいています。より大きなケージ(ラットのホームケージなど)に合うように、幅を調整する必要があります。- ラチェット式PVCカッターでPVCパイプを8つのセクションに切断し、 図1Cに従って組み立てます。これにより、約4つのケージを保持できるオープンテーブルトップ構造が得られます。必要な数のライザーを作成します。
- 部屋のセットアップ
- テストルーム内の各ライザーに場所を割り当てます。交絡変数を避けるために、異なる文脈刺激(すなわち、臭い)を受け取るように設定されたライザーを最低2m分離します。
注:各マウスには、異なる場所と熱発生刺激との間に関連性が生じないように、可能な限り、試験室内および物理的なライザーにテスト場所を割り当てる必要があります。 - 磁気ストリップを使用して、ライザー全体に外科用シートまたはガウンを取り付け、研究者と被験者の間に視覚的な障壁を作成します。このバリアを設定して、実験者がケージに向かって移動したり、試験室の周りを移動したりするのを見るときのマウスの活動に起因する温度変化を最小限に抑えます。
- (オプション)ライザーの下の面にミラーを配置して、テスト中にケージの底部を見やすくします。
注意: ライザーは、ケージ洗浄システムを介して消毒できます。布または外科用シートは、慣れとテストの前に洗濯する必要があります。
- テストルーム内の各ライザーに場所を割り当てます。交絡変数を避けるために、異なる文脈刺激(すなわち、臭い)を受け取るように設定されたライザーを最低2m分離します。
- ティーボールの準備
- コントロールタオルとPOタオル(約5 cm x 5 cm)でティーボールを準備します。相互汚染を避けるために、最初にコントロール臭のティーボールを準備します。
注意: 捕食者臭タオルは、使用前に病原体テストを行う必要があります。これらのタオルも封じ込め、それらと相互作用する材料は直ちに消毒(すなわち、ケージ洗浄)して、他の動物への臭いの暴露を防ぐ必要があります。
- コントロールタオルとPOタオル(約5 cm x 5 cm)でティーボールを準備します。相互汚染を避けるために、最初にコントロール臭のティーボールを準備します。
6.温度テスト-ホームケージ
注:動物は、実験的な状況刺激または薬理学的刺激を除いて、試験手順全体に慣れる必要があります。これは、テストの前に最低4回完了する必要があります。
- 準備した試験室に動物を移します。ライザーの事前に割り当てられた場所に動物を置きます。この場所は、すべての慣れとテストの手順で同じである必要があります。
- マウスのホームケージから「ホームケージボール」を取り外し、ケージを布またはサージカルシートで覆い直します。マウスを1〜2時間テストスペースに順応させます。
- 順応が完了したら、スキャナーを使用して各被験者のベースライン温度を測定および記録します。測定中は布の覆いを操作しないでください。
注:薬理学的物質はここで適用することができます。インジェクションまたはアプリケーションの後の待機時間は、テスト前に必要に応じて追加できます。薬理学的刺激に対する反応を監視するために、薬理学的物質の追加後に試験直前に二次ベースラインを記録することが推奨される。匂い応答がテストされていない場合、マウスの温度測定は注射直後に開始できます。刺激を提供するときは、ランダム化を採用する必要があります。 - ケージのカバーを外し、ティーボール(コントロールまたはPO)をホームケージの床に置きます。ケージの蓋と布カバーを元に戻します。
- ストップウォッチを開始します。ティーボールの配置と同じ順序で被験者の温度を測定します。目的の時点に続く測定の温度とクロック時間を記録します。
- 実験が完了したら、治療ボールを取り外します。POを受け取ったマウスを、元の「ホームケージボール」と一緒に新しいホームケージに入れます。「ホームケージボール」をコントロール臭を受けたマウスのケージに戻す。マウスを収容場所に移します。
注:上記の手順は、適切なサイズのケージ内のラットモデルに変換できます。 図1C で示されている測定値の調整は、ホームケージの底部へのアクセスを改善するために必要になる場合があります。

図1:トランスポンダとホームケージの温度テスト 。 (A)マウス腓腹筋の温度をテストするための片側トランスポンダ配置の図。プログラムして配置すると、トランスポンダリーダー(DAS-8027-IUS、図示)を使用して温度を測定できます。(B)左、オープンメッシュのステンレス製ティーボールと5cm×5cmのタオルの写真。右、同封のティーボールは、ホームケージテストで慣れタオルと臭いタオルを保持するために使用されます。(C)ホームケージテスト用のPVC配管で構築されたライザーの概略図。(D)ホームケージテストプロトコルのワークフロー。(E)ホームケージテストエリアの施設画像。左、ライザーの上に4つのマウスケージ。磁気ストリップは隣接する壁にあり、磁石と手術用布はテーブルの上にあります。右、ライザーの覆われたマウスケージ。(A)、(C)、および(D)は Biorender.com で作成されました。この図の拡大版を表示するには、ここをクリックしてください。
7.温度テスト-トレッドミルウォーキング
- 各動物に、慣れとテスト手順の割り当て場所としてトレッドミルを割り当てます。
- テストのためにトレッドミルを準備し、ショッカーが機能していることを確認します。
注意: トレッドミルウォーキングの場合、トレッドミルは、継続的な動きを促進するが、慣れとテストの両方のために走らないように、利用可能な最低のペースに設定する必要があります。1012M-2モジュラー密閉型メタボリックトレッドミルの場合、これはマウスで5.2 m / min、ラットで7 m / minです。このペースは、被験者の肥満に基づいて調整する必要があるかもしれません。ショッカーは、強度と繰り返し率を5.0に設定する必要があります。 - 慣れ
- マウスをテストルームに移動します。マウスが1〜2時間、ホームケージ内の部屋の移動に順応するのを待ちます。
- 順応後、マウスを割り当てられたトレッドミルの開口部に導き、トレッドミルを閉じます。ベルト、ショッカー、ストップウォッチを起動します。
- マウスがトレッドミルの上を15分間歩くのを許し、衝撃刺激を動きの動機として使用します。動物が長期間アクティブなショッカーにとどまっている場合は、すぐにテストを中止してください。
- テスト後、マウスを取り外してホームケージに戻します。
- 液体洗剤と水を使用してトレッドミルを清掃します。
- テスティング
- マウスをテストルームに移動します。マウスがホームケージ内の部屋の移動に1〜2時間順応するのを待ちます。
- マウスをトレッドミルに移動する前に、ベースライン温度を測定して記録します。
注意: 薬理学的物質を含むテストの場合は、 図2Aに示す回路図に従って、ここにそれらを適用または注入します。注射後の待ち時間は、マウスをトレッドミルに置く前に必要に応じて追加することができる。刺激を提供するときは、ランダム化を採用する必要があります。 - 5 cm x 5 cmの正方形のコントロールタオルまたはPOタオルを、トレッドミルの前面に最も近いトレッドミル内に置きます。タオルをトレッドミルの天井または下に接着して、簡単に配置および取り外しできるようにします。
- マウスを割り当てられたトレッドミルに誘導します。トレッドミルベルトとショッカーをオンにします。
- ストップウォッチを開始します。マウスをトレッドミルに設置したのと同じ順序で被験者の測定を行います。目的の時点に続く測定の温度とクロック時間を記録します。
注意: 歩行活動中にマウスが密閉されたトレッドミルの中にいる間、温度はトレッドミルの外側から確実に測定できます。ラットの場合、トレッドミルのサイズとトランスポンダーとリーダーの距離の制限により、実験者はトレッドミルの背面を開いたままにして、リーダーをトレッドミル内の被験者の近くに挿入します。 - テストが完了したら、ショッカーとトレッドミルをオフにします。マウスを自宅のケージに戻します。マウスを収容場所に移します。
- 液体洗剤と水を使用してトレッドミルを清掃し、残留POを取り除くように特に注意してください。
- 実験が完了したら、動物を安楽死させ(例えば、CO2 吸入を用いて)、トランスポンダ位置を視覚的に確認する。
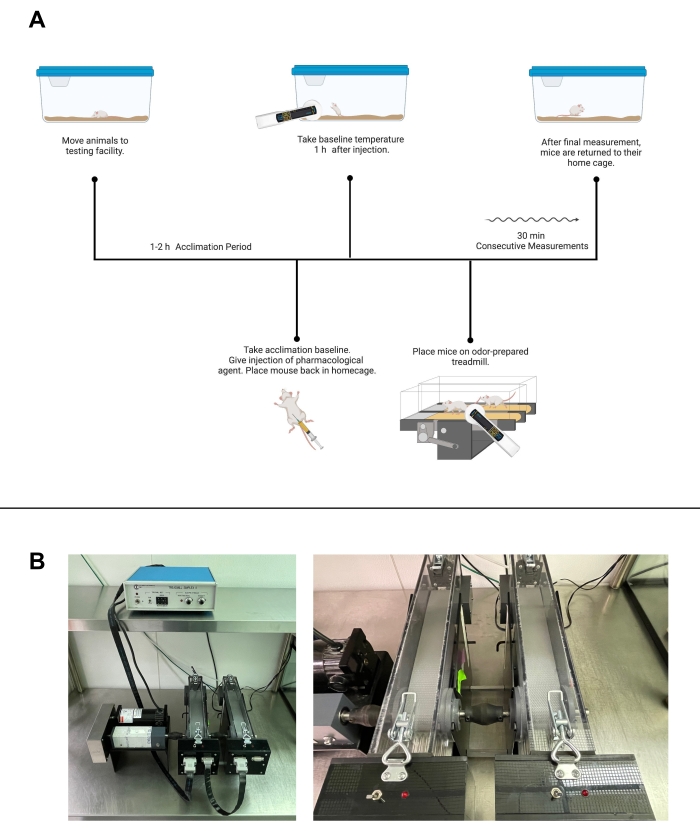
図2:活動制御温度試験 。 (A)トレッドミルウォーキングを使用した薬理学的物質による活動制御温度試験のワークフロー。(B)トレッドミルの施設画像。左は、完全な機器セットアップの画像です。右、個々のトレッドミルとショッカーのより近い画像。(A)は Biorender.com で作成されました。この図の拡大版を表示するには、ここをクリックしてください。
結果
トランスポンダは、SF1-Cre系統(Tg(Nr5a1-cre)7Lowl/J、系統#012462、C57BL/6JおよびFVBバックグラウンド;雌N = 5、雄N = 5)から育てられた10匹の4-6ヶ月齢の野生型(WT)マウスの右腓腹筋に片側的に移植された。回復後、マウスは、文脈刺激(例えば、PO)を含まない家庭用ケージ温度試験手順に慣れさせた。トランスポンダーワンドを使用した温度測定値は、住宅室内および試験場所への移動後に記録されまし?...
ディスカッション
この温度試験プロトコルは、骨格筋の熱発生を直接測定する手段を現場に提供します。これは、研究が筋肉の熱発生の根底にあるメカニズムを特定することを掘り下げるときに重要です33。この方法は、文脈的および薬理学的条件下で骨格筋の熱発生を測定するための2つの費用効果の高いプロトコルを提供します。このプロトコルは、これらの手順における慣れと順応の両?...
開示事項
著者は、利益相反がないことを宣言します。
謝辞
この作業は、R15 DK097644 および R15 DK108668 によってサポートされています。以前の貢献をしてくれたチャイタニヤ・K・ガビニ博士とミーガン・リッチ博士、施設の動物使用ガイドラインを確実に遵守してくれたスタンリー・ダンネミラー博士に感謝します。この方法とそれに関連する研究を構築するために必要な基礎研究を提供してくれたティム・バートネス博士に特に感謝します。図1A、C、D、および図2Aは、Biorender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 1012M-2 Modular Enclosed Metabolic Treadmill for Mice, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1012R-2 Modular Enclosed Metabolic Treadmill for Rats, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1-1/4 in. Ratcheting PVC Cutter | BrassCraft | ||
| 1 mL Syringes | Fisher Scientific | BD 309659 | |
| Betadine Swabs | Fisher Scientific | 19-898-945 | |
| Booster Coil | BioMedic Data Systems | Transponder Accessory | |
| Electric Clippers | Andis | 40 Ultraedge Clipper Blade | |
| Flexible Mirror Sheets | Amazon | Self Adhesive Non Glass Mirror Tiles | |
| Forceps | Fisher Scientific | 89259-940 | |
| Heating Pad | |||
| Induction Chamber (isoflurane) | Kent Scientific | VetFlo-0730 | 3.0 L Low Cost Chambers for Traditional Vaporizers |
| Ketoprophen | Med-Vet Intl. | RXKETO-50 | |
| Magnetic Strips | Amazon | ||
| Magnets | Amazon | DIYMAG Magnetic Hooks 40lbs | |
| Needles | Med-Vet Intl. | 26400 | |
| Neomycin/Polymixin/Bacitracin with Hydrocortisone Ophthalmic Ointment, 3.5 g | Med-Vet Intl. | RXNPB-HC | |
| Oasis Absorbable Suture | Med-Vet Intl. | MV-H821-V | |
| Predator (Ferret) Odor Towels | Marshall BioResources | ||
| PVC pipe | |||
| Reflex Wound Clip Remover | CellPoint Scientific | ||
| Reflex Wound Clip, 7 mm (mouse) | CellPoint Scientific | ||
| Reflex Wound Clip, 9 mm (rat) | CellPoint Scientific | ||
| Srerile Autoclip, 7 mm (mouse) | CellPoint Scientific | Wound Clip Applier (mouse) | |
| Stainless Strainers Interval Seasonings Tea Infuser | Amazon | ||
| Sterile Autoclip, 9 mm (rat) | CellPoint Scientific | Wound Clip Applier (rat) | |
| Sterile Saline | Med-Vet Intl. | RX0.9NACL-10 | |
| Surgical Scissors | Fisher Scientific | 08-951-5 | |
| Surgical Sheets | |||
| Towels (Control/Habituation) | Amazon | 100% Cotton Towels, white | |
| Transponders | BioMedic Data Systems | Model: IPTT-300 | |
| Transponders Reader | BioMedic Data Systems | Model: DAS-8027-IUS/ DAS-7007R | |
| Versaclean | Fisher Scientific | 18-200-700 | liquid detergent |
| Webcol Alcohol Preps | Covidien | 22-246-073 | |
| Wedge pieces for PVC pipe |
参考文献
- Periasamy, M., Herrera, J. L., Reis, F. C. G. Skeletal muscle thermogenesis and its role in whole body energy metabolism. Diabetes Metabolism Journal. 41 (5), 327-336 (2017).
- Rowland, L. A., Bal, N. C., Periasamy, M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy. Biological Reviews of the Cambridge Philosophical Society. 90 (4), 1279-1297 (2015).
- Maurya, S. K., et al. Sarcolipin is a key determinant of the basal metabolic rate, and its overexpression enhances energy expenditure and resistance against diet-induced obesity. Journal of Biological Chemistry. 290 (17), 10840-10849 (2015).
- Grigg, G., et al. Whole-body endothermy: Ancient, homologous and widespread among the ancestors of mammals, birds and crocodylians. Biological Reviews of the Cambridge Philosophical Society. 97 (2), 766-801 (2022).
- Franck, J. P. C., Slight-Simcoe, E., Wegner, N. C. Endothermy in the smalleye opah (Lampris incognitus): A potential role for the uncoupling protein sarcolipin. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. 233, 48-52 (2019).
- Nowack, J., et al. Muscle nonshivering thermogenesis in a feral mammal. Scientific Reports. 9, 6378 (2019).
- Oliver, S. R., Anderson, K. J., Hunstiger, M. M., Andrews, M. T. Turning down the heat: Down-regulation of sarcolipin in a hibernating mammal. Neuroscience Letters. 696, 13-19 (2019).
- Gorrell, E., et al. Skeletal muscle thermogenesis induction by exposure to predator odor. The Journal of Experimental Biology. 223, (2020).
- Gavini, C. K., et al. Leanness and heightened nonresting energy expenditure: Role of skeletal muscle activity thermogenesis. The American Journal of Physiology - Endocrinology and Metabolism. 306 (6), 635-647 (2014).
- Almundarij, T. I., Gavini, C. K., Novak, C. M. Suppressed sympathetic outflow to skeletal muscle, muscle thermogenesis, and activity energy expenditure with calorie restriction. Physiological Reports. 5 (4), 13171 (2017).
- Harshaw, C., Lanzkowsky, J., Tran, A. D., Bradley, A. R., Jaime, M. Oxytocin and 'social hyperthermia': Interaction with beta3-adrenergic receptor-mediated thermogenesis and significance for the expression of social behavior in male and female mice. Hormones and Behavior. 131, 104981 (2021).
- Caldwell, H. K. Oxytocin and vasopressin: Powerful regulators of social behavior. The Neuroscientist. 23 (5), 517-528 (2017).
- Harshaw, C., Leffel, J. K., Alberts, J. R. Oxytocin and the warm outer glow: Thermoregulatory deficits cause huddling abnormalities in oxytocin-deficient mouse pups. Hormones and Behavior. 98, 145-158 (2018).
- Gavini, C. K., Britton, S. L., Koch, L. G., Novak, C. M. Inherently lean rats have enhanced activity and skeletal muscle response to central melanocortin receptors. Obesity. 26 (5), 885-894 (2018).
- Gavini, C. K., Jones, W. C., Novak, C. M. Ventromedial hypothalamic melanocortin receptor activation: regulation of activity energy expenditure and skeletal muscle thermogenesis. The Journal of Physiology. 594 (18), 5285-5301 (2016).
- Zaretsky, D. V., Romanovsky, A. A., Zaretskaia, M. V., Molkov, Y. I. Tissue oxidative metabolism can increase the difference between local temperature and arterial blood temperature by up to 1.3(o)C: Implications for brain, brown adipose tissue, and muscle physiology. Temperature. 5 (1), 22-35 (2018).
- Yoo, Y., et al. Exercise activates compensatory thermoregulatory reaction in rats: A modeling study. Journal of Applied Physiology. 119 (12), 1400-1410 (2015).
- Langer, F., Fietz, J. Ways to measure body temperature in the field. Journal of Thermal Biology. 42, 46-51 (2014).
- Pence, S., et al. Central apolipoprotein A-IV stimulates thermogenesis in brown adipose tissue. International Journal of Molecular Sciences. 22 (3), 1221 (2021).
- Li, D., et al. Homeostatic disturbance of thermoregulatory functions in rats with chronic fatigue. Journal of Neuroscience Research. 165, 45-50 (2021).
- Carlier, J., et al. Pharmacodynamic effects, pharmacokinetics, and metabolism of the synthetic cannabinoid AM-2201 in male rats. Journal of Pharmacology and Experimental Therapeutics. 367 (3), 543-550 (2018).
- Pato, A. M., Romero, D. M., Sosa Holt, C. S., Nemirovsky, S. I., Wolansky, M. J. Use of subcutaneous transponders to monitor body temperature in laboratory rats. Journal of Pharmacological and Toxicological Methods. 114, 107145 (2022).
- Almeida, D. L., et al. Lean in one way, in obesity another: Effects of moderate exercise in brown adipose tissue of early overfed male Wistar rats. International Journal of Obesity. 46 (1), 137-143 (2022).
- Brito, M. N., Brito, N. A., Baro, D. J., Song, C. K., Bartness, T. J. Differential activation of the sympathetic innervation of adipose tissues by melanocortin receptor stimulation. Endocrinology. 148 (11), 5339-5347 (2007).
- Vaughan, C. H., Shrestha, Y. B., Bartness, T. J. Characterization of a novel melanocortin receptor-containing node in the SNS outflow circuitry to brown adipose tissue involved in thermogenesis. Brain Research. 1411, 17-27 (2011).
- Kort, W. J., Hekking-Weijma, J. M., TenKate, M. T., Sorm, V., VanStrik, R. A microchip implant system as a method to determine body temperature of terminally ill rats and mice. Laboratory Animals. 32 (3), 260-269 (1998).
- Mei, J., et al. Body temperature measurement in mice during acute illness: Implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8, 3526 (2018).
- Warn, P. A., et al. Infrared body temperature measurement of mice as an early predictor of death in experimental fungal infections. Laboratory Animals. 37 (2), 126-131 (2003).
- Hargreaves, K., Dubner, R., Brown, F., Flores, C., Joris, J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 32 (1), 77-88 (1988).
- Fiebig, K., Jourdan, T., Kock, M. H., Merle, R., Thone-Reineke, C. Evaluation of infrared thermography for temperature measurement in adult male NMRI nude mice. Journal of the American Association for Laboratory Animal Science. 57 (6), 715-724 (2018).
- Franco, N. H., Geros, A., Oliveira, L., Olsson, I. A. S., Aguiar, P. ThermoLabAnimal - A high-throughput analysis software for non-invasive thermal assessment of laboratory mice. Physiology & Behavior. 207, 113-121 (2019).
- Koganti, S. R., et al. Disruption of KATP channel expression in skeletal muscle by targeted oligonucleotide delivery promotes activity-linked thermogenesis. Molecular Therapy. 23 (4), 707-716 (2015).
- Bal, N. C., Periasamy, M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis. Philosophical Transactions of the Royal Society B. 375 (1793), 20190135 (2020).
- Hicks, C., et al. Body temperature and cardiac changes induced by peripherally administered oxytocin, vasopressin and the non-peptide oxytocin receptor agonist WAY 267,464: a biotelemetry study in rats. British Journal of Pharmacology. 171 (11), 2868-2887 (2014).
- Kasahara, Y., et al. Oxytocin receptor in the hypothalamus is sufficient to rescue normal thermoregulatory function in male oxytocin receptor knockout mice. Endocrinology. 154 (11), 4305-4315 (2013).
- Kasahara, Y., et al. Role of the oxytocin receptor expressed in the rostral medullary raphe in thermoregulation during cold conditions. Frontiers in Endocrinology. 6, 180 (2015).
- Yuan, J., Zhang, R., Wu, R., Gu, Y., Lu, Y. The effects of oxytocin to rectify metabolic dysfunction in obese mice are associated with increased thermogenesis. Molecular and Cellular Endocrinology. 514, 110903 (2020).
- Scholl, J. L., Afzal, A., Fox, L. C., Watt, M. J., Forster, G. L. Sex differences in anxiety-like behaviors in rats. Physiology & Behavior. 211, 112670 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved