このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
P3HR1細胞株からのエプスタインバーウイルスの単離と定量
要約
このプロトコルは、ホルボール12-ミリステート13-アセテートでウイルス溶解サイクルを誘導する際に、ヒトP3HR1細胞株からエプスタインバーウイルス粒子を単離することを可能にします。続いて、ウイルス調製物からDNAを抽出し、リアルタイムPCRに供してウイルス粒子濃度を定量化する。
要約
正式に はヒトヘルペスウイルス4 (HHV-4)と指定されたエプスタインバーウイルス(EBV)は、最初に単離されたヒト腫瘍ウイルスです。世界の成人人口のほぼ90〜95%がEBVに感染しています。分子生物学と免疫学の最近の進歩に伴い、in vitro および in vivo の両方の実験モデルの適用により、多くの疾患におけるEBVの病因およびEBV関連の腫瘍形成に関する深く有意義な洞察が得られました。この視覚化された実験論文の目的は、P3HR1細胞株の細胞からのEBVウイルス粒子の単離の概要を提供し、続いてウイルス調製物を定量することです。もともとヒトバーキットリンパ腫から単離されたP3HR1細胞は、2型EBV株であるP3HR1ウイルスを産生することができる。EBV溶解サイクルは、ホルボール12-ミリステート13-アセテート(PMA)で処理することにより、これらのP3HR1細胞において誘導され、EBVウイルス粒子を生じる。
EBV粒子の単離にこのプロトコルを使用して、P3HR1細胞を35 ng/mL PMAを含む完全なRPMI-1640培地で37°Cおよび5%CO2 で5日間培養します。続いて、培養液を120 x g の速度で8分間遠心分離し、細胞をペレット化します。次に、ウイルスを含む上清を収集し、16,000 x g の速度で90分間スピンダウンして、EBV粒子をペレット化します。次いで、ウイルスペレットを完全なRPMI-1640培地に再懸濁する。これに続いて、DNA抽出と定量的リアルタイムPCRを行い、調製物中のEBV粒子の濃度を評価します。
概要
エプスタインバーウイルス(EBV)は、単離された最初のヒト腫瘍ウイルスです1。正式には ヒトヘルペスウイルス4 (HHV-4)2と呼ばれるEBVは、ヘルペスウイルスファミリーのガンマヘルペスウイルスサブファミリーの一部であり、 リンフォクリプトウイルス 属のプロトタイプです。世界の成人人口のほぼ90〜95%がウイルスに感染しています3。ほとんどの場合、最初の感染は生後3年以内に発生し、無症候性ですが、青年期に感染が後期に発生すると、感染性単核球症と呼ばれる病気を引き起こす可能性があります4。EBVは、休止中のB細胞に感染して増殖性Bリンパ芽球になり、ウイルスが潜伏感染状態を確立し維持することができます5。EBVはいつでも再活性化する可能性があるため、再発性感染症につながる可能性があります6。
過去50年間で、一部のウイルスとヒト悪性腫瘍の発症との関連がますます明らかになり、今日では、すべてのヒト癌の15%から20%がウイルス感染に関連していると推定されています7。EBVを含むヘルペスウイルスは、これらのタイプの腫瘍ウイルスの最も研究された例のいくつかです8。実際、EBVは、バーキットリンパ腫(BL)、ホジキンリンパ腫(HL)、びまん性大細胞型B細胞リンパ腫、および免疫不全宿主におけるリンパ増殖性疾患など、多くの種類のヒト悪性腫瘍を引き起こす可能性があります9,10。EBVはまた、全身性自己免疫疾患の発症と関連していることが示されている。これらの自己免疫疾患の例としては、関節リウマチ(RA)、多発性筋炎皮膚筋炎(PM-DM)、全身性エリテマトーデス(SLE)、混合結合組織疾患(MCTD)、シェーグレン症候群(SS)などがあります11。EBVは炎症性腸疾患(IBD)12の発症にも関連しています。
これらの疾患の多くは、細胞培養、マウス、またはEBVに感染した他の生物を使用して研究またはモデル化することができます。そのため、in vitroまたはin vivoモデル13,14,15,16にかかわらず、細胞または生物に感染するためにEBV粒子が必要であり、したがって、低コストでウイルス粒子を単離できる技術を開発する必要があります。ここで説明するプロトコルは、比較的アクセスしやすい細胞株からEBV粒子を確実に分離し、費用対効果が高く、ほとんどのラボですぐに利用できるリアルタイムPCRを使用して粒子を定量する簡単な方法のガイドラインを提供します。これは、異なる細胞株からEBVを単離するために記載されているいくつかの他の方法と比較したものである17、18、19、20。
P3HR-1は、浮遊状態で増殖し、EBV2型株に潜伏感染するBL細胞株です。この細胞株はEBV産生剤であり、ウイルス粒子を産生するように誘導することができる。この原稿の目的は、P3HR-1細胞株からEBV粒子を単離し、その後、 in vitro および in vivo の両方のEBV実験モデルに使用できるウイルスストックを定量する方法を紹介することです。
プロトコル
注:EBVは潜在的にバイオハザード物質と見なされる必要があるため、バイオセーフティレベル2以上の封じ込めの下で取り扱う必要があります。白衣と手袋を着用する必要があります。水しぶきにさらされる可能性がある場合は、目の保護も考慮する必要があります。以下の手順は、生物学的安全キャビネットで実施する必要があります。
1. P3HR1細胞のカウント
- 細胞の遠心分離と再懸濁
- 進行中のP3HR1細胞培養の100 mm培養プレート(またはT-25フラスコ)から80%コンフルエントで細胞懸濁液を15 mLコニカルチューブに移します。P3HR-1細胞の播種密度は1 x 106 細胞/mLです。完全なRPMI培養培地(79%RPMI培養培地、20%ウシ胎児血清、1%ペンストレプ系抗生物質)で37°Cおよび5%CO2で維持し、3〜4日ごとに継代します。
- 120 x gで8分間遠心分離する。遠心分離後、上清を捨て、細胞ペレットを1 mLの完全RPMI培養培地に再懸濁し、よく混合します(この溶液を懸濁液Aと呼びます)。
- 計数のための細胞懸濁液の準備
- 細胞懸濁液A2 μLと培養液8 μLを混合して、希釈した細胞懸濁液Bを調製します。懸濁液Bに0.4%トリパンブルー10 μLを加えて懸濁液Cを得る。 穏やかなピペッティングで調製物をよく混合します。
- 血球計算盤を使用した細胞のカウント
- 血球計算盤にガラスカバーガラスを置き、10 μLの懸濁液をロードします C.血球計算盤を光学顕微鏡下に置き、40倍の顕微鏡対物レンズを使用して、血球計算盤チャンバーの4つの象限のそれぞれで青色に染色されていない細胞の数を数えます(図1)。
- トリパンブルーは死んだ細胞を青く染めます。これらの細胞や、各血球計算盤の象限の上、下、右、または左の境界のいずれかに接触している細胞を数えないでください。
- 次の式を使用して、mLあたりの細胞濃度を計算します。
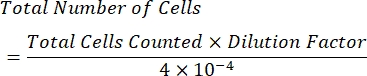
注:カウントされる象限の数は4つであり、10〜4 mLは血球計算盤の正方形の体積です。カウントする必要がある4つの象限は、 図1で緑色で表されています。数式で カウントされる セルの合計は、象限 1、2、3、および 4 のセル数の合計です。 図 1 で青で示されているセルはカウントする必要がありますが、赤色のセルは象限の上、右、下、または左の境界線に接触しているためカウントしないでください。
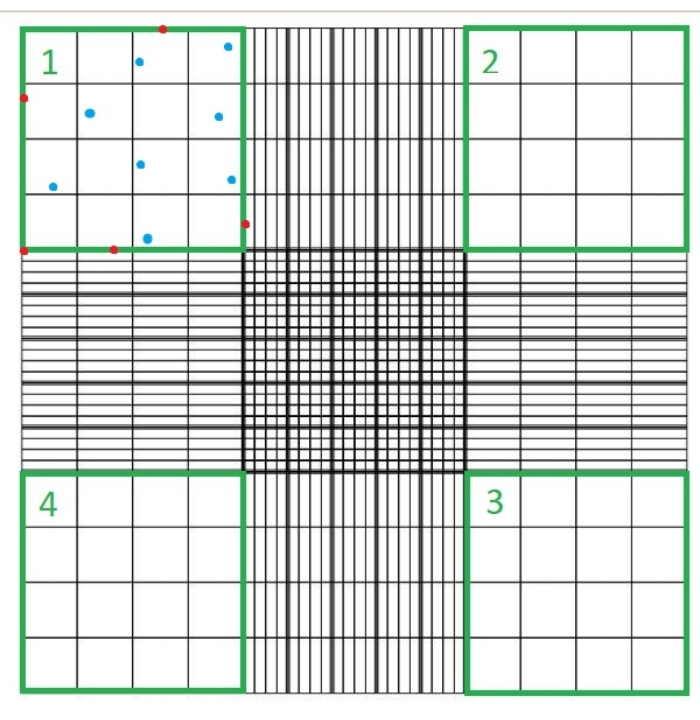
図1:血球計算盤チャンバーを用いた細胞計数。 光学顕微鏡を使用して4つの象限をカウントします。これらの象限は緑色で表されます。ここで説明するプロトコルのステップ1.3.3で示される式で カウントされる総細胞 数は、象限1、2、3、および4のセル数の合計です。青色で示されているセルはカウントする必要がありますが、赤色のセルは象限の上、右、下、または左の境界線に接触しているためカウントしないでください この図の拡大版を表示するには、ここをクリックしてください。
2.培養用プレートの準備
- 細胞懸濁液Aのボリュームを15 mLコニカルチューブに入れます。必要な量は、セル数によって異なります。100 mm培養プレートで細胞数が約2.2 x 106 細胞になるように容量を調整します。
- 5 mLの完全培養液をチューブに加え、チューブの内容物を100 mmの培養プレートに移します。80 μLのジメチルスルホキシド(DMSO)を培養プレートに加えます。
注意: DMSOは光に敏感であるため、耐光性の容器に保管するか、アルミホイルなどの不透明な材料で覆う必要があります。 - 350 μLの1 mg/mLホルボール12-ミリステート13-アセテート(PMA)をチューブに加えます。PMAの最終濃度は35 ng / mL、DMSOの最終濃度は0.08%である必要があります。
注意: PMAは有毒、腐食性、発がん性があるため、細心の注意を払って取り扱う必要があります。PMAは光に敏感であるため、耐光性の容器に保管するか、アルミホイルなどの不透明な材料で覆う必要があります。 - 全容量が10 mLになるように4.27 mLの培地を追加します。チューブの内容物を傾けて混合し、内容物を100 mmの培養プレートに移します。プレートを細胞培養インキュベーター内に37°C、5%CO2で5日間放置する。
3. エプスタイン・バーウイルス粒子の誘導と単離
- インキュベーター内で5日後、プレートの内容物を120 x g で8分間遠心分離し、細胞をペレット化します。無細胞でウイルスを含む上清を回収し、細胞ペレットを廃棄します。
- 上清を16,000 x g で4°Cで90分間遠心分離し、ウイルス粒子をペレット化します。上清を廃棄し、ウイルスペレットを5 mLの培養液に再懸濁します。
注:リン酸緩衝生理食塩水(PBS)を使用して、培地の代わりにウイルスペレットを再懸濁できます。 - 得られたウイルス懸濁液を、それぞれ250μLのウイルス懸濁液を含む20本のチューブに分注する。懸濁液を-80°Cで保存する。
4.ウイルス粒子からのDNA抽出
注意: フェノールは有毒で腐食性があり、重度の火傷を引き起こす可能性があるため、取り扱いには細心の注意を払う必要があります。フェノールは光に敏感で、光や空気に触れると酸化します。耐光性の容器に保管するか、フェノールチューブをアルミホイルなどの不透明な材料で覆います。
- DNAからのタンパク質の分離
- 500 μLのTrisCl飽和フェノールを250 μLチューブの1つに加えます。100μLの水を加え(水相の容量を増やすため)、よくボルテックスしてピンク色のエマルジョンを得ます。9650 x gで15分間遠心分離します。
- DNA沈殿
- 上清(透明な水相)を収集し、新しい1.5 mLマイクロ遠心チューブに移します。
- 上清の1/10に相当する冷酢酸ナトリウム(3 M、pH 5.2)を加え、上下にピペッティングして混合します。1 μLの20 mg/mLグリコーゲンを加え、ピペッティングで混合します。
注:この手順はオプションですが、グリコーゲンを添加すると、DNA沈殿が促進され、DNAペレットの視覚化が容易になります。 - 上清の3倍の量の冷たい100%エタノールを加えます。-80°Cで一晩保存してください。
注 : この手順はここで停止して、後で再開できます。サンプルは、-80°Cで1時間、または一晩保存できます。一晩保存するとDNA沈殿が促進されるため、推奨されます。
- ウイルスDNAの単離
- 翌日、9650 x g で4°Cで15分間遠心分離し、上清を捨ててDNAペレットを得た。
- ペレットを1 mLの冷たい70%エタノールで3回洗浄し、9650 x g で15分間遠心分離し、上清を廃棄します。
- ペレットを約10分間風乾します。ペレットを10〜50 μLのヌクレアーゼフリー蒸留水に再懸濁します(DNAペレットのサイズによって異なります)。
- サンプルを-20°Cで保存して後で処理するか、DNAを最大限に溶解させてから-20°Cで保存するために一晩保存します。 または、手順 5 に直接進みます。
5. DNA濃度と純度の確認
- 繊細なタスクワイパーでマイクロ分光光度計の台座を洗浄した後、1μLのDNA製剤をロードします。
- サンプル中のDNAの濃度に注意してください。と
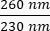 の両方の
の両方の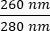 吸光度の比率を確認してください。DNAは260nm、タンパク質は280nm、フェノールなどの有機物は230nmで吸収します。リアルタイムPCRには1.8-2の比率で十分と考えられます。
吸光度の比率を確認してください。DNAは260nm、タンパク質は280nm、フェノールなどの有機物は230nmで吸収します。リアルタイムPCRには1.8-2の比率で十分と考えられます。
6. リアルタイムポリメラーゼ連鎖反応による定量
- PCR反応ミックスの調製
- 5 μL の SYBR グリーンリアルタイム PCR ミックスを 0.2 mL PCRチューブに入れます。各チューブに1 μLの7.5 pmol/μLフォワードプライマーと1 μLの7.5 pmol/μLリバースプライマーを加えます。フォワードプライマー配列:5'-CCCTAGTGGTTTCGGACACA-3';リバースプライマー配列:5'-ACTTGCAAATGCTCTAGGCG-3'.EBVゲノムコピー数を決定するために増幅された遺伝子は、 エプスタインバーウイルス低分子RNA2(EBER-2) 遺伝子である。
- チューブの1つに、ステップ4のヌクレアーゼフリー水2 μLとウイルスDNA1 μLを加えます。反応混合物の全容量は10μLである。
注:サンプル中のDNAの濃度によっては、希釈ステップが必要になる場合があります。希釈係数Fに注意する必要があり、ステップ6.3の式に積分されます。 - 既知のEBVゲノムコピー番号(1000、2000、5000、10,000、および54,000コピー)で標準として使用される他のチューブを準備します。
- PCR混合物を、95°Cで5分間活性化する最初のステップから始めて実行し、次に95°Cと58°Cでそれぞれ15秒と30秒間40サイクル(アニーリング)します。
- 標準チューブあたりのEBVゲノムコピー数の対数に対して標準のCt値をプロットすることにより、qPCR標準曲線を生成します。標準曲線プロット式を採用して、誘導されたウイルスDNAを含むPCRチューブ内のEBVゲノムコピー数を導出する。次に、次の式を使用して、誘導されたウイルス製剤の濃度を計算します。

ここで、Xは標準曲線に由来するEBVゲノムコピーの数であり、FはPCR反応ごとに利用されるDNAを設定するために使用される希釈因子です。
7. ウイルス粒子の生物活性・感染力の確認
- BC-3細胞を80%コンフルエンシーで100 mm培養プレートから15 mLコニカルチューブに移します。P3HR-1細胞の播種密度は1 x 106 細胞/mLです。完全なRPMI培養培地(79%RPMI培養培地、20%ウシ胎児血清、1%ペンストレプ系抗生物質)で37°Cおよび5%CO2で維持し、3〜4日ごとに継代します。
- P3HR-1細胞と同様にBC-3細胞を計数し、以下の工程1により計数した。96ウェルプレートに、各ウェルに10個の5 BC-3細胞を追加します。3つ、6つ、9つ、または12つのウェルを使用して、結果の重要性を確保し、エラーを最小限に抑えます。
- ステップ6.3で決定したウイルス調製物の濃度に応じて、各ウェルにウイルスストックの量を追加します。MOIは変化する可能性があり、このプロトコルの最適化により、感染に最適なMOIが明らかになります(2〜50のMOI範囲が推奨されます)。各ウェルに存在する混合物の総量が250 μLであることを確認してください。
- 必要な量を決定するには、ウイルスストックの濃度を知り、MOIを選択する必要があります。たとえば、MOIが2の場合、追加するウイルス粒子の数は細胞数の2倍である必要があります。式を使用して必要なウイルスストックの体積 V を計算します:
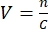 nは必要なウイルス粒子の数、Cは既知のウイルスストックの濃度です。
nは必要なウイルス粒子の数、Cは既知のウイルスストックの濃度です。
- 必要な量を決定するには、ウイルスストックの濃度を知り、MOIを選択する必要があります。たとえば、MOIが2の場合、追加するウイルス粒子の数は細胞数の2倍である必要があります。式を使用して必要なウイルスストックの体積 V を計算します:
- 96ウェルプレートの内容物を5日間インキュベートします。5日後、各ウェルの内容物を1.5 mLチューブに移します。
- チューブを120 x g で8分間遠心分離し、ウイルス含有培養液から細胞を分離します。細胞ペレットと上清をDNA抽出にかけ、続いてリアルタイムPCR定量を行い、各画分にウイルスゲノムが存在するかどうかを確認し、ウイルス粒子の感染力を評価します。
結果
この手順の目的は、既知のウイルス力価を有する懸濁液中のEBV粒子を単離することであり、その後EBV感染をモデル化するために使用することができる。したがって、手順から最高のEBV収率を得るために、さまざまな試薬の最適濃度を使用することが最も重要です。
最も多くのEBV粒子を生成するPMAおよびDMSOの濃度を決定するために、最適化試験が実施されました(
ディスカッション
EBV粒子の生産は、このウイルスの生物学とそれに関連する病気を理解するために必要です。ここでP3HR-1細胞株からのこれらの粒子の産生について記載した。この細胞株は唯一のEBV産生株ではありません。実際、EBV粒子は、B95-8細胞21,22ならびにRaji細胞株18,19からも単離されている。EBV溶解サイクルは、n-酪...
開示事項
著者は利益相反を宣言しません。
謝辞
この研究への資金提供は、アスマール研究基金、レバノン国立科学研究評議会(L-CNRS)、およびベイルートアメリカン大学の医療実践計画(MPP)からのERへの助成金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 mL thin-walled PCR tubes | Thermo Scientific | AB0620 | Should be autoclaved before use |
| 0.2-10 µL Microvolume Filter Tips | Corning | 4807 | Should be autoclaved before use |
| 0.5-10 µL Pipette | BrandTech | 704770 | |
| 10 mL Disposable Serological Pipette | Corning | 4488 | |
| 1000 µL Filtered Pipette Tips | QSP | TF-112-1000-Q | |
| 100-1000 µL Pipette | Eppendorf | 3123000063 | |
| 100x20 mm Cuture Plates | Sarstedt | 83.1802 | |
| 10-100 µL Pipette | BrandTech | 704774 | |
| 15 mL Conical Tubes | Corning | 430791 | |
| 200 µL Filtered Pipette Tips | QSP | TF-108-200-Q | |
| 20-200 µL Pipette | Eppendorf | 3123000055 | |
| 50 mL Conical Tubes | Corning | 430828 | |
| CFX96 Real-Time C-1000 Thermal Cycler | Bio-Rad | 184-1000 | |
| DMSO | Amresco | 0231 | |
| DNase/RNase Free Water | Zymo Research | W1001-1 | |
| EBER Primers | Macrogen | N/A | Custom Made Primers |
| EBV DNA Control (Standards) | Vircell | MBC065 | |
| Ethanol (Laboratory Reagent Grade) | Fischer Chemical | E/0600DF/17 | |
| Fetal Bovine Serum | Sigma | F9665 | |
| Fresco 21 MicroCentrifuge | Thermo Scientific | 10651805 | |
| Glycogen Solution | Qiagen | 158930 | |
| Hemocytometer | BOECO | BOE 01 | |
| Inverted Light Microscope | Zeiss | Axiovert 25 | |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5121 | |
| Microcentrifuge Tube | Costar (Corning) | 3621 | Should be autoclaved before use |
| P3HR-1 Cell Line | ATCC | HTB-62 | |
| Penicillin-Streptomycin Solution | Biowest | L0022 | |
| Phenol | VWR | 20599.297 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Pipette Filler | Thermo Scientific | 9501 | |
| Precision Wipes | Kimtech | 7552 | |
| RPMI-1640 Culture Medium | Sigma | R7388 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | |
| Sodium Acetate | Riedel-de Haën (Honeywell) | 25022 | |
| Spectrophotomer | DeNovix | DS-11 | |
| Tris-HCl | Sigma | T-3253 | |
| Trypan Blue Solution | Sigma | T8154 | |
| Water Jacketed CO2 Incubator | Thermo Scientific | 4121 |
参考文献
- Epstein, M. A., Achong, B. G., Barr, Y. M. Virus particles in cultured lymphoblasts from Burkitt's lymphoma. Lancet. 1 (7335), 702-703 (1964).
- Sample, J., et al. Epstein-Barr virus types 1 and 2 differ in their EBNA-3A, EBNA-3B, and EBNA-3C genes. Journal of Virology. 64 (9), 4084-4092 (1990).
- Chang, M. S., Kim, W. H. Epstein-Barr virus in human malignancy: a special reference to Epstein-Barr virus associated gastric carcinoma. Cancer Research and Treatment. 37 (5), 257-267 (2005).
- Manet, E., Schwab, M. . Encyclopedia of Cancer. , 1602-1607 (2017).
- Babcock, G. J., Decker, L. L., Volk, M., Thorley-Lawson, D. A. EBV persistence in memory B cells in vivo. Immunity. 9 (3), 395-404 (1998).
- Khan, G., Miyashita, E. M., Yang, B., Babcock, G. J., Thorley-Lawson, D. A. Is EBV persistence in vivo a model for B cell homeostasis. Immunity. 5 (2), 173-179 (1996).
- Jha, H. C., Banerjee, S., Robertson, E. S. The role of gammaherpesviruses in cancer pathogenesis. Pathogens. 5 (1), 18 (2016).
- El-Sharkawy, A., Al Zaidan, L., Malki, A. Epstein-Barr virus-associated malignancies: roles of viral oncoproteins in carcinogenesis. Frontiers in Oncology. 8, 265 (2018).
- Vereide, D., Sugden, B. Insights into the evolution of lymphomas induced by Epstein-Barr virus. Advances in Cancer Research. 108, 1-19 (2010).
- Vereide, D. T., Sugden, B. Lymphomas differ in their dependence on Epstein-Barr virus. Blood. 117 (6), 1977-1985 (2011).
- Houen, G., Trier, N. H. Epstein-Barr virus and systemic autoimmune diseases. Frontiers in Immunology. 11, 587380 (2020).
- Ortiz, A. N., et al. Impact of Epstein-Barr virus infection on inflammatory bowel disease (IBD) clinical outcomes. Revista Espanola de Enfermedades Digestivas. 114 (5), 259-265 (2021).
- Caplazi, P., et al. Mouse models of rheumatoid arthritis. Veterinary Pathology. 52 (5), 819-826 (2015).
- Kiesler, P., Fuss, I. J., Strober, W. Experimental models of inflammatory bowel diseases. Cellular and Molecular Gastroenterology and Hepatology. 1 (2), 154-170 (2015).
- Warde, N. Experimental arthritis: EBV induces arthritis in mice. Nature Reviews Rheumatology. 7 (12), 683 (2011).
- Jog, N. R., James, J. A. Epstein Barr virus and autoimmune responses in systemic lupus erythematosus. Frontiers in Immunology. 11, 623944 (2020).
- Shimizu, N., Yoshiyama, H., Takada, K. Clonal propagation of Epstein-Barr virus (EBV) recombinants in EBV-negative Akata cells. Journal of Virology. 70 (10), 7260-7263 (1996).
- Hsu, C. H., et al. Induction of Epstein-Barr virus (EBV) reactivation in Raji cells by doxorubicin and cisplatin. Anticancer Research. 22, 4065-4071 (2002).
- Nutter, L. M., Grill, S. P., Li, J. S., Tan, R. S., Cheng, Y. C. Induction of virus enzymes by phorbol esters and n-butyrate in Epstein-Barr virus genome-carrying Raji cells. Cancer Research. 47 (16), 4407-4412 (1987).
- Fresen, K. O., Cho, M. S., zur Hausen, H. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Glaser, R., Tarr, K. L., Dangel, A. W. The transforming prototype of Epstein-Barr virus (B95-8) is also a lytic virus. International Journal of Cancer. 44 (1), 95-100 (1989).
- Sairenji, T., et al. Inhibition of Epstein-Barr virus (EBV) release from P3HR-1 and B95-8 cell lines by monoclonal antibodies to EBV membrane antigen gp350/220. Journal of Virology. 62 (8), 2614-2621 (1988).
- Savage, A., et al. An assessment of the population of cotton-top tamarins (Saguinus oedipus) and their habitat in Colombia. PLoS one. 11 (12), 0168324 (2016).
- Kallin, B., Klein, G. Epstein-Barr virus carried by raji cells: a mutant in early functions. Intervirology. 19 (1), 47-51 (1983).
- Fresen, K. O., Cho, M. S., Hausen, H. Z. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Bounaadja, L., Piret, J., Goyette, N., Boivin, G. Evaluation of Epstein-Barr virus, human herpesvirus 6 (HHV-6), and HHV-8 antiviral drug susceptibilities by use of real-time-PCR-based assays. Journal of Clinical Microbiology. 51 (4), 1244-1246 (2013).
- Buelow, D., et al. Comparative evaluation of four real-time PCR methods for the quantitative detection of Epstein-Barr virus from whole blood specimens. Journal of Molecular Diagnostics. 18 (4), 527-534 (2016).
- Wu, D. Y., Kalpana, G. V., Goff, S. P., Schubach, W. H. Epstein-Barr virus nuclear protein 2 (EBNA2) binds to a component of the human SNF-SWI complex, hSNF5/Ini1. Journal of Virology. 70 (9), 6020-6028 (1996).
- Li, C., et al. EBNA2-deleted Epstein-Barr virus (EBV) isolate, P3HR1, causes Hodgkin-like lymphomas and diffuse large B cell lymphomas with type II and Wp-restricted latency types in humanized mice. PLoS Pathogens. 16 (6), 1008590 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved