Method Article
ヒト誘起多能性幹細胞由来心臓スフェロイドの作製、ハイスループットスクリーニング、バイオバンキング
* これらの著者は同等に貢献しました
要約
ここでは、ハイスループットの多次元フォーマットで培養されたヒト誘導多能性幹細胞由来心筋細胞からの心臓スフェロイド(CS)の生成と凍結保存のための一連のプロトコルを紹介します。この3次元モデルは、疾患モデリング、ハイスループットスクリーニングのための堅牢なプラットフォームとして機能し、凍結保存後もその機能を維持します。
要約
ヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)は、ヒト心臓病のモデリングと治療にとって最も重要です。私たちは最近、hiPSC-CMを2次元(2D)で大規模に拡大するための費用対効果の高い戦略を発表しました。2つの大きな制限は、細胞の未熟さと、ハイスループットスクリーニング(HTS)プラットフォームにおける3次元(3D)配置とスケーラビリティの欠如です。これらの制限を克服するために、拡張された心筋細胞は、3D心臓細胞培養および組織工学技術の生成に理想的な細胞源を形成します。後者は心臓血管分野で大きな可能性を秘めており、より高度で生理学的に関連するHTSを提供します。ここでは、96ウェルフォーマットの心臓スフェロイド(CS)の生成、メンテナンス、および光学分析のための容易なスケーラビリティを備えたHTS互換ワークフローについて説明します。これらの小さなCSは、現在の in vitro 疾患モデルおよび/または3D組織工学プラットフォームの生成に存在するギャップを埋めるために不可欠です。CSは、高度に構造化された形態、サイズ、および細胞組成を示します。さらに、CSとして培養されたhiPSC-CMは、成熟度が高く、自発的なカルシウム処理や収縮活動など、ヒト心臓のいくつかの機能的特徴を示します。CSの生成から機能解析までのワークフロー全体を自動化することで、ハイスループット(HT)イメージングやカルシウムハンドリング分析で実証されるように、バッチ内およびバッチ間の再現性を向上させます。記載されたプロトコルは、完全に自動化されたHTSワークフローにおいて、心臓病のモデリングおよび複雑な3D細胞環境内の単一細胞レベルでの薬物/治療効果の評価を可能にする。さらに、この研究では、全スフェロイドの長期保存とバイオバンキングのための簡単な手順を説明し、それによって研究者に次世代の機能的組織ストレージを作成する機会を提供します。HTSと長期保存を組み合わせることで、創薬・試験、再生医療、個別化医療の開発など、幅広い分野でのトランスレーショナルリサーチに大きく貢献します。
概要
ヒト人工多能性幹細胞(hiPSC)の発見は、ヒトの発生と疾患を細胞レベルで研究する前例のない機会を提供しました。過去10年間で、発達の教訓を使用して、hiPS細胞を心筋細胞(CM)に効率的に分化させるためのさまざまなプロトコルが確立されてきました1,2,3,4。hiPSC由来心筋細胞(hiPSC-CM)は、遺伝的に遺伝する心血管疾患(CVD)のモデリング、新薬の心臓安全性の試験、および心臓再生戦略のためのリソースとして役立ちます5、6、7、8。hiPS細胞の指向性心臓分化にもかかわらず、成熟したhiPSC-CMは一般に非増殖性であり、初代ヒト細胞は大量に入手できないため、心臓分野では不定のCM数が依然として課題です。
最近、我々は、低細胞密度培養によるWntシグナル伝達活性化が、hiPSC-CMの大規模な増殖応答(最大250倍)をもたらすことを説明しました9,10。培養フラスコフォーマットでのシリアル継代によるhiPSC-CMの大規模な拡張のためのこの費用対効果の高い戦略は、多数の機能的なhiPSC-CMの標準化と品質管理を容易にします。さらに、様々なドナーからのhiPSC-CMの大量バッチの需要に追いつくために、hiPSC-CMのバイオバンキングが記載されている10。しかしながら、これらの標準的な培養皿に播種された心筋細胞単層は、心臓に存在する複雑な3D構造を代表するものではない。さらに、hiPSC-CMの未熟さは依然として障害であり、したがって、in vivo心血管環境の生物学的および生理学的表現型を模倣するには不十分です。
新しい3Din vitroモデルが開発されており、hiPSC-CMは、自己組織化11,12、細胞外マトリックス(ECM)リモデリング13、成熟の亢進14,15,16、同期収縮17,18,19などのより近い生理学的挙動を示します。.3Dモデルは、創薬、薬物心毒性試験、疾患モデリング、再生療法、さらには最初の臨床試験に利用されています20、21、22、23、24。最も使用されるモデルの1つは、フィブリンベースの人工心臓組織(EHT)であり、組織様配置および心臓収縮性を示す13,17,25。これまでに、拡張型hiPSC-CMから作製したEHTは、非拡張型hiPSC-CMと同等の収縮性を示し、拡張後も損なわれない細胞機能を示すことを示しました9。しかしながら、hiPSC-CMからのEHTの生成は十分に確立されているが、HT評価プラットフォームの確立に関してはさらなる進展が期待される。ここでは、96ウェルフォーマットの多数の自己凝集型心筋スフェロイド(CS)を迅速に生成することで、ハイスループットスクリーニング(HTS)目的の3D条件を改善することができます。
全体として、3D細胞培養としてのCSの利点は、その高い再現性とスケーラビリティです。特に、ロボットによるサンプルハンドリングと組み合わせたCSは、CS培養、薬物処理、およびハイコンテント分析を標準化および自動化することができます20。ここでは、光学カルシウム取得および分析システムを使用してCa2+過渡測定を行うことにより、効率的に凍結保存および心機能のスクリーニングが可能な、高純度で高品質のCSを生成するための最適化されたプロトコルについて説明します。このモデルは、数百から数千のスフェロイド17,18でハイスループットスクリーンを実行するためのシンプルでありながら強力なツールを提供します。
プロトコル
注:この研究で使用されたhiPSC-CMは、前述のhiPSC培養およびCM分化プロトコルに従って生成されました26,27。オプションで、cisプロトコルを開始する前に、hiPSC-CMを拡張して最近公開した凍結保存することができます(セクション4)10。
1. 細胞培養培地、溶液、アリコートの調製
- 基礎培地を準備する
- ペニシリン-ストレプトマイシンと培地(RPMI 1640)を室温(RT)に平衡化し、完全に解凍されていることを確認します。500 mLの培地と5 mLのペン/連鎖球菌を混合します。4°Cで最大8週間保管します。使用前に37°Cに平衡化してください。
- RPMI + B27を準備する
- B27サプリメントと基礎培地をRTに平衡化します。 サプリメントを完全に解凍してください。490 mLの基礎培地と10 mLの50x B27サプリメントを混合します。4°Cで最大2週間保管します。使用前に37°Cに平衡化してください。
- hiPSC-CM再めっき培地の準備
- プロテインキナーゼ(ROCK)阻害剤(最終濃度2 μM)および10%ノックアウト血清置換(KSR)を含むRho関連コイルドコイルをRPMI + B27培地に追加します。必要に応じて、ROCK阻害剤をRM培地に直接添加します。一度補充した培地は保管しないでください。
- CM解凍メディアを準備する
- 1:100濃度の細胞生存サプリメント(レビタセルなど)と20%KSRをRPMI + B27培地に加え、使用前に37°Cに平衡化します。
- 成熟サプリメントを準備する
- 前述の成熟培地式28 は、3 mMグルコース、10 mM L-乳酸塩、5 mg/mLビタミンB12、0.82 mMビオチン、5 mMクレアチン一水和物、2 mMタウリン、2 mM L-カルニチン、0.5 mMアスコルビン酸、1x NEAA、0.5%(w / v)アルブマックス、1x B27、および1%KOSRで構成されています。成熟サプリメントのフルボトル(500 mL)を1本調製するには、グルコースを含まないDMEMのボトルから65 mLを取り出し、2.7 gのグルコース、5.6 gのL-乳酸塩、0.025 mgのビタミンB12、1 mgのビオチン、3.73 gのクレアチン一水和物、1.25 gのタウリン、1.975 gのL-カルニチン、0.7125 gのアスコルビン酸、 50 mLのNEAA、12.5 gのアルブマックス、および5 mLのペニシリン-ストレプトマイシン。
- 0.22 μmの細孔ポリエーテルスルホン(PES)メンブレンを備えた滅菌使い捨てフィルターユニットでろ過します。
- 45 mL(500 mLの成熟培地を調製するため)または4.5 mL(50 mLの成熟培地を調製するため)に分注します。20°Cで最大6か月間保管してください。
- 成熟培地を準備する
- B27サプリメント、ノックアウトSR、ペニシリン-ストレプトマイシン、成熟サプリメント28、およびDMEM非グルコース培地をRTで平衡化します。 サプリメントを完全に解凍してください。435 mLのDMEM無グルコース培地を10 mLの50x B27サプリメント、5 mLのペニシリン-ストレプトマイシン、5 mLのノックアウトSR、および45 mLの成熟サプリメントと混合します。4°Cで最大2週間保管します。使用前に37°Cで平衡化してください。
- 蛍光光輝培地を準備する
- RTでペニシリン-ストレプトマイシンとDMEMフルオロブライト培地を平衡化します。 サプリメントが完全に解凍されていることを確認してください。500 mLのDMEM蛍石培地を5 mLのペニシリン-ストレプトマイシンと混合します。4°Cで最大1ヶ月間保管してください。使用前に37°Cで平衡化してください。
- 非イオン性洗剤溶液を準備する
- 20%w / v非イオン性洗剤粉末(F-127など)をPBSと混合します。0.22 μmフィルターを使用してろ過し、4°Cで最大6か月間保管します。使用前にRTで平衡化してください。
- カルシウム染料培地の調製
- 非イオン性洗剤溶液(最終濃度0.04%v / v)と0.1倍のカルシウム染料(Cal520 AMなど)を蛍光明るい媒体に混合します。50 mLのコニカルチューブに、10 μLのCal520と20 μLの非イオン性洗剤溶液を加えます。完全に溶解するまで混合する。細胞に加える前に溶液を暗所に保管してください。
2. バッファーの調製
- 透過処理およびブロッキングバッファーの調製:このバッファーには、10 mL の PBS、5% wt/v BSA、および 0.3% v/v Triton-X-100 が含まれています。
- フローサイトメトリーバッファーの調製:このバッファーには、50 mL の PBS、1% wt/v BSA、および 0.3% v/v Triton-X-100 が含まれています。
- フローサイトメトリー洗浄バッファー:このバッファーには、50 mLのPBSと1%wt/v BSAが含まれています。
- スフェロイド洗浄バッファー(SWB):このバッファーには、1 mLのTriton-X-100、2 mLの10%(DPBSではw / v)SDS、および1 LのPBS中に2 gのBSAが含まれています。
注意: SWBは4°Cで最大2週間保存できます。 - 包埋溶液(ES)の調製:100 mLの包埋溶液を調製するには、50 mLのグリセロールを9.09 mLのdH2O、1 mLのトリス緩衝液(1 M、pH 8.0)、および200 μLのEDTA(0.5 M)と混合します。フルクトース22.7 gを加え、暗所で溶解するまでRTで混合します。透明になったら、フルクトース22.2 gを加え、溶解するまで混ぜます。次に尿素15 gを加え、溶解するまで混合します(暗所で4°Cで保存します)。
- PBT(トゥイーン-20を含むPBS)バッファーを準備します。このバッファーには、PBS/トゥイーン-20 (0.1% v/v) が含まれています。1 LのPBSに対して、1 mLのTween-20を加えます。
3. 低分子の調製
- チアゾビビン(ROCK阻害剤)粉末をDMSO溶液50 μLの10 mMアリコートで再構成し、-20°Cで最大6か月間保存します。光から保護してください。
- Cal-520 AMをそれぞれ10 μLずつ2.5 mMのアリコートをDMSOで調製し、-20°Cで最大6ヶ月間保存します。光から保護してください。
4. 心臓スフェロイドの生成
注:大量のCSの場合は、2 mLのhiPSC-CM再めっき培地を含む6ウェル超低アタッチメントプレートに最大100万CMをシードします。この研究では、96ウェルプレートのウェルあたり最低2,500(2.5k CS)から最大20,000(20k CS)のhiPSC-CMを使用しました。
- 1枚の96ウェルプレートに対して、最低2 x 106 個のヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)10を含む細胞培養液を調製します。
- 培養したhiPSC-CMがコンフルエントに達したら、0.1 mL/cm2 の滅菌心臓剥離溶液(トライプルなど)を各ウェルに加えます。プレートを37°Cで15分間インキュベートします。
- 5 mLのピペットを使用して、2 mLの温かい基礎培地で洗い流すことで細胞を機械的に解離させ、単一細胞懸濁液を作製します。明視野顕微鏡(倍率4倍)で剥離を確認します。細胞は白く見え、丸い形をします。
- 細胞懸濁液を15 mLコニカルチューブに移し、300 x gで3分間遠心分離します。
- 上清を吸引し、細胞を1 mLのhiPSC-CM再プレーティング培地に再懸濁します。
- 1,000 μLのピペットチップを使用して、細胞ペレットを機械的に解離します。溶液は、3回または4回混合した後に均質に見える。セルを数えます。100 μLの再プレーティング培地中の適量の細胞を各超低付着丸底96ウェルに移します。
- CSのプレートをインキュベーター内の70rpmのオービタルシェーカーに24時間置きます。インキュベーターの条件を37°C、5%CO2、21%O2、および90%湿度に設定します。
- 各ウェルから50 μLの培地を吸引し、最初の48時間、ウェルあたり100 μLのRPMI + B27培地を加えます。
注:偶発的な吸引や回転楕円体の破裂を防ぐために、常に50 μLの培地を96ウェルプレートに保管してください。 - 各ウェルから100 μLの培地を吸引し、ウェルあたり100 μLの成熟培地を追加します。成熟培地中の細胞を維持し、2〜3日ごとに培地をリフレッシュします。
5. CSの凍結保存
注意: CSは長期保存のために凍結保存できます。CSは、CSの生成後3日目から実施でき、CSは96ウェルプレートのウェルで直接凍結保存することも、クライオバイアルのCS懸濁液として凍結保存することもできます。
- プレートを氷の上に10分間置き、プレートを予冷します。
- 回転楕円体プレートを70 x gで3分間遠心分離します。
- 50 μLが残るまで上清を除去し、ウェルあたり200 μLの氷冷hiPSC凍結培地を加えます。
注意: CSサスペンションは、手順の全期間にわたって氷上に置いてください。スフェロイドを含む6ウェルプレートの場合は、1つのウェルを500 μL凍結培地クライオバイアルで凍結します。 - プレートシールフィルムでプレートをシールします。
注意: 96ウェルプレートはポリスチレンボックスに保管するか、利用できない場合は、手順5.5.1の説明に従ってシリコンモールドを作成できます。 - ウェルプレートと冷凍庫の間の均一な熱交換を確実にするために、プレートをポリスチレンボックスまたはシリコンモールドに慎重に配置します。
- シリコンモールドを準備するには:シリコンエラストマーキットの2つのコンポーネントを10:1の比率で激しく混合します。真空ポンプを使用して15〜20分間溶液を脱泡します。続いて、溶液をウェルプレートの底部の内側にキャストし、真空ポンプを使用して10分間気泡除去します。金型をオーブンに入れ、60°Cで8時間硬化させて、プレートを剥離した半可撓性エラストマーを得た。
- プレートを-80°Cでポリスチレンボックスまたは準備したシリコンモールドで最低4時間凍結します。
- プレートを液体窒素タンクまたは-150°Cの冷凍庫に移して長期保存します。
6. 心臓スフェロイドの融解
注意: 迅速な解凍プロセスを確実にするために、一度に複数のプレートを解凍しないでください。
- 20 mLの37°C予熱基礎培地を50 mLのコニカルチューブに調製します。
- 液体窒素からCSを含むセルプレートを収集し、インキュベーターに15分間入れます。インキュベーターの条件を37°C、5%CO2、21%O2、および90%湿度に設定します。
- 細胞ペレットが残っている上清を除去し、各ウェルを温かい基礎培地に再懸濁する。ウェルあたり200 μLの培地を使用してください。
- 70 x gで3分間遠心分離します。
- 手順 6.3 と 6.4 を繰り返します。
- 細胞ペレットが残るまで上清を除去し、各ウェルに200 μLのCM融解培地を加えます。
- CSのプレートをインキュベーター内の70rpmのオービタルシェーカーに24時間置きます。インキュベーターの条件を37°C、5%CO2、21%O2、および90%湿度に設定します。
- 各ウェルから50 μLの培地を吸引し、最初の48時間、ウェルあたり100 μLのRPMI + B27培地を加えます。
- 各ウェルから100 μLの培地を吸引し、ウェルあたり100 μLの成熟培地を加えます。成熟培地中の細胞を維持し、2〜3日ごとに培地をリフレッシュします。
7. 細胞内Ca2+ トランジェントの評価
注:CSは合計3週間培養されています。凍結の2週間前、解凍の1週間後。「新鮮な」コントロールは年齢が一致しています。
- 1週間の培養後、解凍したCSはカルシウム処理光学イメージングに最適です。カルシウム色素(Cal520AMなど)を使用して、細胞からのCa2+ の取り込みと放出を評価します。
- ウェルあたり100 μLのカルシウム色素培地で処理し、インキュベーター内で60分間インキュベートします。インキュベーターの条件を37°C、5%CO2、21%O2、および90%湿度に設定します。
注意: Cal520AMは光に敏感です。すべてのロード手順と実験を暗闇の中で実行してください。 - カルシウム取得および分析システムを準備します。
- 顕微鏡に電力を供給し、環境制御オプションがオンになっていることを確認します。
- カメラとフレーミングの絞り寸法を調整して、背景領域を最小限に抑えます。
注:ここでは、ライカサンダーDMi8顕微鏡を使用しました。他の顕微鏡システムも、30フレーム/秒(fps)を超えるサンプリングレートを可能にするまで適用できます。
- 10秒以内に2〜10ピークの一貫したストリームでビデオを録画し、96ウェルプレートをスキャンし、最初は左に移動し、次にジグザグに下に移動してプレート全体をカバーします。488 nmレーザーを使用してカルシウム信号を測定します。カルシウム放出中の明るい緑色の信号を持つ黒い背景にコントラストを設定します。
- Ca2+トランジェントを取得した後、製造元の指示に従って蛍光トレース分析ソフトウェア(CyteSeer、Vala Sciencesなど)でデータを解析します。
8. 解離した心臓スフェロイドのフローサイトメトリー解析
注:この研究では、フローサイトメトリーを使用して、解凍プロセスの前後のCSの生存率を決定しました。
- スフェロイド損傷を避けるために、5 mLピペットを使用して15 mLコニカルチューブにCSを収集し、70 x gで3分間遠心分離します。上清を吸引し、1 mLのPBSを加える。
- 200 x gで3分間遠心分離します。上清を吸引し、1 mLの心臓剥離溶液(トライプルなど)を加えてCSを解離します。チューブを37°Cで15分間インキュベートします。
- 5 mLピペットを使用して、顕微鏡下で観察したときに単一細胞が見えるまで、2 mLの基礎培地でフラッシュすることにより、細胞を機械的に解離させます。
- 200 x gで3分間遠心分離します。
- 上清を吸引し、1x PBS中の200 μLの4%パラホルムアルデヒド(PFA)溶液でCMを固定します。RTで10分間インキュベートします。
- 200 x gで3分間遠心分離します。上清を吸引し、1 mLのPBSを加える。
注:一時停止ポイント:固定されたhiPSC-CMは、4°Cで最大4週間保存できます。 - 細胞懸濁液をFACSチューブに移し、200 x gで3分間遠心分離します。上清を吸引し、1 x 105 細胞を50 μLの透過処理バッファーに再懸濁します。
- 細胞を4°Cで30分間インキュベートします。
- 免疫蛍光フローサイトメトリー分析では、ステップ8.9.1〜8.9.4を実行します。
- 細胞をα-アクチニン抗体を含むフローサイトメトリーバッファー(50 μL)に1:300の希釈率で再懸濁します。別のFACSチューブで、1 x 105 細胞をフローサイトメトリーバッファー(50 μL)に、それぞれのアイソタイプコントロール(例:FITCマウスIgM、κアイソタイプ[1:200希釈])で再懸濁します。同様に、ネガティブコントロールのために、1 x 105 細胞を50 μLのフローサイトメトリーバッファーに再懸濁します。
- 細胞を4°Cで30分間インキュベートします。
- 2.5 mLのフローサイトメトリーバッファーを加え、細胞を200 x g で4°Cで3分間遠心分離します。上清を捨て、この洗浄ステップを2回繰り返す。
- 細胞を50 μLのフローサイトメトリーバッファーに、二次抗体ヤギ抗マウス(1:300希釈)で再懸濁します。
注:二次抗体溶液は光に敏感であるため、チューブを暗所に置いてください。
- ヨウ化プロピジウム(PI)による生存率チェックのために、サンプルあたり150 μLのPI(1:1,000)を加え、15分間インキュベートします。
注意: PI溶液は感光性であるため、チューブを暗所に置いてください。 - 補足図1に示すように、標準的なゲーティング戦略に従ってゲートを調整し、フローサイトメーターで細胞を分析します。
9. 全3次元スフェロイドの免疫蛍光染色
注:このプロトコルは、免疫蛍光標識によるオルガノイド全体の高解像度3Dイメージングのためのプロトコルに基づいており、以前に公開されており29 、心臓スフェロイド用に調整されています。手順中、すべてのピペットチップとコニカルチューブを1%wt/v BSA-PBSでコーティングして、スフェロイドがプラスチックに付着するのを防ぐことができます。材料をコーティングするには、1%BSA-PBSに浸します。機械的破壊を避けるために、5 mLピペットを使用してスフェロイドを損傷しないように注意してください。
- 5 mL ピペットで 15 mL コーティングされたチューブに CS を回収します。回転楕円体は目に見える。抗体の組み合わせごとに~20-50個のスフェロイドを収集します。70 x g で3分間遠心分離し、上清を吸引します。
- コーティングされた1 mLチップを使用して、1 mLの氷冷4%パラホルムアルデヒド(PFA)溶液中の1x PBS溶液にスフェロイドを注意深く再懸濁します。
- 4°Cで45分間固定します。20分後、コーティングされた1 mLチップを使用してスフェロイドを静かに再懸濁します。これにより、すべての回転楕円体の間で固定が均一になります。
- 10 mLの氷冷PBSをチューブに加え、チューブを反転させて穏やかに混合します。4°Cで10分間インキュベートし、70 x g で3分間スピンダウンします。
注意: このステップ以降、固定後にCSがチップに付着しないため、チップとコニカルチューブのコーティングは通常必要ありません。 - ペレットを氷冷SWB(ウェルあたり200 μLのSWB)に再懸濁してCSをブロックし、スフェロイドを24ウェル懸濁培養プレートに移します。
注:1つの大きなペレットからのCSは、複数のウェルに分割して、異なる染色を行うことができます。抗体の組み合わせごとに~20-50 CSを使用します。 - 4°Cで少なくとも15分間インキュベートします。
- 200 μLのSWBを空のウェルに追加して、参照ウェルとして使用します。
注:免疫蛍光染色では、48ウェルまたは96ウェルプレートを使用して抗体の使用量を減らすこともできます。ただし、ウェルあたりの体積が小さいため、染色および洗浄の結果を減らすことができます。 - プレートを45°の角度で5分間傾けたままにして、スフェロイドをプレートの下部に定着させます。
- SWBを取り外し、CSを200 μLのSWBに残します(リファレンスウェルを使用して、200 μLの最小容量を推定します)。
- 一次抗体を2倍濃縮したSWB200 μL(ɑ-アクチニン[1:200]およびトロポニンT [1:200]など)を加え、揺動/振とうしながら4°Cで一晩インキュベートします(水平シェーカーで40 rpm)。
- 翌日、各ウェルに1 mLのSWBを追加します。
- プレートを45°の角度で5分間放置することにより、スフェロイドをプレートの下部に沈降させます。
- SWBを取り外し、プレートに200μLを残します。1 mLのSWBを加え、ゆっくりと揺れ/振とうしながら2時間洗浄します。
- 手順 9.12 と 9.13 をさらに 2 回繰り返します。
- プレートを45°に5分間傾けたままにして、CSをプレートの下部に沈降させます。SWBを取り外し、各ウェルに200 μLを残します
- 二次抗体、結合抗体、および2倍濃縮された色素(DAPI [1 μg/mL]、マウス-AF488 [1:500]、ウサギ-AF568 [1:500]など)を含む200 μLのSWBを加え、ゆっくりと揺れ/振とうしながら、暗所で4°Cで一晩インキュベートします。
- 翌日、手順 9.12 と 9.13 をさらに 2 回繰り返します。
- CSを慎重に1.5 mLチューブに移し、70 x g で3分間スピンダウンします。
- CSを中断することなくピペッティングして、できるだけ多くのSWBを取り外します。
- 端を切り落とした状態で200 μLのチップを使用して包埋溶液(ES、RTで少なくとも50 μL)を追加し、気泡の形成を防ぐために穏やかに再懸濁し、RTで20分間インキュベートします。
- それまでの間、スライドガラスにマニキュアまたはシリコンシーラントを入れた正方形の容器を作成します。
- 200 μLのチップの端を切り取り、ESのCSを正方形の容器の中央に移します。
- 正方形のカバーガラスを上に置きます。気泡を減らすには、最初にカバーガラスの片側を置き、次に表面の下に空気が閉じ込められなくなるまでカバーガラスを片側から反対側にゆっくりと下げてから、カバーガラスを解放します。
- カバーガラスのすべての端をそっと押して、マニキュアまたはシリコンシーラントにシールします。
- スライドをRTで一晩放置します。翌日、スライドはイメージングの準備が整います。
注意: ESによる光学的透明化は、組織のわずかな収縮を引き起こす可能性があります。ただし、これはCSの全体的な形態に影響を与えることはできません。染色手順は、スライドを4°C(少なくとも1週間)または-20°C(少なくとも6ヶ月間)で保存することにより、ここで一時停止できます。
結果
図1Aに示すプロトコルは、以前に拡張されたhiPSC-CMからのCSの生成を示しています。CSは、播種後1日目までに超低接着丸底プレートで3D構造を取得し、最大6週間培養することができます(図1B)。免疫蛍光染色によって評価されるように、3週齢CSの細胞の大部分は、α-アクチニンやトロポニンTなどのサルコメアタンパク質を発現し、規則的なサルコメア組織を示しました(図1C)。α-アクチニン陽性細胞の定量のために、フローサイトメトリー分析を行った。免疫蛍光法の結果によると、フローサイトメトリーデータは、0日目(76.9%±16.6%)と3週齢のCS(71.1%±22.7%)の両方で同等の高レベルのαアクチニンを示し(図1D)、培養中に一定で高純度の細胞組成を示しました。hiPSC-CM由来のスフェロイド(42日目)では、接合部(GJA1、JPH2、およびPKP2)、デスモソーム(DES)、およびミトコンドリア(ATP5A)の心臓遺伝子の発現が、2Dで90日間培養されたhiPSC-CMと比較して増加しました(図1E)。これらの遺伝子の発現は、細胞間相互作用および成熟の特徴である30。
続いて、CSの機能特性、すなわち叩解率とCa2+処理を異なる時点で評価しました(図2)。立ち上がり時間、ピーク時間、減衰時間、カルシウム過渡持続時間(CTD90)などのカルシウム過渡パラメータは、図2A、Bに示すように評価されました。CSを叩く割合は、生成後最初の3週間で類似していますが、6週目(Wk6)のCSでは大幅に低下しました(図2C)。叩動率はWk1と比較してWk3で有意に低下し、CSの叩解率と同様に、Wk6で劇的に低下しました(図2D)。Wk6ではCSの劣化が見られ、これは拍動速度と拍解CS数の両方の低下を説明することができます。 カルシウム過渡パラメータの測定では、Wk2で有意に高いピーク値が示され(図2E)、立ち上がり時間、減衰時間、およびCTD90はWk1と比較してWk3で有意に増加しました(図2F-H).まとめると、これらの結果は、hiPSC-CM由来のスフェロイドが、世代後2週目と3週目頃に機能的に最適であることを示しています。
図3は、拍動速度およびカルシウム取り扱いに対するスフェロイドサイズの影響を示す。CSは、96ウェルプレートのウェルに2.5 x 10 4、5 x 10 4、10 x 104、および20 x 10 4 hiPSC-CMを播種することによって生成され、条件ごとに合計24個のCS/ウェルになりました(図3A)。予想通り、使用する細胞数が増えるにつれてスフェロイドのサイズが大きくなり、178 ± 36 μmから351 ± 65 μmの範囲になりました(図3A、右パネル)。Ca2+過渡現象は、3週齢のCSで4つの異なる播種密度で測定されました(図3B)。叩倒CSの測定では、小型のCS(2.5Kおよび5K-CS)の約50%のみが鼓動しているのに対し、大きなサイズの叩きCSの割合(10Kおよび20K-CS)の割合は有意に高い(約85%)ことが示されました(図3C)。同様の鼓動速度(約28bpm)は、5K、10K、および20K-CSによって示され、2.5K-CSと比較して有意に高かった(図3D)。カルシウム画像のピーク値はすべてのテスト条件で類似していましたが(図3E)、立ち上がり時間(図3F)、減衰時間(図3G)、およびCTD90(図3H)は、小さいサイズ(2.5Kおよび5K-CS)と比較して、大きいサイズCS(10Kおよび20K-CS)で有意に増加しました。これらの結果を総合すると、hiPSC-CM由来のスフェロイドは、10K〜20K hiPSC-CM/ウェルの播種密度を使用する場合、カルシウム取り扱いスクリーニングに最適であることがわかります。
次に、凍結保存がCSの生存率と機能に与える影響を評価しました。分析前に、融解したCSを培養液中で1週間維持した(図4A)。フローサイトメトリー(図4B)およびCalcein-AM(図4C)の両方の細胞生存率試験によって示されるように、凍結保存はCS内の細胞生存率に影響しなかった。 さらに、融解CSは、新鮮な年齢を一致させたCSと比較して、同様のサルコメアタンパク質の発現レベルを示した(図4D)。これらのデータは、CSがその後の心機能解析およびハイスループットスクリーニングのために効率的に凍結保存できることを示しています。
最後に、叩解活性とCa2+取り扱いを、新鮮なCSと凍結保存されたCSの両方で測定しました(図5)。CSを叩解する割合は、解凍後の異なる時点で、それぞれ2、5、および7日目に測定されました。新鮮なCSのほとんどは時間の経過とともに拍動活性を示しましたが、凍結保存されたCSは、拍動活性を回復するために最大1週間の培養を必要としたことは明らかです(図5B)。解凍したCSと新鮮なCSの鼓動率に有意な変化はなかった。しかし、一部の凍結CSでは自発的な拍動活動は観察されませんでした(図5C)。凍結/解凍CSでは、新鮮なものと比較してピーク値が大幅に減少しましたが(図5D)、新鮮なものと比較して、凍結/解凍されたCSの立ち上がり時間、減衰時間、およびCTD90に大きな変化は見られませんでした(図5E-G)。これらのデータは、融解後、拍動活性およびCa2+過渡を測定する前に、CSをインキュベーター内で少なくとも1週間回復させることが重要であることを示している。
これらの結果は、hiPSC-CM由来スフェロイドの凍結保存が、心筋細胞の生存率、サルコメア構造、および自発拍動活性やカルシウム取り扱いなどの機能的特徴を維持することを示しています。したがって、hiPSC-CM由来のスフェロイドは、 in vitroで心臓電気生理学を正確に要約するのに適したモデルを表しています。
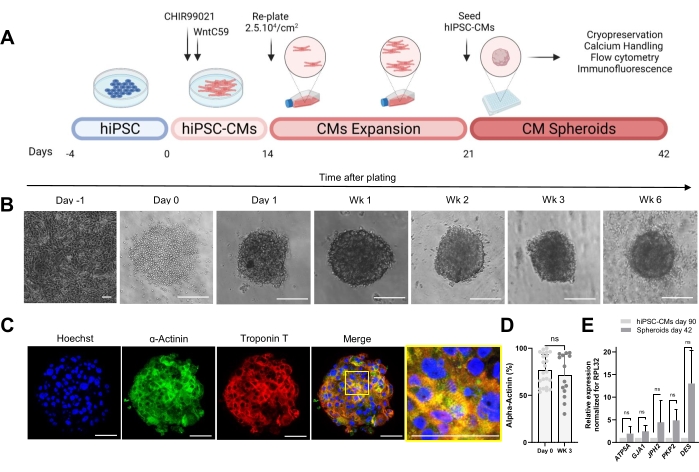
図1:心臓スフェロイドの生成 。 (A)Wntベースの指向性心臓分化、その後のhiPSC-CMの拡大、およびCSの生成の模式図。 biorender.com で作成。(B)CS培養の異なる時点での明視野画像。スケールバー、200μm。Wk は週を表します。(C)3週齢CSにおける心臓サルコメアタンパク質α-アクチニンおよびトロポニンTの代表的な免疫蛍光画像。 免疫蛍光:ヘキスト(青)、α-アクチニン(緑)、およびトロポニンT(赤)。スケールバー、200μm。右側のズームインマージ画像は、サルコメア組織を示しています。スケールバー、50μm。 (D)CSの形成前(0日目)および3週間後のα-アクチニン陽性細胞のフローサイトメトリー定量(条件あたりn = 14〜23。(E)細胞接合部、中間径フィラメント、ミトコンドリアに関連するさまざまな心臓遺伝子の発現レベルを確立するために、90日間培養したhiPSC-CMおよび42日間培養したスフェロイドサンプルに対してRT-qPCRを実施します。(n = 1〜3バッチ)。データは、対応のないt検定によって計算されたSD.NS(有意でない)±平均値として表されます。 この図の拡大版を表示するには、ここをクリックしてください。
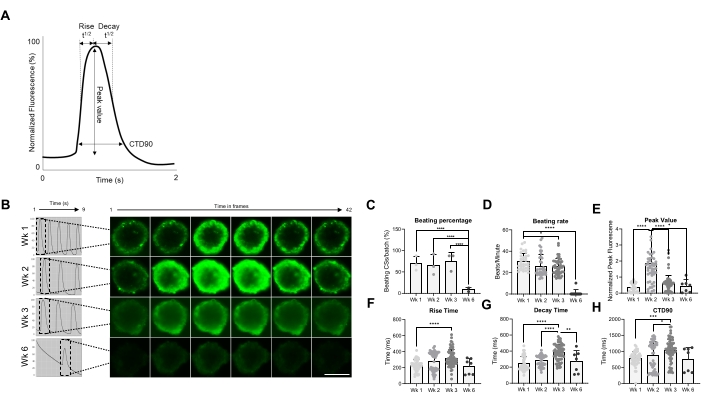
図2:生成後の異なる週におけるCSにおける叩解率とカルシウム処理。 (A)CyteseerソフトウェアのVala科学分析アルゴリズムによって計算されたカルシウム過渡パラメータの例。(B)生成後の異なる時点(数週間)におけるCSの代表的なカルシウム過渡痕跡とタイムラプス画像。スケールバー、200μm。 (C)自発拍動活動の経時変化定量は、叩解CSの割合として表されます。 (D)培養時間中のCSの叩解率。(E-H)カルシウム過渡現象の定量は、ピーク値、立ち上がり時間、減衰時間、およびCTD90を示す。生物学的反復=3、技術反復=38、50、66、および7のそれぞれ、および生物学的反復=38、50、66、および7の±SDの平均を示すデータ。*p < 0.05, ****p < 0.001;一元配置分散分析とそれに続くテューキーの事後多重比較検定。略語;CTD =カルシウム過渡持続時間、Wk =週、CSs =ヒト心臓スフェロイド。この図の拡大版を表示するには、ここをクリックしてください。
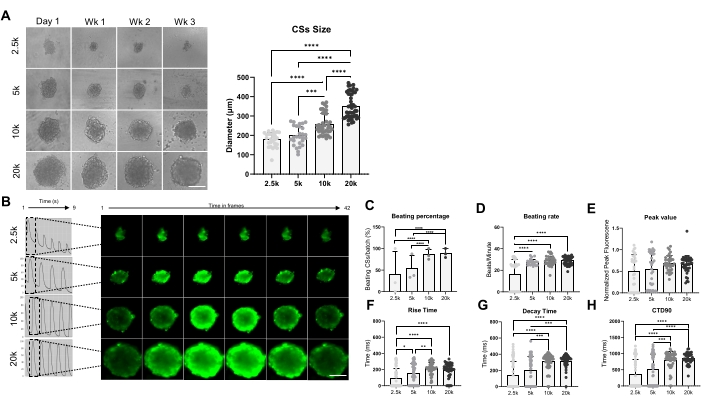
図3:異なる細胞播種密度を用いて生成されたCSにおける拍解速度およびカルシウム処理。 (A)異なる数のhiPSC-CMを用いて作製したCSの明視野イメージング(左)とサイズ測定(右)。スケールバー、200 μm。 (B)2.5K-20K-CSの代表的なカルシウム過渡痕跡とタイムラプス画像。(C,D)2.5K-20K-CSの殴打率と打率。(E-H)ピーク値、立ち上がり時間、減衰時間、および2.5K-20K-CSのCTD90±生物学的反復= 3、技術的反復= 28-39。*p < 0.05, ****p < 0.001;一元配置分散分析とそれに続くテューキーの事後多重比較検定。略語:CTD =カルシウム過渡持続時間、Wk =週、k = x 1,000細胞、CSs =心臓スフェロイド。この図の拡大版を表示するには、ここをクリックしてください。
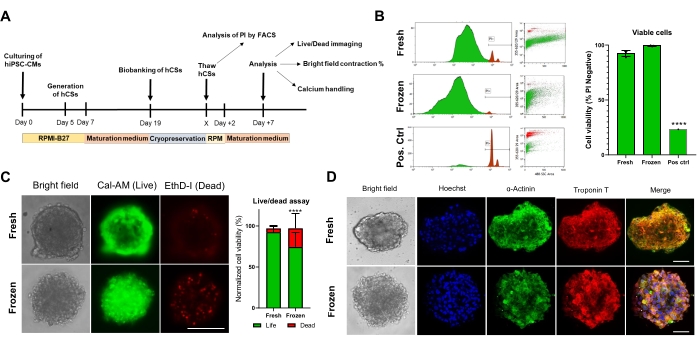
図 4.心臓スフェロイドの生存率と構造に対する凍結保存の影響。 (A)CS生成、その後のバイオバンキング、融解の模式図。(B)新鮮なCSと凍結保存されたCSの両方におけるフローサイトメトリー細胞生存率試験。ポジティブコントロールとして、10%Triton-X溶液による5分間の処理を使用した。(条件あたりn = 4)。データは、SD±平均値として表されます。 ** **p < 0.001;一元配置分散分析とそれに続くテューキーの事後多重比較検定。(C)培養7日後の新鮮なCSと解凍したCSのカルセインAM細胞生存率試験(条件あたりn = 15-17、 ****p < 0.001、対応のあるt検定による;スケールバー、200μm)。(D)新鮮および融解したCSにおけるα-アクチニンおよびトロポニンT発現の代表的な明視野(左)および免疫蛍光染色。 免疫蛍光:ヘキスト(青)、α-アクチニン(緑)、およびトロポニンT(赤)。右側のマージされた写真は、CSのサルコメア線条を示しています。 スケールバー、50μm。 略語:X =選択の解凍日、PI =ヨウ化プロピジウム、Cal-AM =カルセイン-AM、EthD-I =エチジウムホモダイマーI。 この図の拡大版を表示するには、ここをクリックしてください。
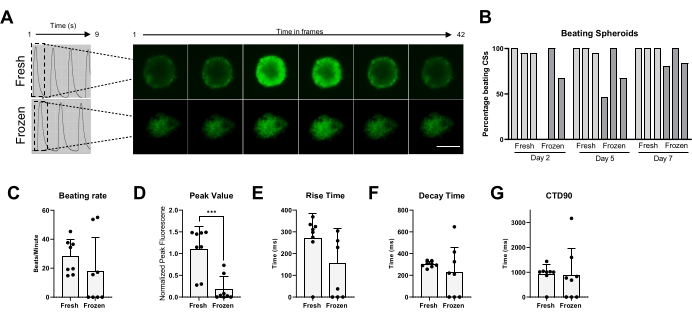
図5:新鮮なCSと解凍したCSのカルシウム過渡現象。 (A)凍結保存前および融解後1週間のCSの代表的なカルシウム過渡痕跡とタイムラプス画像。(B)新鮮および凍結/解凍された心臓スフェロイドの拍動率。棒グラフは個々の実験を表します。(C)新鮮および凍結/解凍された心臓スフェロイドの鼓動率。(D-G)カルシウム過渡パラメータの定量化:ピーク値、立ち上がり時間、減衰時間、CTD90。データは平均±SDです。 *p < 0.05, ****p < 0.001;一元配置分散分析とそれに続くテューキーの事後多重比較検定。略語;CTD = カルシウム過渡持続時間、CSs = 心スフェロイド。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:フローサイトメトリー分析のための代表的なゲーティング戦略。 (A)純粋な集団におけるα-アクチニン陽性hiPSC-CMの代表的なゲーティング戦略と陰性対照およびアイソタイプ対照の比較。α-アクチニン陽性の分析細胞数は25 x 105である。略語;SSC = 側方散乱、PI+ = ヨウ化プロピジウム陽性。(B)新鮮、解凍、ポジティブコントロール(Triton-X)、およびネガティブコントロール(染色なし)の両方での生存率分析のための代表的なゲーティング戦略。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
心臓創薬は、正確な読み出しを実行するための不十分なスループットと生理学的忠実度を備えた非ヒト動物および細胞モデルへの依存によって妨げられています。hiPSC-CM生物学とHT機器および生理学的プローブを組み合わせることで、心臓病モデリングと創薬の初期段階にヒトモデルを再導入する可能性があります。我々は、最適な心疾患モデリングおよび薬物スクリーニングプラットフォームのための高品質で機能的なCSを生成する3次元心臓組織生成法を開発しました。さらに、産業用EV生産用の3Dバイオリアクターシステムにスフェロイド技術を組み合わせることで、EVベースの治療の臨床翻訳に向けて必要なステップが可能になります。ここで説明する方法は、いくつかの重要な要因に依存しており、既存のプロトコル9、10、28、29の変形である。これらの方法には、1)3D組織構築物の生成、2)スクリーニング前の最適な細胞数とタイミング、3)機器の感度とハイスループット能力の向上、4)機能解析の前にスフェロイドを凍結できることが含まれます。前述のプロトコルとは異なり、提案されたプロトコルは、1日あたり最大1,500個のスフェロイドの生成とHTSへの適合性を説明しています。既存の96ウェルカルシウムイメージングシステムまたは24ウェルマルチプレックス操作心臓組織を使用して、10回の反復で6 x 0.5ログ用量にわたる100の化合物の従来の分析には、約5億から30億のhiPSC-CMが必要です31,32。提案されたアプリケーションは、96ウェルプレートが記載された方法と比較して播種密度の10%しか必要としないため、従来のシステムと比較して心臓スクリーニングのコストと時間効率を低下させます。さらに、ハンギングドロップ法などの以前のプロトコルと比較して、超低付着プレートでの自己凝集によるスフェロイドの生成により、単一の微小組織の高品質の自動イメージングが可能になります33。
この小さな3Dモデルは、 in vivo 心血管環境の生物学的および生理学的表現型を模倣しています。以前に実証されたように、カルシウム一過性は、2D単層細胞培養物と比較して3D心臓組織構築物において劇的に増加する34。
次に、播種密度と適切な培養時間もCSスクリーニングを成功させるための重要な要素であることがわかりました。スフェロイドあたりの10K-20K hiPSC-CMの密度と、生成後2〜3週の間のスクリーニングは最適でしたが、小さすぎるスフェロイドまたは古すぎるスフェロイドはカルシウム処理の乱れを示します(図2 および 図3)。したがって、サイズが機能パラメータに影響を与えるため、播種密度をできるだけ一定に保つことが重要です。また、この光学的方法は、組織全体としての生きた3D培養に対して良好な結果をもたらしますが、時間のかかる組織学的方法に頼らずに、より大きなスフェロイド内のデータを(サブ)細胞レベルで取得することは困難です。最近、マーカーの単一細胞定量の機会を備えた3Dスフェロイド全体の取得を可能にする「光学的透明化」を使用したいくつかのアプローチが発表されています。ここでは、CSハーベスティングから共焦点顕微鏡を使用した3Dイメージングに最適化された画像解析までの3日間のプロトコルを採用しました29 (図1C および 図4D)。
最後に、3D心臓組織アプリケーションと商用アプリケーションの増加に伴い、さまざまなドナーからの長期保存と患者固有のバイオバンキングの需要が高まっています。凍結保存は、時間の経過とともに複数のバッチからHTSプレートを生成するための効果的な戦略です。hiPSC-CMの凍結は以前に説明されており、他の培養細胞タイプと比較して違いはありません10、35、36。最近、2D細胞でプレートを凍結するためのアプローチが記載されている37。ここでは、PSC凍結保存キットが他の3つ(データ示さず)と比較して最適な条件であることを発見し、スフェロイドの効率的な凍結のためにこの培地を使用しました。凍結保存後、生存率は高いままですが(図4B、C)、CSの電気生理学的特性が影響を受け、解凍後のインキュベーション期間が必要です。実際、融解の1週間後、CSは自発的な拍動活性とカルシウムの取り扱いを示しました。しかしながら、新鮮および回収されたhiPSC-CMは、必ずしも同一の分子的および生理学的特性を示すとは限らないことが記載されている38。凍結保存されたhiPSC-CMを薬物誘発性心臓読み出しの評価に使用する場合は、この制限を考慮する必要があります。さらに、スフェロイド当たりの細胞数やカルシウム一過性イメージングの最適なタイミングを効果的に調節するが、hiPS細胞由来の心筋細胞を内皮細胞、線維芽細胞、細胞間接合部、細胞間マトリックス(キトサン、コラーゲンIV、フィブロネクチン、マトリゲル、ラミニンなど)と混合し、生体内心臓環境を模倣することで、心臓スフェロイドを改善することができた39。40。全体として、疾患モデリングやHT薬物スクリーニングなどのダウンストリームアプリケーションに適したCSを効率的に生成するための段階的なプロトコルを提案します。
開示事項
著者は開示するものは何もありません。
謝辞
Cyteseerソフトウェアパッケージと自動3Dカルシウム分析の最適化に関するVALA科学に感謝したいと思います。PLN財団(RM)からの助成金支援に感謝したいと思います。P.A.D. と F.S. は CUREPLaN Leducq によってサポートされています。J.P.G.S.は、欧州研究会議(ERC)のH2020-EVICARE(#725229)によってサポートされています。JWBは、UMCユトレヒトクリニカルフェローシップ、オランダ心臓研究所フェローシップ、およびCVON-Dosisヤングタレントグラントによってサポートされています。オランダ心臓財団(CVON-Dosis 2014-40)。ノースカロライナ州は、オランダ科学研究機構による重力プログラム「材料駆動再生」(RegmedXB #024.003.013)とマリー・スクウォドフスカ・キュリーアクション(助成金契約RESCUE #801540)によってサポートされています。V.S.-P.アライアンス基金(UMCU、UU、TU/e)によってサポートされています。A.v.M.は、EUが資金提供するプロジェクトBRAVE(H2020、ID:874827)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
参考文献
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved